Method Article
생체 내 큰 두개골 창을 사용한 마우스의 광시야 및 2광자 칼슘 이미징
요약
본 프로토콜은 식품 랩, 투명 실리콘 및 커버 유리를 사용하여 큰(6 x 3 mm2) 두개골 창을 만드는 방법을 설명합니다. 이 두개골 창은 동일한 마우스에서 생체 내 광시야 및 2광자 칼슘 이미징 실험을 허용합니다.
초록
마우스의 신피질에서 나온 광시야 칼슘 이미징을 통해 다양한 뇌 기능과 관련된 피질 전체의 신경 활동을 관찰할 수 있습니다. 반면에 이광자 이미징은 단일 세포 수준에서 국소 신경 회로의 활동을 해결할 수 있습니다. 동일한 마우스에서 두 이미징 기술을 사용하여 다중 스케일 분석을 수행하려면 큰 두개골 창을 만드는 것이 중요합니다. 이를 위해서는 두개골의 큰 부분을 제거하고 노출 된 피질 표면을 투명한 물질로 덮어야합니다. 이전에는 유리 두개골과 폴리머 기반 두개골 창이 이러한 목적으로 개발되었지만 이러한 재료는 쉽게 제작되지 않습니다. 본 프로토콜은 시판되는 폴리염화비닐리덴(PVDC) 포장 필름, 투명 실리콘 플러그 및 커버 글라스로 구성된 대형 두개골 윈도우를 만드는 간단한 방법을 설명한다. 전체 반구의 등쪽 표면을 이미징하기 위해, 창 크기는 대략 6 x 3mm2였다. 심한 뇌 진동은 그러한 큰 창문에 관계없이 관찰되지 않았습니다. 중요한 것은 뇌 표면의 상태가 한 달 이상 악화되지 않았다는 것입니다. 특히 성상 세포에서 유 전적으로 암호화 된 칼슘 지표 (GECI) 인 GCaMP6f를 발현하는 마우스의 광시야 이미징은 수 밀리미터에서 동기화 된 반응을 나타 냈습니다. 동일한 마우스의 이광자 영상은 몇 초 동안 개별 성상 세포에서 두드러진 칼슘 반응을 보였다. 또한, 아데노 관련 바이러스의 얇은 층을 PVDC 필름에 적용하고 두개골 창 위의 피질 뉴런에서 GECI를 성공적으로 발현했습니다. 이 기술은 큰 두개골 창을 만드는 데 신뢰할 수 있고 비용 효율적이며 거시적 및 미시적 수준에서 행동 중 신경 및 신경교 역학과 상호 작용의 조사를 용이하게합니다.
서문
광시야 칼슘 영상은 동물 뇌의 넓은 영역에 걸쳐 시공간 활동 패턴을 효과적으로 조사합니다 1,2,3. 광시야 이미징은 설치류의 피질이 비교적 평평하기 때문에 설치류의 전체 피질 표면을 관찰하는 데 광범위하게 사용되었습니다 2,3,4,5,6,7,8,9,10. 트랜스제닉 마우스 또는 뉴런 및 신경교세포와 같은 다양한 세포에서 GECI를 특이적으로 발현하는 아데노-관련 바이러스(AAV)를 주사한 마우스는 광시야 칼슘 영상화11,12,13에 사용될 수 있다. 그러나, 이 기술의 공간 분해능은 일반적으로 생체내14에서 개별 세포의 활성을 해결하기에 충분하지 않다. 또한 더 깊은 층에 위치한 이미징 셀에도 적합하지 않습니다.
한편, 이광자 칼슘 이미징은 세포 내 공간 분해능으로 동시에 여러 세포의 활동을 관찰 할 수있어 신경 수상 돌기 및 신경교 과정 15,16,17,18,19,20,21,22에서도 개별 세포의 활동을 관찰 할 수 있습니다. 또한 대뇌 피질(23,24)의 더 깊은 층에있는 세포를 관찰 할 수 있습니다. 2 광자 현미경의 최근 기술 발전으로 밀리미터 폭 피질 영역25,26,27,28,29에서 이미징이 가능하지만 2 광자 이미징에 의한 광시야 이미징에 필적하는 영역을 관찰하는 것은 여전히 어렵습니다.
단일 세포에서 전체 뇌로의 뇌 활동의 생리적 관련성을 이해하려면 전체 피질에 걸친 피질 영역의 활동과 국소 신경 회로의 단일 세포 분해능 사이의 격차를 해소하는 것이 중요합니다. 따라서 동일한 마우스에서 수행되는 광시야 및 2광자 칼슘 이미징의 조합이 특히 효과적입니다. 이를 실현하려면 이상적으로 장기간에 걸쳐 넓고 안정적인 두개골 창을 만들어야합니다.
이전에는, 동일한 마우스(30, 31)에서 광시야 및 이광자 이미징이 수행될 수 있도록 두개골 윈도우를 만들기 위한 몇몇 기술이 개발되었다. 제거된 뼈를 대체하기 위해 피질 표면의 형상으로 성형되는 사다리꼴 형상의 커버 유리 윈도우(crystal skull)는 전체 피질(32)에 걸친 광학 접근을 허용한다. 대안적으로, 중합체-기재 두개골 창은 폴리에틸렌 테레프탈레이트(PET)33 또는 폴리에틸렌-옥사이드-코팅된 비정질 플루오로중합체 나노시트(34)로 제조될 수 있다. 각 방법은 1 개월 이상 안정적인 창을 유지하는 것으로 나타났습니다. 그러나 이러한 창문을 생산하는 것은 쉽지 않으며 사용되는 재료와 장비는 종종 비쌉니다.
본 연구는 PVDC 필름(플라스틱 식품 랩)을 사용하여 대형 두개골 창을 만드는 새로운 방법을 설명합니다(그림 1). 이 창을 사용하여 생체 내 광시야 및 이광자 이미징 실험을 동일한 마우스에서 수행할 수 있습니다. 또한 GECI는 랩에 AAV 입자를 포함하는 얇은 필름 층을 형성하여 마우스 피질의 넓은 영역에 걸쳐 뉴런에서 발현 될 수 있음이 밝혀졌습니다.
프로토콜
실험 절차는 야마나시 대학 동물 실험위원회의 승인을 받았습니다. 야생형(C57BL/6J, 일본 SLC) 및 성상세포에서 막 고정 GECI(Lck-GCaMP6f)를 발현하는 형질전환 마우스를 본 연구에 사용하였다. 형질전환 마우스를 AldH1l1-CreERT2 마우스[B6N. FVB-Tg(Aldh1l1-cre/ERT2)1Khakh/J, 상업적으로 입수, 재료 표 참조] 및 Flx-Lck-GCaMP6f 마우스 [C57BL/6N-Gt(ROSA)26Sor/J, 상업적으로 입수] 마우스. 트랜스제닉 마우스를 타목시펜(20mg/mL)으로 5일 동안(0.05mL/10g bw, i.p.) 처리하여 GCaMP6f를 발현시켰다. 사용된 모든 마우스는 적어도 4주령의 수컷 및 암컷이었다. 창의 개략도는 그림 1A에 나와 있으며 수술 절차는 그림 1B에 요약되어 있습니다.
1. 두개골 창 수술 준비
- 마우스를 이소 플루 란으로 마취하십시오 (유도 : 3 %, 수술 : 1 % -1.5 %, 유속 : 0.2-0.3 L / min). 꼬리 또는 발가락 핀치 반사의 손실로 마취 깊이를 확인하십시오. 가열 패드 (36-38 °C)를 사용하여 체온을 유지하십시오. 마취하에 생쥐의 눈이 마르지 않도록 면봉으로 눈 연고를 바르십시오.
- 15% 만니톨 용액( 재료 표 참조)을 복강내(3mL/100g 체중)로 주사합니다. 마우스 머리를 이어 바가있는 스테레오 프레임에 고정하십시오. 면도기와 제모 크림을 사용하여 마우스 머리에서 머리카락을 제거하십시오.
- 포비돈 요오드와 알코올로 피부 표면을 3 번 소독하십시오. 리도카인을 국소 적으로 적용하여 선제 진통제를 제공하십시오. 수술 용 가위로 관심 부위의 피부를 제거하고 두개골을 노출시킵니다 (크기 : 15 x 15mm). 출혈이 있으면 면봉을 사용하여 출혈을 멈추십시오.
참고: 이 연구에서는 시각 피질에 대한 전두엽 피질을 관찰하기 위해 피부를 제거했습니다. - 마이크로 큐렛을 사용하여 노출된 두개골 위의 골막을 제거하고 두개골 표면을 건조시켜 치과용 시멘트로 헤드 플레이트를 두개골에 단단히 부착합니다( 재료 표 참조)(그림 2B).
알림: 맞춤형 헤드 플레이트는 3D 프린터를 사용하여 생성됩니다. 디자인 파일은 Github 리포지토리(https://github.com/Satoshi-Manita/Head-plates)에 보관됩니다. - 치과용 시멘트를 사용하여 헤드 플레이트를 부착합니다(그림 2C). 시멘트가 굳을 때까지 20 분 이상 기다리십시오. 헤드 플레이트 홀더(35)로 헤드 플레이트를 고정한다.
2. 두개골 창 만들기
- 치과 용 드릴로 두개골 위의 여분의 시멘트를 제거하십시오 ( 재료 표 참조). 뼈를 뚫고 구멍을 뚫어 뇌를 손상시키지 않도록주의하십시오.
- 절단 할 부위를 펜으로 표시하고 메스로 뼈에자를 수 있습니다. 끝이 두개골을 관통하지 않도록 메스 끝을 무디게 합니다(보충 그림 1). 브레인 아틀라스를 참조하여 창을 만들 위치를 결정하십시오.
참고 : 본 연구에서는 전후 축의 브레그마에서 -2mm에서 +4mm 사이에, 시상 봉합사에서 운동, 체성 감각 및 시각 피질을 포함한 중간 측 축의 +3mm까지 창이 생성되었습니다. - 가볍게 만졌을 때 다듬을 부위의 뼈가 잘 움직일 때까지 메스로 뼈를 반복적으로 긁어 홈을 깊게합니다.
- 미세한 핀셋으로 절개 된 뼈를 제거하십시오. 뇌를 손상시킬 수 있는 뼈 플랩을 뇌로 밀어 넣지 마십시오(그림 1Ba).
알림: 뼈를 제거한 후 출혈이 관찰되면 즉시 인공 뇌척수액 (ACSF, 재료 표 참조)을 바르고 흡인하고 출혈이 멈출 때까지이 과정을 반복하십시오. 또는 ACSF에 담근 지혈 젤라틴 스폰지 (약 3mm 정사각형 큐브)를 출혈 지점에 놓습니다. - dura가 제거되지 않은 경우 2.7단계로 진행합니다.
- 아래 단계에 따라 경막을 제거하십시오.
- 예를 들어 다음과 같은 상황에서 경막을 제거하십시오. 피브로인-AAV 막방법을 사용하여 형질감염시키고 수지상 가시와 같은 작은 구조를 관찰하였다.
- 약 10 μm의 테이퍼 팁으로 당겨진 유리 피펫을 사용하여 경막을 자릅니다. 이 컷을 전체 창에 걸쳐 확장하려면 U 자형 바늘을 사용하십시오.
- 실체 현미경 줌을 60-100x로 설정하고 초미세 핀셋으로 절단된 경막을 제거합니다. 경막을 제거하여 출혈이 발생하면 ACSF로 헹구거나 젤라틴 스폰지를 사용하여 출혈을 멈추십시오.
- PVDC 랩을 잘라냅니다.
- 큰 (예 : 10 x 15 mm) PVDC 랩 (약 11 μm, 재료 표, 그림 2A참조)을 오토 클레이빙하고 70 % 에탄올로 멸균합니다.
- 실체 현미경으로 핀셋과 메스를 사용하여 필요한 크기의 랩을 잘라냅니다.
알림: 랩 크기는 두개골 창 크기보다 약 10mm 크지만 헤드 플레이트의 개구부보다 작아야 합니다. 6 x 3 mm 2 두개골 창의 경우 15 x 10 mm2 랩을 준비하십시오.
- 아래 단계에 따라 랩을 정확하게 배치하십시오.
- 랩을 뇌 표면에 놓고 ACSF를 표면에 남겨 둡니다. 랩의 가장자리에서 ACSF를 빨아 들여 랩이 뇌 표면에 단단히 붙도록합니다 (그림 1Bb, c).
참고: 사용된 랩은 주름에 강하므로 뇌 표면에 놓기만 해도 주름이 거의 생기지 않습니다. - 두개골 창의 가장자리와 랩 사이에 약 1mm의 여백이 있도록 메스와 핀셋으로 랩을 자릅니다(그림 1Bd).
- 랩이 제자리에 있으면 랩의 가장자리를 생물학적 접착제로 두개골에 붙입니다( 재료 표, 그림 2D 참조). 접착제를 약 30분 동안 건조시키십시오.
- 랩을 뇌 표면에 놓고 ACSF를 표면에 남겨 둡니다. 랩의 가장자리에서 ACSF를 빨아 들여 랩이 뇌 표면에 단단히 붙도록합니다 (그림 1Bb, c).
- 투명한 실리콘 엘라스토머를 바르십시오.
- 혼합 팁이 있는 디스펜서(그림 1Be, 2A b-d)를 사용하여 랩 위에 시판되는 투명 실리콘 엘라스토머(재료 표 참조)를 바르고 덮개 유리(0.12-0.17mm 두께)를 맨 위에 놓습니다(그림 2E).
- 커버 유리의 둘레를 방수 필름, 초접착제 또는 치과용 시멘트로 밀봉합니다(그림 1Bf).
- 수술 후 흉골 누운 자세를 유지하기 위해 의식을 회복 할 때까지 마우스를 모니터링하십시오. 그 후, 마우스를 개별적으로 보관하고 적어도 7 일 동안 집 케이지에서 회복하도록하십시오.
- 스트레스와 통증을 줄이려면 항염증제 및 진통제(예: 덱사메타손 및 케토프로펜, 각각 5mg/kg, 즉)를 투여하십시오.
- 마우스의 감염 여부를 정기적으로 모니터링하십시오. 감염이 확인되면 감염이 사라질 때까지(일반적으로 4주 미만) 음용수에 항균제(예: 10% 엔로플록사신, 1.7μL/mL)를 투여합니다.
3. 피브로인 용액을 사용하여 플라스틱 랩에 AAV 필름 만들기
참고: 3단계는 선택 사항입니다.
- 이전에 발표 된 방법37에 따라 누에 고치에서 피브로인 용액을 준비하십시오.
- 간단히 말해서, 시판되는 일반 누에 고치 (5g, 재료 표 참조)를 탄산나트륨 용액 (0.02M, 2L)에 끓입니다. 고치를 초순수로 씻고 밤새 말리십시오.
- 건조된 고치를 브롬화리튬 용액(9.3M, 20% w/v 피브로인)에 녹이고 60°C의 오븐에서 4시간 동안 가열합니다. 용해된 누에고치 용액을 투석하고, 원심분리(12,700 x g에서 2회, 4°C에서 20분 동안)37, 상층액을 수집한다.
- 아래 단계에 따라 피브로인-AAV 필름을 준비합니다.
- 마이크로피펫을 사용하여 작은 샘플 튜브에서 피브로인과 AAV 용액20 을 1:4 비율로 혼합합니다. 혼합 된 피브로인 -AAV 용액의 분취액을 두개골 창의 플라스틱 랩에 떨어 뜨리고 최소 3 시간 동안 건조시킵니다.
참고: 직경 3mm의 영역에서 발현하려면 5μL 방울의 피브로인-AAV 용액을 바르십시오. 이 비율은 주어진 영역에 대한 용액의 양을 결정합니다. - 건조 후 플라스틱 랩을 창에 필요한 크기 (예 : 10 x 15 mm)로 자르고 뇌 표면에 놓습니다. 그런 다음 2.8.1단계부터 위에서 언급한 방법을 따르십시오.
알림: 랩을 뇌 표면에 놓기 전에 가능한 한 뇌 표면의 ACSF를 제거하십시오. 이는 ACSF가 피브로인-AAV 막을 용해시키고 AAV 입자의 농도를 감소시킬 것으로 예상되기 때문이다. - AAV 처리 창을 만든 후 GECI가 충분히 표현될 때까지 약 2-4주 정도 기다리십시오. 이 과정에서 마우스와 창문의 상태를 정기적으로 점검하십시오.
- 마이크로피펫을 사용하여 작은 샘플 튜브에서 피브로인과 AAV 용액20 을 1:4 비율로 혼합합니다. 혼합 된 피브로인 -AAV 용액의 분취액을 두개골 창의 플라스틱 랩에 떨어 뜨리고 최소 3 시간 동안 건조시킵니다.
4. 칼슘 이미징 및 분석
참고: 이미징 및 분석에 대한 자세한 내용은 이전에 게시된 보고서 1,2,38을 참조하십시오.
- 아래 단계에 따라 광시야 이미징을 수행합니다.
- 탠덤 렌즈 형광 매크로 스코프 아래의 머리 고정 장치를 사용하여 마우스를 고정합니다( 재료 표 참조).
- 여기 필터, 이색성 거울 및 대물 렌즈를 통해 465nm LED 광원의 여기 빛으로 마우스의 대뇌 피질을 비춥니다.
- 대물 렌즈(1.0x), 이색성 거울, 방출 필터 및 이미징 렌즈(2.0x)를 통해 CCD 카메라로 대뇌 피질의 형광 이미지를 수집합니다. 이 렌즈의 조합은 약 0.5x의 총 배율을 제공합니다.
- 50Hz의 샘플링 주파수에서 이미지를 수집합니다. 데이터 수집 후 ImageJ 소프트웨어를 사용하여 이미지를 분석합니다. 관심 영역(ROI)을 수동으로 선택합니다. 각 ROI의 형광 변화를 ΔF/F = (Ft - F0)/F0으로 계산하며, 여기서 Ft는 각 프레임의 원시 형광 값이고 F0는 모든 프레임의 평균 이미지에서 얻은 평균 형광 값입니다.
참고: ImageJ에 대한 매크로 프로그램은 칼슘 이미징 데이터에서 ΔF/F 이미지를 계산하는 GitHub(https://github.com/Satoshi-Manita/ImageJ-macro)에 기탁됩니다.
- 아래 단계에 따라 2광자 이미징을 수행합니다.
- 머리 고정 장치를 사용하여 2 광자 현미경으로 마우스를 고정시킵니다. 저배율(5x) 대물 렌즈가 있는 명시야 모드에서 현미경을 사용하여 이미징할 영역을 식별합니다.
- 2광자 이미징으로 전환합니다. 고배율 대물 렌즈(16x 또는 25x)를 사용하고 2광자 여기를 위해 레이저를 비춥니다.
참고: 녹색 Lck-GCaMP6f22 및 빨간색 XCaMP-R36 은 각각 920nm 및 1070nm의 여기 파장에서 초고속 레이저에 의해 여기되었습니다. - 30Hz에서 형광 이미지를 획득합니다. 데이터 수집 후 suite2p 소프트웨어39의 등록 기능으로 모션 아티팩트를 수정합니다. 광시야 이미징에 동일한 방법을 사용하여 이미지에서 ROI 및 ΔF/F를 얻습니다.
- 다음 라이브러리와 함께 파이썬을 사용하여 데이터를 플로팅하십시오 : NumPy, Matplotlib 및 Pandas ( 재료 표 참조).
결과
PVDC 랩 방법을 사용하여 만든 대형 두개골 창 평가
수술 직후 출혈이나 허혈로 인한 출혈, 색변화 등 피질 표면의 상태를 한눈에 확인할 수 있다. 수술 후 오랜 시간이 지나면 감염으로 인해 피질 표면이 불투명 한 흰색 막으로 덮이거나 출혈로 인해 혈액이 창을 덮을 수 있습니다 (그림 2G). 이 경우 피질이 건강한 상태가 아닐 수 있으며 영상이 불가능할 수 있습니다. 이는 부분적으로 절단된 랩 또는 접착제에 의한 랩의 불충분한 고정으로 인해 발생할 수 있습니다. 감염이 반복적으로 관찰되면 항생제, 예를 들어 겐타 마이신 설페이트 (10 μL, 50 mg / mL)를 창 배치시 뇌 표면에 적용하는 것이 효과적 일 수 있습니다. 수막이나 뼈의 재생은 피질 표면과 랩 사이의 수직 간격이 클 때도 나타납니다. 이를 방지하려면 창을 준비하는 동안 랩을 뇌 표면에 최대한 단단히 적용하는 것이 중요합니다. 이것은 뇌 표면에 플라스틱 랩을 놓고 가능한 한 많은 ACSF를 빨아들임으로써 달성 할 수 있습니다. ACSF가없는 경우 뇌 표면에 플라스틱 랩을 놓기 만하면 가능합니다. 뇌와 혈관은 뇌의 색이 변색되지 않고 혈관이 절단되지 않기 때문에 손상되지 않은 것으로 판단됩니다.
창문의 수명은 주로 수술의 질에 달려 있습니다. 상태가 양호하면 수술 후 1 개월 이상 감염, 출혈 또는 재생의 징후가 없습니다 (그림 2F 및 그림 3B). 10 마리의 마우스 중 8 마리에서, 창은 10 주 이상까지 깨끗하게 유지 될 수 있었다. 두 마우스의 창문은 감염이나 출혈로 인해 제대로 유지 관리되지 않았습니다. 큰 창은 기계적 응력이나 충격을 받기 쉬울 수 있지만 깨지거나 금이 간 창은 관찰되지 않았습니다.
랩, 실리콘 및 유리를 사용한 새로운 두개골 창의 이미징 품질을 평가하기 위해 한천에서 0.1μm 형광 비드를 이미징하여 새 창 아래의 점 확산 기능을 기존 유리 창 아래의 점 확산 기능과 비교했습니다( 보충 파일 1 참조). 결과는 두 조건 모두에 대해 최대 절반 (FWHM)에서 전체 너비의 차이가 없음을 보여주었습니다. [X축(μm): 유리만, 1.99 ± 0.07, 랩, 1.76 ± 0.13, Y축(μm): 유리만, 2.11± 0.27, 랩, 1.90 ± 0.15, Z축(μm): 유리만, 25.29 ± 0.71, 랩, 26.64 ± 1.02, N=7 비드, p > 0.05, Mann-Whitney U 테스트, 보충 그림 2A,B]. 따라서 추가 된 새로운 요소 (랩 및 실리콘)는 이미징 품질을 저하시키지 않았습니다.
호흡, 심장 박동 및 신체 움직임으로 인한 진동 아티팩트는 광시야 및 2광자 이미징에 존재합니다. 새로운 두개골 창이 얼마나 진동하는지 확인하기 위해 생체 내 이광자 이미징 데이터에서 작은 형광 입자를 선택하고 60초 동안 이미지가 얼마나 움직였는지 조사했습니다. 그 형광 입자의 중심의 표준 편차는 약 0.3 μm이며, 이는 종래의 유리창 하에서의 표준 편차와 비슷하다(보충 그림 2C). 이것은 뇌가 투명한 실리콘 플러그 앤 커버 글라스에 의해 고정되어 있기 때문에 진동이 기존의 작은 창에서 관찰되는 것과 비슷했으며 오프라인 이미지 등록이 진동 아티팩트를 제거하기에 충분하다는 것을 나타냅니다.
광시야 칼슘 영상에서 피질 활동은 감각 자극에 의해 유도 된 피질을 가로 질러 전파되는 것을 관찰 할 수있었습니다 (그림 3A-D, K-N). 2광자 이미징을 통해 뉴런과 신경교 세포에 특이적인 단일 세포 형광 이미지를 관찰할 수 있었습니다(그림 3E,O). 감각 자극에 의해 유도 된 형광 변화는 개별 세포에서 관찰 될 수 있었다 (그림 3E-J, OT).
PVDC 랩과 AAV를 사용하여 대뇌 피질의 넓은 영역에서 유 전적으로 암호화 된 칼슘 지표 (GECI)의 발현
창용 PVDC 랩은 피질의 넓은 영역에서 기능성 단백질을 발현하는 데 적용될 수 있습니다. 이것은 AAV와 피브로인, 생체 재료로 널리 적용된 누에 고치의 구성 단백질을 사용하여 달성됩니다37. 이전 연구에 따르면 피브로인은 AAV와 혼합되어 뇌에 이식되어 광활성성 옵신 또는 GECI와 같은 기능성 단백질을 발현하는 막을 형성할 수 있습니다.36. 본 연구에서는 GECI와 피브로인을 발현하는 AAV를 랩에 혼합하여 건조시키고, 두개골 창에는 AAV 코팅 랩을 사용하였다. 그 결과 수술 후 2-4 주 후에 피질의 넓은 영역에서 GECI가 발현되었습니다 (그림 3K-M). 창이 크기 때문에 동일한 마우스의 다른 피질 영역을 이미지화 할 수 있습니다 (그림 3M-T).
이 방법의 발현 효율을 확인하기 위해, GECI를 발현하는 세포의 수를 고정된 뇌에서 계수하였다(보충 그림 2D). 피브로인-AAV를 사용한 랩을 사용한 본 전략은 표재성 및 심층층 모두에서 대략 20%의 효율을 갖는 GECI의 발현을 초래하는 것으로 밝혀졌다(L2/3: 20.78%, XCaMP-R 발현 세포: 32개, DAPI: 154개소, L5: 20.08%, XCaMP-R 발현 세포: 51개, DAPI: 254개소). 따라서이 방법은 표면층뿐만 아니라 더 깊은 층에서도 세포에서 GECI를 발현했습니다.
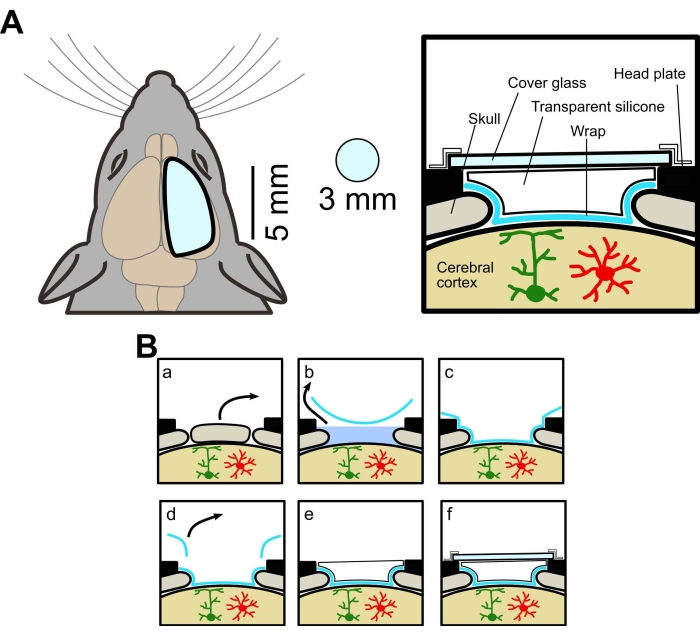
그림 1: 큰 두개골 창의 개념도. (A) 왼쪽, 새 두개골 창의 개략도. 기존 창 (직경 3mm)보다 큽니다. 오른쪽, 횡단면도. 큰 두개골 창을 만드는 방법은 식품 랩, 투명 실리콘 엘라스토머 및 커버 유리를 사용하여 동일한 마우스에서 광시야 및 2광자 이미징을 허용합니다. (B) 두개골 창 제작 절차 : (a) 뼈 제거. (b) 랩 아래의 ACSF 제거. (c) ACSF를 제거하여 뇌 표면에 랩을 부착합니다. (d) 초과 랩을 잘라냅니다. (e) 투명 실리콘 적용. (f) 커버 유리 부착. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
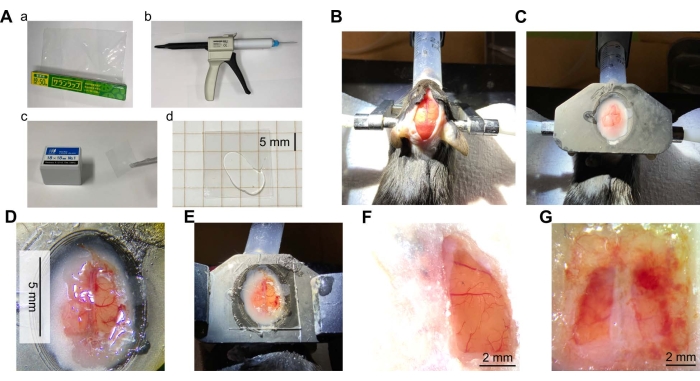
그림 2: 두개골 창 수술 개요 . (A) 두개골 창에 필요한 재료 및 장비. (a) 폴리 염화 비닐 리덴 (PVDC) 포장 필름. (b) 혼합 팁이 있는 투명한 실리콘 엘라스토머 디스펜서. (c) 커버 유리. (d) 커버 유리의 두 조각 사이에 놓인 투명한 실리콘. (B) 두개골을 노출시키기 위해 절개된 마우스 머리 피부 사진. 마우스를 마취시키고, 마우스의 머리를 이어 바를 사용하여 고정화시켰다. 그런 다음 머리를 탈모하고 국소 진통제로 치료하고 피부를 절개했습니다. (C) 헤드 플레이트 설치 후 사진. 헤드 플레이트 (3D 프린터의 수지로 만든)를 치과 용 시멘트로 마우스 머리에 부착했습니다. (D) 두개골 창 사진. 두개골 창은 마우스 뇌의 오른쪽 반구의 피질에서 만들어졌습니다. 경막이 제거되고 랩이 제자리에 접착되었습니다. (E) 위에 투명한 실리콘과 커버 유리로 랩으로 만든 창 사진. (F) 성공적인 창의 전형적인 예 (우반구, 수술 후 7 주). (G) 실패한 창의 예 (양쪽 반구, 수술 후 5 주). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
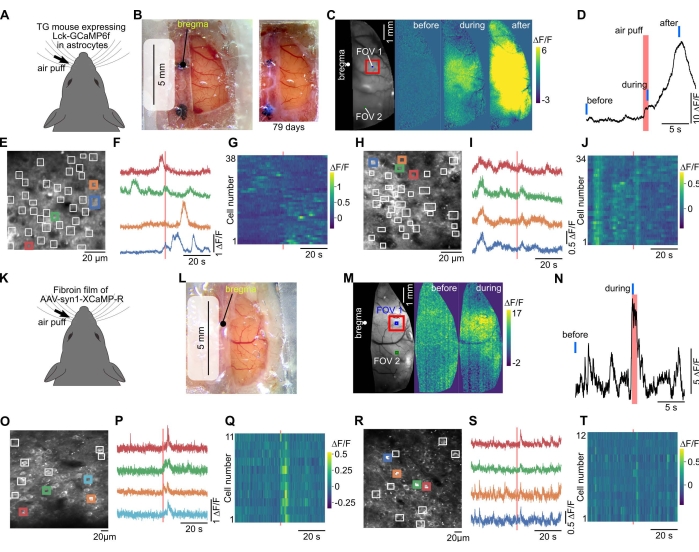
그림 3: 큰 창은 동일한 마우스에서 광시야 및 2광자 칼슘 이미징을 허용합니다. (A) 칼슘 영상화는 성상세포40에서 막 고정 GECI(Lck-GCaMP6f)를 발현하는 형질전환 마우스에서 수행하였다. (B) 왼쪽에는 플라스틱 랩, 투명 실리콘 및 커버 유리로 큰 창이 만들어졌습니다. 이 창을 통해 광시야 이미징이 수행되었습니다. 오른쪽, 두개골 창을 설치 한 지 79 일 후에 사진이 캡처되었습니다. (C) 반대쪽 수염에 에어퍼프 자극을 가했을 때 형광 변화가 관찰되었습니다. (D) 체성 감각 피질 (C의 붉은 사각형)의 형광 변화의 시간 과정을 플롯팅했다. 빨간색과 파란색 막대는 각각 (C)에서 에어 퍼프 타이밍과 "이전", "중" 및 "후" 타이밍을 나타냅니다. (E) 이광자 칼슘 영상의 시야(FOV 1 in C). GCaMP6f는 막에 국한되도록 표현되었기 때문에 관심 영역(흰색 사각형)을 수동으로 배치하여 성상세포 과정에서 국소 반응을 감지했습니다. (F) (E)의 착색 된 사각형의 형광 변화가 플롯됩니다. (G) (E)의 모든 제곱에서의 형광 변화가 플롯됩니다. 수평 및 수직 축은 각각 시간과 셀 번호를 나타냅니다. (H-J) (C)에 FOV2(시각 피질에서)에 대한 데이터가 도시되어 있다. FOV 2를 FOV 1에서 이미징한 후에 이미징하였다. (k) 적색 GECI, XCaMP-R, 야생형 마우스에서 피브로인-AAV 방법에 의해 뉴런에서 발현되었다. (L) 수술 2 주 후에 피브로인 필름을 사용하여 창을 만든 사진을 캡처 한 사진. (M) 이 마우스에 대해 광시야 칼슘 영상화를 수행하였다. (N) 수염 자극에 의해 유발 된 형광 변화는 가장 두드러진 부위 (체성 감각 피질, (M)의 빨간색 사각형)에서 플롯되었습니다. 빨간색과 파란색 선은 각각 (M)에서 에어 퍼프 타이밍과 "이전" 및 "동안" 타이밍을 나타냅니다. (O) 300 μm 깊이에서 이광자 칼슘 영상의 시야 (체성 감각 피질, FOV 1 in (M)). ROI는 수동으로 뉴런 소마타에 배치되었습니다. (P) (O)의 착색 된 사각형의 형광 변화가 플롯됩니다. (Q) (O)의 모든 사각형에서의 형광 변화는 색상으로 표시됩니다. (R-T) 정수리 피질에 위치한 FOV 2 in (M)에 대한 데이터가 표시됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
보충 그림 1: 메스를 위한 팁. 뭉툭한 끝으로 두개골을 자르는 데 사용되는 메스와 비교한 새 메스의 끝(위)(아래). 이 파일을 다운로드하려면 여기를 클릭하십시오.
보충 그림 2: 새로운 두개골 창 및 피브로인-AAV 발현 방법의 검증. (a) 한천에서 0.1 μm 형광 비드의 형광 강도 프로파일. 위쪽 행에는 한천에 혼합된 형광 비드 위에 덮개 유리만 놓은 상태의 데이터가 표시되고 아래쪽 행에는 랩, 투명 실리콘 및 덮개 유리가 배치된 상태의 데이터가 표시됩니다. 회색 트레이스는 각 비드의 형광 강도 프로파일에 대한 가우스 피팅을 보여주고 빨간색 트레이스는 평균값(n = 7)을 보여줍니다. (B) (A)의 데이터 요약. 각 그래프는 XYZ 축에서 점 확산 함수의 최대 반값(FWHM)에서의 전체 폭을 보여줍니다. 회색 플롯은 각 비드에 대한 데이터를 표시하고 빨간색은 평균 및 표준 오차를 보여줍니다. (C) 생체 내 이미징 데이터의 2,000 프레임 (60 초 기록)에서 작은 형광 입자를 선택하고 60 초 동안 이미지가 얼마나 움직 였는지 조사했습니다. 중앙의 형광 이미지는 평균 2,000 프레임을 나타냅니다. 이미지는 X축 및 Y축 방향으로 평균화하여 투사되었습니다. 히스토그램은 각 프레임에서 중심의 분포를 보여줍니다. 중심의 표준 편차는 X: 0.36 및 Y: 0.315 μm였다. (D) 피브로인-AAV 방법에 의한 GECI 발현의 예. 왼쪽: 피브로인-AAV 발현법을 적용한 대뇌 피질 조각. 빨간색과 파란색은 각각 XCaMP-R 및 DAPI의 형광을 나타냅니다. XCaMP-R은 층 2/3 세포뿐만 아니라 층 5 세포에서도 발현되었습니다. 중앙과 오른쪽. 왼쪽 그림에서 각각 레이어 2/3 및 5의 확대 된 뷰 (청록색 사각형). 이 파일을 다운로드하려면 여기를 클릭하십시오.
보충 파일 1 : (A) 피브로인-AAV 필름 방법을 사용한 랩의 발현 효율 및 (B) 이광자 이미징 중 점 확산 기능 평가. 이 파일을 다운로드하려면 여기를 클릭하십시오.
토론
이 기사에서는 PVDC 플라스틱 랩, 투명 실리콘 및 커버 유리를 사용하여 대형 두개골 창을 만드는 저렴한 방법을 제시합니다. 이 방법을 사용하여 우리는 대뇌 피질의 넓은 영역에서 광역 칼슘 이미징을 수행 할 수 있음을 보여주었습니다. 이광자 칼슘 영상은 광시야 영상화를받은 동일한 마우스의 여러 다른 피질 영역에서 수행 할 수 있습니다. 또한, 창에 사용 된 플라스틱 랩의 피브로인 -AAV 필름은 피질의 넓은 영역에서 GECI를 발현 할 수 있음이 밝혀졌습니다.
중요 단계
플라스틱 랩을 사용하여 두개골 창을 만들 때 감염과 뇌 손상을 피하는 것이 중요합니다. 이러한 조건에서는 신경 및 신경교 활동을 관찰 할 수 없으며 더 깊은 영역의 이미징이 불가능합니다. 혈관 손상은 또한 출혈을 일으켜 혈액으로 인해 영상이 불가능합니다. 감염을 피하려면 ACSF를 빨아들여 뇌 표면과 랩을 가능한 한 단단히 부착하는 것이 중요합니다. 만니톨 투여는 수술 중 뇌압 상승을 방지하여 뇌 및 혈관 손상을 방지하는 데 중요합니다. 이것은 뇌 표면과 경막 사이의 공간을 유지하고 두개골과 경막을 제거하는 동안 뇌와 혈관이 만지는 것을 방지합니다. 고배율의 실체 현미경과 끝이 날카로운 핀셋도 정확한 수술에 효과적입니다.
피브로인-AAV 방법에서는 피브로인 용액을 동결시키지 않고 피브로인-AAV 용액을 충분히 건조시키고 충분한 양의 용액(직경 3mm당 5μL)을 도포하기 위해 살누에 고치를 사용하는 것이 필수적입니다. 오래된 고치를 사용했을 때 표현 효율이 낮았습니다. 오래된 고치의 피브로인이 쉽게 변성될 수 있기 때문입니다. 피브로인 용액을 -80°C에서 동결시키고 사용시에 해동시킨 경우, 발현 효율이 불량하였다. 이것은 동결 및 해동으로 인한 단백질의 변성 때문일 수 있습니다. 4 °C에서 보관 된 피브로인 용액은 겔화 될 때까지 효과적으로 사용할 수 있으므로 피브로인 용액은 냉장 보관하고 겔화 후 다시 고치에서 정제하는 것이 좋습니다. 피브로인-AAV 용액은 3시간 미만 후에 발현이 불량하므로 최소 3시간 동안 건조해야 합니다. 마지막으로, 발현 영역은 사용 된 피브로인 -AAV 용액의 양에 따라 다릅니다. 도 3M의 예에서, 양은 작았다 (5 μL); 따라서 피브로인-AAV 필름은 창의 상반부만 덮어 창 위에 균일하지 않은 표현을 초래했습니다. 충분한 양의 피브로인 -AAV가 사용되면 전체 창에서 표현이 균일합니다.
기술의 수정
새로운 두개골 창 기술을 사용하면 동일한 마우스에서 피질 회로의 거시적 활동과 기본 단일 세포 수준 활동을 검사 할 수 있습니다. 따라서이 방법은 다양한 신경 과학 연구에 적용될 수 있습니다. 예를 들어, 의사 결정 작업, 운동 학습 및 뇌 손상 및 질병의 마우스 모델에서 피질 활동을 관찰하는 데 사용할 수 있습니다. 우리는 또한이 방법이 설치류뿐만 아니라 인간이 아닌 영장류에도 적용될 수 있다고 믿습니다.
이 논문은 큰 두개골 창이 형질전환 마우스와 기능성 단백질을 발현하는 AAV를 주입한 마우스를 이미징하는 데 효과적임을 보여줍니다. 특히, 랩 상의 피브로인-AAV 필름은 피질의 넓은 영역에 걸쳐 GECI를 발현하는 것이 기존의 AAV 주입 방법보다 훨씬 쉽다는 것을 보여준다. 상이한 색상41의 GECI를 암호화하는 2 개의 AAV의 혼합물을 사용하여, 뉴런과 신경교 세포 활동 사이의 상관 관계는 피질의 넓은 영역에 걸쳐 동시에 이미징 될 수있다. 더욱이, 피브로인-AAV 막 방법은 다른 유전적으로 암호화된 바이오센서(42,43,44,45,46,47)에도 적용될 수 있다.
두 반구를 이미지화할 수 있는 더 큰 두개골 창도 가능합니다. 훨씬 더 넓은 시야 (~ 25 mm 2)를 가진2 광자 현미경이 최근25,26,27,28,29로 개발되었습니다. 이 2 광자 이미징 기술을 여기에 설명 된 넓은 두개골 창을 사용하여 1 광자 광시야 이미징과 결합하면 전례없는 규모에서 인구 활동과 단일 세포 활동 간의 관계를 조사 할 수 있습니다.
제한
식품 랩은 어떤 물질도 통과시키지 않습니다. 이로 인해이 방법을 약리학 실험에 사용하기가 어렵습니다. 랩을 제거하기가 어렵 기 때문에 유리 피펫이나 전극을 삽입 할 수 없습니다. 따라서 동시 칼슘 이미징 및 전기 생리 학적 기록, 유리 피펫을 사용한 약물의 국소 투여와 같은 다른 방법과 결합 된 실험을 구현하기가 어렵습니다. 이러한 제한에 대한 가능한 해결책은 구멍이있는 랩 및 유리창을 사용하는 것입니다. 이것은 유리 피펫 또는 기록 전극을 통해 뇌에 접근하는 것을 허용하면서 두개골 창을 장기간 멸균 상태로 유지합니다48.
공개
저자는 공개 할 것이 없습니다.
감사의 말
이 연구는 변형 연구 분야 (A) 'Glial Decoding'(JP21H05621에서 SM으로), JSPS KAKENHI (JP19K06883에서 SM, 15KK0340에서 ES, JP22H00432, JP22H05160, JP17H06312에서 HB로, JP17H06313에서 KK), 질병 연구를위한 통합 신경 기술 (Brain / MINDS) (JP19dm0207079h0002에서 SM, JP19dm0207079에서 HB, JP19dm0207080에서 KK까지), Narishige Neuroscience Research Foundation (SM에게), 야마나시 현 (SM)과 다케다 과학 재단 (SM)의 젊은 연구원을위한 보조금과 야마나시 대학의 프론티어 뇌 연구 보조금이 부분적으로 지원합니다.
동물 관리 및 기술 지원을 해준 N. Yaguchi와 K. Okazaki, 그리고 유용한 토론을 해준 Kitamura 연구소 회원들에게 감사드립니다.
자료
| Name | Company | Catalog Number | Comments |
| 4% paraformaldehyde phosphate buffer solution | NACALAI TESQUE, Kyoto, Japan | TritonX | Expression efficiency of the wrap with the fibroin-AAV film method |
| 50 mL beaker | |||
| Acquisition software | Brain vision | BV_Ana | For wide-field calcium imaging of GCaMP6f |
| Acquisition software | Hamamatsu photonics | High speed recording software: HSR | For wide-field calcium imaging of XCaMP-R |
| Acquisition software | Vibrio Technologies | scanImage | For two-photon calcium imaging |
| ACSF (artificial cerebrospinal fluid) | 150 mM NaCl, 2.5 mM KCl, 10 mM HEPES, 2 mM CaCl2, 1 mM MgCl2, pH = 7.4 with 1M NaOH | ||
| ACSF aspiration needle | |||
| Adeno-associated virus | VectorBuilder | custom-made | AAV-DJ/8-Syn1-XCaMP-R |
| Adhesives for biological use | Daiichi Sankyo | Aron Alpha-A | |
| Anesthesia machine | Shinano seisakusho | SN-487 | |
| Anesthetic | Kyoritsu Seiyaku Corporation | pentobarbital | Expression efficiency of the wrap with the fibroin-AAV film method |
| Auxiliary ear bar | Narishige | EB-5N | |
| CCD camera | Brain vision | MiCAM02-HR | For wide-field calcium imaging of GCaMP6f |
| Clear vinyl polysiloxane | GC | Exaclear | |
| CMOS camera | Hamamatsu photonics | ORCA-spark | For wide-field calcium imaging of XCaMP-R |
| Cotton swab | |||
| Cover glass | Matsunami | 18 x 18 NO.1 | Size: 18 x 18 mm, Thickness: 0.13-0.17 mm, Borosilicate glass |
| DAPI | Thermo Fisher | D1306 | Expression efficiency of the wrap with the fibroin-AAV film method |
| Ddialysis cassette | 3.5K MWCO, Slide-A-Lyzer | ThermoFisher | |
| Dental adhesive resin cement | SUN MEDICAL | Super-Bond | |
| Dental drill | Nakanishi | VOLVERE Vmax | |
| Digital scale | Dretec | KS-243 | |
| Filters | Brain vision | EM: BP466/40-25, DM: DM506, EX: BP520/36-50 | |
| Filters | Olympus | U-MRFPHQ, EM: BP535-555HQ, DM: DM565HQ, Ex: BA570-625HQ | |
| Fluorescence microscope | Keyence | BZ-X810 | Expression efficiency of the wrap with the fibroin-AAV film method |
| Fluorescent beads | Fluoresbrite YG Carboxylate Microspheres | 0.1 µm | Evaluation of the point spread function under the conventional and the new cranial windows in two-photon imaging |
| Forceps | FST | No. 11252-20 | thin-tipped, for removal of dura mater |
| Forceps | KFI | K-7, No.J 18-8 | for general use |
| Gelatin for hemostasis | Johnson & Johnson | Spongostan | |
| Gentamicin sulfate | Iwaki seiyaku | ||
| Glass pipette | custom-made | ||
| Hair remover | Reckitt Japan | Veet | |
| Head fixing device | custom-made | Craniotomy for Cortical Voltage-sensitive Dye Imaging in Mice. Suzuki, T., and Murayama, M. Bio-protocol 2016 6:e1722. | |
| Head plate | custom-made | aluminum or resin, size: 40 x 25 mm, thickness: 1.5 mm or 2 mm, hole in the center: 15 x 10 mm (head_plate_06 v3.f3d) | |
| Heating pad | |||
| Image processing software (for calcium imaging data analysis) | ImageJ | https://imagej.net | |
| Isoflurane | Pfizer | ||
| Light source | Hayashi-repic | LA-HDF108AA | |
| Light source | Brain vision | LEX2-LZ4-B | For wide-field calcium imaging of GCaMP6f |
| Light source | Olympus | U-HGLGPS | For wide-field calcium imaging of XCaMP-R |
| Mannitol solution (15% with saline) | Sigma-Aldrich (Merck) | M4125 | |
| Micro curette | FST | No. 10080-05 | |
| Microscope | Brain vision | For wide-field calcium imaging of GCaMP6f | |
| Microscope | Olympus | MVX10 | For wide-field calcium imaging of XCaMP-R |
| Microscope | Sutter Instruments | MOM | For two-photon calcium imaging |
| Microslicer | Dosaka EM | DTK-1000N | Expression efficiency of the wrap with the fibroin-AAV film method |
| Mixing tip | GC | ||
| Needle (30 G) | |||
| Polyethylens spoids | AS ONE | 1-4656-01 | |
| Polyvinylidene chloride (PVDC) film | Asahi Kasei | Asahi Wrap (or Saran Wrap) | |
| Povidone-iodine | Mundipharma | Isodine | |
| Python libralies | NumPy | package for scientific computing, https://numpy.org/doc/stable/index.html# | |
| Matplotlib | library for visualizations, https://matplotlib.org/stable/index.html# | ||
| pandas | data analysis and manipulation tool, https://pandas.pydata.org | ||
| Scalpel | Kai | No. 11 | |
| Shaver for animal | |||
| Silicone dispensers | GC | ||
| Silkworm cocoon | Satoyama Craft News | https://sato-yama.jp/ | |
| Stereomicroscope | LEICA | MZ6 | objective lens: 0.63x, eyepiece: 25x |
| Surfactant | NACALAI TESQUE | TritonX | Expression efficiency of the wrap with the fibroin-AAV film method |
| Surgical Scissors | FST | No. 91460-11 | |
| Syringe for mannitol injection | Terumo | 1mL | |
| Transdermal anesthetic | AstraZeneca | Lidocaine | |
| Transgenic mice used for calcium imaging of astrocytes | The mice were obtained by the following method. AldH1l1-CreERT2 mice: B6N.FVB-Tg(Aldh1l1-cre/ERT2)1Khakh/J (The Jackson laboratory, strain #: 031008) Tamoxifen-inducible Cre recombinase expression directed at high levels to the vast majority of astrocytes Flx-Lck-GCaMP6f mice: C57BL/6N-Gt(ROSA)26Sor[tm1(CAG-GCaMP6f)Khak]/J (The Jackson laboratory, strain #: 029626) Cre-dependent expression of a plasma membrane-targeted GCaMP6f. A mouse born from crossbreeding these mice were treated with tamoxifen (20 mg/mL) for 5 days (0.05 mL/10g bw, i.p.) to express GCaMP6f. | ||
| Tunable ultrafast lasers | Spectra-Physics | InSight X3 | For two-photon calcium imaging |
| Waterproof film | Nichiban | BFR5 | |
| Wild-type mice | Japan SLC | C57BL/6J | Male and femalek, >4 weeks old |
참고문헌
- Ren, C., Komiyama, T. Wide-field calcium imaging of cortex-wide activity in awake, head-fixed mice. STAR Protocols. 2 (4), 100973 (2021).
- Couto, J., et al. Chronic, cortex-wide imaging of specific cell populations during behavior. Nature Protocols. 16 (7), 3241-3263 (2021).
- Kauvar, I. V., et al. Cortical Observation by Synchronous Multifocal Optical Sampling Reveals Widespread Population Encoding of Actions. Neuron. 107 (2), 351-367 (2020).
- Clancy, K. B., Orsolic, I., Mrsic-Flogel, T. D. Locomotion-dependent remapping of distributed cortical networks. Nature Neuroscience. 22 (5), 778-786 (2019).
- MacDowell, C. J., Buschman, T. J. Low-dimensional spatiotemporal dynamics underlie cortex-wide neural activity. Current Biology. 30 (14), 2665-2680 (2020).
- Makino, H., et al. Transformation of cortex-wide emergent properties during motor learning. Neuron. 94 (4), 880-890 (2017).
- Murphy, T. H., et al. Automated task training and longitudinal monitoring of mouse mesoscale cortical circuits using home cages. eLife. 9, 559654 (2020).
- Rynes, M. L., et al. Miniaturized head-mounted microscope for whole-cortex mesoscale imaging in freely behaving mice. Nature Methods. 18 (4), 417-425 (2021).
- Cardin, J. A., Crair, M. C., Higley, M. J. Mesoscopic imaging: Shining a wide light on large-scale neural dynamics. Neuron. 108 (1), 33-43 (2020).
- Ren, C., Komiyama, T. Characterizing cortex-wide dynamics with wide-field calcium imaging. The Journal of Neuroscience. 41 (19), 4160-4168 (2021).
- Hamodi, A. S., Martinez Sabino, A., Fitzgerald, N. D., Moschou, D., Crair, M. C. Transverse sinus injections drive robust whole-brain expression of transgenes. eLife. 9, 53639 (2020).
- Michelson, N. J., Vanni, M. P., Murphy, T. H. Comparison between transgenic and AAV-PHP.eB-mediated expression of GCaMP6s using in vivo wide-field functional imaging of brain activity. Neurophotonics. 6 (2), 025014 (2019).
- Oomoto, I., et al. Protocol for cortical-wide field-of-view two-photon imaging with quick neonatal adeno-associated virus injection. STAR Protocols. 2 (4), 101007 (2021).
- Fan, J. T., et al. Video-rate imaging of biological dynamics at centimetre scale and micrometre resolution. Nature Photonics. 13 (11), 809-816 (2019).
- Stuart, G. J., Spruston, N. Dendritic integration: 60 years of progress. Nature Neuroscience. 18 (12), 1713-1721 (2015).
- Grienberger, C., Chen, X., Konnerth, A. Dendritic function in vivo. Trends in Neurosciences. 38 (1), 45-54 (2015).
- Takahashi, N., et al. Locally synchronized synaptic inputs. Science. 335 (6066), 353-356 (2012).
- Kitamura, K., Hausser, M. Dendritic calcium signaling triggered by spontaneous and sensory-evoked climbing fiber input to cerebellar Purkinje cells in vivo. The Journal of Neuroscience. 31 (30), 10847-10858 (2011).
- Manita, S., et al. A top-down cortical circuit for accurate sensory perception. Neuron. 86 (5), 1304-1316 (2015).
- Stobart, J. L., et al. Cortical circuit activity evokes rapid astrocyte calcium signals on a similar timescale to neurons. Neuron. 98 (4), 726-735 (2018).
- Srinivasan, R., et al. Ca(2+) signaling in astrocytes from Ip3r2(-/-) mice in brain slices and during startle responses in vivo. Nature Neuroscience. 18 (5), 708-717 (2015).
- Shigetomi, E., Patel, S., Khakh, B. S. Probing the complexities of astrocyte calcium signaling. Trends in Cell Biology. 26 (4), 300-312 (2016).
- Tischbirek, C., Birkner, A., Jia, H., Sakmann, B., Konnerth, A. Deep two-photon brain imaging with a red-shifted fluorometric Ca2+ indicator. Proceedings of the National Academy of Sciences of the United States of America. 112 (36), 11377-11382 (2015).
- Kondo, M., Kobayashi, K., Ohkura, M., Nakai, J., Matsuzaki, M. Two-photon calcium imaging of the medial prefrontal cortex and hippocampus without cortical invasion. eLife. 6, 26839 (2017).
- Demas, J., et al. cortex-wide volumetric recording of neuroactivity at cellular resolution using light beads microscopy. Nature Methods. 18 (9), 1103-1111 (2021).
- Ota, K., et al. cell-resolution, contiguous-wide two-photon imaging to reveal functional network architectures across multi-modal cortical areas. Neuron. 109 (11), 1810-1824 (2021).
- Sofroniew, N. J., Flickinger, D., King, J., Svoboda, K. A large field of view two-photon mesoscope with subcellular resolution for in vivo imaging. eLife. 5, 14472 (2016).
- Stirman, J. N., Smith, I. T., Kudenov, M. W., Smith, S. L. Wide field-of-view, multi-region, two-photon imaging of neuronal activity in the mammalian brain. Nature Biotechnology. 34 (8), 857-862 (2016).
- Yu, C. H., Stirman, J. N., Yu, Y., Hira, R., Smith, S. L. Diesel2p mesoscope with dual independent scan engines for flexible capture of dynamics in distributed neural circuitry. Nature Communications. 12 (1), 6639 (2021).
- Barson, D., et al. Simultaneous mesoscopic and two-photon imaging of neuronal activity in cortical circuits. Nature Methods. 17 (1), 107-113 (2020).
- Wekselblatt, J. B., Flister, E. D., Piscopo, D. M., Niell, C. M. Large-scale imaging of cortical dynamics during sensory perception and behavior. Journal of Neurophysiology. 115 (6), 2852-2866 (2016).
- Kim, T. H., et al. Long-term optical access to an estimated one million neurons in the live mouse cortex. Cell Reports. 17 (12), 3385-3394 (2016).
- Ghanbari, L., et al. Cortex-wide neural interfacing via transparent polymer skulls. Nature Communications. 10 (1), 1500 (2019).
- Takahashi, T., Zhang, H., Otomo, K., Okamura, Y., Nemoto, T. Protocol for constructing an extensive cranial window utilizing a PEO-CYTOP nanosheet for in vivo wide-field imaging of the mouse brain. STAR Protocols. 2 (2), 100542 (2021).
- Suzuki, T., Murayama, M. Craniotomy for cortical voltage-sensitive dye imaging in mice. Bio-Protocol. 6 (3), 1722 (2016).
- Jackman, S. L., et al. Silk fibroin films facilitate single-step targeted expression of optogenetic proteins. Cell Reports. 22 (12), 3351-3361 (2018).
- Rockwood, D. N., et al. Materials fabrication from Bombyx mori silk fibroin. Nature Protocols. 6 (10), 1612-1631 (2011).
- Jia, H., Rochefort, N. L., Chen, X., Konnerth, A. In vivo two-photon imaging of sensory-evoked dendritic calcium signals in cortical neurons. Nature Protocols. 6 (1), 28-35 (2011).
- Pachitariu, M., et al. Suite2p: beyond 10,000 neurons with standard two-photon microscopy. bioRxiv. , 061507 (2017).
- Srinivasan, R., et al. New transgenic mouse lines for selectively targeting astrocytes and studying calcium signals in astrocyte processes in situ and in vivo. Neuron. 92 (6), 1181-1195 (2016).
- Inoue, M., et al. Rational engineering of XCaMPs, a multicolor GECI suite for in vivo imaging of complex brain circuit dynamics. Cell. 177 (5), 1346-1360 (2019).
- Patriarchi, T., et al. Ultrafast neuronal imaging of dopamine dynamics with designed genetically encoded sensors. Science. 360 (6396), (2018).
- Sun, F., et al. A genetically encoded fluorescent sensor enables rapid and specific detection of dopamine in flies, fish, and mice. Cell. 174 (2), 481-496 (2018).
- Marvin, J. S., et al. An optimized fluorescent probe for visualizing glutamate neurotransmission. Nature Methods. 10 (2), 162-170 (2013).
- Feng, J., et al. A genetically encoded fluorescent sensor for rapid and specific in vivo detection of norepinephrine. Neuron. 102 (4), 745-761 (2019).
- Piatkevich, K. D., et al. Population imaging of neural activity in awake behaving mice. Nature. 574 (7778), 413-417 (2019).
- Sabatini, B. L., Tian, L. Imaging neurotransmitter and neuromodulator dynamics in vivo with genetically encoded indicators. Neuron. 108 (1), 17-32 (2020).
- Roome, C. J., Kuhn, B. Chronic cranial window with access port for repeated cellular manipulations, drug application, and electrophysiology. Frontiers in Cellular Neuroscience. 8, 379 (2014).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유