Method Article
체외 기질 스크리닝을 위해 정제된 재조합 초파리 카스파제를 사용한 절단 분석
요약
여기에서는 재조합 초파리 카스파제 Dronc 및 Drice를 발현하고 정제하는 프로토콜과 시험관 내 절단 분석에서의 사용을 제시합니다.
초록
Caspases는 세포 사멸 및 비 세포 사멸 과정에 관여하는 매우 특정한 세포 사멸 프로테아제입니다. 아폽토시스 동안 카스파제의 역할은 매우 잘 정의되어 있고 카스파제의 많은 아폽토시스 단백질 분해 기질이 확인되고 특성화되었지만, 비-아폽토시스 과정에 대한 카스파제의 역할은 잘 이해되지 않았다. 특히, 카스파제의 비 세포 사멸 기질은 지금까지 거의 확인되지 않았다. 여기서, 잠재적 카스파제 기질의 확인 및 특성화를 용이하게 하기 위해, 시험관내 카스파아제 절단 분석에서 후보 기질의 시험을 허용하는 프로토콜이 설명된다. 이 프로토콜에는 재조합 카스파아제 단백질의 생산 및 정제, 재조합 또는 무세포 발현 시스템에서의 후보 기질 생산, SDS-PAGE 및 면역블로팅에 따른 실제 시험관 내 절단 반응이 포함됩니다. 이 프로토콜은 초파리 카스파제 Dronc 및 Drice에 맞게 조정되었지만 포유류를 포함한 다른 유기체의 캐스파제에 쉽게 적용할 수 있습니다.
서문
프로그램된 세포 사멸 또는 세포자멸사는 카스파제(caspases)라고 하는 고도로 전문화된 세포 사멸 프로테아제 클래스에 의해 실행됩니다(참고문헌1에서 검토됨). 카스파제는 촉매 부위에 Cys 잔기를 함유하는 Cys 프로테아제이다. 그들은 합의 절단 부위를 정의하고 Asp 잔기 후에 단백질 분해 적으로 기질을 절단합니다 (Drosophila caspase Dronc도 Glu 잔기2 이후에 절단되는 것으로보고되었지만). 이들은 개시제 (정점 또는 업스트림이라고도 함)와 이펙터 (사형 집행 인 또는 다운 스트림) 카스파제로 세분됩니다. 개시제 카스파제는 이펙터 카스파제를 활성화시킨다. 예를 들어, 포유동물에서, 개시제 카스파아제 카스파아제-9는 이펙터 카스파아제 카스파아제-33을 절단하고 활성화시킨다. 마찬가지로, 초파리 멜라노가스터에서 카스파제-9-오르토로그 드론크는 카스파제-3-오르토로그 Drice 2,4를 절단하고 활성화합니다. 아폽토시스 동안, 이펙터 카스파제는 수백 개의 기질을 절단하여 세포(5)의 사멸을 초래한다.
Caspases는 세포에서 비활성 프로 엔자임 (zymogens)으로 합성됩니다. 이 형태에서는 N- 말단 프로 도메인, 프로 엔자임의 중앙 부분에 촉매 Cys가있는 큰 서브 유닛, C- 말단 1에 작은 서브 유닛을 포함합니다 (그림 1). 활성화 메커니즘은 개시제와 이펙터 카스파제 사이에서 다릅니다. 개시제 카스파제(Caspase-9, Dronc)는 활성화를 위해 이량체화가 필요하며, 이는 아폽토솜6이라고 하는 큰 단백질 복합체에 혼입되어 발생합니다. 아폽토솜으로의 통합을 위해 Caspase-9 및 Dronc는 N-말단 프로도메인에서 카스파아제 활성화 및 모집 도메인(CARD)을 운반합니다(그림 1). 아폽토솜 성분 Apaf-1은 또한 CARD를 포함하고 카드/CARD 상호작용을 통해 카스파제-9 또는 드론크를 아폽토솜 3,6,7로 모집합니다. Caspase-9 및 Dronc는 아폽토솜에서 단백질 분해 처리될 수 있지만, 이 처리는 효소 활성 8,9에 완전히 필요하지 않습니다.
대조적으로, 이펙터 카스파제 (Caspase-3, Drice)는 그들의 prodomain에 CARD를 운반하지 않으며, 활성화1을 위해 큰 단백질 복합체에 혼입되지 않는다. 이들은 각각 활성 Caspase-9 또는 Dronc1에 의한 단백질 분해 절단에 의존합니다. 활성 이펙터 카스파아제는 두 개의 큰 서브유닛과 두 개의 작은 서브유닛으로 구성된 사량체를 형성하므로 두 개의 촉매 부위를 포함합니다(그림 1). 이 프로토콜에서 중요한 것은 대장균에서 카스파제의 재조합 발현은 Apaf-1이 없는 경우에도 Drice 10 및 Dronc 2,8,9,11,12를 포함한 카스파제의 자동 처리 및 활성화를 유발합니다. 이러한 자동 처리는 재조합 카스파아제 단백질을 갖는 후보 기질의 시험관내 절단 분석을 수행할 수 있게 한다.
Caspases는 세포 사멸에 관여 할뿐만 아니라 증식, 분화, 세포 이동, 신경 가지 치기, 선천성 면역 및 기타13,14,15를 포함한 많은 비 세포 사멸 기능을 가질 수 있습니다. 비 세포 사멸 과정에서 활성 카스파 제를 함유하고 있음에도 불구하고 세포가 어떻게 생존 할 수 있는지는 현재 알려져 있지 않습니다. 이들 세포는 준치사 수준(16)에서만 카스파제를 활성화시키거나 원형질막(17, 18)과 같은 세포의 비-아폽토시스 구획에서 활성 카스파제를 격리하는 것이 가능하다. 따라서 비-아폽토시스 기질의 확인 및 검증은 카스파제가 비-아폽토시스 과정을 매개하는 방법을 밝힐 뿐만 아니라 활성 카스파제의 존재 하에서 세포가 어떻게 생존할 수 있는지 이해하는 데 도움이 될 수 있습니다.
카스파아제 기질로서의 후보 단백질은 유전적 및 생화학적 방법을 사용하여 확인할 수 있다. 확인된 단백질은 컨센서스 Dronc 절단 부위의 존재 여부를 확인할 수 있습니다. 이는 단백질 서열을 육안으로 검사하거나 CasCleave(https://sunflower.kuicr.kyoto-u.ac.jp/~sjn/Cascleave/)19,20과 같은 보다 정교한 온라인 생물정보학 도구를 사용하여 수행할 수 있습니다. 이러한 도구는 카스파제의 알려진 합의 절단 부위와 구조적 고려 사항을 사용하여 카스파제의 새로운 표적을 예측합니다. CasCleave는 인간 Caspases-1, -3, -6, -7 및 -8의 검증된 기질의 정보를 통합하지만, 그럼에도 불구하고 이러한 카스파제 및 이들의 합의 절단 부위가 잘 보존되어 있기 때문에 여기에 설명된 목적에도 유용할 수 있습니다. 그러나 Dronc 절단 부위가 잘 정의되어 있지 않기 때문에(2건의 연구에서 TATD/E2 및 LALD9라는 두 가지 다른 최적 절단 부위가 확인됨), 후보 기질은 Drice를 포함한 다른 카스파아제 절단 부위의 존재에 대해서도 검사됩니다.
카스파제의 예측된 기질을 검증하려면 추가 분석이 필요합니다. 이러한 분석 중 하나는 주어진 카스파아제가 실제로 후보 단백질을 시험 관 내에서 절단할 수 있다는 입증입니다. 여기에서, 우리는 시험관 내 카스파제 절단 분석을 위한 편리한 프로토콜을 제공합니다. 이 프로토콜을 사용하여 후보 기질을 Dronec를 카스파제로 사용하여 테스트합니다. 그들은 또한 Drice의 기질로 테스트 할 수 있습니다. 이 프로토콜은 Drosophila caspases Dronc 및 Drice를 위해 작성되었지만 다른 유기체의 caspases에도 적용 할 수 있습니다.
시험관 내 절단 분석과 함께 Dronc 및 Drice의 추출 및 정제는 이러한 카스파제에 의한 촉매 활성의 손실로 인해 같은 날에 수행되어야 합니다. 이 프로토콜은 이전 간행물 8,9,11,12,21,22에서 수정 및 최적화되었습니다. 이 프로토콜에서, 4개의 상이한 카스파제 단백질은 E. coli 균주 BL21 (DE3) pLysS에서 재조합적으로 발현된다. 이러한 단백질은 6xHis-Dronc wt, 6xHis-DroncC318A, 6xHis-Dricewt 및 6xHis-DriceC211A입니다. 이들 단백질 각각은 정제를 위해 N- 말단에 6 개의 히스티딘 잔기 (6xHis)로 태그됩니다. Dronc wt 및 Dricewt는 야생형 단백질이며 재조합 발현시 활성 카스파아제로 자동 처리할 수 있습니다. DroncC318A 및 DriceC211A는 촉매 Cys 잔기를 Ala 잔기로 변경하는 Dronc 및 Drice의 돌연변이 형태를 암호화합니다. 이러한 구조물은 촉매적으로 비활성이며 자동 처리할 수 없습니다(그림 2A 참조). 이들은 절단 분석에서 대조군으로 사용됩니다. DriceC211A는 자동 처리할 수 없기 때문에 여기에 설명된 체외 절단 분석에서 Droncwt의 모델 기질로도 사용됩니다.
프로토콜
1. 박테리아에서 재조합 카스파아제 발현
- 관심 유전자(카스파제 또는 추정 기질)를 표준 프로토콜23을 사용하여 N- 및/또는 C-말단 태그(들)를 갖는 박테리아 발현 벡터로 복제한다.
참고: 태그는 재조합 단백질의 용해도를 증가시킬 수 있으며 재조합 단백질의 정제에 사용됩니다. 여기서, Dronc, Drice, 및 이들의 촉매 돌연변이체는 벡터 pET28a에 클로닝되고, 이는 N-말단 6xHis 태그 (pET28a-6xHis-Dronc wt, pET28a-6xHis-Dronc C318A, pET28a-6xHis-Dricewt, pET28a-6xHis-DriceC211A)를 제공한다. (입문서 정보는 보충 표 1 참조). - 관심 유전자를 갖는 벡터를 표준 절차 23,24를 사용하여 유능한 BL21 (DE3) pLysS E. 대장균 세포로 형질전환시킨다. 형질전환 혼합물을 LB 한천 플레이트에 적절한 항생제(pET28a의 경우 카나마이신)로 플레이팅하여 형질전환 박테리아를 선택합니다. (보충 표 2 참조)
- 플레이트에서 콜로니를 선택하고 적절한 항생제가 포함된 LB 배지 5mL에 접종하여 진탕 플랫폼에서 220rpm으로 37°C에서 밤새 성장시킵니다.
- 다음 날, 항생제로 LB 배지 30-50mL(샘플당)를 준비하고 하룻밤 동안 배양한 배양액 1mL를 추가합니다. 바이오 광도계 / 분광 광도계를 사용하는 600 nm (OD600)에서의 광학 밀도는 0.1에서 0.2 사이 여야합니다.
- 배양물을OD600 이 0.6에 도달할 때까지 진탕 플랫폼 상에서 220 rpm으로 37°C에서 성장시킨다. OD600 이 0.6에 도달할 때까지 매시간 확인하십시오. 약 2-3 시간이 걸립니다.
- 단백질 (카스파제) 발현을 유도하려면 IPTG를 0.1-0.2mM의 최종 농도로 첨가하십시오 (IPTG 스톡에서 1 : 1,000-1 : 500으로 희석, 보충 표 2 참조).
- 배양물을 220 rpm에서 30°C에서 3시간 동안 성장시킨다.
참고: 시간과 온도는 발현되는 단백질의 종류와 용해도에 따라 다릅니다. 이러한 조건은 다른 카스파제 또는 기질이 표현되는 경우 조정해야 할 수 있습니다. - 3시간 후, 배양물을 50mL 원심분리 튜브에서 4°C에서 2,000 x g으로 20분 동안 스핀다운합니다. 상청액을 버리고 펠릿으로 진행하십시오.
참고: 이 시점에서 프로토콜을 중지하고 나중에 계속할 수 있습니다. 박테리아 펠릿은 -80 °C에서 동결 될 수 있습니다.
2. 소규모 재조합 카스파제 추출
- -80°C 보관에서 펠렛화된 배양액과 함께 냉동 튜브를 제거하고 펠릿을 부드럽게 하기 위해 10분 동안 얼음 위에 보관합니다.
- 10분 후, 1mL 혈청학적 피펫이 있는 피펫 컨트롤러를 사용하여 새로 첨가된 프로테아제 억제제, 10mg/mL의 리소자임 및 50U/mL의 벤조나제가 보충된 0.6mL의 박테리아 세포 용해 완충액(보충 표 2)을 펠릿 함유 튜브에 추가합니다.
- 동일한 피펫 팁을 사용하여 펠릿 입자가 없는 투명한 옅은 노란색 용액이 보일 때까지 위아래로 피펫팅하여 펠릿을 용해시킵니다. 얼음 위에서 30분 동안 배양합니다.
- 용해물을 적절한 원심분리 튜브로 옮기고 용해물을 17,000 x g 에서 4°C에서 40분 동안 원심분리합니다.
- 상청액을 1.5mL 마이크로 원심분리 튜브로 옮깁니다. 이것은 카스파제를 함유 한 조 추출물입니다.
- 튜브를 얼음 위에 놓고 Ni-NTA 아가 로스로 정제를 진행하십시오.
3. 소규모 His-tagged 카스파제 정제
- 단계 2.5로부터의 카스파아제 추출물의 각 튜브에 Ni-NTA 아가로스의 50% 슬러리 0.2 mL를 첨가한다. 엔드 온 엔드 회전 장치의 튜브를 4 ° C에서 1 시간 동안 회전시킵니다.
- 1시간 후, 팁이 손상되지 않은 상태에서 Ni-NTA 아가로스가 있는 추출물을 폴리프로필렌 컬럼 1mL에 넣고 랙에 넣습니다. 5 분 동안 그대로 두십시오.
- 5분 후, 컬럼의 캡을 제거하고 중력 흐름에 의해 상청액이 흘러나오도록 합니다.
- Ni-NTA 아가로스의 충전된 수지를 방해하지 않고 컬럼에 세척 완충액 1mL(보충 표 2)를 조심스럽게 추가하고 중력 흐름을 통해 세척합니다.
- 세척 단계를 세 번 수행하십시오.
- 카스파아제 용리를 위해 세척 버퍼를 완전히 배출한 후 컬럼의 수집 노즐 아래에 1.5mL 미세 원심분리 튜브를 놓습니다.
- 각 컬럼에 0.5mL의 용출 완충액(사용 직전에 1x 프로테아제 억제제가 보충됨)을 추가하고 1.5mL 미세 원심분리 튜브에 용출액을 수집합니다.
참고: 미세 정제된 용출액은 색상이 투명합니다. - 용출액을 얼음 위에 보관하고 Bradford 분석25로 단백질 농도를 측정합니다. 정제된 카스파제의 순도/균질성을 SDS-PAGE로 확인한 후 쿠마시 블루 염색26.
참고: 50mL LB 배양의 수율은 카스파아제 단백질 0.5mg에서 1.5mg 사이입니다. 용리에 0.5mL의 용리 완충액이 사용된다는 점을 감안할 때 농도 범위는 1에서 3mg/mL입니다. 이러한 카스파아제 제제가 밤새 활성을 잃기 때문에 용해 및 정제 당일에 시험 관내 절단 분석을 위해 정제된 카스파제 용출액을 사용하는 것이 중요합니다.
4. 무세포 발현 시스템에서 추정 카스파아제 기질의 발현
참고: 이 프로토콜에서 Dronc의 천연 기질인 Drice는 대장균 의 재조합 발현(위의 섹션 3 참조)과 포유류 무세포 발현 시스템인 토끼 망상적혈구 용해물(RRL)에서의 발현에 의해 제조됩니다(이 섹션, 아래 참조).
- 추정 기질의 유전자를 표준 절차 23을 사용하여 T7,T3 또는 SP6 프로모터 중 어느 하나를 함유하는 발현 벡터 내로 복제한다.
참고: 이 프로토콜에서 DriceC211A 는 모델 기질로 사용되고 유전자 발현을 위한 T7 프로모터를 운반하고 면역 블로팅에 의한 검출을 위해 N-말단 Myc-태그로 추정 단백질 기질을 태그하는 벡터 pT7CFE1-N-Myc에 클로닝되었습니다. - RRL에서, 후보 기질은 방사성 또는 비방사성으로 합성될 수 있다.
- 비방사성 합성: 0.5mL 미세 원심분리 튜브에 RRL 25μL, 반응 완충액 2μL, 류신 마이너스 아미노산 혼합물 0.5μL(1mM), 아미노산 혼합물-마이너스 메티오닌(1mM), 리보뉴클레아제 억제제 1μL(40U/μL), DNA 주형(0.5μg/μL) 2μL, T7-RNA 폴리머라제 1μL를 추가합니다. 뉴클레아제가 없는 물을 추가하여 반응의 최종 부피를 50μL로 조정합니다. 피펫팅을 하거나 피펫 팁으로 교반하여 성분을 부드럽게 혼합하고 잠시 스핀다운합니다.
참고: RRL 용해물에는 100-200mg/mL의 내인성 단백질이 포함되어 있습니다. 시험관 내 번역 반응의 경우 RRL을 50% 농도로 추가합니다(여기서는 25μL/50μL 반응). - 방사성 합성: 0.5mL 미세원심분리 튜브에 RRL 용해물 25μL, 반응 완충액 2μL, 아미노산 혼합물-마이너스 메티오닌 0.5μL(1mM), 리보뉴클레아제 억제제 1μL(40U/μL), DNA 주형 2μL(0.5μg/μL), S35 표지 메티오닌 2μL(10mCi/mL에서 1000Ci/mmol) 및 T7-RNA 폴리머라제 1μL를 추가합니다. 뉴클레아제가 없는 물을 추가하여 반응의 최종 부피를 50μL로 조정합니다. 피펫팅을 하거나 피펫 팁으로 교반하여 성분을 부드럽게 혼합하고 잠시 스핀다운합니다. 팁과 튜브는 방사성 폐기물 용기에 폐기하십시오.
참고: 류신 없이 아미노산 혼합물을 첨가하지 마십시오. pT7CFE1 벡터는 단백질 발현을 위해 T7 프로모터를 사용한다. 다른 벡터는 T3 또는 SP6 프로모터를 사용한다. 이 경우 T7 RNA 중합효소 대신 T3 또는 SP6 RNA 중합효소를 사용해야 합니다. DNA 주형이 고순도인지 확인하십시오.
- 비방사성 합성: 0.5mL 미세 원심분리 튜브에 RRL 25μL, 반응 완충액 2μL, 류신 마이너스 아미노산 혼합물 0.5μL(1mM), 아미노산 혼합물-마이너스 메티오닌(1mM), 리보뉴클레아제 억제제 1μL(40U/μL), DNA 주형(0.5μg/μL) 2μL, T7-RNA 폴리머라제 1μL를 추가합니다. 뉴클레아제가 없는 물을 추가하여 반응의 최종 부피를 50μL로 조정합니다. 피펫팅을 하거나 피펫 팁으로 교반하여 성분을 부드럽게 혼합하고 잠시 스핀다운합니다.
- 반응물을 30°C에서 90분 동안 인큐베이션한다.
- 10초 동안 잠깐 돌리고 튜브를 얼음 위에 놓습니다. RRL에서 추정 기질의 발현 수준을 SDS-PAGE 및 면역블로팅/자가방사선촬영으로 확인합니다.
참고: 절단 반응에 첨가되는 RRL 추출물의 양은 검출 방법(면역블로팅 또는 S35 오토라디오그래피)으로 검출할 수 있는 단백질의 양을 기준으로 해야 합니다. 시험관 내 절단 분석(다음 섹션)으로 진행하거나 -80°C에서 보관하십시오.
5. RRL로 생성된 기질 을 사용한 시험관 내 절단 분석
- 섹션 4에 설명된 대로 생성된 추정 기판을 가져옵니다. 이 프로토콜에서는 N-Myc-DriceC211A 가 모델 기판으로 사용됩니다.
- 추정 기질의 발현 수준에 따라(면역블롯 또는 자가방사선 촬영 분석에 의해 별도로 결정됨, 단계 4.4 참조), 절단 분석에서 관심 단백질로 프로그래밍된 RRL의 1-10μL를 사용합니다.
- 섹션 1, 2 및 3에서 생성된 정제된 카스파아제 단백질 10μg을 추가합니다.
- 카스파아제 분석 완충액으로 총 반응 부피를 50μL로 만듭니다.
- 반응물을 30°C의 수조에서 3시간 동안 인큐베이션합니다. 절단 분석에 적절한 대조군을 포함해야 합니다. 여기서, 촉매 돌연변이 DroncC318A 가 대조군으로 사용된다.
- 3 시간 후, 튜브를 얼음 위로 옮겨 반응을 중지하십시오.
- 50mM DTT를 포함하는 LDS 샘플 버퍼 한 부피를 추가합니다. 반응은 LDS 샘플 완충액의 첨가로 완전히 정지된다.
- 샘플을 열 블록에서 75°C에서 10분 동안 인큐베이션합니다.
- 빠르게 회전하고, 플릭으로 혼합하고, 샘플당 24μL를 로드하고, SDS-PAGE를 실행하거나(섹션 7 참조) 샘플을 -20°C에서 보관합니다.
6. 박테리아로 발현된 재조합 기질 단백질을 사용한 시험관 내 절단 분석
- 10μg의 정제된 후보 기질(여기서는 섹션 1, 2 및 3에서 생성된 6xHis-DriceC211A)을 0.5mL 미세 원심분리 튜브에 추가합니다.
- 섹션 1 및 2에서 생성된 정제된 카스파아제 단백질 10μg을 추가합니다. 카스파아제 분석 완충액을 사용하여 총 부피를 50μL로 가져옵니다.
- 5.5-5.9단계를 수행합니다.
7. SDS-PAGE 및 면역 블로팅
- 절단 반응(24μL)을 4%-12% 트리스-글리신 또는 비스-트리스 그래디언트 겔(재료 표)에 로드하고 단백질 전기영동 및 면역블로팅(또는 S35 표지 기질을 사용하는 경우 자가방사선 촬영)을 수행하여 표준 절차27,28을 사용하여 결과를 시각화합니다.
참고: 여기, 이 프로토콜에서, Mops 실행 버퍼 및 LDS 로딩 버퍼가 있는 Bis-Tris 그래디언트 겔이 사용되었습니다. 일반적으로 트리스-글리신 겔의 일반적으로 사용되는 PAGE 프로토콜은 트리스-글리신-SDS 실행 버퍼와 SDS 로딩 버퍼를 사용하여 실행됩니다.
결과
이 프로토콜은 대장균에서 카스파아제 단백질 유도, 재조합 초파리 카스파제 Dronc 및 Drice의 정제, 후보 기질의 합성, 후보 기질(여기서는 DriceC211A) 및 카스파아제 Dronc와의 시험관 내 절단 반응에 대한 단계별 지침을 제공합니다. 촉매 돌연변이 DriceC211A는 자동 처리 활성이 없고(그림 2A) Droncwt에 의해 절단될 때까지 전장으로 남아 있기 때문에 이 분석에서 모델 기질로 사용되었습니다. DriceC211A는 Droncwt 제제가 효소 활성을 가지고 있음을 검증하기 위해 항상 양성 대조군으로 사용해야합니다.
도 2A는 재조합 카스파제의 발현 및 정제의 대표적인 예를 제공한다. 4개의 상이한 재조합 카스파제를 유도하고 정제하였다: 6xHis-Droncwt, 6xHis-Dronc C318A, 6xHis-Drice wt, 및 6xHis-Drice C211A. 정제된 카스파제를 SDS-PAGE에 의해 실행시키고, 면역블롯하고, 블롯을 항-His 항체 (희석된 1:5,000; 이어서 항-마우스 IgG, HRP-연결된 항체 (1:10,000))로 프로빙하였다. 처리되지 않은 6xHis-Dronc (proDronc)는 55kDa (레인 2)의 상대 분자량 (MW r)에서 실행되며 처리되지 않은 6xHis-Drice (proDrice)는 35kDa (레인 4)의 MWr을 갖습니다. 카스파제의 자동 처리는 N- 말단에 His- 태그가 존재하기 때문에 카스파제의 큰 서브 유닛을 나타내는 더 작은 MWr의 밴드의 출현으로 볼 수 있습니다 (그림 1). 6x-Dronc의 경우 대형 서브 유닛의 MWr은 40kDa입니다 (레인 1). 6x-Drice의 큰 서브 유닛은 23kDa (레인 3)에서 실행됩니다. 촉매 돌연변이 6xHis-DroncC318A 및 6xHis-DriceC211A는 자동 처리에 실패하고 전장 단백질로만 검출 할 수 있습니다 (레인 2 및 4).
그림 2B 박테리아적으로 생성 및 정제된 6xHis-Droncwt 제제가 효소 활성을 갖는다는 것을 입증하기 위해, 본 프로토콜에 기재된 바와 같이 시험관내 절단 분석을 수행하였다. 음성 대조군으로서, 촉매 돌연변이체 6xHis-DroncC318A를 사용하였다. 기질은 RRL 생성 N-Myc-DriceC211A였으며, 이는 N-말단에 Myc-태그로 태그되어 있습니다. 시험관 내 절단 반응 후, 단백질을 SDS-PAGE로 분리하고, 면역 블롯 처리하고, 블롯을 항 Myc 항체 (희석 1 : 1,000)와 함께 배양 한 후 항 마우스 IgG, HRP 결합 항체 (1 : 10,000))를 배양하여 N-Myc-DriceC211A를 검출했다. 카스파아제의 성공적인 절단 및 따라서 효소 활성은 기질의 전장, 미처리 형태에 비해 더 작은 MWR의 적어도 하나의 밴드의 출현에 의해 입증될 수 있다. 처리되지 않은 전장 N-Myc-Drice C211A는 MWr이 40kDa(레인 2 및 4)인 반면, 처리된 N-Myc-DriceC211A의 큰 서브유닛은 30kDa(레인 3)에서 실행됩니다. 레인 1은 프로그램되지 않은 RRL 용해물(플라스미드/전사체 첨가 없음)을 나타낸다. 레인 2는 RRL 발현에 의한 DriceC211A의 시험관내 생산을 입증한다. 레인 3은 6xHis-Dronc중량을 갖는 시험관내 절단 반응을 함유한다. 레인 4는 6xHis-DroncC318A와의 시험관 내 절단 반응을 포함합니다.
그림 2C 이 프로토콜에 따라 재조합 및 정제된 카스파아제(6xHis-Droncwt 및 6x-His-DroncC318A) 및 기질(6xHis-DriceC211A)을 모두 사용하는 시험관내 절단 반응을 SDS-PAGE 및 면역블롯으로 분석하였다. 절단 반응의 분석을 위해, 항-절단된 Drice 항체 (희석된 1:5,000; 이어서 항-토끼 IgG, HRP-결합 항체 (1:10,000))를 이 면역블롯에 사용하였다. 항-절단된 Drice 항체는 6xHis-Droncwt (레인 1)에 의해 처리된 후에만 6xHis-DriceC211A의 큰 서브유닛(23kDa)에서 그의 네오-에피토프를 검출한다. 촉매 돌연변이 6xHis-DroncC318A는 이 분석에서 6xHis-Drice C211A를 처리할 수 없으며 전장 6xHis-DriceC211A는 35kDa(레인 2)의 희미한 미처리 대역으로 나타납니다.
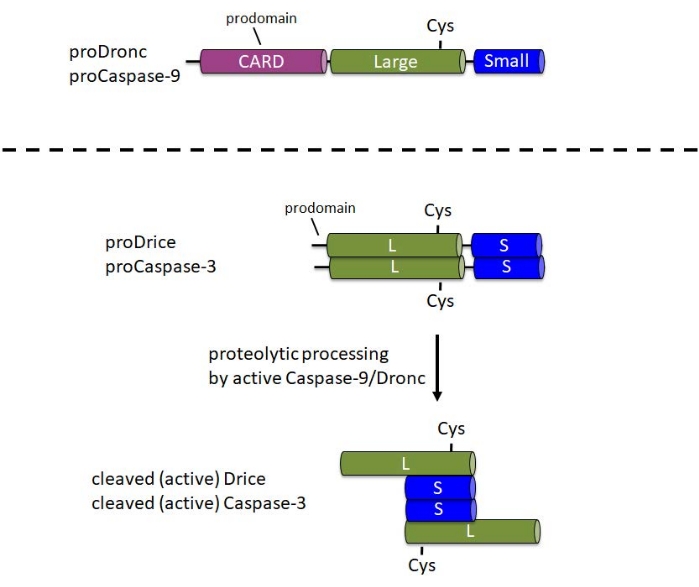
그림 1: 개시제 카스파아제 카스파제-9 및 드론과 이펙터 카스파제 카스파제-3 및 드리스의 도메인 구조. CARD - 카스파아제 활성화 및 모집 도메인; Cys - 촉매 시스테인 잔기의 상대적 위치; L - 큰 서브 유닛; S - 작은 서브 유닛. N 터미널 프로 도메인의 위치가 표시됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
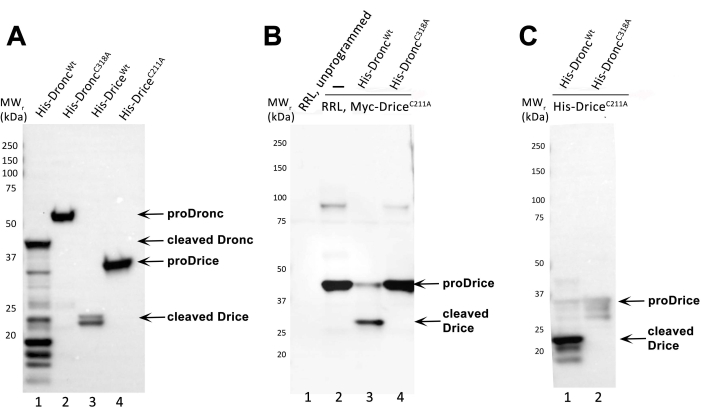
그림 2: 대표적인 결과. (A) 항-His 항체로 프로빙된 정제된 재조합 6xHis-Dronc 및 6xHis-Drice 제제의 면역블롯 분석. 처리되지 않은 (proDronc 및 proDrice) 및 절단 된 6xHis-Dronc 및 6xHis-Drice는 화살표로 표시됩니다. MW 마커는 왼쪽에 표시됩니다. (B) 항-Myc 항체로 프로빙된 카스파제 6xHis-Droncwt (레인 3) 또는 6x-His-DroncC318A (레인 4)를 사용한 RRL-생성 N-Myc-Drice의 시험관내 절단 반응의 면역블롯 분석. 프로그래밍되지 않고 프로그래밍된(N-Myc-DriceC211A) RRL 반응은 레인 1과 2에서 로드되고 분리됩니다. 처리되지 않은 (proDrice) 및 절단 된 N-Myc-Drice는 화살표로 표시됩니다. MW 마커는 왼쪽에 표시됩니다. (c) 항-절단된 Drice 항체로 프로빙된 박테리아 발현 및 정제된 재조합 6xHis-Drice C211A와 카스파제 6xHis-Droncwt (레인 1) 또는 6x-His-DroncC318A(레인 2)의 시험관내 절단 반응의 면역블롯 분석. 전장 (proDrice) 및 절단 된 6xHis-DriceC211A는 화살표로 표시됩니다. MW 마커는 왼쪽에 표시됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
보충 표 1: 이 표에는 pET28a 벡터에서 클로닝에 사용된 프라이머가 포함되어 있습니다. 이 파일을 다운로드하려면 여기를 클릭하십시오.
보충 표 2: 이 표에는 버퍼 및 미디어의 구성이 포함되어 있습니다. 이 파일을 다운로드하려면 여기를 클릭하십시오.
토론
카스파제와 카스파아제 기능에 대한 우리의 지식의 대부분은 지난 30년 동안 세포자멸사에 대한 집중적인 작업에서 파생되었습니다. 개시제 카스파제가 이펙터 카스파제를 단백질 분해적으로 처리한다는 것은 매우 잘 확립되어 있으며, 수백 개의 단백질이 아폽토시스 5,29 동안 이펙터 카스파제 기질로서 확인되었다. 대조적으로, 비 세포 사멸 과정에 대한 카스파 제의 기능과 그들이 처리하는 비 세포 사멸 기질에 대해서는 알려진 바가 훨씬 적습니다. 개시자 카스파제가 여기에서 주요 의사 결정자라고 생각할 수 있습니다. 세포 사멸 동안, 그들은 세포 사멸을 일으키는 이펙터 카스파 제를 활성화시킵니다. 그러나, 비 세포 사멸 과정을 유발하기 위해, 그들은 비 세포 사멸 과정을 제어하는 다른 단백질 (이펙터 카스파제 제외)을 활성화 할 수있다. 이 프로토콜은 Drosophila17,30에서 개시제 카스파아제 Dronc의 기질로서 후보 단백질을 테스트합니다.
절단 분석에서 시험될 기질은 RRL과 같은 시험관내 포유동물 무세포 발현 시스템에서 또는 E. coli에서의 재조합 발현에 의해 생산될 수 있다. 박테리아 발현에 비해 RRL 을 사용한 시험관 내 발현에는 몇 가지 이점이 있습니다. RRL 발현 프로토콜은 간단하고 빠르기 때문에 다양한 기질을 병렬로 준비할 수 있습니다. 많은 경우에, 관심있는 단백질을 함유하는 RRL 추출물은 절단 분석에 사용하기 전에 -80 °C에서 저장 될 수있다 (이는 각 기질에 대해 별도로 결정되어야 함). 추정 기질은 S35-Met로 표지 할 수 있으므로 SDS-PAGE 후 자동 방사선 촬영으로 쉽게 분석 할 수 있습니다. 이는 이용가능한 기질 특이적 항체가 없는 경우에 특히 유용하다. 대안적으로, S35-Met 표지가 바람직하지 않은 경우, 추정 기질은 Flag, HA, 또는 Myc 태그와 같은 공통 태그로 태깅될 수 있으며, 이는 면역블로팅에 의한 카스파아제 절단의 검출을 허용한다.
이 프로토콜의 성공 여부는 재조합 Dronc 및 Drice 단백질의 신중하고 일관된 정제에 달려 있음을 강조해야합니다. 불행히도, 이러한 단백질은 냉장고에 보관하거나 냉동하지 않고 단기간에도 보관할 수 없습니다. 그들은 저장된 형태로 하룻밤 사이에 효소 활성을 잃습니다. 따라서 절단 분석 당일에 신선하게 준비해야합니다. 테스트 중인 후보 단백질에 관계없이 DriceC211A는 Droncwt 제제의 효소 활성을 검증하기 위해 항상 양성 대조군으로 사용해야 합니다(그림 2B, C 참조). 대안적으로, Dronc 및 Drice 제제의 활성은 또한 플루오로제 닉 합성 테트라펩타이드 기질 2,9,31의 시험관내 절단에 의해 시험될 수 있다.
항체가 후보 기질을 검출하기 위해 사용되는 경우, 이들은 사용자(32, 33)에 의해 검증될 필요가 있다. 이는 Flag, HA, Myc 등과 같은 에피토프 태그를 검출하는 상업적으로 이용가능한 항체에도 적용된다. 항체 품질이 좋지 않으면 중요한 결과가 가려질 수 있습니다. 상이한 태그를 갖는 N- 및 C-말단 둘 둘 상의 후보 기질의 이중-에피토프-태깅이 또한 권장된다(34). 절단이 발생하면 이중 태깅은 두 절단 생성물을 추적하는 데 도움이 되며 하나 이상의 부위에서 절단이 발생하는지 설명하는 데 도움이 될 수 있습니다.
이 프로토콜은 Dronc, Drice의 알려진 생물학적 기질을 쉽게 검증하지만 한계도 있습니다. 한 가지 한계는 이것이 재조합 단백질을 사용한 시험관내 프로토콜이라는 것입니다. 이 분석에서 카스파제는 비생리학적으로 높은 농도로 존재하며, 이는 대장균 에서 자발적으로 자동 처리할 수 있다는 관찰에서 분명합니다. 자발적인 자동 처리는 일반적으로 생리적 조건 하에서 발생하지 않습니다. 이 높은 카스파아제 농도는 가짜 활성을 유발하여 위양성을 유발할 수 있습니다. 위양성은 시험관내 절단 반응에서 카스파아제 농도를 낮춤으로써 제거될 수 있다. 또한 아래에 자세히 설명된 대로 정품 기질을 확인하고 위양성을 제거하기 위해 추가 분석이 필요합니다.
재조합 카스파제는 생체내에서 그의 정상 세포 환경에서 갖는 것과 동일한 특이성을 갖지 않을 수 있다. 예를 들어, 카스파제의 활성은 번역 후 변형에 의해 수정될 수 있다. 이들은 재조합 단백질에 존재하지 않습니다. 또한, 생체 내에서, Dronc를 포함한 개시제 카스파제는 아폽토솜과 같은 큰 단백질 복합체에 혼입된다. 이 프로토콜의 조건 하에서, 세포 사멸의 형성은 달성되지 않는다. 이를 위해서는 Drosophila Apaf-1 (일명 Dark 또는 Hac-1)35-37의 재조합 발현이 필요합니다. 따라서 in vitro, Dronec는 in vivo와 동일한 특이성을 갖지 않을 수 있습니다.
또한 Dronec가 비 세포 사멸 과정을 위해 다른 단백질 복합체에 통합되는 것으로 생각할 수 있습니다. 이것은 Dronc에 다른 절단 특이성을 부여할 수 있으며, 이는 또한 Dronc가 비-아폽토시스 조건에서 세포자멸사를 유도하지 않는 이유를 설명할 수 있습니다. 이와 관련하여, CasCleave는 새로운 카스파제 기질을 예측하기 위해 공지된 절단 컨센서스 부위를 사용한다. 그러나, 동일한 절단 합의 부위가 비 세포 사멸 과정에도 사용되는지 여부는 알려지지 않았다. 실제로, 최근에, Caspase-3는 병아리 배아38에서 발달하는 청각 뇌간에서 비-아폽토시스 과정 동안 그의 바람직한 합의 부위를 변화시키는 것으로 나타났다. 마찬가지로, 개시제 카스파제가 상이한 단백질 복합체에 혼입되는 경우, 이들은 상이한 특이성을 가질 수 있고, 따라서 상이한 컨센서스 서열에서 절단될 수 있다.
이러한 제한은 이 프로토콜에 기재된 시험관내 절단 분석에 전적으로 의존하는 것만으로는 충분하지 않다는 것을 보여줍니다. 이 프로토콜을 사용하여 얻은 결과를 추가로 검증하기 위해 대체 접근 방식을 사용해야 합니다. 이상적으로, 생체 내 분석은 다음의 질문을 해결하기 위해 사용되어야 한다: 후보 단백질은 생체내에서 비-아폽토시스 과정 동안 단백질 분해 처리되는가? 그렇다면 생체 내 및 시험 관 내에서 동일한 절단 부위가 사용됩니까? 분열 부위의 돌연변이 유발에 의해 분열이 차단되면 어떤 결과가 발생합니까? 후보 기판의 처리는 카스파제에 의존하며, 그렇다면 어느 것입니까? 비 세포 사멸 과정에서 절단 단편의 역할은 무엇입니까? 이러한 질문은 표준 유전 및 형질 전환 방법을 사용하여 C. elegans 및 Drosophila 와 같은 유전 모델 유기체에서 쉽게 해결할 수 있습니다.
요약하면, 이 프로토콜은 효소 활성 카스파제, 특히 초파리 카스파제 Dronc 및 Drice를 생산하는 신뢰할 수 있고 일관된 방법을 설명합니다. 이 프로토콜의 궁극적인 목표는 Dronec가 유전적, 생화학적 또는 생물정보학적 접근 방식으로 식별된 후보 기질을 시험 관 내에서 절단할 수 있는지 여부를 조사하는 것입니다. 이전 단락에서 설명한 바와 같이, 이러한 단백질을 생체 내에서 카스파제 기질로 검증하기 위해서는 추가 분석이 필요합니다. 후생동물에 걸친 카스파아제 유전자의 보존 정도를 감안할 때 이 프로토콜을 다른 유기체의 카스파제에도 적용할 수 있어야 합니다.
공개
저자는 경쟁 이익이 없다고 선언합니다.
감사의 말
실험실에서 프로토콜을 수립하는 데 도움을 주신 Elif Kamber-Kaya박사에게 감사드립니다. Guy Salvesen 박사는 친절하게도 DriceC211A 돌연변이9를 제공했습니다. 이 연구는 보조금 번호 2R35GM118330에 따라 국립 보건원 (NIH)의 국립 일반 의학 연구소 (NIGMS)의 MIRA 상으로 자금을 지원했습니다. 자금 제공자는 연구 설계, 데이터 수집 및 분석, 출판 결정 또는 원고 준비에 아무런 역할도 하지 않았습니다.
자료
| Name | Company | Catalog Number | Comments |
| Ampicillin | Fisher | BP1760-25 | |
| Anti-His antibody | Sigma-Aldrich | MA1-21315 | |
| Anti-mouse IgG, HRP-linked Antibody | Cell signaling | 7076P2 | |
| Anti-Myc antibody | Santa Cruz Biotechnology | sc-40 | |
| Anti-rabbit IgG, HRP-linked Antibody | Cell signaling | 7074P2 | |
| Benchtop Centrifuge | Eppendorf | 5415 R | |
| Benzonase | Sigma-Aldrich | E1014-5KU | |
| BioPhotometer | Eppendorf | #6131 | |
| BL21 (DE3) pLysS Competent Cells | Promega | L1195 | |
| Centrifuge rotor | Beckman Coulter | JA-25.50 | |
| CHAPS | Sigma-Aldrich | C3023-1G | |
| ChemiDoc with image software | Bio-Rad | Universal Hood II | For Chemiluminiscence imaging |
| Chemiluminiscence Substrate | Thermofisher Scientific | 34095 | For Chemiluminiscence imaging |
| Cleaved Drosophila ICE (drICE) (Asp230) Antibody | Cell Signaling Technology | 9478S | |
| Disposable cuvettes | Fisher Scientific | 14955128 | Used to measure bacterial growth and protein concentration |
| Dithiothreitol (DTT) | Bio-Rad | #1610610 | |
| Erlenmeyer flasks, 1000 mL | Millipore sigma | CLS49801L | For LB agar media preparation and autoclaving |
| Erlenmeyer flasks, 250 mL | Millipore sigma | CLS4980250 | For bacterial culture growth and induction. |
| Ethylene-diamine-tetra-acetic Acid (EDTA) | Sigma-Aldrich | E5134 | |
| Gel extraction kit | Qiagen | 28704 | |
| Gel tank SDS-PAGE system | Thermofisher Scientific | STM1001 | |
| Glycine | Sigma-Aldrich | G8898 | |
| Halt Protease Inhibitor Cocktail (100x) | Thermofisher scientific | 87786 | |
| HEPES | Sigma-Aldrich | H3375 | |
| His-Drice-pET28a | This study | N/A | Available from authors |
| His-DriceC211A-pET28a | This study | N/A | Available from authors |
| His-Dronc-pET28a | This study | N/A | Available from authors |
| His-DroncC318A-pET28a | This study | N/A | Available from authors |
| Imidazole | Sigma-Aldrich | I2399-100G | |
| Isopropyl-ß-D-thiogalactopyranoside (IPTG) | Thermofisher Scientific | FERR0392 | |
| Kanamycin | Fisher Scientific | BP906-5 | |
| LB Agar, Miller (Powder) | Fisher Scientific | BP1425-500 | |
| LB Broth, Miller | Fisher Scientific | BP1426-500 | |
| Lysozyme | Thermofisher Scientific | 90082 | |
| Microbiological plate incubator | Fisher Scientific | 11-690-650D | For colony growth after transformation |
| Microcentrifuge tubes, 0.5 mL | Eppendorf | 22363611 | |
| Microcentrifuge tubes, 1.5 mL | Eppendorf | 22363204 | |
| Midiprep kit | Qiagen | 12243 | |
| Mini tube rotator | Fisher Scientific | 05-450-127 | for mixing bacterial lysates and Ni-NTA agarose |
| Miniprep kit | Qiagen | 27106 | |
| Motorized Pipette Controller | Gilson | F110120 | For using serological pipettes |
| NaH2PO4 | Fisher Scientific | BP330-1 | |
| Ni-NTA Agarose | Qiagen | 30210 | |
| NuPAGE 4 to 12%, Bis-Tris, 1.0 mm, Midi Protein Gel, 20-well | Thermofisher Scientific | WG1402BOX | |
| NuPAGE LDS Sample Buffer (4x) | Thermofisher Scientific | NP0007 | |
| NuPAGE MOPS SDS Running Buffer (20x) | Thermofisher Scientific | NP0001 | |
| NuPAGE Transfer Buffer (20x) | Invitrogen | NP00061 | |
| Orbital shaking incubator with temperature control | New Brunswick Scientific | C25 incubator shaker | |
| Petridish 100 mm x 15 mm | Fisher Scientific | FB0875712 | |
| Plating beads | Zymo research | S1001 | For spreading culture on AmpR/KanR plates |
| Polypropylene Columns (1 mL) | Qiagen | 34924 | For purification of His-tagged proteins |
| Precision Plus Protein Standards | Bio-Rad | #161-0374 | |
| Protein Assay Dye Reagent Concentrate | Bio-Rad | #5000006 | |
| pT7CFE1-NMyc | Thermofisher Scientific | 88863 | For cloning substrates for RRL expression |
| PVDF membrane | Invitrogen | LC2007 | |
| 14 mL Polypropylene round bottom tubes | Fisher Scientific | 352029 | For growing plasmid cultures |
| QiaRack | Qiagen | 19095 | For holding polypropylene columns during purification |
| Refrigerated High speed Centrifuge | Beckman Coulter | Avanti J-25 | |
| rRNasin Ribonuclease Inhibitor | Promega | N251A | For RRL expression |
| Sodium chloride | Fisher Scientific | BP358-212 | |
| Sodium Hydroxide | Fisher Scientific | BP359-500 | |
| Sterile Falcon tubes, 15 mL | Fisher Scientific | 05-527-90 | |
| Sterile Falcon tubes, 50 mL | Fisher Scientific | 14-959-49A | |
| Sucrose | Sigma-Aldrich | S70903-250G | |
| 1 mL Serological Pipets, Sterile | celltreat | 229001B | For bacterial cell lysis in 50 mL tubes |
| TnT Coupled Reticulocyte Lysate -T7 | Promega | L4611 | |
| Tris-base | Fisher Scientific | BP154-1 | |
| Tween 20 | Sigma-Aldrich | P1379 | |
| Waterbath | Fisher Scientific | 2340 | |
| Western wet transferring cassette | Thermofisher Scientific | STM2001 |
참고문헌
- Kumar, S. Caspase function in programmed cell death. Cell Death and Differentiation. 14 (1), 32-43 (2007).
- Hawkins, C. J., et al. The Drosophila caspase DRONC cleaves following glutamate or aspartate and is regulated by DIAP1, HID, and GRIM. Journal of Biological Chemistry. 275 (35), 27084-27093 (2000).
- Li, P., et al. Cytochrome c and dATP-dependent formation of Apaf-1/caspase-9 complex initiates an apoptotic protease cascade. Cell. 91 (4), 479-489 (1997).
- Meier, P., Silke, J., Leevers, S. J., Evan, G. I. The Drosophila caspase DRONC is regulated by DIAP1. EMBO Journal. 19 (4), 598-611 (2000).
- Timmer, J. C., Salvesen, G. S. Caspase substrates. Cell Death and Differentiation. 14 (1), 66-72 (2007).
- Zou, H., Li, Y., Liu, X., Wang, X. An APAF-1.cytochrome c multimeric complex is a functional apoptosome that activates procaspase-9. Journal of Biological Chemistry. 274 (17), 11549-11556 (1999).
- Zou, H., Henzel, W. J., Liu, X., Lutschg, A., Wang, X. Apaf-1, a human protein homologous to C. elegans CED-4, participates in cytochrome c-dependent activation of caspase-3. Cell. 90 (3), 405-413 (1997).
- Stennicke, H. R., et al. Caspase-9 can be activated without proteolytic processing. Journal of Biological Chemistry. 274 (13), 8359-8362 (1999).
- Snipas, S. J., Drag, M., Stennicke, H. R., Salvesen, G. S. Activation mechanism and substrate specificity of the Drosophila initiator caspase DRONC. Cell Death and Differentiation. 15 (5), 938-945 (2008).
- Fraser, A. G., Evan, G. I. Identification of a Drosophila melanogaster ICE/CED-3-related protease, drICE. EMBO Journal. 16 (10), 2805-2813 (1997).
- Denton, D., Mills, K., Kumar, S. Methods and protocols for studying cell death in Drosophila. Methods in Enzymology. 446, 17-37 (2008).
- Dorstyn, L., Kumar, S. A biochemical analysis of the activation of the Drosophila caspase DRONC. Cell Death and Differentiation. 15 (3), 461-470 (2008).
- Aram, L., Yacobi-Sharon, K., Arama, E. CDPs: caspase-dependent non-lethal cellular processes. Cell Death and Differentiation. 24 (8), 1307-1310 (2017).
- Arama, E., Baena-Lopez, L. A., Fearnhead, H. O. Non-lethal message from the Holy Land: The first international conference on nonapoptotic roles of apoptotic proteins. FEBS Journal. 288 (7), 2166-2183 (2021).
- Baena-Lopez, L. A. All about the caspase-dependent functions without cell death. Seminars in Cell and Developmental Biology. 82, 77-78 (2018).
- Florentin, A., Arama, E. Caspase levels and execution efficiencies determine the apoptotic potential of the cell. Journal of Cell Biology. 196 (4), 513-527 (2012).
- Amcheslavsky, A., et al. Plasma membrane localization of apoptotic caspases for non-apoptotic functions. Developmental Cell. 45 (4), 450-464 (2018).
- Bergmann, A. Are membranes non-apoptotic compartments for apoptotic caspases. Oncotarget. 9 (60), 31566-31567 (2018).
- Song, J., et al. Cascleave: towards more accurate prediction of caspase substrate cleavage sites. Bioinformatics. 26 (6), 752-760 (2010).
- Wang, M., et al. Cascleave 2.0, a new approach for predicting caspase and granzyme cleavage targets. Bioinformatics. 30 (1), 71-80 (2014).
- Kamber Kaya, H. E., Ditzel, M., Meier, P., Bergmann, A. An inhibitory mono-ubiquitylation of the Drosophila initiator caspase Dronc functions in both apoptotic and non-apoptotic pathways. PLoS Genetics. 13 (2), 1006438 (2017).
- Stennicke, H. R., Salvesen, G. S. Caspases: preparation and characterization. Methods. 17 (4), 313-319 (1999).
- Green, M. R., Sambrook, J. . Molecular Cloning: A Laboratory Manual (4th edition). , (2012).
- Froger, A., Hall, J. E. Transformation of plasmid DNA into E. coli using the heat shock method. Journal of Visualized Experiments. (6), e253 (2007).
- Bradford, M. M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Analytical Biochemistry. 72, 248-254 (1976).
- Brunelle, J. L., Green, R. Coomassie blue staining. Methods in Enzymology. 541, 161-167 (2014).
- Hirano, S. Western blot analysis. Methods in Molecular Biology. 926, 87-97 (2012).
- Kim, B. Western blot techniques. Methods in Molecular Biology. 1606, 133-139 (2017).
- Luthi, A. U., Martin, S. J. The CASBAH: a searchable database of caspase substrates. Cell Death and Differentiation. 14 (4), 641-650 (2007).
- Fogarty, C. E., et al. Extracellular reactive oxygen species drive apoptosis-induced proliferation via Drosophila macrophages. Current Biology. 26 (5), 575-584 (2016).
- Song, Z., et al. Biochemical and genetic interactions between Drosophila caspases and the proapoptotic genes rpr, hid, and grim. Molecular and Cellular Biology. 20 (8), 2907-2914 (2000).
- Edfors, F., et al. Enhanced validation of antibodies for research applications. Nature Communications. 9 (1), 4130 (2018).
- Uhlen, M., et al. A proposal for validation of antibodies. Nature Methods. 13 (10), 823-827 (2016).
- Brizzard, B. Epitope tagging. Biotechniques. 44 (5), 693-695 (2008).
- Kanuka, H., et al. Control of the cell death pathway by Dapaf-1, a Drosophila Apaf-1/CED-4-related caspase activator. Molecular Cell. 4 (5), 757-769 (1999).
- Rodriguez, A., et al. Dark is a Drosophila homologue of Apaf-1/CED-4 and functions in an evolutionarily conserved death pathway. Nature Cell Biology. 1 (5), 272-279 (1999).
- Zhou, L., Song, Z., Tittel, J., Steller, H. HAC-1, a Drosophila homolog of APAF-1 and CED-4 functions in developmental and radiation-induced apoptosis. Molecular Cell. 4 (5), 745-755 (1999).
- Weghorst, F., Mirzakhanyan, Y., Hernandez, K. L., Gershon, P. D., Cramer, K. S. Non-Apoptotic caspase activity preferentially targets a novel consensus sequence associated with cytoskeletal proteins in the developing auditory brainstem. Frontiers in Cell and Developmental Biology. 10, 844844 (2022).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유