Method Article
표적 질량분석법 기반 단백질 분석의 마이크로샘플링 저농도 단백질
요약
바이오마커 프로가스트린 방출 펩타이드(ProGRP)로 예시된 건조 혈청 샘플에서 저농도 바이오마커를 측정하기 위한 프로토콜이 제시됩니다. 항체 코팅된 마그네틱 비드는 프로테오타입 ProGRP 펩타이드의 선택적 클린업 및 농축에 사용됩니다. 포획된 펩타이드는 이후 액체 크로마토그래피-탠덤 질량 분석법으로 분석됩니다.
초록
이 논문은 건조된 샘플에서 소농도 단백질의 효율적인 샘플 클린업을 위한 자세한 설명이 포함된 프로토콜을 제시합니다. 이는 단백질 분해 펩타이드 친화성 캡처 및 액체 크로마토그래피 탠덤 질량분석법(LC-MS/MS) 측정 전에 비드 기반 단백질 분해를 사용하여 수행됩니다. 이 절차는 종이 카드를 사용하는 기존의 건조 검체(예: 건조 혈반[DBS] 및 건조 혈청 기반[DSS])와 체적 흡수 미세 시료 채취(VAMS)와 같은 새로운 시료 채취 방법으로 수집된 시료 모두에 적용할 수 있습니다. 이 절차를 설명하는 것 외에도 트립신 비드와 항체 코팅 비드 모두의 제조가 이 작업에서 단계별 방식으로 제시됩니다. 제시된 절차의 장점은 비드를 사용한 시간 효율적인 단백질 가수분해와 펩타이드 친화성 캡처를 사용한 선택적 강력한 클린업입니다. 현재 절차는 건조 혈청(DSS 및 VAMS 모두)에서 저농도 소세포 폐암(SCLC) 바이오마커인 프로가스트린 방출 펩타이드(ProGRP)의 결정을 설명합니다. 비드 준비에 대한 자세한 절차를 통해 새로운 응용 분야 또는 다른 실험실에서 워크플로우를 더 쉽게 구현할 수 있습니다. 결과는 샘플링 재료에 따라 달라질 수 있음이 입증되었습니다. 현재 프로젝트의 경우 DSS에 비해 VAMS를 사용하여 수집된 샘플에서 더 높은 신호 강도가 나타났습니다.
서문
마이크로샘플링은 1913년 Ivar Bang이 DBS의 포도당 모니터링을 설명한 이래로 100년 이상 사용되어 왔습니다1. Guthrie와 Susi가 1963년 신생아의 페닐알라닌 측정을 위해 DBS를 도입한 후2, 이 기술은 점점 더 널리 보급되었습니다. 단백질의 샘플링 및 저장을 위한 DBS의 첫 번째 보고는 1970년대 초3,4에 이루어졌으며, 10년 후인 1980년대에 DBS에서 단백질을 측정하기 위한 질량분석법(MS)에 대한 첫 번째 보고를 발견했습니다5. 이러한 초기 도입에도 불구하고 세기가 바뀔 때까지 DBS 및 기타 마이크로 샘플링 기술에서 단백질의 MS 측정이 더 널리 보급되었습니다.
임상 적 맥락에서, 질병의 진단 및 추적 관찰뿐만 아니라 치료 모니터링 및 도핑 목적으로 단백질을 결정하는 것이 중요합니다. 소량의 건조된 샘플에서 MS에 의한 단백질 분석물의 표적 측정은 여전히 어려운 일이며, 종종 분석 전에 광범위한 샘플 준비가 필요합니다.
MS에 의한 단백질의 표적 정량 측정은 일반적으로 상향식 접근법을 적용하여 분석 전에 단백질을 펩타이드로 분해하여 수행됩니다. 이 절차는 무수히 많은 펩타이드를 생성하므로 소화된 생물학적 샘플의 직접 분석이 어렵습니다. 이를 회피하는 방법은 분해전후에 MS 분석에 앞서 선택적 친화성 클린업 단계를 적용하는 것이다 6,7,8. 이러한 방식으로, 관심 단백질(또는 분해 후 친화성 포획 단계가 수행되는 경우 이의 단백질형 펩타이드)을 분석 전에 샘플 매트릭스에서 선택적으로 분리하여 검출 한계를 낮춥니다9.
DBS 카드를 사용한 마이크로샘플링은 기존의 혈액 샘플에 비해 적은 샘플 부피, 덜 침습적인 샘플링 및 향상된 저장 안정성을 포함하여 특정 이점이 있습니다. 그러나 시료 매트릭스는 다르며 분석에 다른 문제가 발생할 수 있습니다(예: 건조 시료 매트릭스 대 액체 시료 매트릭스 및 모세혈관 대 혈청 또는 혈장)10,11. DBSs에서 관찰되는 또 다른 문제는 소위 헤마토크릿 효과(hematocrit effect)인데, 여기서 혈액 헤마토크릿은 분석을 위해 추가로 처리된 샘플 부피에 영향을 미치며, 따라서 분석에서 개인간 변동성을 도입한다12. 201413년에 도입된 VAMS와 같은 최신 마이크로샘플링 장치는 혈액 방울 대신 고정된 양의 혈액을 수집하여 이 문제를 해결합니다.
이 프로토콜은 건조된 미세 샘플에서 저농도 바이오마커 분석을 위한 설정을 설명합니다. 용출 후, 건조된 샘플은 분해되고, 이어서, 단백질형 펩티드는 펩티드 친화성 포획에 의해 분리된다. 모델 분석물은 SCLC 바이오마커 ProGRP입니다. ProGRP는 전혈에서 확실하게 측정할 수 없기 때문에 혈청을 샘플 매트릭스로 사용했습니다. VAMS를 사용하여 수집된 DSS 및 혈청 샘플의 대표적인 결과가 표시됩니다.
프로토콜
건강한 헌혈자의 혈청을 표준 용액의 제조에 사용했습니다. 건강한 헌혈자의 혈청 사용은 노르웨이 법에 따라 엄격하게 수행되었습니다. 모든 피험자로부터 정보에 입각한 동의를 얻었습니다. 혈청 샘플은 관련 지침 및 규정에 따른 방법을 사용하여 분석되었습니다. 설명된 프로토콜은 이전 작업14에서 설명한 방법의 수정된 버전입니다. 완충액 및 용액의 구성과 준비 방법에 대한 개요는 보충 표 S1에서 찾을 수 있으며, 재료 표에는 이 프로토콜에 사용되는 재료 , 장비 및 시약이 포함되어 있습니다.
1. 항체 코팅 마그네틱 비드의 제조
- 원하는 수의 비드를 준비하는 데 필요한 항체의 양을 계산합니다. 마그네틱 비드 50mg 당 항체 1mg을 사용하십시오.
참고: 일반적으로 후속 실험에서는 샘플당 20μL의 20mg/mL 비드 현탁액이 사용됩니다(5.1단계 참조). - 원하는 수의 비드를 준비하는 데 필요한 항체 부피를 계산합니다.
참고: 항체 부피는 항체 농도에 따라 다르며 각 항체에 대해 계산해야 합니다. - 원하는 부피의 항체 용액을 5mL 저단백질 결합 미세원심분리기 튜브에 옮깁니다. 예를 들어, 항체 용액에 1mg/mL 항체가 포함된 경우 0.4mL를 사용하여 1.0mL의 비드 현탁액(20mg beads/mL with 1mg antibody/50mg beads)을 준비합니다.
참고: 항체는 아민이 없는 완충액에 있어야 합니다. 흡착으로 인한 분석물 손실을 방지하기 위해 단백질이 포함된 모든 용액에 저단백질 결합 미세 원심분리기 튜브를 사용하십시오. - 항체 용액에 작은 자석 교반 막대를 추가하고 연속 교반 하에서 pH를 2.5로 조정합니다. 마이크로 전극이 있는 pH 측정기를 사용하여 pH를 측정하고 정의된 부피의 1.0M HCl을 단계적으로 추가하여 pH를 조정합니다(1.0M HCl의 10μL 부분을 추가하고 pH가 2.5에 가까워지면 부피를 줄임). pH를 2.5로 조정하는 데 필요한 총 부피 1.0M HCl을 기록합니다.
- 마이크로 전극을 제거하고 산성화된 항체를 자석 교반기의 얼음 위에서 1시간 동안 배양합니다.
참고: 항체의 산 처리는 비드에서 항체의 올바른 방향을 촉진하기 위해 수행됩니다. HCl의 농도는 항체 용액 중의 완충액 농도에 따라 0.5 M 또는 0.2 M HCl로 감소될 수 있다. - 항체 용액을 중화시킨다. 마이크로 전극이 있는 pH 측정기를 사용하여 pH를 측정하고 정의된 부피의 1.0M NaOH를 단계적으로 첨가하여 pH를 7로 조정합니다(10μL 부분으로 시작하여 pH가 7에 가까워지면 부피를 줄임). 첨가된 총 부피 1.0 M NaOH를 기록한다.
알림: NaOH의 농도는 1.4단계에서 사용된 HCl 농도와 동일해야 합니다. NaOH는 부식성이 강합니다. 장갑과 적절한 보안경을 포함한 보호 장비를 사용하십시오. - 사용할 토실 활성화 마그네틱 비드의 원하는 부피를 계산합니다.
알림: 일반적으로 소규모 커플링을 수행할 때 20mg beads/mL를 사용하는 것이 좋습니다. 최소 5mg의 비드를 사용해야 합니다. - 마그네틱 비드 현탁액을 보텍스 믹서에서 완전히 혼합하고 원하는 양의 비드 현탁액을 포함하는 부피를 회수합니다. 예를 들어, 1mL의 비드 현탁액을 준비하기 위해 20mg의 비드가 포함된 부피를 회수합니다(비드의 농도가 30mg/mL인 경우 667μL).
- 비드 현탁액을 마그네틱 랙에 1분 동안 놓고 상층액을 제거합니다. 동일한 부피의 유형 1 H2O로 비드를 2배 세척합니다(30mg/mL 비드 용액을 사용하여 20mg/mL 항체 코팅 비드 1mL를 제조하는 경우 667μL). 세척 용액을 첨가할 때마다 볼텍스 믹서를 사용하여 혼합하고 상층액을 제거하기 전에 1분 동안 마그네틱 랙에 놓습니다.
- 마그네틱 비드에 다음을 추가합니다: 산 처리된 항체, 0.5M 붕산염 완충액(pH 9.5)(최종 농도는 0.1M이어야 하므로 총 부피의 1/5, 비드 현탁액 1mL를 준비하려면 0.2mL와 같음) 및 항체 결합을 위한 커플링 완충액(항체 코팅 마그네틱 비드 1mL를 준비하기 위해 커플링 완충액의 부피는 1mL - 산 처리된 항체 부피 - 붕산염 완충액 0.2mL와 같아야 함). 소용돌이 믹서를 사용하여 혼합하십시오.
참고: 산 처리된 항체의 부피는 항체 용액의 부피(1mg/mL 항체 용액을 사용하여 비드 현탁액 1mL 준비에서 0.4mL) + pH를 2.5로 조정하는 데 사용되는 1.0M HCl의 부피 + pH를 7로 조정하는 데 사용되는 1.0M NaOH의 부피)와 같습니다.
참고: 항체 결합을 위한 0.5M 붕산염 완충액(pH 9.5) 및 결합 완충액의 조성은 보충 표 S1에서 찾을 수 있습니다. - 엔드 오버 엔드 샘플 믹서를 사용하여 주변 온도에서 밤새 회전하며, 가급적이면 왕복 회전과 진동을 사용하는 것이 좋습니다.
- 239 × g에서 10 분 동안 원심 분리기. 튜브를 자석에 2분 동안 놓고 상층액을 제거합니다.
- 비드를 2 x 2시간 동안 세척하고 종단-끝(end-over-end) 샘플 혼합기를 사용하여 주위 온도에서 항체 비드를 위한 저장 완충액에서 회전시켜 밤새 한 번 세척한다. 1.10단계의 총 볼륨과 동일한 볼륨을 사용합니다. 튜브를 자석에 1분 동안 놓고 각 세척 사이에 상청액을 제거합니다.
참고: 항체 비드에 대한 저장 완충액의 조성은 보충 표 S1에서 찾을 수 있습니다. - 원하는 스톡 농도의 비드(일반적으로 20mg/mL)를 사용하여 원하는 완충액(예: 단계 1.13과 동일한 완충액)에 보관합니다. 냉장고에 보관하십시오.
2. 트립신 고정화 비드 2mL(20mg/mL beads)의 제조
- 20mL의 1mM HCl을 2mL의 NHS-활성화 아가로스 비드에 첨가하여 비드를 세척합니다.
- 2,655 × g 에서 5 분 동안 혼합하고 원심 분리합니다. 상청액을 제거합니다.
- 0.1M 인산염 완충액(pH 7.8) 20mL를 추가합니다. 볼텍스 믹서와 원심분리기를 사용하여 2,655 ×g 에서 5분 동안 혼합합니다. 상청액을 제거합니다.
참고: 0.1M 인산염 완충액(pH 7.8)의 조성은 보충 표 S1에서 찾을 수 있습니다. - 20mg/mL 트립신 2mL를 추가합니다(트립신 결합을 위해 저온 커플링 완충액에 용해됨).
참고: 트립신 커플링을 위한 커플링 버퍼의 조성은 보충 표 S1에서 찾을 수 있습니다. 버퍼를 냉장고에 보관하십시오. - 온도 제어 믹서를 사용하여 22°C 및 1,100rpm에서 25분 동안 배양합니다. 2,655 × g 에서 5분 동안 원심분리기. 상청액을 제거합니다.
- 트립신 비드의 제조를 위해 2 mL의 변형 완충액을 첨가하고, 온도 조절 믹서를 이용하여 22°C 및 1,100 rpm에서 20분 동안 인큐베이션한다. 2,655 × g 에서 5 분 동안 원심 분리기. 상청액을 제거합니다.
참고: 트립신 비드의 제조를 위한 변형 완충액의 조성은 보충 표 S1에서 찾을 수 있습니다. 버퍼를 냉장고에 보관하십시오. - 트립신 비드의 제조를 위해 블로킹 완충액 10 mL를 첨가하고, 온도 조절 믹서를 이용하여 22°C 및 1,100 rpm에서 10분 동안 인큐베이션한다. 2,655 × g 에서 5 분 동안 원심 분리기. 상청액을 제거합니다.
참고: 트립신 비드의 제조를 위한 차단 완충액의 조성은 보충 표 S1에서 찾을 수 있습니다. 버퍼를 냉장고에 보관하십시오. - 보관 버퍼 2mL를 넣고 볼텍스 믹서를 사용하여 혼합한 후 사용할 때까지 냉장고에 보관합니다.
참고: 트립신 비드에 대한 저장 완충액의 조성은 보충 표 S1에서 찾을 수 있습니다. 버퍼를 냉장고에 보관하십시오.
3. DSS/VAMS 샘플링 및 건조 혈청의 후속 추출
- 적절한 수준에서 ProGRP(또는 관심 단백질)로 혈청을 스파이크하여 표준물질을 준비합니다. 스파이크 볼륨을 총 볼륨의 1%≤ 유지합니다.
참고: 여기에서 스파이크 혈청 표준물의 제조를 위해 물에 295μg/mL ProGRP의 원액을 사용했습니다. - 소용돌이 믹서에서 표준을 혼합하십시오.
- 10μL의 혈청(스파이크 표준물질)을 DBS 카드에 적용하거나 제조업체의 지침에 따라 VAMS(10μL)에서 10μL의 혈청을 채취합니다. DSS의 경우 지점이 점선 원 안에 있는지 확인합니다.
- 주변 온도에서 최소 2시간 동안 자연 건조시키십시오.
- 전체 스팟을 잘라내어 2mL 저단백질 결합 미세원심분리기 튜브로 옮기거나 홀더에서 VAMS를 제거하고 2mL 저단백질 결합 미세원심분리기 튜브에 넣습니다.
- 1,000 μL의 100 mM 중탄산암모늄(ABC) 용액을 첨가한다. 1,000rpm의 온도 제어 믹서를 사용하여 22°C에서 1시간 동안 스팟/VAMS에서 건조된 혈청을 추출합니다.
- 트립신 단백질 분해를 위해 추출물을 새로운 1.5mL 저단백질 결합 미세 원심분리 튜브로 옮깁니다.
4. DSS/VAMS 추출물의 소화
- 샘플당 30μL의 트립신 비드(섹션 2에서 제조됨)를 사용합니다. 모든 샘플에 대한 트립신 비드가 포함된 부피를 새로운 1.5mL 저단백질 결합 미세원심분리 튜브로 옮기고 2,655× g 에서 5분 동안 원심분리한 후 상층액을 제거합니다.
- 트립신 비드를 차가운 50mM ABC 1mL로 2배 세척한 후 피펫 아웃된 동일한 부피로 재현탁합니다. 2,655 × g 에서 5분 동안 원심분리하고 단계 사이에 상층액을 제거합니다.
- 세척된 트립신 비드 30μL를 각 DSS/VAMS 추출물에 추가하여 소화를 시작합니다.
- 온도 제어 믹서 또는 이와 유사한 것을 사용하여 37°C 및 1,000rpm에서 2시간 동안 배양합니다. 2,655 × g 에서 5 분 동안 원심 분리하고 상청액 (비드가 아님)을 새로운 2.0 mL 저 단백질 결합 미세 원심 분리기 튜브로 옮깁니다.
- 안정 동위원소 표지(SIL) 펩타이드 ALGNQQPSWDSEDSSNF[K_13C6_15N2]를 포함하는 100 ng/mL 내부 표준물질(IS) 용액 25μL을 추가합니다.
5. 항체 코팅 마그네틱 비드를 사용한 Proteotypic ProGRP 펩타이드 포획
- 추출당 20μL의 항체 코팅 비드(섹션 1에서 제조된 대로 20mg/mL)를 사용합니다. 모든 항체 코팅 비드를 새로운 1.5mL 저단백질 결합 미세 원심분리 튜브로 옮기고 자석 위에 1분 동안 놓고 보관 완충액을 제거합니다.
- 0.05% 폴리소르베이트 20을 함유하는 1mL의 인산염 완충 식염수(PBS), pH 7.4 및 2 x 1mL의 PBS로 자성 항체 코팅 비드를 세척한 후 동일한 부피로 재현탁한 후 피펫 아웃했습니다. 소용돌이 믹서에서 혼합하고 버퍼 교환 사이에 1분 동안 자석 위에 놓습니다.
참고: PBS는 137 mM NaCl, 2.7 mM KCl, 8 mM Na2HPO4 및 1.8 mMKH2PO4를 함유한다. 안정성을 높이기 위해 10x 농도로 용액을 준비하는 것이 좋습니다. 10x PBS 100mL의 조성에 대해서는 보충 표 S1을 참조하십시오. 10x PBS 10x의 희석은 ~7.4의 pH를 달성할 것입니다. - 세척된 마그네틱 비드 현탁액 20μL를 소화된 DSS/VAMS 추출물과 IS가 들어 있는 각 저단백질 결합 미세 원심분리기 튜브에 추가합니다. 상온에서 엔드 오버엔드 샘플 혼합기를 사용하여 1시간 동안 면역추출을 수행합니다.
- 다음 용액을 사용하여 마그네틱 비드를 세척하십시오: 0.05%(v/v) 폴리소르베이트 20이 포함된 PBS 500μL, PBS 400μL, 10mM Tris HCl(pH 7.4) 300μL 및 100mM ABC 300μL.
- 각 세척 용액을 첨가한 후 비드가 있는 저단백질 결합 미세 원심분리기 튜브를 제거하고 자석 랙에서 용액을 세척하고 균질해질 때까지 조심스럽게 뒤집습니다. 그런 다음 저단백질 결합 미세 원심분리기 튜브를 자석에 30초 동안 놓고 30초 동안 뒤집은 다음 자석에 1분 동안 놓습니다. 세척액을 제거하십시오.
- 미세 원심분리기를 사용하여 나머지 현탁액을 회전시킵니다. 자석에 1 분 동안 놓고 남은 세척액을 제거하십시오.
- Type 1 H 2O 중 2%(v/v) 포름산 15μL을 각 시료에 추가하고 온도 제어 믹서 또는 이와 유사한 것을 사용하여22°C 및 1,000rpm에서 5분 동안 배양하여 포획된 펩타이드를 용출합니다. 자석 위에 1분 동안 놓고 용리액을 새로운 1.5mL 저단백질 결합 미세 원심분리기 튜브에 옮깁니다. 한 번 반복하고 두 번째 용출액을 첫 번째 용출액과 동일한 저단백질 결합 미세 원심분리기 튜브로 옮깁니다.
- 각 용출액에 100mM ABC 20μL를 추가합니다(총 부피 50μL).
- 원심분리기(microcentrifuge)로 용출액 40 μL를 고성능 액체 크로마토그래피(HPLC) 바이알용 마이크로 삽입물로 옮깁니다.
6. LC-MS/MS에 의한 분석
- 높은 견고성을 위해 전기 분무 이온화 기능이 있는 마이크로 LC 삼중 사중극자 MS를 사용하십시오.
- 이동상 A(H 2O 및 MeCN에서 20mM FA, 95:5 v/v) 및 B(H 2O 및 MeCN에서20mMFA, 5:95 v/v)로 펌프를 퍼지하여 분석을 위한 LC-MS/MS 시스템을 준비합니다.
- 분석 컬럼(C18, 50 mm x 1 mm 내경[ID], 3 μm 입자)을 삽입합니다.
- 특정 기기에 대한 시작 절차에 따라 분석을 위해 기기를 계속 준비합니다.
- 기기 소프트웨어에서 컬럼 오븐 온도를 25°C로 설정하고 유속을 50μL/min(100% 이동상 A)으로 설정합니다.
- 적어도 15분 동안 이동상 A로 컬럼을 평형화합니다.
- 샘플을 자동 시료 주입기에 넣습니다.
- ProGRP 특이적 트립신 펩타이드 ALGNQQPSWDSEDSSNFK 및 그 IS의 분석을 위한 기기 방법을 준비합니다.
알림: 여러 분석법 매개변수는 기기에 따라 다르며 사용되는 특정 기기에 맞게 최적화해야 합니다. 여기에 사용된 메서드 매개 변수에 대한 자세한 내용은 6.9-6.11단계에 설명되어 있습니다. - LC의 그래디언트 프로그램의 경우 다음 설정을 사용합니다: 유속: 50μL/min; 시간 0.0에서 3.0 분까지: 100% 이동상 A; 시간 3.0 내지 18.0 분 : 0 %에서 50 % 이동상 B까지 선형 구배를 실행한다. 시간 18.0에서 18.1 분까지 : 이동상 B를 50 %에서 100 %로 증가시킵니다. 시간 18.1 내지 20.0 분 : 100 % 이동상 B; 시간 20.0에서 20.1 분 : 이동상 B를 100 %에서 0 %로 감소시킵니다. 시간 20.1 내지 30분: 컬럼을 재평형화하기 위한 100% 이동상 A(최소 10개의 컬럼 부피 사용).
- MS/MS 설정의 경우, 효율적인 이온화를 보장하는 기기 설정을 사용하여 포지티브 모드에서 MS/MS를 실행합니다. 이 프로토콜을 따르려면 +4,000V의 분무 전압, 270°C의 가열된 모세관 온도, 시트 가스로서의 질소(5개의 임의 단위) 및 충돌 유도 해리(CID) 단편화를 위한 아르곤(2mTorr)을 사용합니다. 기기가 허용하는 경우 LC 흐름이 MS로 들어가는 대신 실행의 처음 2분(0-2분)과 마지막 1분(29-30분)을 낭비하도록 지시합니다.
- (A) 시그니처 펩티드 (ALGNQQPSWDSEDSSNFK): 1,005.45.45→913.3, 1,005.45→1,028.3 및 1,005.45→1,398.5 및 (B) IS SIL 펩티드 (ALGNQQPSWDSEDSSNF[K_13C6_15N2]): 1,009.45→.3, 1,009.45→1,036.3 및 1,009.45→1,406.5에 대해 선택된 반응 모니터링 (SRM) 전이를 사용하십시오. 모니터링되는 모든 전환에 대해 최적화된 충돌 에너지(이 프로토콜의 경우 35V)를 사용합니다.
- LC-MS/MS 시스템에 사용할 수 있는 소프트웨어를 사용하여 실행할 샘플이 포함된 시퀀스를 준비합니다. 주입 부피를 10μL로 설정합니다.
알림: 필요에 따라 빈 샘플 및 품질 관리 샘플을 추가해야 합니다. - 기기 소프트웨어에서 "Run sequence"를 눌러 시퀀스를 시작합니다.
- 친화성 포획, ProGRP 특이적, 트립신 펩타이드 ALGNQQPSWDSEDSSNFK 및 IS SIL 펩타이드의 피크 면적을 모니터링합니다.
참고: 시그니처 펩타이드인 ALGNQQPSWDSEDSSNFK의 선택 및 확인은 다른 문헌14에 기재되어 있습니다.
결과
DSS 샘플링과 VAMS를 모두 사용하는 분석 워크플로우의 개요는 그림 1에 나와 있습니다. 샘플링 방법의 차이를 제외하고는 절차가 동일합니다. 두 가지 샘플링 방법을 사용하여 샘플링된 혈청의 이미지는 그림 2에서 볼 수 있습니다.
두 가지 샘플링 형태(VAMS 및 DSS)는 ProGRP 함유 혈청의 샘플링에 적합합니다. 이는 DSS 및 VAMS 샘플링에서 얻은 단백질 형 펩타이드 및 IS SIL 펩타이드의 MS 크로마토그램이 표시된 그림 3 에서 확인할 수 있습니다. 또한, 상기 MS 크로마토그램은 건조된 시료와 동일한 방법으로 처리된 스파이크된 액체 혈청 시료 10 μL로 구성된 대조군 시료를 분석한 후 포함된다. 후자는 DSS/VAMS 추출 용액의 부피와 동일한 부피로 희석하고, 트립신 비드를 사용하여 소화를 실시하고, 펩타이드 친화성 캡처를 사용하여 세척했습니다.
VAMS와 DSS 샘플링을 비교하면(그림 4) VAMS는 DSS보다 더 높은 단백질형 펩타이드/IS 면적 비율을 제공합니다. 이는 DSS(순수 셀룰로오스)에 사용된 종이에 대한 표적 단백질 ProGRP의 손실이 있을 수 있음을 나타냅니다. 추가 처리 및 분석 전에 혈청이 건조되지 않은 대조군 시료와 비교할 때(그림 4), VAMS는 대조군 시료와 유사한 면적 비율을 제공하는 것으로 나타났으며(양측 t-검정, p≤ 0.65), 표본 시료에 손실이 없음을 나타내는 반면, DSS는 현저히 낮은 면적 비율(양측 t-검정, p≤ 0.005), 샘플링 재료에 대한 손실을 나타냅니다.
VAMS를 사용하여 간단한 평가를 수행했습니다. 선형성은 10 - 1,000 ng/mL (R2 = 0.9996)로 나타났으며, 검출 한계 (LOD, S/N = 3)는 6.7 ng/mL였습니다. LOD는 1mm ID 컬럼을 갖는 다소 오래된 삼중 사중극자(2008)에서 분석이 수행되었기 때문에 만족스러운 것으로 간주됩니다. S/N > 10인 모든 레벨의 반복성은 IS 보정을 사용하여 7%에서 17%(n = 3) 사이의 RSD에서도 만족스러운 것으로 간주되었습니다.
친화성 포획은 관심 단백질 또는 이의 단백질형 펩타이드를 포획함으로써 소화 단계 전후에 모두 수행될 수 있다. 현재 절차는 펩티드 친화성 포획에 대해 설명합니다. 단백질 포획과 비교했을 때 이 접근법의 장점은 관심 펩타이드만 포획되고 훨씬 더 효율적인 샘플 클린업이 달성된다는 것입니다. 이는 그림 5에 나와 있으며, 펩타이드 포획 후와 비교하여 단백질 포획 후 노이즈가 더 많은 더 복잡한 전체 스캔 크로마토그램을 보여줍니다. 그림 5 에서 분석된 샘플은 DSS 샘플링 또는 VAMS를 사용하여 샘플링되지 않습니다. 그러나, 혈청은 또한 샘플 매트릭스이고, 친화성 포획은 기술된 절차에서 펩티드 포획에 사용된 것과 동일한 항체를 사용하여 수행된다.
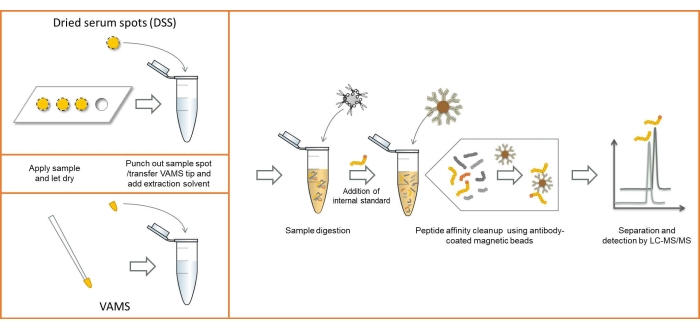
그림 1: DSS 및 VAMS 샘플링을 모두 사용한 분석 워크플로 개요. 약어: DSS = 건조 혈청 반점; VAMS = 체적 흡수 미세 샘플링; LC-MS/MS = 액체 크로마토그래피-탠덤 질량 분석법. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
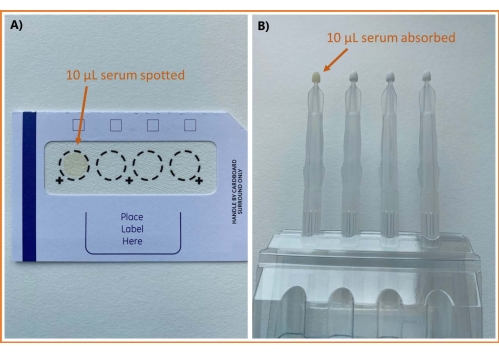
그림 2: 다양한 방법을 사용하여 샘플링한 혈청 이미지 . (A) DBS 셀룰로오스 카드 및 (B) VAMS. 약어: DBS = 말린 혈반; VAMS = 체적 흡수 미세 샘플링. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
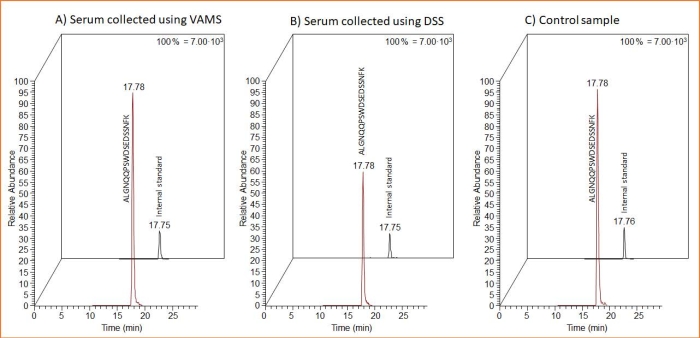
그림 3: DSS 및 VAMS 샘플링 후 단백질 형태 펩타이드 및 IS SIL 펩타이드의 대표적인 MS 크로마토그램과 추출 용액에 직접 첨가된 스파이크된 혈청 샘플에 대한 것입니다. MS 크로마토그램은 1.5μg/mL의 ProGRP를 첨가하고 (A) VAMS, (B) 셀룰로오스 샘플링 카드(DSS용) 또는 (C) 추출 버퍼(대조군 샘플)에 직접 적용한 10μL 혈청 샘플을 보여줍니다. 25마이크로리터의 14ng/mL IS SIL 펩타이드가 펩타이드 친화성 캡처 전에 모든 샘플에 추가되었습니다. 약어: DSS = 건조 혈청 반점; VAMS = 체적 흡수 미세 샘플링; MS = 질량 분석법; ProGRP = 프로가스트린 방출 펩티드; IS = 내부 표준물질; SIL = 안정 동위원소 표지. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
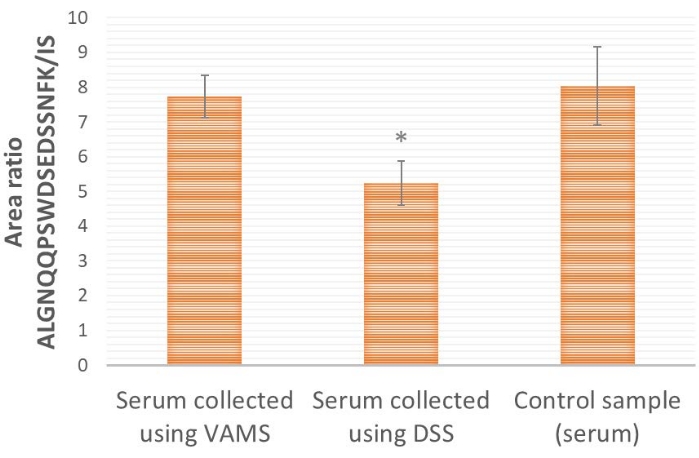
그림 4: 혈청에 대한 ALGNQQPSWDSEDSSNFK/IS 면적 비율의 대표 결과ampProGRP로 스파이크하고 VAMS, DSS 또는 추출 용액(대조군 샘플)에 적용(10μL). ProGRP의 농도는 1.5μg/mL, 각 조건에 대해 n = 4입니다. 14ng/mL IS SIL 펩타이드 25μL을 펩타이드 친화성 캡처 전에 모든 샘플에 추가합니다. *면적 비율이 VAMS에 적용된 샘플과 유의하게 다르다는 것을 나타냅니다(양측 t-검정, p≤ 0.005). 오차 막대는 표준 편차± 있습니다. 약어: DSS = 건조 혈청 반점; VAMS = 체적 흡수 미세 샘플링; ProGRP = 프로가스트린 방출 펩티드; IS = 내부 표준물질; SIL = 안정 동위원소 표지. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
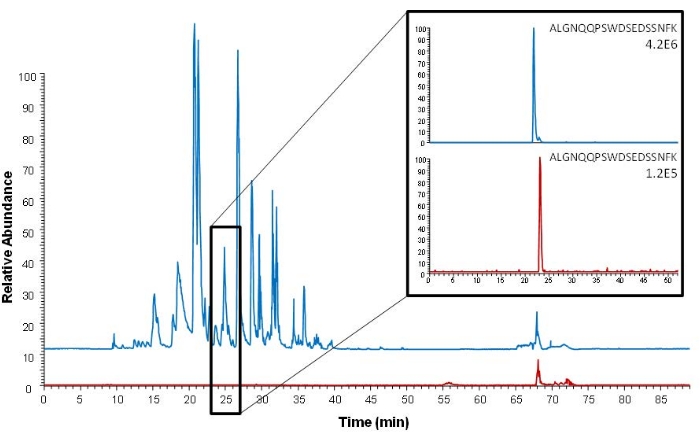
그림 5: 원형(intact) 단백질 추출(파란색)과 단백질형 에피토프 펩타이드 추출(빨간색) 후 염기 피크 크로마토그램(전체 스캔 Orbitrap 분석) 비교. 단백질형 에피토프 펩타이드(ALGNQQPSWDSEDSSNFK, m/z 1005.45)의 추출된 이온 크로마토그램이 오른쪽에 나와 있습니다. 150 ng mL-1 ProGRP로 스파이크된 혈청을 샘플로 사용했습니다. 이 그림은 Levernæs et al.14에서 재인쇄되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
보충 표 S1: 완충액 및 용액의 구성과 준비 방법에 대한 개요. 이 파일을 다운로드하려면 여기를 클릭하십시오.
토론
설명된 프로토콜에는 트립신 비드 및 항체 코팅 마그네틱 비드의 준비를 포함하여 건조된 미세 샘플(DSS 및 VAMS)에서 저농도 바이오마커 분석에서 몇 가지 중요한 단계를 수행하는 방법에 대한 정보가 포함되어 있습니다. 이전 경험에 비추어 볼 때, 우리는 항체의 배향을 개선하기 위해 비드 고정화 전에 항상 항체를 산으로 처리한다15.
이 절차에서 중요한 단계 중 하나는 가장 적합한 마이크로샘플링 형식을 선택하는 것입니다. 첫째, 문제의 분석 물을 전혈에서 측정 할 수 있는지 또는 농도가 혈액 세포의 영향을 받아 혈청 또는 혈장에서 측정해야하는지 고려해야합니다 (모델 분석 물, ProGRP의 경우).
종이 및 폴리머 기반 접근 방식에는 장점과 한계가 있습니다. ProGRP의 경우 VAMS는 샘플러에서 추출한 후 분석물 회수와 관련하여 분명한 이점을 제공합니다. 그러나 이것은 아마도 DSS 샘플에 대해 다른 추출 용액을 사용하여 최적화될 수 있습니다. 그럼에도 불구하고 분석물과 샘플링 물질 간의 이러한 잠재적 상호 작용은 분석 변동을 증가시키고 검출 한계를 높일 수 있으므로 고려하는 것이 중요합니다. 사용된 IS는 SIL 펩타이드이고 소화 후 처음 첨가되므로 IS는 분해 후 단계(예: 친화성 추출 및 LC-MS/MS 분석)를 보정합니다. DSS/VAMS 및 분해 단계에서 추출하는 경우 IS 보정이 불가능합니다.
절차에는 두 가지 유형의 비드가 사용됩니다: 샘플러에서 혈청 샘플을 추출한 후 소화를 위한 트립신 비드와 소화 후 단백질 형성 펩타이드를 포획하기 위한 항체 코팅된 자기 비드. 트립신 비드를 사용하는 주된 이유는 소화 속도를 높이는 것 외에도 친화성 포획 중에 샘플의 잔류 트립신 활성을 최소화하기 위함입니다. 이는 친화성 포획 동안 mAb의 트립신 단백질 분해를 피하는 데 중요합니다.
아가로스 비드는 트립신 비드의 제조에 사용되었고, 자성 비드는 항체 코팅 비드의 제조에 사용되었습니다. 아가로스 비드는 자성 비드보다 저렴하지만 용액으로부터 비드를 분리하려면 원심분리가 필요하다는 한계가 있습니다. 이것은 비드와 상청액의 분리를 자기 비드를 사용할 때보다 덜 효율적으로 만듭니다. 또한, 워크플로우의 자동화는 아가로스 비드를 사용하는 것이 어렵다. 그러나 마그네틱 NHS 활성화 비드를 사용할 수 있으며 보다 능률적이고 자동화된 시료 전처리 워크플로우에 사용할 수 있습니다.
마이크로샘플링은 약물과 바이오마커 모두의 바이오분석에서 중요한 추세입니다. 현재 접근 방식의 한 가지 과제는 제한된 양의 시료량(10μL)이며, 이는 ProGRP(pg/mL-낮은 ng/mL 수준)와 같은 매우 낮은 존재비의 분석물을 측정하는 데 특히 중요할 수 있습니다. 그러나 이러한 문제는 최첨단 분석 장비를 사용하여 우회할 수 있습니다. 이러한 저농도 분석물질의 경우 시료 전처리의 선택이 매우 중요하며, 항체 기반 친화성 캡처를 통한 선택적 시료 세척이 가장 자주 필요합니다. 펩타이드 포획은 단백질 포획(동일한 항체 사용)보다 더 깨끗한 추출물과 낮은 검출 한계를 제공하는 것으로 나타났기 때문에14, 본 방법은 마이크로샘플링과 함께 이 접근법에 초점을 맞춥니다. 펩타이드 포획 접근법의 또 다른 장점은 IS SIL 펩타이드가 친화성 포획 단계도 보정한다는 것입니다.
이 연구에서는 단백질을 표적으로 하는 항체를 펩타이드 포획에 사용했습니다. 이는 단백질을 표적으로 하는 기성 항체의 가용성이 단백질형 펩타이드를 표적으로 하는 기성 항체보다 높기 때문에 이점입니다. 그러나, 항-단백질 항체가 프로테오타입 펩티드를 효율적으로 포획하기 위해서는 단백질 소화 후 에피토프가 손상되지 않아야 합니다. 또한, 많은 항체의 경우, 정확한 에피토프가 알려져 있지 않아 항 단백질 항체를 찾는 것이 지루합니다. 이는 펩티드 포획에 적용할 수 있는 이용 가능한 항단백질 항체의 수를 제한한다. 설명된 절차는 혈청을 매트릭스로, ProGRP를 표적 분석물로 사용하여 시연됩니다. 이 절차는 다른 매트릭스 및 다른 표적 분석물에 적용할 수 있도록 고안되었습니다. 단백질형 펩티드의 친화성 포획을 위해 시판되는 항-단백질 항체를 사용하는 대신에, 또한 맞춤형 항-펩티드 항체를 사용할 수 있다. 단백질 포획과 비교한 펩타이드 포획의 클린업 효율은 그림 5에 나와 있습니다. 트립신 비드의 제조에 사용되는 아가로스 비드를 자성 비드로 교환함으로써, 절차는 또한 시장에 나와있는 로봇 샘플 준비 워크 스테이션과 호환되어야합니다.
공개
저자는 공개할 이해 상충이 없습니다.
감사의 말
노르웨이 라듐 병원(노르웨이 오슬로 대학 병원)의 Elisabeth Paus 교수가 ProGRP 표준물질과 항-ProGRP 단일클론항체 M18을 제공한 것에 대해 큰 감사를 드립니다. 출판비는 Apoteker Harald Conrad Thaulows legat의 보조금으로 충당되었습니다. Trine Grønhaug Halvorsen과 Léon Reubsaet은 노르웨이 INFRASTRUKTUR 연구 위원회(프로젝트 번호: 295910)가 자금을 지원하는 NAPI(National Network of Advanced Proteomics Infrastructure) 컨소시엄의 파트너입니다.
자료
| Name | Company | Catalog Number | Comments |
| Acetic acid N-hydroxysuccinimide ester | Carbosynt (Staad, Switzerland) | FA33719 | Store in freezer below -20 °C |
| ALGNQQPSWDSEDSSNF[K_13C6 _15N2] (≥ 95%) | Innovagen (Lund, Sweden) | Not applicable | Store in freezer below -20 °C |
| Ammonium bicarbonate BioUltra (≥ 99.5% ) | Sigma Aldrich (St. Louis, MO, USA) | 09830-500G | |
| Aquasil C18 column, 3 µm, 50 mm x 1 mm | Thermo scientific (Waltham, MA, USA) | 77503-051030 | Analytical column compatible with 100% aqueous mobile phase |
| Benzamidine (≥ 95.0% ) | Sigma Aldrich (St. Louis, MO, USA) | 12072 | Store in fridge at 2-6 °C |
| Calsium chloride dihydrate (≥ 99% ) | Sigma Aldrich (St. Louis, MO, USA) | 223506-500G | |
| Centrifuge 5804 | Eppendorf (Hamburg, Tyskland) | 5804000010 | |
| Cloned ProGRP isoform 1 | Radium hospital, Oslo University Hospital (Oslo, Norway) | Not applicable | Store in freezer below -20 °C |
| Disodium hydrogenphosphate dihydrate (pro analysis) | Sigma Aldrich (St. Louis, MO, USA) | 30435-500G | |
| Disodium hydrogenphosphate dodecahydrate (pro analysis) | Merck (Darmstadt, Tyskland) | 1.06579.0500 | |
| Dynabeads M-280 tosylactivated 10 mL | Invitrogen (Carlsbad, USA) | 14204 | Store in fridge at 2-6 °C |
| DynaMag-2 | Invitrogen (Carlsbad, USA) | 123-21D | |
| Ethanolamine (pro analysis, ≥ 99%) | Sigma Aldrich (St. Louis, MO, USA) | #02400 | |
| Formic acid (≥ 99% ) for LC-MS | VWR International (Radnor, PA, USA) | 84865.260 | |
| FTA DMPK-C cellulose card | Whatman (Kent, UK) | WB129243 | DBS card |
| HPLC vials, clear glass, 1.5 mL, 32 x 11.6 mm, Clean Pack | Nerliens Meszansky (Oslo, Norge) | LPP 11 09 0519 | |
| Hulamixer sample mixer | Invitrogen (Carlsbad, USA) | 101561503016 | Sample mixer with end-over-end mixing and reciprocal rotation and vibration |
| Human serum from healty blood donors | Bloodbank, Ullevål, Oslo University Hospital (Oslo, Norway) | Not applicable | Store in freezer below -20 °C |
| Hydrochloric acid fuming 37% (Emsure for analysis) | Merck (Darmstadt, Tyskland) | 1.00317.1000 | |
| LC-MS/MS system: Ultimate 3000 system (Autosampler, WPS-3000TRS; Micropump, LPG-3400M; Flow manager, FLM-3300, MIC, 1X2P-10P) and TSQ Quantum access. Controlled by Xcalibur 2.2 SP1.48 | Thermo scientific (Waltham, MA, USA) | Not applicable | |
| LiChrosolv Acetonitrile hypergrade for LC-MS | Merck (Darmstadt, Tyskland) | 1.00029.2500 | |
| LL Biotrode, Combined glass electrode | Metrohm (Herisau, Sveits) | 6.0224.100 | |
| Magnetic stirrer, Type M10 | Franz Morat KG (Eisenbach, Germany) | 10236 | |
| Micro inserts, glass (31 x 6 mm, 0.1 mL) | VWR International (Radnor, PA, USA) | 548-0006 | |
| MilliQ integral 3 with Q-POD | Merck Millipore (Molsheim, France) | ZRXQ003T0 | For production of Type 1 water |
| monoclonal antibody M18 | Radium hospital, Oslo University Hospital (Oslo, Norway) | Not applicable | Store in fridge at 2-6 °C |
| Neoteryx Mitra microsampler (10 μL) 4 sampler Clamshell | Fisher Scientific (Waltham, MA, USA) | NC1382947 | |
| NHS-activated sepharose beads 4 fast flow | Sigma Aldrich (St. Louis, MO, USA) | GE17-0906-01 | Agarose beads, store in fridge at 2-6 °C |
| Optifit, Refill pipet tips, 10 mL | Sartorius Biohit (Helsinki, Finland) | 613-2911 | |
| Optifit, Refill pipet tips, 10 μL | Sartorius Biohit (Helsinki, Finland) | 790012 | |
| Optifit, Refill pipet tips, 1,000 μL | Sartorius Biohit (Helsinki, Finland) | 791002 | |
| Optifit, Refill pipet tips, 200 μL | Sartorius Biohit (Helsinki, Finland) | 790202 | |
| pH glass electrode | Metrohm (Herisau, Sveits) | 6.0233.100 | |
| pH meter 744 | Metrohm (Herisau, Sveits) | 8.744.1003 | |
| Pipet 10 mL | Sartorius Biohit (Helsinki, Finland) | 725090 | |
| Pipet m10 µL | Sartorius Biohit (Helsinki, Finland) | 725020 | |
| Pipet m100 µL | Sartorius Biohit (Helsinki, Finland) | 725050 | |
| Pipet m1,000 µL | Sartorius Biohit (Helsinki, Finland) | 725070 | |
| Pipet m20 µL | Sartorius Biohit (Helsinki, Finland) | 725030 | |
| Potassium chloride (KCl ≥ 99.9%) | Sigma Aldrich (St. Louis, MO, USA) | P-3911 | |
| Potassium dihydrogenphosphate (pro analysis) | Merck (Darmstadt, Tyskland) | 1.04873.0250 | |
| Protein LoBind Eppendorf tube 0.5 mL | Eppendorf (Hamburg, Tyskland) | 525-0133 (0030 108.094) | |
| Protein LoBind Eppendorf tube 1.5 mL | Eppendorf (Hamburg, Tyskland) | 525-0132 (0030 108.116) | |
| Protein LoBind Eppendorf tube 2.0 mL | Eppendorf (Hamburg, Tyskland) | 525-0134 (0030 108.450) | |
| Protein LoBind Eppendorf tube 5.0 mL | Eppendorf (Hamburg, Tyskland) | 525-0792 (0030108.302) | |
| Scissors | Sigma Aldrich (St. Louis, MO, USA) | Z186716-1EA | |
| Sodium azide (BioUltra; ≥ 99.5% ) | Sigma Aldrich (St. Louis, MO, USA) | 71289-5G | |
| Sodium chloride (for analysis) | Merck (Darmstadt, Tyskland) | 1.06404.1000 | |
| Sodium dihydrogenphosphate monohydrate (pro analysis) | Merck (Darmstadt, Tyskland) | 1.06346.0500 | |
| Sodium hydroxide (AnalaR NORMAPUR) | VWR International (Radnor, PA, USA) | 28244.295 | |
| Sodium tetraborate decahydrate (≥ 99. %) | Sigma Aldrich (St. Louis, MO, USA) | S9640-500G | |
| Spectrafuge Mini Centrifuge | LABNET International (Edison, NJ, USA) | C1301 | |
| Stirring magnet, 25 mm x 6 mm Ø, circular | Leybold (Cologne, Germany) | 666 851 | |
| Stuart Scientific SA8 vortex mixer | Stuart (Staffordshire, UK) | Z648531-1EA | |
| SuperClear centrifuge tubes (15 mL) | VWR International (Radnor, PA, USA) | 525-0150 | |
| SuperClear centrifuge tubes (50 mL) | VWR International (Radnor, PA, USA) | 525-0155 | |
| Thermomixer comfort 1.5 mL | Eppendorf (Hamburg, Tyskland) | 53,55,27,831 | Temperature controlled mixer |
| Trizma base (reagent grade, ≥ 99.0 %) | Sigma Aldrich (St. Louis, MO, USA) | T6066 | Tris(hydroxymethyl)aminometan (tris) |
| Trizma HCl (reagent grade, ≥ 99.0%) | Sigma Aldrich (St. Louis, MO, USA) | T3253-100G | Tris(hydroxymethyl)aminometan HCl (tris HCl) |
| Trypsin (TCPK-treated from bovine pancreas, 10,000-15,000 BAEE units/mg Protein) | Sigma Aldrich (St. Louis, MO, USA) | T8802 | Store in freezer below -20 °C |
| Tween 20 | Sigma Aldrich (St. Louis, MO, USA) | P7949-500ML | polysorbate 20 |
| Tweezers | Sigma Aldrich (St. Louis, MO, USA) | TEM-78511-27 | |
| Vial caps, white, 9 mm | Nerliens Meszansky (Oslo, Norge) | LPP 09 15 0981 | |
| Mitra microsampler with VAMS (Volumetric adsorptive microsampling) technology, 10 µL, 4-sampler clamshell | Neoteryx (Torrance, CA, USA) |
참고문헌
- Bang, I. B. Fresenius. Zeitschrift für analytische Chemie. 52 (7), 521-523 (1913).
- Guthrie, R., Susi, A. A simple phenylalanine method for detecting phenylketonuria in large populations of newborn infants. Pediatrics. 32 (3), 338-343 (1963).
- Laurell, C. B. A screening test for α1-antitrypsin deficiency. Scandinavian Journal of Clinical and Laboratory Investigation. 29 (3), 247-248 (1972).
- Thielmann, K., Aquino, A. M. Whole blood samples dried and stored on filter paper as substrate for the electrophoretic separation on hemoglobin S from hemoglobin A. A screening procedure. Clinica Chimica Acta. 35 (1), 237-238 (1971).
- Wada, Y., Fujita, T., Kidoguchi, K., Hayashi, A. Fetal hemoglobin variants in 80,000 Japanese neonates: High prevalence of Hb F Yamaguchi (AγT 80 Asp→Asn). Human Genetics. 72 (3), 196-202 (1986).
- Halvorsen, T. G., McKitterick, N., Kish, M., Reubsaet, L. Affinity capture in bottom-up protein analysis-overview of current status of proteolytic peptide capture using antibodies and molecularly imprinted polymers. Analytica Chimica Acta. 1182, 338714(2021).
- Halvorsen, T. G., Reubsaet, L. Antibody based affinity capture LC-MS/MS in quantitative determination of proteins in biological matrices. TrAC Trends in Analytical Chemistry. 95, Supplement C 132-139 (2017).
- Neubert, H., et al. Protein biomarker quantification by immunoaffinity liquid chromatography-tandem mass spectrometry: Current state and future vision. Clinical Chemistry. 66 (2), 282-301 (2020).
- Pan, S., et al. Mass spectrometry based targeted protein quantification: methods and applications. Journal of Proteome Research. 8 (2), 787-797 (2008).
- Enderle, Y., Foerster, K., Burhenne, J. Clinical feasibility of dried blood spots: Analytics, validation, and applications. Journal of Pharmaceutical and Biomedical Analysis. 130, 231-243 (2016).
- Londhe, V., Rajadhyaksha, M. Opportunities and obstacles for microsampling techniques in bioanalysis: Special focus on DBS and VAMS. Journal of Pharmaceutical and Biomedical Analysis. 182, 113102(2020).
- Denniff, P., Spooner, N. The effect of hematocrit on assay bias when using dbs samples for the quantitative bioanalysis of drugs. Bioanalysis. 2 (8), 1385-1395 (2010).
- Denniff, P., Spooner, N. Volumetric absorptive microsampling: A dried sample collection technique for quantitative bioanalysis. Analytical Chemistry. 86 (16), 8489-8495 (2014).
- Levernæs, M. C. S., et al. Immunocapture sample clean-up in determination of low abundant protein biomarkers-a feasibility study of peptide capture by anti-protein antibodies. RSC Advances. 9 (60), 34902-34911 (2019).
- Conradie, J. D., Govender, M., Visser, L. Elisa solid phase: Partial denaturation of coating antibody yields a more efficient solid phase. Journal of Immunological Methods. 59 (3), 289-299 (1983).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유