JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
재조합 G 단백질 결합 수용체의 고처리량 스크리닝을 위한 "이중 첨가" 칼슘 형광 분석
요약
이 작업에서는 재조합 G 단백질 결합 수용체(GPCR)에서 소분자 라이브러리를 스크리닝하기 위한 384웰 플레이트에 대한 고처리량 세포 내 칼슘 형광 분석에 대해 설명합니다. 표적, 소열 진드기, Rhipicephalus microplus 의 키닌 수용체는 CHO-K1 세포에서 발현됩니다. 이 분석은 하나의 "이중 첨가" 분석에서 동일한 세포를 사용하여 작용제와 길항제를 식별합니다.
초록
G 단백질 결합 수용체 (GPCR)는 수용체의 가장 큰 수퍼 패밀리를 나타내며 수많은 인간 약물의 표적입니다. GPCR에 대한 무작위 소분자 라이브러리의 고처리량 스크리닝(HTS)은 제약 산업에서 표적별 약물 발견을 위해 사용됩니다. 이 연구에서는 치명적인 인간 및 수의학 병원체 벡터의 생리학적 연구를 위한 프로브로서 무척추동물 특이적 신경펩티드 GPCR의 새로운 소분자 리간드를 식별하기 위해 HTS를 사용했습니다.
무척추 동물 특이 적 키닌 수용체는 이뇨, 수유 및 소화를 포함하여 무척추 동물의 많은 중요한 생리적 과정을 조절하기 때문에 표적으로 선택되었습니다. 또한, 많은 무척추 동물 GPCR의 약리학은 특성이 좋지 않거나 전혀 특성화되지 않습니다. 따라서 다른 후생 동물, 특히 인간의 관련 GPCR과 관련하여 이러한 수용체 그룹의 차별적 약리학은 수퍼 패밀리로서 GPCR의 구조-활성 관계에 지식을 추가합니다. HTS 분석은 소열 진드기 또는 남부 소 진드기 인 Rhipicephalus microplus에서 키닌 수용체의 리간드를 발견하기 위해 384 웰 플레이트의 세포에 대해 개발되었습니다. 틱 키닌 수용체는 CHO-K1 세포에서 안정적으로 발현되었다.
키닌 수용체는 내인성 키닌 신경 펩티드 또는 다른 소분자 작용제에 의해 활성화 될 때 칼슘 저장소에서 세포질로의Ca 2+ 방출을 유발합니다. "이중 첨가" 접근법과 결합된 이 칼슘 형광 분석은 동일한 분석 플레이트에서 기능성 작용제와 길항제 "적중" 분자를 검출할 수 있습니다. 각각의 분석은 320개의 무작위 소분자의 어레이를 운반하는 약물 플레이트를 사용하여 수행되었다. 0.7의 신뢰할 수 있는 Z' 계수가 얻어졌고, HTS가 2μM 최종 농도일 때 3개의 작용제 및 2개의 길항제 히트 분자가 확인되었습니다. 여기에 보고된 칼슘 형광 분석은Ca2+ 신호전달 캐스케이드를 활성화하는 다른 GPCR을 스크리닝하도록 조정할 수 있습니다.
서문
효모에서 인간으로 존재하는 G 단백질 결합 수용체 (GPCR)는 많은 유기체에서 수용체의 가장 큰 수퍼 패밀리를 나타냅니다1. 그들은 동물의 거의 모든 생물학적 과정을 조절하는 데 중요한 역할을합니다. 절지동물의 게놈에는 50-200개의 GPCR이 있으며, 이는 그들이 가장 큰 막 수용체 수퍼패밀리2를 대표한다는 것을 의미합니다. 이들은 서열 유사성과 기능에 따라 6개의 주요 클래스인 AF로 분류됩니다3. GPCR은 호르몬, 신경 펩티드, 생체 아민, 글루타메이트, 양성자, 지방 당 단백질 및 광자4와 같은 다양한 세포 외 신호를 전달합니다. GPCR은 이종 삼량체 G 단백질 (Gα, Gβ 및 Gγ)에 결합하여 다운 스트림 신호를 전송합니다. Gαs 또는 Gαi/o 단백질에 결합된 GPCRs는 각각 아데닐릴 사이클라제를 활성화 또는 억제함으로써 세포내 3',5'-사이클릭 아데노신 모노포스페이트 (cAMP) 수준을 증가 또는 감소시킨다. Gαq/11에 결합된 GPCR은 포스포리파아제 C(PLC)-이노시톨-1,4,5-삼인산(IP3) 경로를 활성화하여 소포체 칼슘 저장소에서 칼슘 방출을 유도합니다. Gα12/13에 결합 된 GPCR은 RhoGTPase 뉴클레오티드 교환 인자 5,6을 활성화시킵니다. GPCR은 인간 약물의 50 % 이상과 살비제 인 amitraz4의 표적입니다. GPCR은 이러한 다양한 신호를 전달하기 때문에 무척추 동물 고유의 생리 기능을 방해하는 새로운 살충제 개발을위한 유망한 표적입니다.
HTS의 목표는 수용체 기능을 조절할 수있는 히트 분자를 확인하는 것입니다. HTS에는 분석 개발, 소형화 및 자동화가 포함됩니다7. 절지동물 신경펩티드 GPCR은 발달, 탈피 및 엑디시스, 배설, 에너지 동원및 생식과 같은 대부분의 생리적 기능에 관여합니다4. 절지 동물 및 후생 동물의 대부분의 신경 펩티드 GPCR은 검게 다리 진드기 Ixodes 견갑골의 근억제 펩티드 및 SIFamide 수용체와 같은 칼슘 신호 전달 캐스케이드 2,6,8,9,10을 통해 신호를 보냅니다. 그들의 리간드는 뒷부 운동성 분석에서 길항성이며, SIF는 수축을 유도하고 MIP는11,12를 억제합니다. 황열병 모기의 NPY 유사 수용체 인 Aedes aegypti는13을 찾는 암컷 숙주를 조절합니다. 애쿼린 칼슘 생물발광 분석법14와 같은 다른 대안적인 칼슘 동원 분석과 비교하여, 칼슘 형광 분석은 수행하게 용이하고, 다른 재조합 칼슘 검출 단백질의 형질감염을 필요로 하지 않으며, 비용 효율적이다. 칼슘 형광 분석은 애쿼린 칼슘 생물발광 분석14,15에서 수득된 빠른 운동 신호에 비해 연장된 신호를 생성한다.
여기 예에서, 소열병 진드기의 키닌 수용체인 Rhipicephalus microplus를 CHO-K1 세포주에서 재조합적으로 발현시키고 칼슘 형광 분석에 사용했습니다. R. microplus에서 발견되는 키닌 수용체 유전자는 하나뿐입니다. 수용체는 Gq 단백질 의존성 신호전달 경로를 통해 신호를 보내고 칼슘 저장소로부터 세포 내 공간16으로Ca2+의 유출을 유발합니다. 이 과정은 칼슘 이온과 결합할 때 형광 신호를 유도하는 형광단으로 감지하고 정량화할 수 있습니다(그림 1).
키닌 수용체는 클래스 A 로돕신 유사 수용체에 속하는 무척추 동물 특이 적 GPCR입니다. Kinin은 연체 동물, 갑각류, 곤충 및 Acari 4,17,18에 존재하는 고대 신호 전달 신경 펩티드입니다. 딱정벌레 (딱정벌레)는 키닌 신호 시스템이 부족합니다. 모기 Aedes aegypti에는 3 개의 aedeskinins와 결합하는 키닌 수용체가 하나만 있으며, Drosophila melanogaster에는 독특한 리간드 19,20,21로 drosokinin과 함께 하나의 키닌 수용체가 있습니다. 척추 동물에는 상동 키닌 또는 키닌 수용체가 없습니다. 진드기에서 키닌의 정확한 기능은 알려져 있지 않지만, 키닌 수용체 RNAi- 침묵 된 R. microplus의 암컷은 생식 적합성이 현저히 감소 된 것으로 나타났습니다22. Kinins는 곤충의 다방성 펩타이드입니다. 초파리 멜라노가스터에서, 그들은 중추 및 말초 신경 조절 시스템23, 전-엑디시스(pre-ecdysis)24, 섭식25, 대사(26), 수면 활동 패턴(26, 27) 및 유충 운동28 모두에 관여한다. Kinins는 모기 A. aegypti 29,30,31 에서 뒷장 수축, 이뇨 및 먹이를 조절합니다. 키닌 펩티드는 보존된 C-말단 펜타펩티드 Phe-X1-X2-Trp-Gly-NH2를 가지며, 이는 생물학적 활성(32)에 필요한 최소 서열이다. 절지 동물 특이성, 내인성 리간드의 작은 크기로 인해 소분자 간섭에 민감하며 곤충의 다발성 기능은 키닌 수용체를 해충 방제를위한 유망한 표적으로 만듭니다4.
"이중-첨가" 분석(도 2)은 동일한 HTS 분석(15)에서 작용제 또는 길항제의 식별을 허용한다. 이는 약물 발견33을 위해 제약 산업에서 일반적으로 사용되는 "이중 첨가" 분석으로부터 채택된다. 간단히 말해서, 세포 플레이트에 약물을 먼저 추가하면 용매 제어의 적용에 비해 더 높은 형광 신호가 검출될 때 화학 라이브러리에서 잠재적 작용제를 식별할 수 있습니다. 이러한 소분자와 함께 5분 동안 배양한 후 알려진 작용제(키닌 펩타이드)를 모든 웰에 적용합니다. 약물 플레이트로부터 길항제를 무작위로 받은 웰은 첫 번째 첨가에서 용매를 수용한 대조군 웰에 비해 작용제 첨가 시 더 낮은 형광 신호를 표시합니다. 그런 다음 이 분석을 통해 동일한 세포를 가진 잠재적 작용제 및 길항제를 식별할 수 있습니다. 표준 HTS 프로젝트에서 이러한 적중 분자는 용량 반응 분석 및 여기에 표시되지 않은 추가 생물학적 활성 분석을 통해 추가로 검증됩니다.
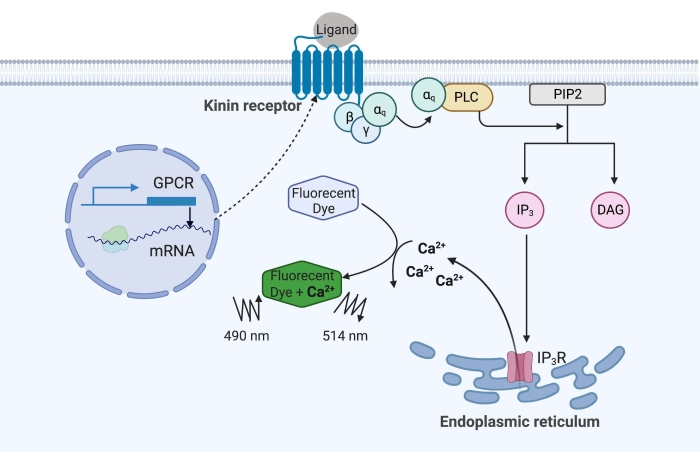
그림 1: 칼슘 형광 분석 메커니즘의 그림. Gq 단백질은 세포 내 칼슘 신호 전달 경로를 유발합니다. 키닌 수용체(G 단백질 커플링 수용체)는 CHO-K1 세포에서 재조합적으로 발현되었다. 작용제 리간드가 수용체에 결합할 때, 키닌 수용체와 연관된 Gq 단백질은 PLC를 활성화시키고, 이는PIP2 분자의IP3 및 DAG로의 전환을 촉매한다. 그런 다음 IP 3는 소포체 표면의 IP3R에 결합하여Ca2+가 세포질로 방출되고, 여기서Ca 2+ 이온은 형광단에 결합하여 형광 신호를 유도합니다. 형광 신호는 490nm에서 여기하여 얻을 수 있고 514nm에서 검출할 수 있습니다. 약어 : GPCR = G 단백질 결합 수용체; PLC = 포스포리파아제 C; PIP2 = 포스파티딜이노시톨 4,5-비스포스페이트; IP3 = 이노시톨 트리포스페이트; DAG = 디아실글리세롤; IP3 R = IP3 수용체. BioRender.com 로 만들었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
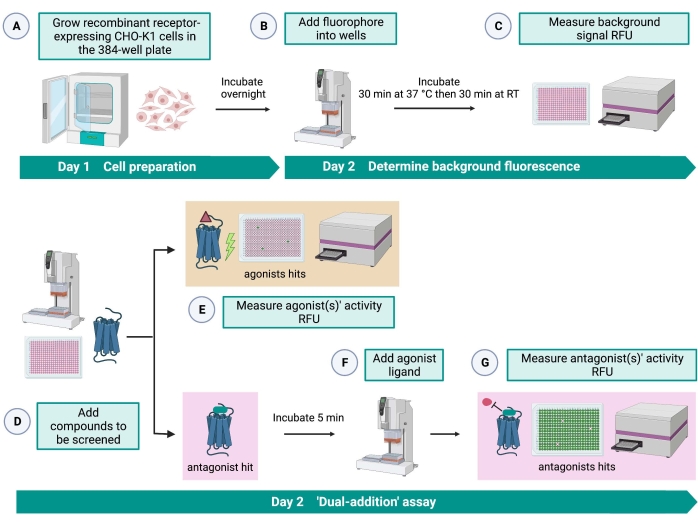
그림 2: CHO-K1 세포에서 발현되는 G 단백질 결합 수용체에서 소분자의 고처리량 스크리닝을 위한 워크플로. (A) 키닌 수용체를 안정적으로 발현하는 재조합 CHO-K1 세포를 액체 처리 시스템(25μL/웰)을 사용하여 384웰 플레이트(10,000세포/웰)에 첨가하고 가습된 CO2 인큐베이터에서12-16시간 동안 배양하였다. (B ) 형광 염료(25μL/웰)를 함유하는 분석 완충액을 액체 처리 시스템을 사용하여 세포 플레이트에 첨가하였다. 플레이트를 37°C에서 30분 동안 인큐베이션하고, RT에서 또 다른 30분 동안 평형화시켰다. (C) 각 웰에서 세포의 배경 형광 신호를 플레이트 리더로 측정하였다. (D) 384웰 라이브러리 플레이트와 블랭크 용매(모두 0.5μL/웰)의 약물 용액을 액체 처리 시스템을 사용하여 세포 분석 플레이트에 첨가했습니다. (e) 세포 칼슘 형광 반응은 약물 용액의 첨가 직후에 플레이트 리더로 측정되었다; 평균 형광 신호보다 높은 형광 신호를 유도하는 화합물은 작용제 히트로 선택되었습니다. GPCR을 차단하는 길항제 히트(아래 아이콘)는 단계 G 동안 펩티드 작용제의 첨가 후에 밝혀졌다. (f) 동일한 분석 플레이트에서, 세포를 스크리닝 화합물로 5분간 배양한 후, 진드기 키닌 수용체의 내인성 작용제 펩티드 Rhimi-K-1 (QFSPWGamide)을 각 웰(1 μM)에 첨가하였다. (g) 작용제 펩티드 첨가 후의 세포 형광 반응은 즉시 플레이트 리더로 측정하였다. 형광 신호를 억제하는 화합물(들)을 길항제 히트(들)로서 선택하였다. 약어 : GPCR = G 단백질 결합 수용체; RT = 실온; RFU = 상대 형광 단위. BioRender.com 로 만들었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
Access restricted. Please log in or start a trial to view this content.
프로토콜
1. 세포 유지 관리
참고: R. 마이크로플러스의 키닌 수용체를 안정적으로 발현하는 CHO-K1 세포주(BMLK3)는 Holmes et al.16에 의해 개발되었습니다. 세포주의 발달에 대한 세부사항은 다른 곳에 제시되어 있다14. 다음 모든 단계는 클래스 II 생물 안전 캐비닛의 멸균 조건에서 수행됩니다.
- 표적 수용체의 발현을 보장하기 위해 선택적 배지(10% 소 태아 혈청[FBS] 및 800μg/mL G418 황산염을 포함하는 F-12K 배지)에서 재조합 세포주를 성장시킵니다. 수용체를 안정적으로 발현하는 세포를 1mL의 냉동 배지(90% FBS 및 10% 디메틸설폭사이드[DMSO])에 -80°C 냉동고의 2mL 극저온에 보관합니다.
알림: 냉동 세포를 장기간 보관하려면 액체 질소에 보관하십시오. - 세포 배양 전에 모든 배지를 예열합니다. 생물안전 캐비닛에서 예열된 선택 배지 13mL(10% FBS 및 800μg/mL G418 황산염을 포함하는 F-12K 배지)를 T-75 플라스크에 옮기고 생물안전 캐비닛에 보관합니다. 동결된 BMLK 3 세포(~1.5 × 106 세포)의 한 바이알을 37°C 수조에서2-3분 동안 해동합니다. 해동 된 세포를 T-75 플라스크로 옮깁니다. 달리 명시되지 않는 한 세포를 37°C 및 5%CO2에서 가습된 인큐베이터에 유지한다.
- 세포가 90% 컨플루언시(1-2일)에 도달하면 실온으로 유지되는 Dulbecco의 인산염 완충 식염수(DPBS)를 제외한 모든 배지를 37°C로 예열합니다. 생물 안전 캐비닛에서 T-75 플라스크에서 사용한 배지를 제거하고 플라스크를 부드럽게 소용돌이 치며 DPBS 10mL로 세포를 5 초 동안 씻은 다음 혈청 학적 피펫으로 DPBS를 제거합니다.
참고: 90% 컨플루언시에서 CHO-K1 세포의 이미지는 Lu et al.14에 나와 있습니다. - 0.25% 트립신-EDTA 2mL를 첨가하여 T-75 플라스크에서 세포를 분리하고 인큐베이터에서 37°C에서 3-5분 동안 배양합니다. 그런 다음 8mL의 선택 배지를 추가하고 동일한 혈청학적 피펫으로 피펫팅하고 2x-3x 부드럽게 풀어 잘 혼합합니다.
- 1.4단계의 세포 현탁액 2mL(~1 ×10 6 개 세포)를 10mL의 따뜻한 선택 배지가 포함된 새 T-75 플라스크에 옮깁니다. 90 % confluency에 도달 할 때까지 인큐베이터에서 1-2 일 동안 세포를 성장시킵니다.
- 다음 단계에 따라 분석을 위해 세포를 사용하거나 분석에서 세포를 사용하기 전에 1.4-1.5단계를 한두 번 반복합니다.
참고: 특정 세포주의 분석 신호가 추가 계대에 따라 약해질 수 있으므로 3-4계대를 초과하지 마십시오.
2. 칼슘 형광 분석
- 셀 플레이트를 코팅합니다.
- 384웰 플레이트의 모든 피펫팅 단계를 위해 생물안전 캐비닛 내부에 배치된 액체 처리 시스템을 사용하십시오. 384-웰 플레이트31 (보충 표 S1)에 피펫팅을 위한 맞춤형 프로그램을 생성합니다. 멸균 된 384 웰 플레이트를 미리 코팅하십시오. 생물안전 캐비닛에서 폴리-D-라이신(PDL) 수용액 10μL/웰을 0.05mg/mL로 각 플레이트에 넣고 실온에서 5분 동안 배양합니다.
- 접시를 빠르게 뒤집어 멸균 종이 타월에 부드럽게 닦아서 접시를 비우십시오. 그런 다음 각 웰을 10μL의 물로 헹구고 플레이트를 비운 다음 뚜껑 없이 생물안전 캐비닛에서 밤새 건조되도록 둡니다. 뚜껑이 있는 접시를 닫고 냉장고에 4°C에서 보관합니다.
알림: 코팅된 플레이트는 4°C에서 최대 6개월 동안 보관할 수 있습니다.
- 1일차
- -20°C 냉동고에 보관된 약물 플레이트(90% DPBS + 10% DMSO에서 100μM, HTS에 대한 웰의 최종 농도는 2μM임)를 꺼내 실온에 놓습니다.
참고: 약물 플레이트의 레이아웃: 각 384웰 플레이트(24열 x 16행)에는 라이브러리 화합물이 다른 320개의 웰과 블랭크 용매(10% DMSO 함유 DPBS)가 있는 64개의 웰이 포함되어 있으며, 각 측면의 가장자리에 2개의 열이 있는 4개의 열로 배열됩니다. 플레이트 레이아웃에 대해서는 보충 표 S2 를 참조하십시오. - 세포가 T-75 플라스크에서 ~70%-75% 컨플루언시에 도달하면 아래 설명된 대로 T-75 플라스크에서 세포를 분리합니다. DPBS(실온)를 제외한 모든 매체를 37°C로 예열합니다.
- 사용한 배지를 제거하고 10mL의 DPBS로 세포를 세척한 다음 DPBS를 제거합니다. 인큐베이터에서 37°C에서 3-5분 동안 0.25% 트립신-EDTA 2mL를 사용하여 T-75 플라스크에서 세포를 분리하고 8mL의 선택 배지를 추가한 다음 세포 현탁액을 15mL 원뿔형 튜브에 옮겨 1,000× g 에서 3분 동안 원심분리합니다.
- 상청액을 버리고 1% FBS 및 400μg/mL G418 황산염을 포함하는 F-12K 배지 10mL에 세포 펠릿을 재현탁합니다. 세포 수를 결정하는 동안 생물 안전 캐비닛에 현탁액을 보관하십시오.
- 추가 희석을 위한 현탁액의 세포 밀도 결정: 20μL의 세포 현탁액을 20μL의 0.4% 트리판 블루에 혼합한 다음 혼합물 20μL를 세포 계수 챔버에 로드하여 세포 계수기에서 세포 밀도를 판독합니다.
- 동일한 배지(1% FBS 및 400μg/mL G418 황산염을 포함하는 F-12K 배지)에서 세포 현탁액을 4 × 105 cells/mL의 밀도에서 최소 15mL의 최종 부피로 희석합니다.
- PDL 코팅된 384-웰 플레이트에 세포를 시드한다. 위의 세포 현탁액 15mL(4 × 105 cells/mL)를 150mL 자동 친화적인 시약 저장소로 옮깁니다. 액체 처리 시스템을 사용하여 플레이트의 384개 웰의 각 웰에 25μL의 세포 현탁액(~10,000개 세포/웰)을 분배합니다. 384/12.5 μL의 저머무름 팁을 액체 처리기 헤드에 로드하고 저장소에서 12.5 μL를 흡입하고(속도 5.2 μL/s) 각 웰에 분주합니다(속도: 3.1 μL/s).
- 이전 단계 2.2.5에서와 같이 피펫팅을 반복하여 웰당 25μL에 도달합니다. 이어서, 플레이트를 가습된 인큐베이터에서 37°C 및 5%CO2 에서 밤새(14-16 h) 인큐베이션한다.
참고: 이 특정 헤드의 최대 피펫팅 부피는 12.5μL이므로 25μL에 대한 피펫팅은 두 단계로 수행됩니다.
- -20°C 냉동고에 보관된 약물 플레이트(90% DPBS + 10% DMSO에서 100μM, HTS에 대한 웰의 최종 농도는 2μM임)를 꺼내 실온에 놓습니다.
- 2일차
- 다음날 아침, 현미경으로 덮인 세포 판을 확인하십시오. 합류하지 않으면 세포가 90 % 합류에 도달 할 때까지 기다리십시오.
- 형광 염료의 스톡 용액 준비: 동결 건조된 형광 염료를 100μL의 DMSO에 재현탁하고 스톡 용액에 직사광선을 피하십시오. 광표백을 방지하기 위해 튜브를 알루미늄 호일로 감싸십시오.
참고: 스톡은 반복적인 동결 및 해동을 피하기 위해 각 플레이트 분석에 대해 15μL 분취량으로 분취될 수 있습니다. 분취량은 -80°C에서 최대 1개월 동안 보관할 수 있습니다. - 조명이 꺼진 생물안전 캐비닛에서 15μL의 형광 염료 원액(2.3.2단계)과 나머지 예열된 키트 구성 요소(37°C)를 결합하여 알루미늄 호일로 감싼 15mL 원추형 튜브에 로딩 염료(1x)를 준비합니다: 13.5mL의 1x HHBS(20mM HEPES가 있는 행크 완충액) 및 1.5mL의 시약 B(염료 유출 억제제).
알림: 이 단계에서는 실내 조명이 켜집니다. - 튜브를 닫고 튜브를 여러 번(일반적으로 3-5배) 부드럽게 뒤집어 잘 섞습니다.
알림: 실온에서 보관하고 30분 이내에 로딩 염료 혼합물을 사용하십시오. - 세포가 90% 컨플루언스에 도달하면 플레이트를 빠르게 뒤집고 멸균 종이 타월에 부드럽게 블로팅하여 384웰 분석 플레이트에서 사용한 배지를 제거합니다. 이 동작을 2x-3x 반복하여 플레이트에서 모든 액체를 제거합니다. 젖은 수건은 버리십시오.
- 방에서 대부분의 인공 직사광선을 끄고(부드럽고 희미한 책상 램프를 켜거나 이와 유사한 상태로 두어 작업 조건을 볼 수 있도록 함) 분석이 끝날 때까지(약 1.5시간 동안) 모든 단계에서 생물안전 캐비닛에서 꺼집니다.
- 2.3.3단계의 로딩 염료(1x) 15mL를 자동 친화적인 저장소 150mL에 넣습니다.
- 플레이트의 각 웰에 12.5μL를 분주하여 384/12.5μL의 저머무름 팁이 있는 액체 처리 시스템을 사용하여 저장소에서 25μL의 로딩 염료(1x)를 저장소에서 각 웰로 옮깁니다(흡인 및 분주 속도: 3.8μL/s).
- 2.3.7.1에서와 같이 피펫팅 단계를 반복하여 플레이트의 각 웰에서 25μL의 최종 부피에 도달합니다. 주변광으로부터 보호하기 위해 플레이트를 알루미늄 호일로 덮고 감싸십시오.
- 덮인 세포 플레이트를CO2 가습 인큐베이터에서 37°C에서 30분 동안 인큐베이션하고, 인큐베이터로부터 제거하고, 플레이트 판독기 내부 또는 벤치에서 실온에서 평형을 이루고, 플레이트를 덮고 호일로 30분 더 감싸 유지한다. 그런 다음 세포는 고처리량 스크리닝(HTS)을 위한 준비가 됩니다.
- 화학 제제: 플레이트 원심분리기에서 1,200 × g 에서 단계 2.2.1의 약물 플레이트를 실온에서 1분 동안 회전시킵니다.
- 0.1% DMSO를 함유하는 1x HHBS 10mL에 동결건조된 펩타이드 100nmole을 재현탁하여 Rhimi-K-1(QFSPWGamide)(10μM)의 10x 작용제 펩타이드 용액을 제조하고, 용액을 150mL 자동 친화적인 저장소로 옮깁니다.
- 배경 신호 측정: 플레이트 리더의 전체 HTS 분석에 대해 프로토콜에서 종말점 형광 모드를 선택합니다.
알림: 형광 신호는 495nm/525nm의 여기/방출 파장에서 플레이트 바닥에서 읽습니다.- 셀 플레이트를 플레이트 리더에 삽입합니다. 계기판에서 게인 조정을 선택하고, 플레이트에서 임의의 웰을 선택하고, 측정 가능한 최대 형광 값의 5%-10%로 할당하고, 높이 조정(판독)을 선택합니다.
- 측정 시작을 클릭하여 상대 형광 단위(RFU)의 배경 형광 신호에 대한 전체 플레이트를 읽습니다.
- "이중 첨가" 분석
- 384/12.5 μL 팁이 있는 액체 처리 시스템을 사용하여 약물 플레이트의 각 웰에 약물 용액을 혼합하기 위해 약물 용액의 10μL(10% DMSO를 포함하는 DPBS에서)를 3x 위아래로 피펫팅하고(피펫팅 속도: 5.2μL/s) 및 약물 플레이트의 각 웰에서 1.5μL를 "흡인"합니다(흡인 속도: 1.0μL/s).
- 0.5 μL의 화합물을 세포 분석 플레이트(피펫팅 속도: 1 μL/s)에 "분주"하여 0.2% DMSO에서 2 μM의 최종 농도에 도달합니다.
- 스크리닝 화합물을 추가한 후 분석 플레이트를 플레이트 리더에 즉시 놓습니다. 정방향 및 역방향 읽기 방향으로 동일한 플레이트를 읽으십시오. 이러한 판독값을 얻으려면 "well 1-384"에서 읽고 "384-1"에서 즉시 읽을 프로그램을 정의하십시오.
알림: 양방향으로 판독하는 데 총 2분이 걸립니다. 이 판독 설계는 각 방향에서 플레이트를 읽는 동안 발생하는 신호 강도의 감소를 보상하기 위한 것입니다. 판독값 분석은 3.1단계를 참조하십시오. - 팁을 ~150mL의 DPBS가 들어 있는 50mL 폐기물 저장소에 담가 팁에 나머지 1μL의 약물 용액을 폐기합니다(분주 속도: 1.0μL/s).
- 스크리닝 화합물을 불이 꺼진 상태에서 생물안전 캐비닛의 실온에서 총 5분(플레이트 판독 2분 포함) 동안 세포와 함께 배양합니다. 384/12.5 μL 팁이 있는 액체 처리 시스템(분주 속도: 3.1 μL/s)을 사용하여 저장소(흡인 속도: 3.1 μL/s)에서 작용제 펩타이드인 Rhimi-K-1(QFSPWGamide) 3μL를 분석 플레이트에 추가합니다.
- 플레이트를 작용제 펩티드의 첨가 직후에 플레이트 판독기에 놓는다. 2.3.12.3단계와 동일한 프로그램을 사용하여 정방향과 역방향으로 플레이트를 읽습니다.
3. 데이터 분석
- 컴퓨터에 설치된 플레이트 리더와 연결된 분석 소프트웨어를 사용하여 첫 번째 화합물 첨가 후 두 판독값에 대한 세포 형광 반응(RFU에서)을 계산합니다(First read; RFU전 [보충 표 S2]) 및 작용제 첨가 단계 후(제2 판독 = RFU개미 [보충 표 S2]). 각 판독값은 각각 2.3.12.3단계 및 2.3.12.6단계의 정방향 및 역방향 플레이트 판독값에 의해 얻은 두 값(표시되지 않음)을 평균화하여 얻습니다.
참고: RFU 전, RFU개미는 각각 잠재적 작용제 히트(단계 2.3.12.3에서 판독) 및 잠재적 길항제 히트(단계 2.3.12.6에서 판독)의 상대적 형광 단위를 참조한다. - 분석 소프트웨어에서 세 가지 데이터 세트(RFU bg, RFU ago 및 RFUant)를 모두 세 개의 개별 스프레드시트로 내보냅니다. 각 스프레드시트에는 웰 위치와 원시 RFU(여기에 표시되지 않은 파일)의 두 개의 열만 있습니다.
참고: RFU bg는 2.3.11.2단계에서 읽은 배경의 RFU를 나타냅니다. - 세 개의 스프레드시트에서 데이터의 형식을 지정하고 위의 데이터를 하나의 csv 파일로 구성합니다(보충 표 S2의 예 참조). RFU전 및 RFU 개미에서 읽은 배경 신호를 각각 뺍니다(보충 표 S2의 G 및 H 열).
- 다운스트림 데이터 분석(표 1) 및 저장을 위해 csv 파일을 상용 "온라인 HTS 데이터 플랫폼"(재료 표 참조)으로 가져옵니다.
- 방정식 (1)을 사용하여 각 플레이트 분석의 품질 관리에 대한 Z'-factor를 수동으로 계산합니다.
식 (1):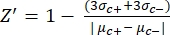 (1)
(1)
참고: μ c- 및 μc+는 동일한 웰 판독값의 평균 RFU를 나타내며, 이는 용매를 추가한 후 첫 번째 첨가에서 음성 대조군(빈 용매, n = 64, 보충 표 S2의 파란색 숫자) 작용제 추가 후 양성 대조군 역할을 합니다(빈 용매 + 작용제, n = 64, 자홍색 숫자). 각각. 또한 σ c- 및 σc+는 해당 표준 편차(SD)를 나타냅니다. - "온라인 HTS 데이터 플랫폼"의 히트 맵에서 히트 분자를 수동으로 선택하고 방정식 (2) 및 방정식 (3)을 사용하여 작용제 히트 및 길항제 히트에 대한 정규화된 활성화 백분율(NPA) 및 억제 활성(Io)을 계산합니다.
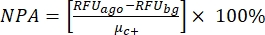 (2)
(2)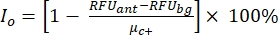 (3)
(3)
Access restricted. Please log in or start a trial to view this content.
결과
320개의 무작위 소분자로 구성된 사내 약물 플레이트(SAC2-34-6170)를 예로 이 HTS 분석을 시연하는 데 사용했습니다. HTS는 Z' 계수가 0.7인 우수한 분석 품질을 가졌습니다(표 1). 이 Z' 인자는 시험된 화합물34와 무관한 분석 품질을 반영한다. 0.5 이상의 Z' 계수는 양성 대조군과 음성 대조군의 RFU 사이의 양호한 분석 신호 동적 범위를 나타냅니다. Z' 계수가 0...
Access restricted. Please log in or start a trial to view this content.
토론
HTS의 목표는 대량의 소분자를 스크리닝하여 적중 분자를 식별하는 것입니다. 따라서 이 예제의 결과는 기존 HTS 실험의 작은 부분만을 나타냅니다. 또한, 확인된 적중 분자는 동일한 재조합 세포주 및 빈 벡터만 운반하는 CHO-K1 세포주에 대한 용량 의존적 분석과 같은 다운스트림 분석에서 검증되어야 하며, 이는 소분자를 저장하기 위해 동시에 수행할 수 있습니다. 세포독성 분석은 제2 첨가에서의...
Access restricted. Please log in or start a trial to view this content.
공개
저자는 공개 할 이해 상충이 없습니다.
감사의 말
이 작업은 USDA-NIFA-AFRI 동물 건강 및 웰빙 상 (수상 번호 2022-67015-36336, PVP [프로젝트 디렉터])과 텍사스 A & M AgriLife 연구 곤충 벡터 질병 보조금 프로그램 (FY'22-23)의 경쟁 기금에서 P.V.P.로 지원되었습니다. 농업 생명 과학 대학 TAMU의 A.W.E.S.O.M.E. 교수 그룹은 원고 편집에 도움을 준 것으로 인정 받았습니다. 보충 표 S2 에는 텍사스 A&M 대학과 텍사스 A&M AgriLife Research의 James Sacchettini 박사 실험실에서 얻은 사내 무작위 소분자 라이브러리의 데이터가 포함되어 있습니다.
Access restricted. Please log in or start a trial to view this content.
자료
| Name | Company | Catalog Number | Comments |
| 0.25% trypsin-EDTA | Gibco Invitrogen | 15050-065 | with phenol red |
| 0.4% trypan blue | MilliporeSigma | T8154 | liquid, sterile |
| 1.5 mL microcentrifuge tubes | Thermo Fisher | AM12400 | RNase-free Microfuge Tubes |
| 5 mL serological pipette | Corning | 29443-045 | Corning Costar Stripette individually wrapped |
| 10 mL serological pipette | Corning | 29443-047 | Corning Costar Stripette individually wrapped |
| 15 mL conical tubes | Falcon | 352196 | sterile |
| 20 µL filter tips | USA Scientifc Inc. | P1121 | sterile, barrier |
| 25 mL serological pipette | Corning | 29443-049 | Corning Costar Stripette individually wrapped |
| 50 mL conical tubes | Corning | 430828 | graduated, sterile |
| 150 mL auto-friendly reservior | Integra Bioscience | 6317 | sterile, individually wrapped for cell seeding in day 1 |
| 150 mL auto-friendly reservior | Integra Bioscience | 6318 | sterile, stacked, for loading dye in day 2 |
| 384/ 12.5 µL low retention tips | Integra Bioscience | 6405 | long, sterile filter |
| 384/ 12.5 µL tips | Integra Bioscience | 6404 | long, sterile filter |
| 384-well plate | Greiner | 781091 | CELLSTAR, clear polystyrene, µClear, Black/Flat |
| Aluminum plate seals | Axygen Scientific | PCR-AS-200 | polyester-based |
| Aluminum foil wrap | Walmart | ||
| Biosafty cabinet II | NuAire | NU-540-300 | |
| Cell counter | Nexcelom | AutoT4 | |
| cell counting slides | Nexcelom | SD-100 | 20 µL chamber |
| CO2 humidified incubator | Thermo Fisher | Forma Series II | |
| Desk Lamp | SunvaleeyTEK | RS1000B | |
| Dimethyl sulfoxide | MilliporeSigma | 276855 | anhydous, >99.9% |
| Drug plate | Corning | 3680 | |
| Dulbecco's phosphate-buffered saline | Corning | 21-031-CV | DPBS, 1x without calcium amd magnesium |
| Ethanol | Koptec | 2000 | |
| F-12K Nutrient Mixture | Corning | 45000-354 | (Kaighn's Mod.) with L-glutamine |
| Fetal bovine serum | Equitech-Bio | SFBU30 | |
| Fluorescent calcium assay kit | ENZO Lifescience | ENZ-51017 | 10x96 tests |
| G418 sulfate | Gibco Invitrogen | 10131-027 | Geneticin selective antibiotic 50 mg/mL |
| Hank's buffer | MilliporeSigma | 55037C | HBSS modified, with calcium, with magnesium, without phenol read |
| HEPES buffer | Gibco Invitrogen | 15630-080 | 1 Molar |
| HTS data storage plateform | CDD vault | https://www.collaborativedrug.com/ | |
| Liquid handling system | Integra Bioscience | Viaflo | 384/12.5 µL |
| Plate centrifuge | Thermo Fisher | Sorvall ST8 | |
| Plate reader | BMG technology | Clariostar | |
| Poly-D-lysine | MilliporeSigma | P6407 | |
| Rhimi-K-1 agonist peptide | Genscript | custom order | QFSPWGamide |
| T-75 flask | Falcon | 353136 |
참고문헌
- Hanlon, C. D., Andrew, D. J. Outside-in signaling - A brief review of GPCR signaling with a focus on the Drosophila GPCR family. Journal of Cell Science. 128 (19), 3533-3542 (2015).
- Liu, N., Li, T., Wang, Y., Liu, S. G-protein coupled receptors (GPCRs) in insects-A potential target for new insecticide development. Molecules. 26 (10), 2993(2021).
- Pierce, K. L., Premont, R. T., Lefkowitz, R. J. Seven-transmembrane receptors. Nature Reviews Molecular Cell Biology. 3, 639-650 (2002).
- Pietrantonio, P. V., Xiong, C., Nachman, R. J., Shen, Y. G protein-coupled receptors in arthropod vectors: Omics and pharmacological approaches to elucidate ligand-receptor interactions and novel organismal functions. Current Opinion in Insect Science. 29, 12-20 (2018).
- Hilger, D., Masureel, M., Kobilka, B. K. Structure and dynamics of GPCR signaling complexes. Nature Structural & Molecular Biology. 25 (1), 4-12 (2018).
- Liu, N., Wang, Y., Li, T., Feng, X. G-protein coupled receptors (GPCRs): Signaling pathways, characterization, and functions in insect physiology and toxicology. International Journal of Molecular Sciences. 22 (10), 5260(2021).
- Hansen, K. B., Bräuner-Osborne, H. FLIPR® assays of intracellular calcium in GPCR drug discovery. G Protein-Coupled Receptors in Drug Discovery. Leifert, W. , Humana Press. Totowa, NJ. (2009).
- Bauknecht, P., Jekely, G. Large-scale combinatorial deorphanization of Platynereis neuropeptide GPCRs. Cell Reports. 12 (4), 684-693 (2015).
- Frooninckx, L., et al. Neuropeptide GPCRs in C. elegans. Frontiers in Endocrinology. 3, 167(2012).
- Caers, J., et al. More than two decades of research on insect neuropeptide GPCRs: An overview. Frontiers in Endocrinology. 3, 151(2012).
- Šimo, L., Koči, J., Park, Y. Receptors for the neuropeptides, myoinhibitory peptide and SIFamide, in control of the salivary glands of the blacklegged tick Ixodes scapularis. Insect Biochemistry and Molecular Biology. 43 (4), 376-387 (2013).
- Šimo, L., Park, Y. Neuropeptidergic control of the hindgut in the black-legged tick Ixodes scapularis. International Journal for Parasitology. 44 (11), 819-826 (2014).
- Liesch, J., Bellani, L. L., Vosshall, L. B. Functional and genetic characterization of neuropeptide Y-like receptors in Aedes aegypti. PLoS Neglected Tropical Diseases. 7 (10), 2486(2013).
- Lu, H. L., Kersch, C. N., Taneja-Bageshwar, S., Pietrantonio, P. V. A calcium bioluminescence assay for functional analysis of mosquito (Aedes aegypti) and tick (Rhipicephalus microplus) G protein-coupled receptors. Journal of Visualized Experiments. (50), e2732(2011).
- Xiong, C., Baker, D., Pietrantonio, P. V. The cattle fever tick, Rhipicephalus microplus, as a model for forward pharmacology to elucidate kinin GPCR function in the Acari. Frontiers in Physiology. 10, 1008(2019).
- Holmes, S. P., Barhoumi, R., Nachman, R. J., Pietrantonio, P. V. Functional analysis of a G protein-coupled receptor from the Southern cattle tick Boophilus microplus (Acari: Ixodidae) identifies it as the first arthropod myokinin receptor. Insect Molecular Biology. 12 (1), 27-38 (2003).
- Cox, K. J., et al. Cloning, characterization, and expression of a G-protein-coupled receptor from Lymnaea stagnalis and identification of a leucokinin-like peptide, PSFHSWSamide, as its endogenous ligand. Journal of Neuroscience. 17 (4), 1197-1205 (1997).
- Dircksen, H. Chapter 32 - Crustacean bioactive peptides. Handbook of Biologically Active Peptides (Second Edition). Kastin, A. J. , Academic Press. Cambridge, MA. 209-221 (2013).
- Halberg, K. A., Terhzaz, S., Cabrero, P., Davies, S. A., Dow, J. A. Tracing the evolutionary origins of insect renal function. Nature Communications. 6, 6800(2015).
- Pietrantonio, P. V., Jagge, C., Taneja-Bageshwar, S., Nachman, R. J., Barhoumi, R. The mosquito Aedes aegypti (L.) leucokinin receptor is a multiligand receptor for the three Aedes kinins. Insect Molecular Biology. 14 (1), 55-67 (2005).
- Radford, J. C., Davies, S. A., Dow, J. A. Systematic G-protein-coupled receptor analysis in Drosophila melanogaster identifies a leucokinin receptor with novel roles. Journal of Biological Chemistry. 277 (41), 38810-38817 (2002).
- Brock, C. M., et al. The leucokinin-like peptide receptor from the cattle fever tick, Rhipicephalus microplus, is localized in the midgut periphery and receptor silencing with validated double-stranded RNAs causes a reproductive fitness cost. International Journal for Parasitology. 49 (3-4), 287-299 (2019).
- Nässel, D. R. Leucokinin and associated neuropeptides regulate multiple aspects of physiology and behavior in Drosophila. International Journal of Molecular Sciences. 22 (4), 1940(2021).
- Kim, Y. -J., et al. Central peptidergic ensembles associated with organization of an innate behavior. Proceedings of the National Academy of Sciences of the United States of America. 103 (38), 14211-14216 (2006).
- Al-Anzi, B., et al. The leucokinin pathway and its neurons regulate meal size in Drosophila. Current Biology. 20 (11), 969-978 (2010).
- Yurgel, M. E., et al. A single pair of leucokinin neurons are modulated by feeding state and regulate sleep-metabolism interactions. PLoS Biology. 17 (2), 2006409(2019).
- Nässel, D. R., Zandawala, M. Recent advances in neuropeptide signaling in Drosophila, from genes to physiology and behavior. Progress in Neurobiology. 179, 101607(2019).
- Okusawa, S., Kohsaka, H., Nose, A. Serotonin and downstream leucokinin neurons modulate larval turning behavior in Drosophila. Journal of Neuroscience. 34 (7), 2544-2558 (2014).
- Kersch, C. N., Pietrantonio, P. V. Mosquito Aedes aegypti (L.) leucokinin receptor is critical for in vivo fluid excretion post blood feeding. FEBS letters. 585 (22), 3507-3512 (2011).
- Kwon, H., et al. Leucokinin mimetic elicits aversive behavior in mosquito Aedes aegypti (L.) and inhibits the sugar taste neuron. Proceedings of the National Academy of Sciences of the United States of America. 113 (25), 6880-6885 (2016).
- Xiong, C., Baker, D., Pietrantonio, P. V. A random small molecule library screen identifies novel antagonists of the kinin receptor from the cattle fever tick, Rhipicephalus microplus (Acari: Ixodidae). Pest Management Science. 77 (5), 2238-2251 (2021).
- Torfs, P., et al. The kinin peptide family in invertebrates. Annals of the New York Academy of Sciences. 897 (1), 361-373 (1999).
- Ma, Q., Ye, L., Liu, H., Shi, Y., Zhou, N. An overview of Ca2+ mobilization assays in GPCR drug discovery. Expert Opinion on Drug Discovery. 12 (5), 511-523 (2017).
- Zhang, J. -H., Chung, T. D., Oldenburg, K. R. A simple statistical parameter for use in evaluation and validation of high throughput screening assays. Journal of Biomolecular Screening. 4 (2), 67-73 (1999).
- Zhang, R., Xie, X. Tools for GPCR drug discovery. Acta Pharmacologica Sinica. 33 (3), 372-384 (2012).
- Offermanns, S., Simon, M. I. Gα15 and Gα16 couple a wide variety of receptors to phospholipase C. Journal of Biological Chemistry. 270 (25), 15175-15180 (1995).
- Murgia, M. V., et al. High-content phenotypic screening identifies novel chemistries that disrupt mosquito activity and development. Pesticide Biochemistry and Physiology. 182, 105037(2022).
- Lismont, E., et al. Can BRET-based biosensors be used to characterize G-protein mediated signaling pathways of an insect GPCR, the Schistocerca gregaria CRF-related diuretic hormone receptor. Insect Biochemistry and Molecular Biology. 122, 103392(2020).
Access restricted. Please log in or start a trial to view this content.
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유