JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
3D 세포 배양을 위한 미세 다공성 어닐링 입자 스캐폴드의 입자 분획 제어
요약
입상 스캐폴드 내에서 입자 분획의 변동성을 최소화하면 재현 가능한 실험이 용이해집니다. 이 작업은 시험관 내 조직 공학 응용 분야를 위해 제어된 입자 분획으로 과립 스캐폴드를 생성하는 방법을 설명합니다.
초록
마이크로젤은 미세다공성 어닐링 입자(MAP) 스캐폴드의 빌딩 블록으로, 체외 세포 배양 및 생체 내 조직 복구를 위한 플랫폼 역할을 합니다. 이러한 입상 스캐폴드에서 마이크로젤 사이의 빈 공간에 의해 생성된 선천성 다공성은 세포 침윤 및 이동을 가능하게 합니다. 공극률과 입자 분획을 제어하는 것은 MAP 스캐폴드 설계에 매우 중요한데, 이는 다공성이 세포의 생리활성 신호이기 때문입니다. 구형 마이크로겔은 크기 및 형상을 제어하기 위해 마이크로유체 디바이스 상에서 생성될 수 있고, 후속적으로 중합체 네트워크의 파쇄를 방지하는 방법을 사용하여 동결건조될 수 있다. 재수화 시, 동결건조된 마이크로겔은 MAP 스캐폴드에서 제어된 입자 분획으로 이어진다. 마이크로겔 동결건조를 위한 이러한 방법의 구현은 입자 분획이 거대분자 확산 및 세포 확산에 미치는 영향을 보여주는 재현 가능한 연구로 이어졌습니다. 다음 프로토콜은 MAP 스캐폴드에서 입자 분획을 제어하기 위한 마이크로젤의 제조, 동결건조 및 재수화뿐만 아니라 시험관 내 3D 세포 배양을 위한 생체 직교 가교를 통해 마이크로젤을 어닐링하는 방법을 다룹니다.
서문
미세 다공성 어닐링 입자 (MAP) 스캐 폴드는 마이크로 겔 (μgel) 빌딩 블록이 상호 연결되어 벌크 다공성 스캐 폴드를 형성하는 입상 재료의 하위 클래스입니다. 이러한 입상 스캐폴드의 고유한 마이크로아키텍처를 통해 상호 연결된 구형 마이크로겔 사이의 빈 공간에 의해 생성된 타고난 다공성은 가속화된 세포 침투및 이동을 지원합니다1. MAP 스캐폴드의 마이크로겔 빌딩 블록은 화학적 변형2을 갖는 합성 및 천연 중합체 둘 다로부터 제조될 수 있다. 여기에 설명된 방법은 기능성 노르보르넨(NB) 핸들로 변형된 히알루론산(HA) 백본으로 구성된 마이크로젤의 사용을 구체적으로 강조합니다. HA 폴리머의 NB 기능적 핸들은 마이크로겔을 형성하고 이들을 함께 연결하여 MAP 스캐폴드 3,4를 생성하기 위한 클릭 화학 반응을 지원합니다. 마이크로겔을 함께 연결(즉, 어닐링)하기 위해 효소1, 광기반 5,6 및 무첨가 클릭 화학 3,7 반응과 같은 수많은 방식이 사용되었습니다. 무첨가 클릭 화학은 HA-NB 마이크로겔을 상호 결합시키기 위한 테트라진-노르보르넨 역전자 요구량 딜스-알더 컨쥬게이션을 사용하여 본 작업에 기술된다.
MAP 스캐폴드를 제조하기 위해 사용자는 먼저 배치 시스템 또는 미세유체 장치 내에서 역에멀젼을 사용하고 전기유체역학 스프레이, 리소그래피 또는 기계적단편화2를 사용하여 마이크로겔 빌딩 블록을 생성합니다. 구형 HA-NB 마이크로겔의 제조는 배치 에멀젼2 및 마이크로유체 액적 생성 기술 8,9,10,11 둘 다를 사용하여 잘 기술되고 이전에 보고되었다. 이 작업에서, 구형 HA-NB 마이크로겔은 앞서 설명한바와 같이 제어된 크기 및 형상을 위해 유동 집속 마이크로유체 플랫폼 상에서 생성되었다 8,9,10. 정제 후, 마이크로겔은 수성 현탁액에 존재하며 걸림 상태를 유도하기 위해 농축되어야 합니다. 걸림이 있을 때, 마이크로젤은 전단 박화 특성을 나타내어 주사 가능한 공간 채우기 물질1로 기능할 수 있습니다. 걸림 상태를 유도하는 한 가지 방법은 동결건조 또는 동결건조를 통해 마이크로겔을 건조시킨 다음, 건조된 생성물을 제어된 부피(12)에서 후속적으로 재수화시키는 것이다. 대안적으로, 과량의 완충액은 스트레이너를 통한 원심분리를 통해 또는 흡인 또는 흡수성 물질을 사용하여 마이크로겔 펠릿으로부터 완충액을 수동으로 제거함으로써 마이크로겔 슬러리로부터 제거될 수 있다. 그러나, 마이크로겔을 건조시키기 위해 원심분리를 사용하는 것은 과립형 스캐폴드(12)를 제조할 때 매우 다양한 범위의 입자 분획 및 공극 분획을 생성할 수 있다. 마이크로겔을 동결건조하기 위한 기술은 폴리에틸렌 글리콜 (PEG) 마이크로겔13에 대해 70% IPA, 젤라틴 메타크릴로일 (GelMa) 마이크로겔 14에 대한 불소화 오일, 및 HA 마이크로겔12에 대해 70% 에탄올을 사용하여 설명되었다. 이 프로토콜은 건조 공정 중에 원래의 마이크로젤 특성을 유지하기 위해 표준 실험실 시약인 70% 에탄올을 사용하여 구형 HA 마이크로젤을 동결 건조하는 방법을 강조합니다. 동결건조된 HA 마이크로겔은 MAP 스캐폴드12에서 최종 입자 분획을 제어하기 위해 사용자 정의된 중량 백분율로 칭량 및 재수화될 수 있습니다.
MAP 스캐폴드 형성의 마지막 단계는 마이크로겔을 어닐링하여 벌크, 다공성 스캐폴드(1)를 생성하는 것에 의존한다. 천연 세포외 매트릭스 성분을 활용하고 생체 직교 어닐링 방식을 사용함으로써 MAP 스캐폴드는 시험관 내 세포 배양 및 생체 내 조직 복구3 모두를 위한 생체 적합성 플랫폼 역할을 합니다. 이러한 접근법을 통해, MAP 스캐폴드는 조직 공학 애플리케이션(12)에서의 사용을 위해 사용자 정의된 입자 분획을 갖는 HA-NB 빌딩 블록으로부터 제조될 수 있다. 하기 프로토콜은 MAP 스캐폴드에서 입자 분획을 제어하기 위한 동결건조 및 재수화에 따른 HA-NB 마이크로겔의 미세유체 생산을 설명합니다. 마지막으로, 마이크로젤을 어닐링하는 단계는 시험관 내 3D 세포 배양 실험을 위해 생체 직교 화학을 사용하여 설명됩니다.
프로토콜
1. 미세 유체 장치 제작
- 소프트 리소그래피
참고: 이 프로토콜은 de Wilson et al.9의 유동 초점 미세유체 장치 설계의 장치 제조를 설명합니다. 그러나 이 프로토콜은 SU-8 웨이퍼의 모든 장치 설계와 함께 사용할 수 있습니다. 웨이퍼는 페트리 접시에 테이프로 붙일 수 있고, 이어서 PDMS가 웨이퍼 피쳐(15)에 부착되는 것을 방지하기 위해 실란화될 필요가 있다.- 폴리디메틸실록산(PDMS) 엘라스토머 베이스와 경화제( 재료 표 참조)를 10:1 비율로 혼합합니다. ~5mm PDMS로 웨이퍼를 덮기 위해 약 100g을 준비합니다. PDMS 혼합물을 웨이퍼에 붓고 데시케이터에서 약 30분 동안 가스를 제거합니다. 모든 기포가 사라지면 60°C의 오븐에 최소 2시간 동안 두어 PDMS를 경화시킵니다.
- 나이프를 사용하여 웨이퍼를 깨지 않고 장치의 매개 변수 주위를 부드럽게 추적하십시오. 그런 다음 웨이퍼에서 PDMS를 조심스럽게 떼어냅니다. 1mm 생검 펀치( 재료 표 참조)를 사용하여 입구 및 출구 채널을 만듭니다.
알림: 미세 유체 장치를 펀칭 할 때는 부드럽게하십시오. 입구 또는 출구 채널 주변의 찢어짐이나 찢어짐은 마이크로젤 생산 중에 누출을 일으킬 수 있습니다. - 테이프를 사용하여 피처 쪽의 장치에서 먼지를 제거합니다. 장치를 놓고 유리 슬라이드를 135°C의 핫플레이트에 최소 15분 동안 놓아 수분을 제거합니다.
- 흄 후드에서 코로나 플라즈마 건( 재료 표 참조)을 유리 슬라이드와 장치(피쳐 측면 노출) 높이에서 약 30초 동안 사용한 다음 빠르게 결합합니다. 장치와 유리 슬라이드 사이에 잘 밀봉되도록 부드럽게 압력을 가하십시오. 접착을 고정하기 위해 장치를 60°C 오븐에 밤새 두십시오.
2. 노르보르넨(NB) 기능성 손잡이를 사용한 히알루론산(HA) 마이크로젤의 미세유체 생산
- HA-NB 합성
참고 : HA- 노르 보르 넨 (HA-NB) 합성은 HA- 반복 단위의 몰 당량이 1 : 1.5 : 2.5 인 79 kDa 나트륨 HA를 사용하여 Darling et al.3에서 4- (4,6- 디메 톡시 -1,3,5 - 트리 아진 -2- 일) -4- 메틸 모르 폴리 늄 클로라이드 (DMTMM)에서 5- 노르 보르 넨 -2- 메틸 아민 (NMA).- 반응물의 무게를 측정합니다. 교반 플레이트의 비커 또는 플라스크에서 교반하여 200mM MES 완충액(pH ~6)에 HA를 20mg/mL로 녹입니다. 일단 용해되면 DMTMM을 HA 용액에 첨가하고 실온에서 약 20분 동안 반응시킵니다. 예를 들어, 1 g HA + 1.09 g DMTMM + 845 μL NMA가 사용될 수 있다.
- NMA를 HA/DMTMM 용액에 적가한다. 증발을 최소화하고 반응 용기를 호일로 덮기 위해 반응 용기의 개구부에 파라필름을 추가합니다. 반응이 약 24시간 동안 진행되도록 하면서 계속 교반합니다.
- 24시간 후, 200프루프 에탄올(반응 부피의 약 10배)을 식힙니다. 교반 플레이트에서 반응물을 냉각된 에탄올에 적가하여 HA-NB를 침전시키고 200-300rpm에서 20분 동안 계속 교반합니다.
- 용액을 50mL 원뿔형 튜브로 옮긴 다음 5,000 x g 에서 10분 동안 원심분리합니다. 여분의 에탄올을 부어 폐기물로 처리하십시오. 이 시점에서 HA-NB 제품은 원추형 튜브의 흰색 펠릿이어야합니다. HA-NB의 진공 청소기를 데시케이터로 당겨 밤새 건조시킵니다.
- 12-14 kDa 분자량 차단 셀룰로오스 투석 튜브를 사용하여 HA-NB를 정제합니다( 재료 표 참조). HA-NB를 2M NaCl 용액에 녹이고 투석 튜브로 옮깁니다. 필요한 경우 튜브를 묶고 클램프로 고정합니다. 채워진 투석 튜브를 5L의 초순수가 담긴 버킷에 옮기고 HA-NB를 밤새 물에 대해 투석합니다.
- 다음날 물을 제거하고 1M NaCl 용액으로 30 분 동안 교체하십시오. NaCl 용액을 제거한 다음 3 일 동안 초순수로 투석하여 매일 물을 교체하십시오.
- 0.2μm 진공 구동 필터를 사용하여 투석된 제품을 여과한 다음 여과된 제품을 50mL 원뿔형 튜브로 옮깁니다.
- 극저온 용기에 액체 질소를 넣고 HA-NB 튜브를 10분 동안 급속 냉동합니다. 그런 다음 집게로 원추형 튜브를 제거하고 캡을 빠르게 제거하고 실험실 등급 티슈로 덮습니다( 재료 표 참조). 고무 밴드로 조직을 고정하고 동결 건조 용기 또는 챔버 ( 재료 표 참조)로 옮기고 동결 건조합니다. 동결건조된 생성물을 -20°C에서 보관한다.
주의 : 액체 질소는 유해 물질입니다. 액체 질소로 작업 할 때는 적절한 개인 보호 장비를 착용하십시오. - HA-NB를D2O에 10mg/mL로 용해시키고 양성자 NMR을 통해 분석하여 노르보르넨 변형을 정량화합니다(그림 1A)16.
- 기능화의 양을 결정하기 위해, 먼저D2O용매 피크를 4.8 PPM으로 보정한다. HA 메틸 양성자 (δ2.05)에 대한 피크를 적분하고 적분을 3.0으로 보정합니다. 다음으로, δ6.33 및 δ6.02 (비닐 양성자, endo)에서 펜던트 노르 보르 넨 그룹의 피크를 통합합니다. 이러한 피크의 적분을 해당 양성자 수로 정규화하여 평균 변형 정도를 결정합니다3.
- HA-NB 마이크로겔 전구체의 제조
- 50 mM HEPES 완충액(pH 7.5)을 준비하고 0.2 μm 진공 구동 필터를 사용하여 완충액을 멸균 여과한다. hepes 완충액을 사용하여 리튬 페닐 (2,4,6,- 트리메틸 벤조일) 포스 피 네이트 (LAP) 광개시제 및 트리스 (2- 카르복시 에틸) 포스 핀 (TCEP) 환원제의 각각 50mM 스톡을 준비합니다. LAP 용액을 빛으로부터 멀리하십시오.
- 멸균 증류수에서 디티올 링커 및 RGD 펩티드의 각각 50 mM 스톡을 제조함으로써 다른 마이크로겔 전구체 성분을 제조한다. HA-NB를 칭량하고 HEPES 버퍼에 용해시켜 10mg/mL 스톡을 준비합니다.
참고: 사용자 선호도에 따라 마이크로겔의 내부 가교결합에 다른 디티올 링커를 사용할 수 있습니다. 분해성 (즉, MMP-절단가능) 및 비분해성 (디티오트레이톨 또는 DTT) 링커 둘 모두가 물질 표에 열거되었다. RGD 펩타이드는 MAP 스캐폴드에서 세포 부착을 촉진하기 위해 마이크로겔 제형에 포함되지만, 이 성분은 제거되고 동일한 부피의 hepes 완충액으로 대체될 수 있다. - 전구체 성분을 9.9 mM LAP, 0.9375 mM TCEP (4 티올 / TCEP), 2.8 mM 디 티올 링커, 1 mM RGD 펩타이드 및 3.5 중량 % (w / v) HA-NB의 최종 농도와 결합하여 원하는 최종 부피에 도달하기 위해 여분의 hepes 완충액을 추가합니다. 정변위 피펫을 사용하여 전구체를 잘 혼합합니다.
- P1000 피펫을 사용하여 전체 혼합물을 천천히 당깁니다. 팁을 1mL 주사기 끝에 놓고 피펫에서 팁을 꺼냅니다. 주사기 플런저를 당겨 혼합물을 주사기에 넣은 다음 주사기 끝에 0.2μm 필터를 추가하고 새 1.5mL 미세 원심분리 튜브에 필터링합니다. 여과된 전구체 용액을 원심분리하여 여과 동안 생성된 기포를 제거한다.
- 다시 P1000 피펫을 사용하여 기포가 생성되지 않도록 주의하면서 여과된 전구체를 천천히 위로 당깁니다. 거품이 있는 경우 팁을 부드럽게 두드려 거품이 제거되고 상단으로 떠오릅니다.
- 팁을 1mL 주사기 끝에 놓고 피펫에서 팁을 꺼냅니다. 주사기를 수직으로 유지하고 전체 전구체 용액이 주사기에 들어갈 때까지 주사기 플런저를 천천히 당깁니다. 주사기에 무딘 팁 바늘을 추가하고 바늘 끝을 통해 전구체를 밀어 넣습니다. 빛이 들어오지 않도록 주사기를 호일로 싸십시오.
- 마이크로겔 핀칭 용액의 제조
- 무거운 흰색 미네랄 오일에 5 % v / v Span-80을 준비하고 잘 섞습니다. 거품을 제거하기 위해 건조하십시오. 계면활성제/오일 혼합물을 호일로 싸서 실온에서 보관하십시오. 매번 사용하기 전에 잘 섞고 건조시키십시오.
- 플런저와 핑거홀드 사이의 거리가 전구체 주사기의 거리와 거의 같아질 때까지 5mL 주사기를 사용하여 오일/계면활성제 혼합물을 끌어올립니다(기포 최소화). 주사기에 무딘 바늘을 넣고 바늘 끝을 통해 오일을 밀어 넣습니다.
- 미세유체 장치 설정
- 1mL 주사기에 무딘 바늘을 넣고 합성 소수성 처리 용액으로 채 웁니다 ( 재료 표 참조). 각 입구/출구에 고일 때까지 미세유체 장치를 통해 용액을 부드럽게 흐릅니다. 벤치 탑의 장치에서 용액을 약 30 분 동안 건조시킨 다음 배출구의 진공을 당겨 과도한 용액을 제거합니다. 클램프로 장치를 고정하십시오.amp 탁상용 현미경에.
- 15mL 원뿔형 튜브를 호일로 감싸고 튜브 랙에 넣어 마이크로젤 수집 용기로 사용합니다. cl이 있는 링 스탠드를 사용하십시오.amp UV 광 프로브를 수집 튜브의 입구에 넣습니다. UV 검출기 ( 재료 표 참조)를 사용하여 UV 강도를 측정하고 20mW / cm2 가 될 때까지 프로브를 움직입니다. 나중까지 자외선을 끄십시오.
- 미세 유체 장치에서 수집 용기까지 도달 할 길이로 튜브를 절단하십시오. 튜브의 한쪽 끝에서 45° 각도로 자릅니다. 튜브의 각진 끝을 출구 채널에 부드럽게 삽입합니다.
알림: 튜브를 미세 유체 장치에 삽입할 때 주의하십시오. 입구 또는 출구 채널 주변의 찢어짐이나 찢어짐은 마이크로젤 생산 중에 누출을 일으킬 수 있습니다. - 전구체와 오일 상 주사기를 이중 주사기 펌프에 고정합니다( 재료 표 참조). 주사기 끝에서 미세 유체 장치까지 도달 할 수있는 길이로 두 개의 튜브 조각을 더 자릅니다. 각 튜브의 한쪽 끝에서 45° 각도로 자릅니다. 양쪽 주사기 팁에 튜브(무딘 끝)를 조심스럽게 고정합니다.
- 1mL 주사기에 대한 펌프 설정을 변경하고 대략적인 전구체 부피를 포함합니다. 주사기 플런저에 충분한 압력이 가해질 때까지 펌프를 천천히 앞으로 밀어 오일과 전구체를 튜브 끝으로 밀어 시스템에서 공기를 제거합니다. 5단계로 이동하기 전에 10-2.4.6분 동안 압력을 균등화합니다.
- 튜브의 각진 끝을 미세 유체 장치의 입구 채널에 부드럽게 삽입하고 미세 유체 전구체 용액을 전면 입구에 넣고 핀칭 오일을 후면 입구에 삽입합니다. 장치에서 흐름이 시작되고 흐름 초점 영역에서 구형 마이크로 겔이 형성되기 시작할 때까지 펌프를 조금씩 앞으로 움직입니다. 0.4 μL/min 유량으로 펌프를 시작하고 안정될 때까지 장치를 작동시킵니다. 필요한 경우 유속을 ±0.1μL/min으로 조금씩 조정하여 마이크로겔 생산을 안정화합니다.
- 그림 1B와 같이 마이크로젤 생산이 안정화되면 수집 튜브를 새 튜브로 교체하고 UV 광을 켭니다. 마이크로젤 생산이 실행 기간 동안 안정적인지 확인하기 위해 주기적으로 실행을 확인하십시오.
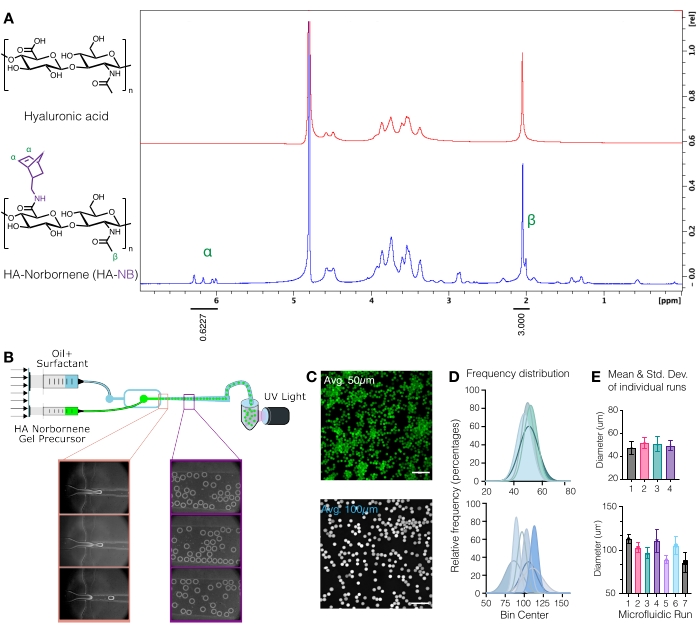
그림 1: 노르보르넨(NB) 기능성 핸들을 사용한 히알루론산(HA) 마이크로젤의 미세유체 생산. (A) HA 반복 단위의 약 31 %가 산화 중수소에서 수행 된 양성자 NMR 분석에 의해 결정된 바와 같이 NB로 성공적으로 변형되었다. 1 δ6.33 및 δ6.02 (비닐 양성자, endo) 및 δ6.26 및 δ6.23 ppm (비닐 양성자, 엑소)에서 펜던트 노르보르넨의 H NMR 이동을 HA 메틸기 δ2.05ppm과 비교하여 기능화를 결정하였다. Anderson et al.12에서 엘스비어의 허가를 받아 증쇄. (B) HA-NB μgels를 생성하기 위해 사용되는 유동 집속 미세유체 장치의 개략도. (C) 공초점 현미경의 최대 강도 투영을 사용하여 형광 표지된 μgel을 시각화했습니다(스케일 바 = 500μm). (D) 마이크로 유체 설정에서 독립적 인 실행에서 마이크로 겔 직경의 주파수 분포는 사용 된 장치에 따라 마이크로 겔 크기 ~ 50 μm 또는 ~ 100 μm에 대한 제어를 보여줍니다. (E) 마이크로겔 직경은 각각의 독립적인 실행에 대한 평균 및 표준 편차로서 보고된다. Wilson et al.9에서 Wiley의 허가를 받아 증쇄. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
3. 마이크로젤 정제 및 건조
- 마이크로젤의 정제
- 마이크로젤 세척 완충액(300mM Hepes, 50mM NaCl, 50mMCaCl2)과 2%(w/v) 플루로닉 F-127 계면활성제 용액을 세척 완충액에 준비합니다. 0.2μm 진공 구동 필터를 사용하여 용액을 멸균합니다.
- 마이크로젤 수집 튜브(5,000 x g)를 5분 동안 원심분리합니다. 멸균 후드에서 상청액 오일 상을 조심스럽게 흡인하십시오. μgels를 1:1로 2% Pluronic F-127 계면활성제 용액 및 와류와 결합하여 잘 혼합합니다. 5분 동안 원심분리(5,000 x g)하고 상청액 세척액을 흡인한다.
- 4x 마이크로젤 부피의 세척 완충액을 추가하고 잘 섞이도록 와류합니다. 혼합물을 원심분리(5,000 x g)하고 5분 동안 세척 용액을 흡인한다. 계면활성제가 시스템에서 제거될 때까지(즉, 기포가 남지 않을 때까지) 세척 완충제로 4-8회 세척을 완료합니다.
- HA-NB 마이크로젤의 형광 표지
참고: 형광 표지된 테트라진의 사내 합성은 잘 설명되고 이전에 보고된 2개의 염기 촉매 티올-마이클 추가 반응에 의존합니다3. 이 작업을 위해 Alexa Fluor-488은 노르보르넨 변형 μgel의 표지를 위해 테트라진과 접합되었습니다. 동결건조된 생성물(Alexa Flour 488-Tet)을 디메틸포름아미드에 1mg/mL로 용해시키고 -20°C에서 보관하였다.- μgels를 형광 라벨링하려면 먼저 멸균 1x PBS에서 1mg/mL 스톡 1:14를 희석하여 Alexa Fluor 488-Tet의 작업 용액을 준비합니다. 멸균 후드에서 μgel을 작업 용액 (2 : 1 부피)과 결합하십시오.
- 변위 피펫을 사용하고 잘 섞는다. 혼합물을 실온에서 1시간 동안 또는 4°C에서 밤새 인큐베이션한다.
- 원심분리기(5,000 x g)하여 염색 용액을 흡인한다. μgels를 1x PBS(1:1 부피)로 두 번 세척하여 미반응 Alexa Fluor 488-Tet를 제거합니다.
참고: 이 시점에서 형광 표지된 μgel을 컨포칼 현미경으로 이미지화하여 마이크로젤 크기를 정량화할 수 있습니다(그림 1C-E)9. 마이크로겔 크기를 측정하는 방법은 Roosa et al.17에 의해 철저하게 기술되었다.
- HA-NB 마이크로젤 건조
- 정제된 μgel(그림 2A)을 용적형 피펫을 사용하여 극저온 안전 스크류 캡 튜브로 옮깁니다. 정제된 μgels 50%(v/v)에 70% 에탄올을 첨가하고 치환 피펫과 잘 혼합합니다. 5,000 x g에서 5분 동안 원심분리합니다.
주의 : 에탄올은 가연성이 높은 물질입니다.
알림: 극저온 안전 스크류 캡 튜브는 μgel을 추가하기 전에 칭량한 다음 동결건조 후 다시 칭량하여 μgel의 질량을 결정할 수 있습니다. 이는 1mg 미만의 양을 사용할 때 오류를 최소화하기 위해 권장됩니다. 사용하기 전에 스케일이 내부적으로 조정되거나 교정되었는지 확인하십시오. - 상청액을 흡입하고 70% 에탄올(50% v/v)로 교체합니다(그림 2B). 변위 피펫과 잘 섞는다. 4°C에서 밤새 배양한다.
알림: 마이크로젤은 필요한 경우 장기 보관을 위해 동결건조 전에 4°C에서 70% 에탄올에 보관할 수 있습니다. 동결건조된 마이크로겔을 도 2C에 나타내었다. 크라이오겔 형성이 필요한 경우 다른 동결건조 매체를 이 단계에서 사용할 수 있습니다(그림 2D). - μgel이 스크류 캡 튜브의 바닥에 있는지 확인하기 위해 간단히 원심분리합니다. 극저온 용기에 액체 질소를 첨가한 다음 μgels 튜브를 추가하여 급속 동결합니다.
- 5-10 분 후, 집게로 μgels 튜브를 제거하십시오. 캡을 빠르게 제거하고 실험실 등급 티슈로 덮습니다. 고무 밴드로 조직을 고정하고 동결 건조 용기 또는 챔버로 옮깁니다.
- 제조업체의 지침에 따라 동결 건조기에 샘플을 로드합니다. 0.066 Torr 및 -63 °C에서 동결 건조. 동결건조된 μgels(lyo-μgels)를 실온에서 단단히 밀봉하여 보관한다.
알림: 동결 건조는 모든 액체가 튜브에서 제거되고 건조 된 제품이 남을 때 완료됩니다. 유기 용매는 일반적인 동결 건조 시스템에서 고무 고정 장치의 수명을 단축시킬 수 있습니다.
- 정제된 μgel(그림 2A)을 용적형 피펫을 사용하여 극저온 안전 스크류 캡 튜브로 옮깁니다. 정제된 μgels 50%(v/v)에 70% 에탄올을 첨가하고 치환 피펫과 잘 혼합합니다. 5,000 x g에서 5분 동안 원심분리합니다.
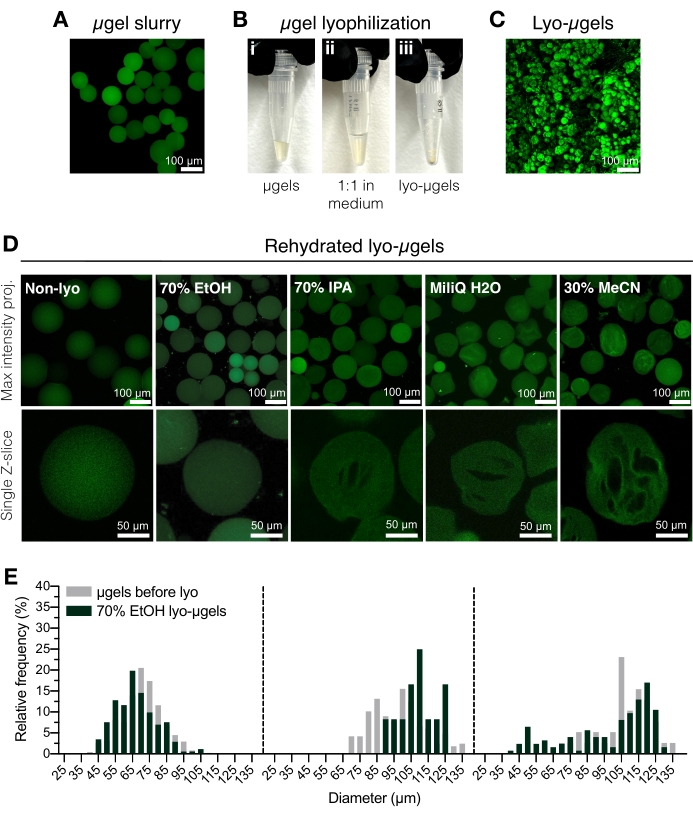
그림 2: HA-NB 마이크로젤 건조. (A) 수용액에서 μgels의 최대 강도 투영 (스케일 바 = 100 μm). (B) 정제된 μgel은 선택한 동결건조 배지에서 1:1 부피비로 배양되고 동결건조될 수 있다. (C) 건조된 lyo-μgels의 최대 강도 투영(스케일 바 = 100μm). (D) 마이크로겔은 동결건조 후 재현탁된다. EtOH (70 %)는 동결 건조 공정 전반에 걸쳐 μgels의 원래 특성을 유지하는 데 권장됩니다. 그러나 이소프로필 알코올(IPA), 물 및 아세토니트릴(MeCN)과 같은 다른 매체는 크라이오겔 형성을 촉진하기 위해 상호 교환적으로 사용할 수 있습니다(명시된 바와 같이 스케일 바 = 100 또는 50μm). (E) 70% EtOH에서 HA-NB 마이크로겔 직경의 측정(회색) 및 동결건조 후(녹색)는 3개의 마이크로겔 집단에 대한 주파수 분포로 표시됨. Anderson et al.12 에서 엘스비어의 허가를 받아 증쇄. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
4. MAP 비계 제작
- 테트라진 링커 합성
참고: 테트라진 링커는 유리 노르보르넨기가 있는 μgel을 상호 연결하는 데 사용할 수 있습니다(그림 3A). HA-테트라진(HA-Tet) 합성 절차는 DH-반복 단위의 몰 당량이 1:1:0.25인 79kDa 나트륨 HA를 사용하여 Zhang et al.18에서 DMTMM을 테트라진-아민으로 조정했습니다(그림 3B)12.- 반응물의 무게를 측정합니다. 교반 플레이트의 비커 또는 플라스크에서 교반하여 200mM MES 완충액(pH ~6)에 HA를 20mg/mL로 녹입니다. 일단 용해되면 DMTMM을 HA 용액에 첨가하고 실온에서 약 20분 동안 반응시킵니다. 예를 들어, 100 mg HA + 72.8 mg DMTMM + 14.14 mg 테트라진-아민이 사용될 수 있다.
- 테트라진-아민을 200mM MES 완충액에 15mg/mL로 용해시키고 HA/DMTMM 용액에 적가합니다. HA-Tet 반응 설정에 대해서는 그림 3C 를 참조하십시오.
- 증발을 최소화하고 반응 용기를 호일로 덮기 위해 반응 용기의 개구부에 파라필름을 추가합니다. 반응이 약 24시간 동안 진행되도록 하면서 계속 교반합니다.
- 24시간 후, 200프루프 에탄올(반응 부피의 약 10배)을 식힙니다. 교반 플레이트에서 반응물을 냉각된 에탄올에 적가하여 HA-Tet(그림 3D)를 침전시키고 20분 동안 계속 교반합니다.
- 용액을 50mL 원뿔형 튜브로 옮긴 다음 5,000 x g 에서 10분 동안 원심분리합니다. 여분의 에탄올을 부어 폐기물로 처리하십시오. HA-Tet의 진공 청소기를 데시케이터로 당겨 밤새 건조시킵니다. 프로토콜의 이 단계에서 건조된 생성물의 예는 도 3E에서 찾을 수 있다.
- 투석을 사용하여 HA-Tet를 정제합니다. HA-Tet를 2M NaCl 용액에 녹이고 12-14kDa 분자량 컷오프로 셀룰로오스 투석 튜브로 옮깁니다. 채워진 투석 튜브를 5L의 초순수가 담긴 버킷에 옮기고 HA-Tet를 밤새 물에 대해 투석합니다.
- 다음날 물을 제거하고 1M NaCl 용액으로 30 분 동안 교체하십시오. NaCl 용액을 제거한 다음 3 일 동안 초순수로 투석하여 매일 물을 교체하십시오.
- 0.2μm 진공 구동 필터를 사용하여 투석된 제품을 여과한 다음 여과된 HA-Tet 제품을 50mL 원뿔형 튜브로 옮깁니다.
- 원추형 튜브를 액체 질소에서 10분 동안 급속 동결한 다음 집게로 원추형 튜브를 제거합니다. 캡을 빠르게 제거하고 실험실 등급 티슈로 덮습니다. 고무 밴드로 조직을 고정하고 동결 건조 용기 또는 챔버로 옮기고 동결 건조합니다. 동결건조된 생성물(도 3F)을 -20°C에서 보관한다.
- HA-Tet를D2O에 10mg/mL로 용해시키고 양성자 NMR을 통해 분석하여 테트라진 변형을 정량화합니다(그림 3G)16.
- 기능화의 양을 결정하기 위해, 먼저D2O용매 피크를 4.8 PPM으로 보정한다. HA 메틸 양성자 (δ2.05)에 대한 피크를 적분하고 적분을 3.0으로 보정합니다. 다음으로, δ8.5 (2H) 및 δ7.7 (2H) (방향족 양성자)에서 펜던트 테트라 진 그룹의 피크를 통합합니다. 이들 피크들의 적분을 상응하는 양성자 수로 정규화하여 평균 변형 정도를 결정한다12.
- lyo-μgel을 상호 연결하여 특성화를 위한 MAP 스캐폴드 형성
- MAP 스캐폴드 성분(즉, μgels, HA-Tet, 재수화 부피)을 준비한다. lyo-μgels(그림 4A)를 칭량하고 1x PBS의 최종 MAP 부피의 84%에서 재구성합니다. 마이크로젤을 약 20분 동안 팽창시킵니다(그림 4B, C). 재수화에 사용되는 wt% MAP는 최종 입자 분획에 대한 사용자의 선호도에 기초하여 선택될 수 있다( 도 4D, E 참조).
- HA-Tet를 선택한 농도의 1x PBS에 용해시킵니다(아래 참고 참조).
알림: 패킹 분율(wt% MAP을 통해 )과 HA-Tet의 농도를 모두 변경하면 벌크 스캐폴드의 기계적 특성이 변경됩니다. 예를 들어, 0.02 mg / mL HA-Tet (2.6 mol Tet : mol HA-NB의 어닐링 비율)로 가교 결합 된 3.4 wt % MAP 스캐 폴드는 약 700 Pa 전단 저장 모듈러스12를 갖는 MAP 스캐 폴드를 생성합니다. - 치환 피펫을 사용하여 HA-Tet 및 lyo-μgel을 결합하고 잘 혼합합니다. 이 시점에서 혼합물은 치환 피펫을 통해 유리 슬라이드, 웰 플레이트 또는 사용자가 선택한 용기로 이송될 수 있습니다. μgels를 37°C에서 25분 동안 어닐링한 다음 주걱을 사용하여 MAP 스캐폴드를 1x PBS로 채워진 웰 플레이트로 옮깁니다. 특성화 준비가 될 때까지 MAP 스캐폴드를 1x PBS에 보관하십시오.
- MAP 스캐폴드 입자 분율 계산
- 이미지 품질을 개선하려면 주걱을 사용하여 MAP 스캐폴드를 유리 커버슬립으로 옮깁니다. FITC 여기 및 방출을 위해 레이저를 사용하는 컨포칼 현미경의 이미지 MAP 스캐폴드. 이미지 MAP 스캐폴드를 20x 대물렌즈에 놓고 스텝 크기가 2.5μm인 Z 방향으로 250-300μm를 횡단하는 Z 스택을 얻습니다. 이미지의 μm/픽셀 보정을 기록해 둡니다.
- Z 스택 이미지를 분석 소프트웨어로 가져옵니다( 재료 표 참조). 새 서피스 추가 버튼을 선택합니다. 관심 영역만 세그먼트 확인란을 선택하고 파란색 화살표 단추 다음: 관심 영역을 선택합니다.
- 관심 영역을 정의하여 분석 중인 볼륨의 X, Y 및 Z 치수를 추적합니다. 파란색 화살표 단추를 선택합니다. 다음: 소스 채널.
참고: X 및 Y 치수는 픽셀 단위이고 Z 치수는 단계 수입니다. 관심 영역에 권장되는 Z 높이에는 최소 2 μgel이 포함되어야합니다. - 소스 채널 드롭다운 목록을 사용하여 FITC 채널을 선택합니다. 매끄럽게 옆의 확인란을 선택하고 2.50μm의 표면 세부 정보를 입력합니다. 임계값에서 절대 강도를 선택하고 파란색 화살표 단추 다음: 임계값을 선택합니다.
- FITC 채널에 대해 제안된 임계값을 사용합니다. 3D 투영을 회전하여 렌더링 품질을 평가하고 필요에 따라 조정합니다. 다음: 지표면 분류를 선택합니다.
참고: 뒤로 단추를 사용하여 필요에 따라 Z-차원과 같은 프로세스의 이전 단계를 편집할 수 있습니다. - 복셀 수가 10.0인지 확인한 다음 녹색 이중 화살표 단추 마침: 모든 생성 단계를 실행하고 마법사를 종료합니다.
참고: 배치 분석을 위해 볼륨 렌더링 매개변수를 저장할 수 있으므로 모든 스캐폴드를 분석하기 위해 동일한 설정이 적용됩니다. - 데이터를 내보내려면 통계 탭을 선택한 다음 세부 정보 탭을 선택합니다. 두 번째 드롭다운 상자를 사용하여 볼륨 변수를 선택합니다. 플로피 디스크 단추 탭에 통계 내보내기를 선택하여 파일에 표시하고 메시지가 표시되면 스프레드시트 파일(.xls)로 저장합니다.
- 파일을 열고 컬럼 A 볼륨 에서 SUM 함수를 사용하여 관심 영역에 있는 μgel의 총 부피(μm3)를 결정합니다.
- 분석된 관심 영역의 치수를 픽셀에서 μm로 변환합니다. 4.3.1단계에서 이미지의 μm/픽셀 보정을 사용하여 X 및 Y 치수를 변환합니다. Z 치수(단계 수)에 이미지의 스텝 크기를 곱하여 Z 치수를 μm로 변환합니다. X, Y- 및 Z- 치수를 곱하여 관심 영역의 부피 (μm3)를 계산합니다.
- 스캐폴드의 입자 분율을 결정하려면 관심 영역(4.3.8단계에서 발견됨)에 있는 μgel의 총 부피를 관심 영역의 부피(단계 4.3.9에서 발견됨)로 나눕니다.
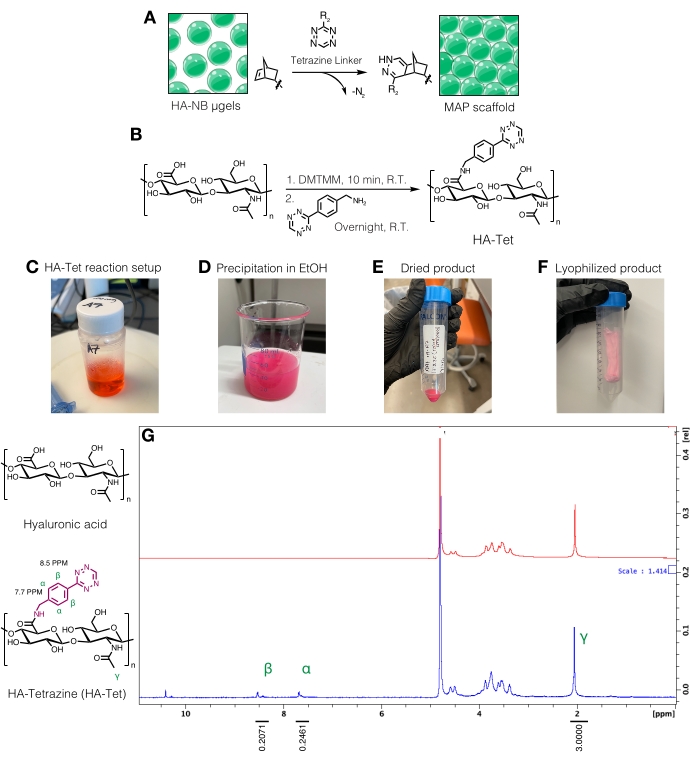
그림 3: 미세 다공성 어닐링 입자(MAP) 스캐폴드 제조를 위한 테트라진 링커의 합성. (A) 테트라진 링커와 상호 연결되어 MAP 스캐폴드를 형성하는 HA-NB μgel의 개략도. (B) HA-Tet 합성을 위한 반응식. (C) HA-Tet 반응을 설정하고 밤새 반응시킨 후 (D) 에탄올에서 HA-Tet의 침전을 허용하였다. (E) 일단 정제 및 건조되면, HA-Tet를 재수화시키고 동결건조시켜 (F) 건조된 연한 분홍색 생성물을 수득하였다. (G) 양성자 NMR 분석은 HA 반복 단위의 11 %의 성공적인 변형을 보여줍니다. Anderson et al.12 에서 엘스비어의 허가를 받아 증쇄. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
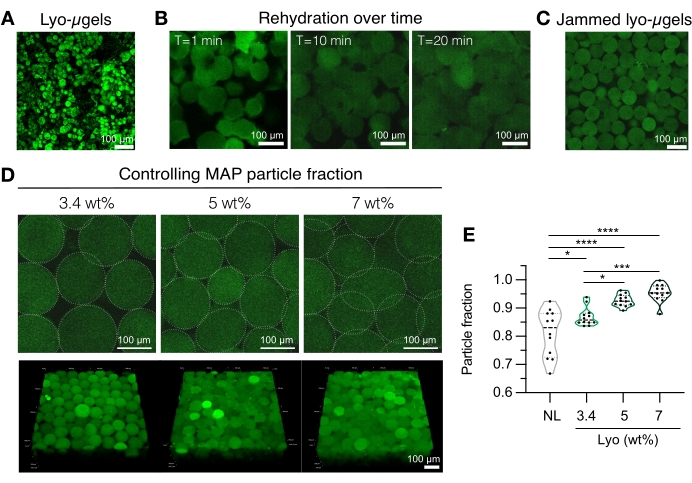
그림 4: MAP 스캐폴드 제조를 위한 동결건조된 마이크로겔의 재수화. (A) 건조된 동결-μgel의 최대 강도 투영(스케일 바 = 100μm). (B) 동결건조 후 lyo-μgels의 재수화는 약 20분이 걸리는 것으로 나타났습니다(스케일 바 = 100μm). (C) Lyo-μgels는 다양한 wt% MAP에서 재수화되어 걸린 μgels를 생성할 수 있습니다(스케일 바 = 100μm). (D) lyo-μgel을 재수화할 때 wt% MAP를 증가시키면 MAP 스캐폴드의 단일 Z 슬라이스 및 부피 돌출부(스케일 바 = 100μm)에서 볼 수 있듯이 MAP 스캐폴드의 입자 분율이 변경됩니다. (E) 이러한 사용자 정의 wt% MAP 스캐폴드를 사용하여, 독특한 입자 분획이 달성될 수 있다 (NL = 비-동결건조된 μgels). 샘플에 대해 Tukey HSD를 사용한 일원 분산 분석(n = 3)을 수행했으며, 유의성은 p < 0.05(*), p < 0.01(**), p < 0.005(***) 및 p < 0.001(****)에서 보고되었습니다. Anderson et al.12 에서 엘스비어의 허가를 받아 증쇄. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
5.3D 지도 스캐폴드의 세포 배양
- 세포 배양 장치 준비
- 이러한 실험을 위한 맞춤형 세포 배양 장치(그림 5A-C)를 만들려면 3D 프린터를 사용하여 보충 코딩 파일 1에 있는 CAD 파일을 사용하여 네거티브 몰드를 인쇄합니다.
참고: 세포 배양 장치의 치수는 94.9mm x 94.9mm x 4.8mm, 총 웰 높이 2.6mm입니다. 내부 웰과 외부 웰의 직경은 각각 4mm와 6mm입니다. - 폴리디메틸실록산(PDMS) 엘라스토머 베이스와 경화제를 10:1질량비로 혼합합니다. PDMS 혼합물을 큰 플라스틱 페트리 접시에 붓고 약 30분 동안 또는 모든 기포가 사라질 때까지 데시케이터에서 가스를 제거합니다.
- 모든 기포가 사라지면 3D 인쇄 된 금형을 PDMS에 조심스럽게 배치하여 새로운 기포 형성을 최소화하십시오. PDMS를 경화시키기 위해 적어도 2 시간 동안 60°C의 오븐에 둔다.
- 칼이나 면도날을 사용하여 배양 장치의 매개 변수 주위를 부드럽게 추적 한 다음 조심스럽게 곰팡이를 제거하십시오. 4mm 생검 펀치를 사용하여 웰 바닥에서 PDMS를 제거하십시오. 유리 커버 슬립에 맞게 장치를 자릅니다.
참고: 세포 배양 장치는 유리 슬라이드에도 접착할 수 있지만 유리 커버슬립은 샘플 이미징을 향상시킵니다. - 테이프를 사용하여 배양 장치의 바닥면에서 먼지를 제거하십시오. 깨끗한 유리 커버슬립과 배양 장치(바닥이 위로 향하게 함)를 135°C의 핫 플레이트에 놓고 최소 15분 동안 수분을 제거합니다.
- 흄 후드에서 코로나 플라즈마 건을 유리 커버슬립과 장치 바닥면의 높은 곳에 사용하여 30초 동안 사용한 다음 처리된 표면을 빠르게 결합합니다. 배양 장치와 유리 커버슬립 사이에 양호한 밀봉을 보장하기 위해 부드럽게 압력을 가합니다.
- 모든 장치에 대해 5.1.6단계를 반복한 다음 60°C 오븐에 밤새 넣어 접착을 고정합니다. 시험관 내에서 사용하기 전에 멸균 할 장치를 오토 클레이브하십시오.
- 이러한 실험을 위한 맞춤형 세포 배양 장치(그림 5A-C)를 만들려면 3D 프린터를 사용하여 보충 코딩 파일 1에 있는 CAD 파일을 사용하여 네거티브 몰드를 인쇄합니다.
- MAP 스캐폴드에서의 세포 배양
- 원하는 입자 분획에 기초하여 MAP 스캐폴드 성분(즉, μgels, HA-Tet, 배지 부피)을 준비한다(도 4D-E 참조). 멸균 후드에서 lyo-μgel을 칭량하고 선택한 wt% MAP를 기준으로 세포 배지의 최종 MAP 부피의 84%를 재구성합니다. μgels가 약 20분 동안 팽창되도록 합니다.
알림: 이러한 방법을 사용하려면 사용자가 재수화를 위해 lyo-microgel 제품의 무게를 측정해야 합니다. 작은 질량(1mg 이하)의 경우 μgel을 추가 및 동결 건조하기 전에 먼저 cryotube의 무게를 측정한 다음 동결건조 후 튜브의 무게를 재측정하여 오류를 최소화하기 위해 제품의 질량을 결정하는 것이 좋습니다. - HA-Tet를 최종 MAP 부피의 16%에 있는 세포 배지에 용해시킨다.
참고: MAP 스캐폴드에서 시드를 위해 셀을 준비하기 위한 다음 단계는 사용 중인 셀 유형에 따라 변경될 수 있습니다. 이 프로토콜에서, D1 마우스 중간엽 세포를 1% 페니실린-스트렙토마이신(펜-스트렙토마이신) 및 10% 태아 소 혈청(FBS)이 보충된 둘베코의 변형 독수리 배지(DMEM)에서 성장시켰다( 재료 표 참조). 조직 배양 처리된 배양 용기에서 배양물을 37°C 및 5%CO2 로 유지하면서 이러한 세포에 대해 표준 부착 세포 배양 프로토콜을 따라야 합니다. - D1 마우스 중간엽 세포가 70%-80% 컨플루언시에 도달하면 배지를 흡인하고 1x PBS로 세포를 세척합니다. 조직 배양 용기의 표면을 덮기에 충분한 부피의 1% 트립신-EDTA를 첨가하여 세포를 들어 올린다. 37°C에서 1-3분 동안 인큐베이션한 다음, 트립신-EDTA 부피의 2배에서 1% 펜-스트렙 및 10% FBS가 보충된 DMEM 배지를 추가하여 트립신화를 켄칭합니다.
- 세포 현탁액을 실온에서 5분 동안 100 x g 에서 원심분리하여 세포를 펠릿화한다. 상청액 배지를 흡인하고 1% 펜-스트렙 및 10% FBS가 보충된 1mL DMEM 배지에 세포를 재현탁합니다.
- 세포 현탁액이 잘 혼합되었는지 확인한 다음 20μL를 새 마이크로 원심분리 튜브로 옮깁니다. 트리판 블루 용액 20μL를 넣고 잘 섞는다. 이 혼합물 20μL를 사용하여 혈구계 또는 세포 계수 챔버 슬라이드가 있는 자동 세포 카운터를 사용하여 세포를 계수합니다.
- 10,000 cells/μL MAP를 파종하는 데 필요한 세포 수를 새로운 마이크로 원심분리 튜브로 옮깁니다. 실온에서 5분 동안 100 x g 로 원심분리하여 세포를 펠릿화합니다. 세포를 흡인하지 않고 세포 펠릿에서 상청액 배지를 조심스럽게 흡인합니다.
- μgels와 가교결합제를 치환 피펫으로 세포 펠릿에 추가합니다. 변위 피펫으로 잘 섞은 다음 웰당 혼합물 10μL를 시드합니다. 도금 할 때 피펫을 원을 그리며 혼합물을 우물에 고르게 분배하십시오.
- μgel을 세포 배양기에서 37°C에서 25분 동안 어닐링한 후 세포 배지를 추가하여 웰을 채웁니다(웰당 ~50μL의 배지). 3D 배양을 37°C로 유지하고 필요에 따라 배지를 교체합니다. 매체를 교체 할 때 비계를 흡인하지 않으려면 상부 웰의 융기를 따라 피펫 팁을 안정화하십시오.
알림: 배양 웰에서 액체를 추가하거나 제거할 때 피펫 팁의 끝을 MAP 스캐폴드 위의 선반에 놓아 웰에서 스캐폴드를 방해하거나 흡인할 가능성을 최소화하십시오. - 원하는 시점에 배지를 제거하고 실온에서 30분 동안 웰당 4% 파라포름알데히드 50μL를 추가하여 샘플을 고정합니다. 샘플을 50 μL의 1x PBS 또는 바람직한 완충액으로 3x 세척한다. 프로토콜의 이 시점에서 작업 부피뿐만 아니라 웰당 50μL를 사용하여 면역형광 또는 형광 염색을 위한 표준 방법을 따를 수 있습니다.
참고: 고정 및 세포 염색을 위한 이러한 방법은 형광 염색의 사용을 구체적으로 설명합니다. 그러나 1차 및/또는 2차 항체 접합을 사용한 면역염색은 웰당 작업 부피로 50μL를 사용하는 제조업체의 지침에 따라 이러한 스캐폴드에서도 수행할 수 있습니다. - 20x 대물렌즈를 사용하여 컨포칼 현미경 상에서 MAP 스캐폴드의 세포를 이미지화하고 2.5μm의 스텝 크기로 Z 방향으로 200-250μm를 횡단하는 Z 스택을 얻습니다. DAPI(1x PBS 중 0.15% 트리톤-X에서 1:1000으로 희석된 핵 염색) 및 팔로이딘-647(1x PBS 중 0.15% 트리톤-X 중 1:40으로 희석된 F-액틴 염색)을 사용한 형광 염색의 예가 도 5E, F에 MAP 스캐폴드에서 배양된 고정된 D1 세포와 함께 3일 동안 나타내었다.
참고: 유리 표면의 플라즈마 처리는 친수성을 증가시켜 세포 접착력을 향상시키는 것으로 나타났습니다. 세포는 세포 배양 웰의 바닥을 따라 퍼지는 것이 관찰될 가능성이 높지만 MAP 스캐폴드에서 세포 반응을 평가하기 위한 세포 수 또는 세포 부피 정량화에 포함되어서는 안 됩니다.
- 원하는 입자 분획에 기초하여 MAP 스캐폴드 성분(즉, μgels, HA-Tet, 배지 부피)을 준비한다(도 4D-E 참조). 멸균 후드에서 lyo-μgel을 칭량하고 선택한 wt% MAP를 기준으로 세포 배지의 최종 MAP 부피의 84%를 재구성합니다. μgels가 약 20분 동안 팽창되도록 합니다.
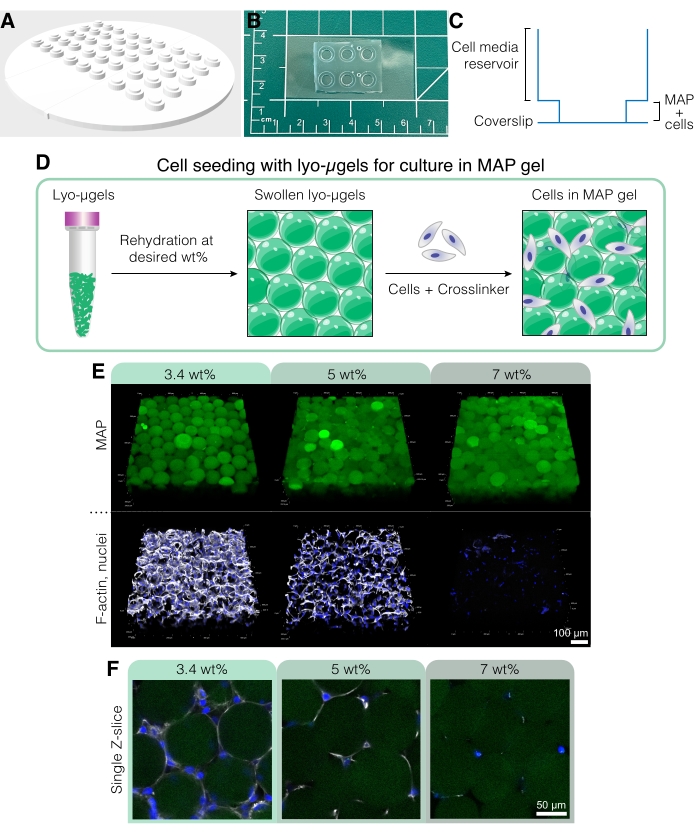
그림 5: MAP 스캐폴드에서의 세포 배양. (A) 세포 배양 웰을 만들기 위한 금형은 PDMS로 3D 프린팅 및 주조할 수 있습니다. 전체 금형의 직경은 95mm, 큰 우물은 직경이 6mm, 작은 내부 우물의 직경은 4mm입니다. (B) PDMS로 캐스팅되면 세포 배양 장치는 향상된 현미경 기능을 위해 커버슬립에 플라즈마 결합됩니다. (C) 세포 배양 웰의 단면은 세포 배지용 저장소(~50μL)와 세포가 있는 MAP 스캐폴드(~10μL)를 파종하기 위한 더 작은 저장소를 나타냅니다. (D) MAP 스캐폴드에 세포를 파종하는 과정은 먼저 사용자가 원하는 wt%에서 lyo-μgels의 재수화에 의존하고, 이어서 μgel을 상호 결합하기 위한 세포 및 가교결합제와 혼합합니다. (e) 세포는 다양한 wt% MAP를 갖는 MAP 스캐폴드(녹색)에 캡슐화될 수 있다. 대표적인 이미지는 MAP 스캐폴드에서 D1 세포 배양 5일째부터이다(스케일 바 = 100 μm). (F) 단일 Z-슬라이스는 상이한 wt% MAP를 포함하는 스캐폴드에서 세포 성장의 차이를 나타낸다(스케일 바 = 50μm). Anderson et al.12 에서 엘스비어의 허가를 받아 증쇄. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
결과
이 프로토콜의 목적은 3D 세포 배양을 위한 제어된 입자 분획뿐만 아니라 생체 직교 가교 구조를 사용한 미세 다공성 어닐링 입자(MAP) 스캐폴드의 제조를 입증하는 것입니다. 먼저, HA는 마이크로겔 형성 및 MAP 스캐폴드를 형성하기 위한 상호 결합 모두에 사용되도록 노르보르넨 펜던트 그룹으로 변형되었습니다. 이러한 방법을 사용하여 HA 반복 단위의 약 31%가 노르보르넨 기능 핸들로 성공적으로 ...
토론
HA-NB 마이크로젤의 미세유체 생산은 에멀젼 배치 생산보다 더 좁은 범위의 크기 분포를 갖는 마이크로겔을 생성하는 것으로 나타났다 3,9. 이 프로토콜에 기재된 마이크로겔은 물질 분해를 지지하기 위해 MMP-절단가능한 가교결합제 (Ac-GCRDGPQGIWGQDRCG-NH2)를 사용하여 제형화하였다. 그러나, HA-NB 마이크로겔은 또한 비분해성인 디티오트레이톨 (DTT)?...
공개
ARA와 TS는이 기술에 대한 임시 특허를 출원했습니다.
감사의 말
저자는 국립 보건원, 국립 신경 장애 및 뇌졸중 연구소 (1R01NS112940, 1R01NS079691, R01NS094599) 및 국립 알레르기 및 전염병 연구소 (1R01AI152568)에 감사드립니다. 이 작업은 노스 캐롤라이나 연구 삼각형 나노 기술 네트워크 (RTNN)의 회원 인 듀크 대학교 공유 재료 계측 시설 (SMIF)에서 부분적으로 수행되었으며, 이는 국립 나노 기술 조정 인프라 (NNCI)의 일환으로 국립 과학 재단 (수상 번호 ECCS-2025064)이 지원합니다. 저자들은 실험실의 전 박사후 연구원인 Lucas Schirmer 박사와 세포 배양 실험을 위한 3D 인쇄 장치를 생성하는 데 도움을 준 Ethan Nicklow에게 감사드립니다.
자료
| Name | Company | Catalog Number | Comments |
| 1 mL Luer-Lok syringe sterile, single use, polycarbonate | BD | 309628 | |
| 5 mL Luer-Lok syringe sterile, single use, polycarbonate | BD | 309646 | |
| Alexa Fluor 488 C5 maleimide | Invitrogen | A10254 | For synthesis of fluorescently-labeled tetrazine |
| Alexa Fluor 647 Phalloidin | Invitrogen | A22287 | For staining cell culture samples |
| Aluminum foil | VWR | 89107-726 | |
| Biopsy punch with plunger, 1.0 mm | Integra Miltex | 69031-01 | |
| Biopsy punch, 4 mm | Integra Miltex | 33-34 | |
| Blunt needle, 23 G 0.5", Non-Sterile, Capped | SAI Infusion Technologies | B23-50 | |
| Bottle-top vacuum filter, 0.22 μm | Corning | CLS430521 | |
| Calcium chloride | VWR | 1B1110 | For microgel washing buffer |
| Capillary-piston assemblies for positive-displacement pipettes, 1000 μL max. volume | Rainin | 17008609 | |
| Capillary-piston assemblies for positive-displacement pipettes, 25 μL max. volume | Rainin | 17008605 | |
| Capillary-piston assemblies for positive-displacement pipettes, 250 μL max. volume | Rainin | 17008608 | |
| Countess Cell Counting Chamber Slides | Invitrogen | C10228 | |
| Countess II FL Automated Cell Counter | Invitrogen | AMQAF1000 | |
| Centrifuge tube, 15 mL | CELLTREAT | 667015B | |
| Centrifuge tube, 50 mL | CELLTREAT | 229421 | |
| Chloroform, ACS grade, Glass Bottle | Stellar Scientific | CP-C7304 | For synthesis of fluorescently-labeled tetrazine |
| Corona plasma gun, BD-10A High Frequency Generator | ETP | 11011 | |
| CryoTube Vials, Polypropylene, Internal Thread with Screw Cap | Nunc | 368632 | |
| D1 mouse mesenchymal cells | ATCC | CRL-12424 | Example cell line for culture in MAP gels |
| DAPI | Sigma-Aldrich | D9542 | For staining cell culture samples |
| Deuterium oxide, 99.9 atom% D | Sigma-Aldrich | 151882 | For NMR spectroscopy |
| Dialysis tubing, regenerated cellulose membrane, 12-14 kDa molecular weight cut-off | Spectra/Por | 132703 | For purifying HA-NB and HA-Tet |
| Diethyl ether | VWR | BDH1121-4LPC | For synthesis of fluorescently-labeled tetrazine |
| Dimethylformamide | Sigma-Aldrich | 277056 | For synthesis of fluorescently-labeled tetrazine |
| 4-(4,6-dimethoxy-1,3,5-triazin-2-yl)-4-methylmorpholinium chloride (DMTMM) | TCI-Chemicals | D2919 | For modifying HA |
| Dithiothreitol (DTT) | Thermo Scientific | R0861 | Non-degradable dithiol linker (substitute for MMP-cleavable peptide) |
| Dulbecco's Modified Eagle's Medium (DMEM), high glucose, w/ 4500 mg/L glucose, L-glutamine, sodium pyruvate, and sodium bicarbonate, liquid, sterile-filtered, suitable for cell culture | Sigma-Aldrich | D6429-500ML | For D1 cell culture |
| EMS Paraformaldehyde, Granular | VWR | 100504-162 | For making 4% PFA |
| Ethanol absolute (200 proof) | KOPTEC | 89234-850 | |
| Fetal bovine serum (FBS) | ATCC | 30-2020 | For D1 cell culture |
| Heating Plate | Kopf Instruments | HP-4M | |
| Hemacytometer with coverglass | Daigger Scientific | EF16034F | |
| 2-[4-(2-hydroxyethyl)piperazin-1-yl]ethanesulfonic acid (HEPES) | Sigma-Aldrich | H3375 | |
| Sodium hyaluronate, 79 kDa average molecular weight, produced in bacteria Streptococcus zooepidemicus, pharmaceutical grade, microbial contamination <100 CFU/g, bacterial endotoxins <0.050 IU/mg | Contipro | N/A | 79 kDa average molecular weight was used for HA-Tet synthesis, but these methods could be adapted for other molecular weights. |
| IMARIS Essentials software package | Oxford Instruments | N/A | Microscopy image analysis software |
| Infusion pump, dual syringe | Chemyx | N/A | |
| Kimwipe | Kimberly-Clark | 34120 | |
| Laboratory stand with support lab clamp | Geyer | 212100 | |
| Liquid nitrogen | Airgas | NI 180LT22 | |
| Lithium Phenyl(2,4,6-trimethylbenzoyl)phosphinate | TCI-Chemicals | L0290 | |
| Lyophilizer | Labconco | N/A | Labconco FreeZone 6 plus has been discontinued, but other lab grade console freeze dryers could be used for this protocol. |
| Methyltetrazine-PEG4-maleimide | Kerafast | FCC210 | For synthesis of fluorescently-labeled tetrazine |
| 2-(4-Morpholino)ethane Sulfonic Acid (MES) | Fisher Scientific | BP300-100 | For modifying HA |
| Micro cover glass, 24 x 60 mm No. 1 | VWR | 48393-106 | |
| Microfluidic device SU8 master wafer | FlowJem | Custom design made either in-house in clean room or outsourced | |
| Mineral oil, heavy | Sigma-Aldrich | 330760 | |
| MMP-cleavable dithiol crosslinker peptide (Ac-GCRDGPQGIWGQDRCG-NH2) | GenScript | N/A | |
| 5-Norbornene-2-methylamine | TCI-Chemicals | 95-10-3 | For HA-NB synthesis |
| Packing tape | Scotch | 3M 1426 | |
| Parafilm | Bemis | PM996 | |
| PEG(thiol)2 | JenKem Technology USA | A4001-1 | For synthesis of fluorescently-labeled tetrazine |
| Penicillin-Streptomycin, 10,000 units/mL | Thermo Fisher Scientific | 15140122 | For D1 cell culture |
| Petri dish, polystyrene, disposable, Dia. x H=150 x 15 mm | Corning | 351058 | |
| Pluronic F-127 | Sigma-Aldrich | P2443 | For washing HMPs |
| Phosphate buffered saline (PBS) 1x | Gibco | 10010023 | |
| RainX water repellent glass treatment | Grainger | 465D20 | Synthetic hydrophobic treatment solution for microfluidic device treatment |
| RGD peptide (Ac-RGDSPGERCG-NH2) | GenScript | N/A | |
| Rubber bands | Staples | 112417 | |
| Sodium chloride | Chem-Impex | 30070 | For dialysis |
| Span 80 for synthesis | Sigma-Aldrich | 1338-43-8 | |
| Sylgard 184 Silicone Elastomer | Electron Microscopy Science | 4019862 | polydimethylsiloxane (PDMS) elastomer for making microfluidic devices and tissue culture devices |
| Syringe filter, Whatman Uniflo, 0.2 μm PES, 13 mm diameter | Cytvia | 09-928-066 | |
| Tetraview LCD digital microscope | Celestron | 44347 | |
| Tetrazine-amine HCl salt | Chem-Impex | 35098 | For HA-Tet synthesis |
| Triethylamine | Sigma-Aldrich | 471283 | For synthesis of fluorescently-labeled tetrazine |
| Tris(2-carboxyethyl)phosphine (TCEP) | Millipore Sigma | 51805-45-9 | |
| Triton X-100 | VWR | 97063-864 | |
| Trypan blue solution, 0.4% | Thermo Fisher Scientific | 15250061 | |
| Trypsin EDTA (0.25%), Phenol red | Fisher Scientific | 25-200-056 | For lifting adherent cells to seed in MAP gels |
| Tygon ND-100-80 Non-DEHP Medical Tubing, Needle Gauge=23, Wall Thickness=0.020 in, Internal diameter = 0.020, Outer diameter = 0.060 in | Thomas Scientific | 1204G82 | |
| UV curing system controller, LX500 LED | OmniCure | 010-00369R | |
| UV curing head, LED spot UV | OmniCure | N/A | |
| UV light meter, Traceable | VWR | 61161-386 | |
| Vacuum dessicator | Bel-Art | 08-594-15C | |
| X-Acto Z Series Precision Utility Knife | Elmer's | XZ3601W |
참고문헌
- Griffin, D. R., Weaver, W. M., Scumpia, P. O., Di Carlo, D., Segura, T. Accelerated wound healing by injectable microporous gel scaffolds assembled from annealed building blocks. Nature Materials. 14 (7), 737-744 (2015).
- Daly, A. C., Riley, L., Segura, T., Burdick, J. A. Hydrogel microparticles for biomedical applications. Nature Reviews Materials. 5 (1), 20-43 (2020).
- Darling, N. J., et al. Click by click Microporous Annealed Particle (MAP) scaffolds. Advanced Healthcare Materials. 9 (10), 1901391 (2020).
- Truong, N. F., et al. Microporous annealed particle hydrogel stiffness, void space size, and adhesion properties impact cell proliferation, cell spreading, and gene transfer. Acta Biomaterialia. 94, 160-172 (2020).
- Pfaff, B. N., et al. Selective and improved photoannealing of Microporous Annealed Particle (MAP) scaffolds. ACS Biomaterials Science & Engineering. 7 (2), 422-427 (2021).
- Sideris, E., et al. Particle hydrogels based on hyaluronic acid building blocks. ACS Biomaterials Science & Engineering. 2 (11), 2034-2041 (2016).
- Caldwell, A. S., Campbell, G. T., Shekiro, K. M. T., Anseth, K. S. Clickable microgel scaffolds as platforms for 3D cell encapsulation. Advanced Healthcare Materials. 6 (15), 1700254 (2017).
- Qazi, T. H., et al. Anisotropic rod-shaped particles influence injectable granular hydrogel properties and cell invasion. Advanced Materials. 34 (12), 2109194 (2022).
- Wilson, K. L., et al. Stoichiometric post modification of hydrogel microparticles dictates neural stem cell fate in microporous annealed particle scaffolds. Advanced Materials. 34 (33), 2201921 (2022).
- Muir, V. G., Qazi, T. H., Shan, J., Groll, J., Burdick, J. A. Influence of microgel fabrication technique on granular hydrogel properties. ACS Biomaterials Science & Engineering. 7 (9), 4269-4281 (2021).
- Highley, C. B., Song, K. H., Daly, A. C., Burdick, J. A. Jammed microgel inks for 3D printing applications. Advanced Science. 6 (1), 1801076 (2018).
- Anderson, A. R., Nicklow, E., Segura, T. Particle fraction as a bioactive cue in granular scaffolds. Acta Biomaterialia. 150, 111-127 (2022).
- Pruett, L., Ellis, R., McDermott, M., Roosa, C., Griffin, D. R. Spatially heterogeneous epidermal growth factor release from microporous annealed particle (MAP) hydrogel for improved wound closure. Journal of Materials Chemistry B. 9 (35), 7132-7139 (2021).
- Sheikhi, A., et al. Microengineered emulsion-to-powder technology for the high-fidelity preservation of molecular, colloidal, and bulk properties of hydrogel suspensions. ACS Applied Polymer Materials. 1 (8), 1935-1941 (2019).
- Brower, K., White, A. K., Fordyce, P. M. Multi-step variable height photolithography for valved multilayer microfluidic devices. Journal of Visualized Experiments. (119), e55276 (2017).
- JoVE. Nuclear Magnetic Resonance (NMR) Spectroscopy. JoVE Science Education Database. Organic Chemistry. JoVE. , (2022).
- Roosa, C., et al. Microfluidic synthesis of microgel building blocks for microporous annealed particle scaffold. Journal of Visualized Experiments. (184), e64119 (2022).
- Zhang, H., Dicker, K. T., Xu, X., Jia, X., Fox, J. M. Interfacial bioorthogonal crosslinking. ACS Macro Letters. 3 (8), 727-731 (2014).
- Welzel, P. B., et al. Cryogel micromechanics unraveled by atomic force microscopy-based nanoindentation. Advanced Healthcare Materials. 3 (11), 1849-1853 (2014).
- Plieva, F., Huiting, X., Galaev, I. Y., Bergenståhl, B., Mattiasson, B. Macroporous elastic polyacrylamide gels prepared at subzero temperatures: control of porous structure. Journal of Materials Chemistry. 16 (41), 4065-4073 (2006).
- Rommel, D., et al. Functionalized microgel rods interlinked into soft macroporous structures for 3D cell culture. Advanced Science. 9 (10), 2103554 (2022).
- Kurt, E., Segura, T. Nucleic acid delivery from granular hydrogels. Advanced Healthcare Materials. 11 (3), 2101867 (2021).
- Isaac, A., et al. Microporous bio-orthogonally annealed particle hydrogels for tissue engineering and regenerative medicine. ACS Biomaterials Science & Engineering. 5 (12), 6395-6404 (2019).
- Truong, N. F., Lesher-Pérez, S. C., Kurt, E., Segura, T. Pathways governing polyethylenimine polyplex transfection in Microporous Annealed Particle scaffolds. Bioconjugate Chemistry. 30 (2), 476-486 (2019).
- Koh, J., et al. Enhanced in vivo delivery of stem cells using microporous annealed particle scaffolds. Small. 15 (39), 1903147 (2019).
- Li, F., et al. Cartilage tissue formation through assembly of microgels containing mesenchymal stem cells. Acta Biomaterialia. 77, 48-62 (2018).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유