Method Article
일차 붉은털 원숭이 B 세포의 유전자 편집
요약
B세포 치료제 연구를 위해 CRISPR/Cas9 및 재조합 아데노 관련 바이러스 혈청형 6을 이용하여 일차 붉은털원숭이 B세포를 배양하고 유전자를 편집하는 방법을 제시합니다.
초록
B 세포와 그 자손은 고도로 발현된 항체의 공급원입니다. 풍부한 단백질, 말초 혈액을 통한 쉬운 접근성, 간단한 입양 이식에 대한 접근성과 함께 높은 단백질 발현 능력은 재조합 항체 또는 기타 치료 단백질을 발현하기 위한 유전자 편집 접근법의 매력적인 표적이 되었습니다. 마우스 및 인간 일차 B 세포의 유전자 편집은 효율적이며 생체 내 연구를 위한 마우스 모델은 가능성을 보여주었지만 더 큰 동물 모델에 대한 타당성과 확장성은 지금까지 입증되지 않았습니다. 따라서 우리는 이러한 연구를 가능하게 하기 위해 시험관 내에서 붉은털 원숭이 일차 B 세포를 편집하는 프로토콜을 개발했습니다. 우리는 CRISPR/Cas9를 사용하여 말초 혈액 단핵 세포 또는 비장 세포에서 일차 붉은털 원숭이 B 세포의 시험관 내 배양 및 유전자 편집 조건을 보고합니다. 대형(<4.5kb) 카세트의 표적 통합을 달성하기 위해 테트라사이클린 활성화 자가 침묵 아데노바이러스 헬퍼 벡터를 사용하여 상동성 지향 복구 템플릿으로 재조합 아데노 관련 바이러스 혈청형 6을 준비하기 위한 빠르고 효율적인 프로토콜이 포함되었습니다. 이러한 프로토콜을 통해 붉은털 원숭이의 전향적 B 세포 치료제를 연구할 수 있습니다.
서문
B 세포는 체액 면역의 기초입니다. 동족 항원과 2차 신호에 의해 활성화되면 나이브 B 세포는 배중심 B 세포, 기억 B 세포 및 형질 세포를 생성합니다1. 후자는 현재 이용 가능한 대부분의 백신의 보호 기능을 매개하는 분비 항체의 공급원이다2. 형질세포는 혈청 내에서 약 2 ng/day/cell3에 달하는 방대한 양의 항체를 분비하며, 이는 혈청 내 7-16 g/L 혈청에 달하는 항체를 가장 풍부한 세 가지 단백질 중 하나로 만들기 때문에 항체 공장으로 알려져 있습니다4. B 세포는 혈액이 풍부하므로 쉽게 얻을 수 있고 개인에게 다시 주입 할 수 있습니다.
이러한 특성으로 인해 B 세포는 B 세포 수용체(BCR)를 유전자 편집하고 인간 면역결핍 바이러스(HIV)5,6,7,8,9,10,11,12,13,14,15 및 기타 단백질에 대한 광범위한 중화 항체(bNAbs)를 발현하기 위한 세포 치료 노력의 표적이 되었습니다 16, 17,18,19,20,21. 이러한 접근법은 생체 내 수많은 마우스 연구에서 잠재력을 보여주었습니다 7,8,10,11,16,22. 그러나 임상 번역 9,15,23을 위해서는 여전히 몇 가지 장애물을 극복해야 하며, 그 중 안전성, 지속 기간 및 치료 효능의 크기뿐만 아니라 비인간 영장류(NHP)와 같은 더 큰 동물로의 스케일링도 포함됩니다. 실제로, NHP, 특히 항체 및 HIV 연구24,25에서 오랜 역사를 가진 붉은털 원숭이는 이러한 매개 변수를 테스트하는 데 가장 적합한 모델입니다.
여기에서 우리는 이러한 문제를 해결할 수 있는 프로토콜을 개발했습니다. 현재까지, 붉은털원숭이 B 세포를 생체 외에서 배양하려는 연구는 거의 없었고, 붉은털원숭이 B 세포의 정제에 대해 CD20을 사용한 양성 선택만이 보고되었다26,27,28. 우리는 다른 세포 유형의 음성 고갈에 의해 손대지 않은 붉은털 원숭이 B 세포를 분리하기 위한 프로토콜을 확립했습니다. 또한, 배양 조건은 붉은털 원숭이 B 세포의 표적 유전자 편집을 위해 정의됩니다. 이 프로토콜은 배양된 붉은털 원숭이 B 세포를 유전자 편집하기 위한 상동성 지향 복구 템플릿(HDRT)으로 CRISPR/Cas9 리보핵단백질(RNP) 및 재조합 아데노 관련 바이러스 혈청형 6(rAAV6)의 사용을 설명합니다. 이 프로토콜을 사용하여 대용량(~1.5kb) 인서트로 최대 40%의 편집 효율성을 달성했습니다. 우리는 또한 테트라사이클린 활성화, 자가 침묵 아데노바이러스 도우미29를 사용하여 rAAV6를 생산하는 빠르고 비용 효율적인 방법을 제시하여 이 형식에서 HDRT의 빠른 테스트를 가능하게 합니다. 이러한 프로토콜은 붉은털 원숭이 B 세포의 유전자 편집을 위한 효율적인 워크플로우를 설명하여(그림 1) NHP 모델에서 B 세포 요법을 평가할 수 있습니다.
실험을 시작하기 위해 기증자 재료는 상업적 출처에서 주문하거나 정맥 절개술 또는 비장 절제술로 얻을 수 있습니다. 이 연구에서, 정맥 절개술 및 혈액 수집은 항응고제 EDTA를 사용하여 앞서 기술한 바와 같이 수행되었다30 . 비장성, 원발성 붉은털원숭이 B 세포를 얻기 위해 이전에 보고된 기술을 사용하여 부분(25%-50%) 또는 전체 비장 절제술을 시행했습니다31. 동물들은 수술 전에 밤새 금식하였다. 간단히 말해서, 수술 중에 복부를 잘라내어 클로르헥시딘과 70% 이소프로필 알코올을 번갈아 가며 세 번 문질러 준비했습니다. 비장을 확인하고 분리하기 위해 복부에 절개 (5-10cm)가 이루어졌습니다. 비장의 혈관 구조는 봉합사 또는 혈관 클램프로 결찰되었습니다. 절개 부위는 4-0 PDS 폴리디옥사논 봉합사로 2층으로 봉합되었습니다. 비장 절제술은 개별 동물에 대해 한 번 수행되었습니다. 단세포 현탁액은 세포 여과기를 통한 침용에 의해 원숭이 비장으로부터 제조되었습니다. 혈액 및 비장 세포 현탁액으로부터의 단핵 세포는 밀도 구배 원심분리를 사용하여 제조되고 액체 질소에 저장되었다.
프로토콜
모든 동물 절차 및 실험은 국립 보건원(National Institutes of Health)의 국립 알레르기 및 전염병 연구소(National Institute of Allergy and Infectious Diseases)의 기관 동물 관리 및 사용 위원회(Institutional Animal Care and Use Committee)에서 승인한 프로토콜에 따라 수행되었습니다. 다음 프로토콜에 대한 요약은 그림 1에 나와 있습니다. 2-8세의 인도 유전적 기원의 수컷 및 암컷 붉은털원숭이(Macaca mulatta)는 생물안전 2등급 시설에서 실험실 동물의 관리 및 사용에 관한 위원회의 지침에 따라 수용 및 관리되었습니다.
주의 : 모든 실험은 층류 후드의 멸균/무균 기술과 적절한 생물학적 안전성 레벨 2 장비를 사용하여 혈액 매개 병원체에 대한 보편적인 예방 조치를 준수하여 수행되었습니다.
1. rAAV6 생산
- rAAV6 생산을 위한 시약을 준비합니다.
- 표준 기술을 사용하여 벡터 pAAV에서 AAV2의 반전 말단 반복(ITR) 사이에 상동성 지향 복구 템플릿을 설계하고 복제합니다. 상동성 암이 양쪽에서 최소 ~250bp인지 확인하되 60bp이면 충분할 수 있지만 구조 설계가 허용하는 경우 더 긴 상동성 암이 선호됩니다. 사용된 sgRNA의 표적 서열이 HDRT에 존재하는 경우, 표적 부위의 프로토스페이서 인접 모티프 또는 시드 영역에서 가장 효과적인 자동 돌연변이를 사용하여 제거합니다.
참고: 효율적인 클로닝을 위해 깁슨 어셈블리와 결합된 유전자 합성(32)을 수행할 수 있다. 트랜스펙션을 위해 올바른 클론의 Maxiprep을 준비합니다. sgRNA 설계의 경우 CHOPCHOP33을 권장하며 https://zlab.bio/guide-design-resources 에서 더 많은 도구 목록을 찾을 수 있습니다. ITR을 포함한 AAV의 최대 패키징 용량은 ~4.7kb입니다. AAV6는 조혈 세포, 특히 B 세포를 편집하는 데 가장 일반적으로 사용되는 혈청형이다9. 붉은털 원숭이 B 세포의 유전자 편집을 위한 AAV의 다른 혈청형은 테스트되지 않았지만 AAV28 및 AAV-DJ10,11이 마우스 연구에 사용되었습니다. - 표 1 및 표 2에 따라 293AAV 배양액 및 생산배지를 준비한다. 0.2μm 폴리에테르설폰(PES) 멤브레인 필터 장치를 통해 멸균 필터합니다. 4 °C에서 보관하십시오.
- 1x 폴리에틸렌이민(PEI) 용액(1mg/mL, 100mL)을 준비합니다.
- 250 mL 유리 비커에서, 마이크로파에서 ~70 mL의H2O를 ~30초 동안 가열한 다음, 100 mg의 PEI를 첨가한다. 마그네틱 교반기를 넣고 PEI가 거의 녹을 때까지 저어줍니다.
- 1M HCl로 pH를 7로 조정한 다음 H2O로 100mL까지 채우고 10분 정도 기다렸다가 pH를 다시 확인하고 필요한 경우 조정합니다.
- PEI 용액을 0.2 μm PES 멤브레인 필터 유닛을 통해 멸균 여과하고, 분취하고, -20°C에서 저장한다. 해동 후 용액은 4°C에서 최대 2개월 동안 보관할 수 있습니다.
- 5x 폴리에틸렌 글리콜(PEG)/NaCl 용액을 준비합니다.
- PEG 8,000 400g과 NaCl 24g의 무게를 잰다.
- 2L 유리 비커에 마그네틱 교반기를 넣고 무게를 잰 PEG 8,000과 NaCl을 넣고 ~ 550mL의 탈이온수로 헹굽니다.
- 가열하면서 저어주고 완전히 녹을 때까지 끓이거나 80-90 °C로 가져옵니다.
- 1M NaOH로 pH를 ~7.4로 조정한 다음 측정 실린더를 사용하여 부피를 1L로 조정하고 마그네틱 교반기로 2L 유리병에 옮깁니다.
- 병, 자기 교반기 및 용액을 121°C에서 30분 동안 수조에서 오토클레이브합니다.
- 오토클레이빙 후 마그네틱 교반기를 사용하여 교반하면서 용액을 냉장실에서 냉각시켜 다른 상으로 분리되지 않도록 합니다. 필요한 경우 분취액을 섭취하고 4°C에서 보관합니다.
- 제형 완충액을 준비한다.
- 500mL의 DPBS와 50μL의 10% Pluronic F-68을 혼합합니다. 0.2 μm PES 멤브레인 필터 유닛을 통해 멸균 필터하고, 상온(RT)에서 보관한다.
- 표준 기술을 사용하여 벡터 pAAV에서 AAV2의 반전 말단 반복(ITR) 사이에 상동성 지향 복구 템플릿을 설계하고 복제합니다. 상동성 암이 양쪽에서 최소 ~250bp인지 확인하되 60bp이면 충분할 수 있지만 구조 설계가 허용하는 경우 더 긴 상동성 암이 선호됩니다. 사용된 sgRNA의 표적 서열이 HDRT에 존재하는 경우, 표적 부위의 프로토스페이서 인접 모티프 또는 시드 영역에서 가장 효과적인 자동 돌연변이를 사용하여 제거합니다.
- rAAV6 생산을 위한 세포 배양, 형질주입 및 형질도입
- 해동, 배양, 및 분할을 위해 위의 293AAV 배양 배지 및 트립신 EDTA를 사용하여 제조자에 의해 기술된 바와 같이 293AAV 세포를 동결시킨다. 일부 초기 계대를 동결하고 계대 40에 도달하기 전에 AAV 생산을 위해 세포를 사용하는 것이 좋습니다.
- rAAV6 생산을 위해, 각각 30 mL에 5 x 106 세포로 4개의 15 cm 세포 배양 접시를 시딩한다. 세포는 일반적으로 80%-90% 합류에 도달할 때 파종 후 1-2일 후에 형질감염 준비가 됩니다.
- AAV6로 패키징할 HDRT를 포함하는 pAAV 플라스미드의 Maxiprep을 해동합니다. 85.6μg의 pAAV 플라스미드를 3mL의 순수 DMEM 배지에 재현탁합니다.
- 1 mg/mL PEI 용액 342 μL를 3 mL의 순수 DMEM 배지에 녹입니다. RT에서 10분 동안 두 용액을 모두 배양합니다.
- 두 개의 3mL 튜브를 ~6.4mL의 형질주입 혼합물의 하나의 튜브에 혼합하고 RT에서 20분 동안 배양합니다.
- 한편, 테트라사이클린이 활성화된 자가 침묵 헬퍼 벡터 RepCap6을 -80°C 냉동고에서 37°C 수조에서 해동합니다. 293AAV 세포를 형질도입하기 위해, 중앙 조직 배양 감염 용량(TCID 50)을 사용하고 1.15 x10 7 세포/접시를 가정하여 25의 감염 다중도(MOI)에서 헬퍼 벡터를 추가합니다. 일반적으로 15cm 접시당 2-10μL가 사용됩니다. 접시를 부드럽게 흔들고 휘젓습니다.
- 형질주입 혼합물의 인큐베이션 후, 1.6mL를 4개의 15cm 접시 각각에 적가합니다. 하룻밤 동안 37°C 및 5%CO2 에서 인큐베이션한다.
참고: 또는 관심 있는 rAAV6 벡터를 이미 사용할 수 있는 경우 이러한 벡터를 사용하여 패키징할 바이러스 게놈을 제공할 수 있으며, 이는 이 시스템을 가진 플라스미드의 필요성을 무효화하고 유사한 rAAV6 역가를 생성합니다. 이 접근법을 위해, 293AAV 세포는 헬퍼 벡터와 함께 50의 MOI (rAAV6 게놈 사본 [GC] / mL 기준)에서 원하는 rAAV6과 함께 transduction됩니다. - 다음날, 배양 배지를 조심스럽게 흡인하고 폐기하고, 예열 된 생산 배지 30 mL로 교체한다. 수확하기 전에 96 시간 더 배양하십시오. 수율을 최대화하기 위해 더 이상의 중간 변경은 권장되지 않습니다.
- 배지로부터 재조합 AAV6의 수확 및 정제
- 접시에서 세포를 빼내지 않고, 모든 세포 상청액을 여과될 배지의 부피보다 적어도 50% 더 큰 0.2μm PES 멤브레인을 갖는 필터 유닛으로 수집한다. 그런 다음 상청액을 여과합니다.
참고: rAAV6의 더 높은 수율이 필요한 경우, 세포를 수확하고 상용 키트 또는 확립된 프로토콜34,35를 사용하여 세포 펠릿에서 rAAV를 추출할 수 있습니다. AAV6는 대부분 배지36으로 분비되기 때문에 상청액만 사용되어 노동력, 비용 및 시간을 줄였습니다. - 수집 된 부피의 5 %에서 여과 된 상청액에 25x PEG / NaCl 용액을 첨가하십시오. 30mL의 15cm 접시 4개를 사용하는 경우 일반적으로 30mL입니다.
- 반전하여 잘 혼합한 다음 4°C에서 밤새 배양하여 바이러스 입자를 침전시킵니다.
알림: AAV 입자는 이 용액에서 최대 2일 동안 안정적입니다. - 250mL의 튜브 삽입물로 스윙 버킷 원심분리기를 4°C로 예냉각합니다. 각 멤브레인을 2mL의 10% Pluronic F-68로 RT에서 최소 1시간 동안 전처리하여 100kDa 컷오프 및 0.22μm 친수성 PES 시린지 필터가 있는 4mL 원심 필터 유닛을 준비합니다.
- AAV-PEG/NaCl 혼합물을 250mL 튜브에 옮기고 2,500°C에서 1시간 동안 x g 로 원심분리한 다음 흡인하여 전체 상층액을 조심스럽게 제거합니다.
- 완전히 재현탁될 때까지 1M HEPES 4mL에서 볼텍싱하여 베이지색에서 백색 바이러스 펠릿을 재현탁합니다. 필요한 경우 5분 동안 그대로 두었다가 다시 소용돌이칩니다. 5mL 혈청학적 피펫을 사용하여 재현탁하고 총 부피를 15mL 튜브로 옮깁니다.
- 흄 후드에서 동일한 부피의 클로로포름을 바이러스 현탁액(일반적으로 4mL)에 추가합니다.
- 2분 동안 격렬하게 와동시킨 다음 RT에서 1,000 x g에서 5분 동안 원심분리합니다.
- 새 50mL 튜브에 최상층(AAV 함유 상층액)을 수집하고 하층(클로로포름)을 버립니다.
주의 : 클로로포름 함유 용액은 유해 폐기물입니다. 폐기에 대한 제도적 지침을 따르십시오. - AAV 함유 상청액을 흄 후드 아래에 놓고 나머지 클로로포름을 30분 동안 증발시킵니다.
- 한편, 전처리된 원심 필터 유닛과 주사기 필터를 세척합니다.
- 1.5mL의 제형 완충액을 전처리된 원심 필터 유닛에 추가합니다. 스윙 버킷 로터에서 15°C에서 10분 동안 3,500 x g 로 원심분리합니다. 4mL의 제형 완충액으로 이 단계를 반복하여 멤브레인을 세척합니다.
- 5mL 주사기를 사용하여 5mL의 제형 완충액으로 주사기 필터를 두 번 헹굽니다.
- 클로로포름 추출에서 ~ 4mL의 AAV 함유 상청액을 5mL 주사기에 넣고 세척 된 주사기 필터를 부착 한 다음 원심 필터 장치에 직접 여과합니다.
- 15°C에서 25분 동안 3,500 x g 로 원심분리한 다음 필터의 AAV 용액이 약 50-100μL인지 확인합니다. 용액의 부피가 >100 μL이면 원심 분리를 계속하십시오.
- 여과액을 제거한 후 원심 필터 유닛의 컵 내부에 제형 완충액 4mL를 넣고 피펫팅으로 용액을 균일하게 혼합합니다. 15°C에서 25분 동안 3,500 x g 에서 원심분리한 다음 필터의 AAV 용액이 50-100μL 사이인지 확인합니다. 용액의 부피가 >100 μL이면 원심 분리를 계속하십시오. 다른 세탁을 위해 이 단계를 반복합니다.
- 최종 원심분리 후 용액의 부피가 50-70 μL인지 확인합니다. 그렇지 않은 경우 원심 분리를 계속하십시오. 제제를 1.5mL 튜브로 옮깁니다. 원하는 경우 분취액을 투여하고 -80°C에서 보관한다.
- 접시에서 세포를 빼내지 않고, 모든 세포 상청액을 여과될 배지의 부피보다 적어도 50% 더 큰 0.2μm PES 멤브레인을 갖는 필터 유닛으로 수집한다. 그런 다음 상청액을 여과합니다.
- qPCR에 의한 재조합 AAV6 역가 측정
참고: qPCR 프라이머는 ITR 영역에서 어닐링되므로 pAAV에 클로닝된 모든 구축물에 적합해야 합니다.- 적정할 rAAV6의 분취량과 AAV6 참조 물질의 분취량을 해동합니다. AAV6 표준물질은 4 x 1011 GC/mL에 가까워야 합니다. 그렇지 않으면 그에 따라 희석액을 조정하십시오.
- 2.0 μL의 샘플 또는 AAV6 표준 물질을 15.6 μL의 뉴클레아제가 없는H2O, 2.0 μL의 10x DNase I 완충액 및 0.4 μL의 DNase I과 조합하여 rAAV6 제제에 남아 있는 임의의 유리 플라스미드 DNA를 제거하기 위해 DNase I 분해를 수행한다.
- 부드럽게 혼합하고 37°C에서 30분 동안 배양한 다음 얼음으로 옮깁니다. 이것은 희석 1입니다( 표 3 참조).
- 아래의 표 3 과 같이 모든 샘플과 AAV6 기준 물질의 5배 연속 희석액을 물로 준비합니다.
- SYBR Green qPCR 마스터 믹스를 준비합니다. 웰당 뉴클레아제가 없는 물 4.7μL와 SYBR Green 마스터 믹스 10μL, ITR 프라이머 정방향 0.15μL(100μM), ITR 프라이머 역방향 0.15μL(100μM)를 혼합합니다.
참고: 각 샘플은 참조 표준의 경우 16웰, 샘플당 8웰, 템플릿 없는 컨트롤의 경우 2웰로 이중으로 측정됩니다. 피펫팅 오류를 설명하기 위해 10% 더 많은 마스터 믹스를 준비합니다. - 광학 96웰 또는 384웰 반응 플레이트에서 SYBR Green qPCR 마스터 믹스 15μL/웰을 로드합니다.
- 다음으로, 템플릿이 없는 대조군을 위해 5μL의 샘플과 AAV6 표준 물질 또는 뉴클레아제가 없는 물을 로드합니다. AAV6 기준 표준의 경우 희석 2를 희석 9로 로드합니다. 샘플의 경우 희석 5에서 희석 8까지 로드합니다. 각 희석액을 이중으로 측정하십시오. 거품을 피하십시오.
- 로드된 플레이트를 광학 투명 필름으로 밀봉하고, RT에서 800 x g 에서 1분 동안 원심분리하고, 적절한 96웰 또는 384웰 설정으로 플레이트를 qPCR 기기에 로드합니다.
- 98°C에서 3분, 98°C에서 15초, 58°C에서 30초 동안 40회 사이클을 수행한 후 용융 곡선을 관찰하는 사이클링 조건에서 SYBR 검출을 사용하여 qPCR 기기를 설정하고 실행합니다.
- AAV6 표준물질의 밀리미터당 게놈 복제 수(GC/mL) 농도를 표준 곡선으로 사용하여 기기 소프트웨어로 데이터를 분석합니다( 표 3 참조). 희석 계수를 곱하여 샘플의 최종 농도를 계산합니다.
- 표준 곡선R2가 1.0에 가까운지, PCR 효율이 90%-110%인지, 기준선이 제거되었는지, 용융 곡선이 단일 피크를 나타내고, 희석에 따라 Ct 값이 변화하고, 중복이 0.5Ct 이내인지 확인하십시오. 그렇지 않으면 이상값을 제외합니다. 그림 2와 같이 예상 수익률.
2. B 세포 배지 및 자극 준비
- 해동 매체 준비: RPMI-1640과 20% FCS를 결합합니다. 0.2 μm PES 멤브레인 필터 유닛을 통한 멸균 필터. 4 °C에서 보관하십시오.
- B 세포 배양 배지 준비: 표 4의 시약을 결합한 다음, 0.2 μm PES 멤브레인 필터 유닛을 통해 멸균 여과한다. 4 °C에서 보관하십시오.
- 뉴클레아제가 없는 물에서 재현탁되어야 하는 CpG ODN을 제외하고, 표 5 의 각각의 B 세포 자극제를 B 세포 배양 배지 중의 스톡 농도로 재현탁시킨다. −80 °C에서 보관하십시오.
- 비 B 세포 음성 고갈(선택적 단계 4)을 수행하는 경우 2% FCS(DPBS 2% FCS)로 DPBS(칼슘 없음, 마그네슘 없음)를 준비합니다. 0.2 μm PES 멤브레인 필터 유닛을 통한 멸균 필터. 4 °C에서 보관하십시오.
3. 붉은털원숭이 B세포의 제조 및 배양
참고: 냉동보존된 붉은털 원숭이 PBMC 또는 비장세포를 사용하여 세포 배양물을 설정합니다30,31.
- 해동 배지 및 B 세포 배양 배지를 37°C 수조에서 예열한다. 표 5 의 B 세포 자극제를 얼음 위에서 해동한다.
- 예열된 해동 매체가 들어 있는 적절한 크기의 튜브를 준비합니다. 이것은 이상적으로는 해동 된 세포의 부피의 10 배 이상이어야합니다.
- PBMC 또는 비장세포의 극저온 세포를 37°C 수조에서 한 번에 1 내지 2개의 극저온 세포를 해동하고, 예열 매체로 준비된 튜브에 디캔팅한다. cryotube를 헹구어 모든 세포를 수집합니다.
- 실온에서 10분 동안 200 x g 에서 세포를 원심분리합니다.
참고: 이러한 원심분리 설정은 PBMC 수율을 유지하면서 혈소판 오염을 줄입니다. 5분 동안 350 x g 와 같은 더 높은 속도를 사용할 수 있습니다. - 세척을 위해 10mL 해동 배지에 세포를 재현탁합니다.
- 3.4단계와 3.5단계를 반복하여 총 3회의 원심분리를 실시하여 동결 매체를 제거한다. 마지막 원심분리 후 B 세포 배양 배지에서 약 ~5 x 106 cells/mL로 세포를 재현탁합니다.
참고: 위의 프로토콜은 다른 세포에 의한 오염으로 전체 PBMC 또는 비장세포 제제를 배양합니다. 더 순수한 B 세포 배양이 필요한 경우, 총 B 세포 수율이 현저히 감소하더라도 4단계를 계속합니다. 두 방법 간의 편집 효율성에는 차이가 관찰되지 않았습니다. - 계수를 위해 필요에 따라 세포 10μL의 분취량을 B 세포 배양 배지로 희석합니다. 혈구계 및 트리판 블루 염색을 사용하여 동일한 부피의 재현탁 세포와 트리판 블루 0.4% 용액을 조합하여 계수합니다.
- 세포 수에 따라 B 세포 배양 배지를 사용하여 세포 농도를 3 x 106 cells/mL로 조정합니다. 이어서, B 세포 자극제를 표 5에 따른 최종 농도로 첨가하고, 혼합한다.
- 세포를 적절한 세포 배양 접시로 옮깁니다. 전반적으로 0.6 x 10 6-0.7 x 106 cells/cm2가 권장됩니다. 세포를 37°C에서 5%CO2와 함께 48시간 ± 2시간 동안 인큐베이션한다.
4. non-B 세포의 선택적 음성 고갈
참고: 수율과 순도는 PBMC의 B 세포 투입 비율에 따라 달라지며, 이는 붉은털원숭이27마리 간에 크게 다를 수 있다. 1 x 107 PBMC에서 80%-95% 순도, 60% 효율 및 1 x 10 6-1.5 x 106 셀을 기대하십시오.
- 마지막 세척(단계 3.6) 후, DPBS 2% FCS 및 1:200으로 희석된 인간 Fc 블록에서 1 x 108 cells/mL로 세포를 재현탁합니다. 세포 수는 해동된 세포의 수를 기준으로 합니다.
- 얼음 위에서 15분 동안 인큐베이션하여 Fc 수용체를 차단한 다음, 표 6의 비오티닐화 항체를 첨가하였다. 얼음 위에서 20분 더 배양합니다.
- 튜브에 DPBS 2% FCS를 채우고 4°C에서 10분 동안 200 x g 로 회전합니다.
- 세포를 4.1 단계부터 부피의 80%로 DPBS 2% FCS에 재현탁합니다(즉, 1 x 107 세포당 80 μL).
- 4.1단계 부피의 20%(즉, 1 x 107 개 세포당 20μL의 비드)로 세포 현탁액에 자성 스트렙타비딘 비드를 추가합니다.
- 얼음 위에서 15분 동안 세포를 배양하고 가끔 저어줍니다.
- 한편, 1 x 108 셀 당, 큰 자기 공핍 컬럼 및 사전 분리 필터를 갖는 자기 분리기를 준비한다. 예비 분리 필터 및 컬럼을 중력 흐름에 의해 2% FCS의 DPBS 2 mL로 헹구고, 플로우 스루를 버린다. 15mL 수집 튜브를 설치합니다.
참고: 포지티브 선택 컬럼 또는 기타 마그네틱 비드 정제 시스템과 같은 다른 컬럼을 사용하면 순도가 크게 감소할 수 있습니다. - 배양 후 부피가 <0.5mL인 경우 DPBS 2% FCS로 세포를 0.5mL로 보충합니다. 부피가 ≥0.5mL인 경우 계속 진행하기만 하면 됩니다.
- 준비된 컬럼의 사전 분리 필터에 세포 현탁액을 로드하고 15mL 튜브에 플로우 스루를 수집합니다.
- 1mL의 DPBS 2% FCS를 예비 분리 필터에 첨가하여 결합되지 않은 농축 B 세포를 2회 용출합니다. 중력 흐름에 의해 동일한 튜브에 결합되지 않은 세포를 수집합니다.
참고: 추가 용출은 수율을 약간 증가시킬 수 있습니다. 순도 및 효율은 입력 세포, 농축 세포 및 컬럼 상에 보유된 세포의 유세포 분석에 의해 평가될 수 있다. 컬럼 상에 보유된 세포를 수득하기 위해, 자석으로부터 컬럼을 제거하고, 제공된 플런저를 사용하여 3 mL의 DPBS 2% FCS로 플러시한다. 원하는 경우, 표 7의 시약을 사용하여 도 3에서와 같이 유세포 분석기로 순도를 평가한다. - 농축된 B 세포를 4°C에서 10분 동안 200 x g 로 원심분리합니다.
- B 세포 배양 배지에서 추정 ~5 x 106 cells/mL로 세포를 재현탁하고 3.7단계에서 계속합니다.
5. 일차 붉은털 원숭이 B 세포 유전자 편집
- 붉은털 원숭이 B 세포를 48시간 ± 2시간 동안 활성화시킨 후, 전기천공 및 형질도입을 위한 시약을 준비합니다.
- 예열 DMSO, 뉴클레아제가 없는 듀플렉스 완충액, 완충액 T 및 완충액 E(10 μL 전기천공 키트) 또는 E2(100 μL 전기천공 키트)를 RT로 전기천공하였다.
- 표 5의 rAAV6 HDRT 및 B 세포 자극제를 얼음 위에서 해동한다.
- CRISPR-Cas9 sgRNA를 듀플렉스 버퍼에서 100μM로 재현탁합니다. RT에서 10분 동안 재구성하고 소용돌이와 튕기기로 혼합합니다. 재구성된 sgRNA를 사용할 때까지 얼음 위에 보관하십시오. −80 °C에서 보관하십시오.
참고: CRISPR-Cas9 sgRNA는 다양한 온라인 도구(1.1.1 참조)로 설계할 수 있으며 절단 효율이 크게 다를 수 있습니다. 절단 효율의 경험적 테스트는 TIDE37 또는 ICE38과 같은 분석을 사용하는 것이 좋습니다. - 전기천공 10 μL 당, 표 5로부터의 모든 자극제와 함께 550 μL의 B 세포 배양 배지를 준비하고, 1% DMSO를 첨가한다. 100 μL electroporations를 위해 부피를 10배 확장합니다. 임의로, 이 배지의 10%는 항생제-항진균제 없이 제조될 수 있으며, 이는 형질감염 후 세포 생존율을 약간 증가시킨다.
- 전기천공을 10 μL 당, 50 μL의 B 세포 배양 배지와 함께 각성제와 항생제-항진균제(사용하는 경우)가 없는 48-웰 세포 배양 플레이트의 웰을 준비합니다. 100 μL 전기천공의 경우, 500 μL를 6-웰 플레이트의 웰에 피펫팅합니다.
- rAAV6 HDRT를 웰 내 부피의 최대 20%까지 웰의 배지에 추가합니다. 형질감염당 세포 수(10 μL 전기천공: 5 x 10 5 세포, 100 μL 전기천공: 5 x 10 6 세포) 및 rAAV6 준비의 GC를 기반으로 1 x 105-1 x 106 범위의 MOI를 목표로 합니다. 5 x 1013 GC/mL에서 5 x 1014 GC/mL의 높은 rAAV6 스톡 농도는 낮은 부피로 높은 MOI를 달성하는 데 권장됩니다.
참고: MOI가 낮을수록 편집 효율성이 떨어질 수 있으며 5 x 105 의 MOI는 일반적으로 지금까지 본 최대 편집 효율성에 가깝습니다. B 세포 생존율에 대한 다양한 MOI의 영향은 관찰되지 않았습니다. rAAV6 HDRT가 없고, RNP 트랜스펙션이 없고, 둘 다 없는 컨트롤을 포함하는 것이 좋습니다. - 준비된 접시와 나머지 배지를 5%CO2로 37°C의 인큐베이터로 옮겨 예열한다.
- 전기천공 10μL당 리보핵단백질(RNP) 1.15μL를 준비합니다: 이중 완충액에서 61μM Cas9 0.4μL와 100μM sgRNA 0.75μL를 혼합합니다. 파이펫팅 오류로 인해 추가로 준비(단일 전기천공에 대해 30% 더 권장)하고 전기천공 팁을 로드할 때 기포를 방지합니다. 100 μL 팁에 대해 10배 스케일링.
- RNP를 세포와 혼합하기 전에 RT에서 적어도 15분 동안 인큐베이션한다. 배양 후, 하나 이상의 유전자좌가 동시에 표적화되는 경우 여러 RNP를 결합할 수 있습니다. 동시에 최대 3개의 유전자좌에서 효율성의 유의미한 차이가 관찰되지 않았습니다.
- 한편, 전기 천공을 위해 셀을 준비합니다. 온도 충격을 피하기 위해 셀을 항상 RT로 유지하십시오. 48시간 ± 2시간 배양 후 세포를 적절한 용기에 수확합니다. DPBS로 접시를 헹구어 최대 세포 수를 수집하십시오.
- RT에서 10분 동안 200 x g 에서 세포를 원심분리하고, 상층액을 버리고, ~2 x 106 cells/mL에서 DPBS의 세포를 다시 현탁시킨다.
- 10 μL의 트립판 블루 0.4% 용액과 10 μL의 세포 현탁액을 결합하고 혈구계를 사용하여 계산합니다.
참고: 이 시점에서 수확 및 세척 중 손실로 인해 48시간 ± 2시간 전에 배양된 세포의 약 60%가 예상됩니다. - 한편, RT에서 10분 동안 200 x g 에서 세포를 원심분리합니다. 상층액을 버리고 남아 있는 DPBS를 최소화합니다. 위의 세포 수를 기준으로 5.55 x 107 cells/mL에서 예열된(RT) 버퍼 T에 세포를 다시 일시 중단합니다.
- 기계를 켜고 1,350V, 15ms 및 1펄스로 설정하여 형질주입 시스템을 설정합니다. 층류 후드 안에 피펫 스테이션을 놓습니다
- 10개의 전기천공법의 각 세트에 대해 3mL의 완충액 E(10μL 형질감염용) 또는 E2(100μL 형질감염용)가 있는 형질주입 튜브를 준비합니다. 튜브를 피펫 스테이션에 삽입합니다.
- 전기천공 10 μL당 RNP 1.15 μL와 세포 9 μL를 결합합니다. 전기천공 팁으로 공기가 흡입되지 않도록 충분한 부피(+30%)가 있는지 확인하십시오. 전기천공 전에 RT에서 1-2분 동안 배양합니다.
- 10 μL 또는 100 μL의 RNP와 세포 혼합물을 전기천공 피펫의 적절한 크기의 전기천공 팁으로 흡인하고, 로드된 피펫을 피펫 스테이션에 삽입하고, 전기천공을 시작합니다. 아크를 방지하기 위해 팁에 기포가 완전히 없는지 확인하십시오. 전기 천공 중에 아크가 발생하지 않는지 확인하십시오.
- 전기천공된 세포를 48웰(10μL 형질감염) 또는 6웰 플레이트(100μL 형질감염) 내부에 rAAV6가 있거나 없는 준비되고 예열된 소량의 배지로 즉시 배출합니다. 나머지 샘플에 대해 5.15-5.17단계를 반복합니다. transfection하지 않고 대조군 샘플을 배양 웰에 추가합니다.
- 세포를 37°C에서 5%CO2 와 함께 4시간 ± 2시간 동안 인큐베이션한 다음, 각성제, DMSO 및 항생제/항진균제를 함유하는 준비된, 예열된 B 세포 배양 배지를 첨가한다: 10 μL 형질주입의 경우 450 μL 또는 100 μL 형질감염의 경우 4.5 mL.
- 37°C에서 5% CO2로12-24 시간 동안 인큐베이션을 계속한다. 그런 다음 연장된 배양이 필요한 경우 배지를 DMSO 없이 각성제 및 항생제/항진균제를 포함하는 B 세포 배양 배지로 변경합니다. 게놈 DNA의 분석은 24 시간 후에 수행 할 수 있습니다. 상동성 암 외부의 프라이머와 삽입물 내부의 프라이머를 사용하는 디지털 액적 PCR은 편집 효율을 정량화하기 위해 사용될 수 있다(39). PCR을 수행하여 삽입 부위를 증폭하고 Sanger 염기서열 분석을 수행하여 올바른 편집을 확인합니다.
- 단백질 수준의 분석을 위해, 단백질 발현 변화를 허용하기 위해 전기천공 후 40-48시간 동안 세포를 배양하고, 표 7의 시약을 사용하여 유세포 분석에 의한 분석을 수행하였다.
결과
테트라사이클린이 활성화된 자가 침묵 아데노바이러스 헬퍼를 사용하여 rAAV6를 생산한 결과, 평균 4 x 1010 GC/mL의 세포 배양 배지가 생산되어 헬퍼가 없는 표준 삼중 형질감염을 사용한 생산보다 30-40배 더 우수한 성능을 보였습니다(그림 2).
붉은털원숭이 B 세포의 선택적 정제는 대다수의 CD3+ T 세포와 CD14+ 및/또는 CD16+ 골수 세포를 제거했으며, 순도는 80%-95%인 CD20+ B 세포를 일상적으로 얻을 수 있었습니다(그림 3). 쥐 B 세포7에 대한 우리의 이전 설계를 기반으로 우리는 붉은털 원숭이 B 세포의 B 세포 수용체 특이성을 편집하는 동시에 불변 영역의 파괴를 통해 내인성 항체 경쇄를 삭제함으로써 대다수의 B 세포에서 대립유전자 배제를 유지하는 방법을 개발했습니다. 우리는 마지막 IGHJ 유전자와 붉은털 원숭이 B 세포의 Eμ 인핸서 사이의 IGH 유전자좌에 삽입할 프로모터가 없는 HDRT를 구성했습니다(그림 4). 이 구축물은 성숙한 B 세포에서 자연적으로 재배열된 상류 VDJ 영역의 내인성 VH 프로모터를 이용하고, 따라서, 에피솜 AAV 게놈에 의해 발현되지 않는다. 더구나, 이 구축물은 세포 표면 상에서 발현되기 위해 하류 항체 중쇄 불변 영역 내로의 스플라이싱을 필요로 한다. 따라서 유세포 분석에 의해 나타난 세포 표면의 특이적 항원 결합은 정확한 표적 유전자좌 통합과 삽입된 서열이 기능적임을 나타냅니다.
우리는 붉은털 원숭이 유래 항-HIVbNAb 40인 항체 Ab1485를 암호화하는 이러한 구축물을 rAAV6에 패키징하고 이를 사용하여 위에서 설명한 바와 같이 활성화된 1차 붉은털 원숭이 비장세포 또는 PBMC 배양물을 편집했습니다(그림 5A). 프로토콜은 높은 세포 생존율(~90%)을 유지하면서 동시에 B 세포의 ~80%에서 경쇄 발현을 삭제했습니다. 대부분의 B 세포는 여전히 이소타입 IgM을 발현했습니다(그림 5B). Ab1485 HDRT를 코딩하는 rAAV6의 첨가는 B 세포의 16%-21%에서 유전자 편집 및 Ab1485 표면 발현을 초래했지만(그림 5A), 편집되지 않은 B 세포보다 항체 사슬에 대한 형광 강도가 더 낮았습니다(그림 5A 오른쪽 패널, 그림 5C). 이는 유세포 분석에서 표면 BCR을 검출하는 데 사용되는 항원 염색과 단일클론 사이의 에피토프 경쟁의 결과일 수 있을 뿐만 아니라 HDRT의 폴리시스트로닉 특성 및 덜 효율적인 스플라이싱으로 인한 실제 단백질 발현 감소의 결과일 수 있습니다. 1% DMSO를 첨가하고 rAAV6 HDRT를 사용한 연장된 농축 배양은 일반적으로 편집 효율을 증가시켰습니다(그림 6A-C). 이 특정 방법(일반적으로 5%-20%, 최대 40%)을 사용하면 개별 붉은털 원숭이(그림 5A, 그림 6A-E)와 rAAV6 HDRT 배치의 품질(그림 6E)에 따라 편집 효율성이 달성됩니다. 전반적으로, 우리는 효율적인 rAAV6 생산과 붉은털 원숭이 B 세포의 배양, 정제 및 유전자 편집을 위한 프로토콜을 제시합니다.
| 시약 | 음량 | 주식 | 최종 농도 |
| DMEM, 고혈당 | 500 mL의 | 1 x | ~ 88.5% |
| FCS, 열 비활성화 | 50 밀리리터 | 1 x | ~ 8.85% |
| 항생제/항진균제 | 5 mL | 100 배 | 1 x |
| 글루타민 | 5 mL | 200 밀리엠 | 2 밀리엠 |
| 소듐 피루브산 | 5 mL | 100 밀리엠 | 1 밀리엠 |
표 1: 293AAV 세포 배양 배지.
| 시약 | 음량 | 주식 | 최종 농도 |
| DMEM, 고혈당 | 500 mL의 | 1 x | ~ 95.2% |
| FCS, 열 비활성화 | 10 mL | 1 x | ~ 1.9% |
| 항생제/항진균제 | 5 mL | 100 배 | 1 x |
| 글루타민 | 5 mL | 200 밀리엠 | 2 밀리엠 |
| 소듐 피루브산 | 5 mL | 100 밀리엠 | 1 밀리엠 |
표 2: 293AAV 셀 생산 배지.
| 희석 시리즈 | 시료의 부피(μL) | 희석제와 부피 | 희석 계수 | 총 희석 | 레퍼런스 AAV6 |
| GC/mL | |||||
| 희석 1 | 4.1 x 1011 GC/mL에서 2 μL 시료 또는 AAV 기준 표준물질 | 18 μL DNAseI 완충액 및 효소 | 10 배 | 10 배 | 4.1 엑스 1010 |
| 희석 2 | 15 μL 딜. 1 | 60 μLH2O | 5 배 | 50 배 | 8.2 엑스 109 |
| 희석 3 | 20 μL 딜. 2 | 80 μLH2O | 5 배 | 250 배 | 1.6 엑스 109 |
| 희석 4 | 20 μL 딜. 3 | 80 μLH2O | 5 배 | 1250 배 | 3.3 엑스 108 |
| 희석 5 | 20 μL 딜. 4 | 80 μLH2O | 5 배 | 6250배 | 6.6 엑스 107 |
| 희석 6 | 20 μL 딜. 5 | 80 μLH2O | 5 배 | 31250 배 | 1.3 x 107 |
| 희석 7 | 20 μL 딜. 6 | 80 μLH2O | 5 배 | 156250 x | 2.6 엑스 106 |
| 희석 8 | 20 μL 딜. 6 | 80 μLH2O | 5 배 | 781250 x | 5.24 엑스 105 |
| 희석 9 | 20 μL 딜. 7 | 80 μLH2O | 5 배 | 3906250 x | 1.05 엑스 105 |
표 3: qPCR 희석 표.
| 시약 | 음량 | 주식 | 최종 농도 |
| RPMI-1640 시리즈 | 420 밀리리터 | 1 x | 84% |
| FCS, 열 비활성화 | 50 밀리리터 | 1 x | 10% |
| 항생제/항진균제 | 5 mL | 100 배 | 1 x |
| 글루타민 | 5 mL | 200 밀리엠 | 2 밀리엠 |
| 소듐 피루브산 | 5 mL | 100 밀리엠 | 1 밀리엠 |
| 헤페스 | 5 mL | 1 미터 | 10 밀리엠 |
| 2-B-메르캅토-에탄올 | 550 μL | 55 밀리엠 | 55 마이크로미터 |
| 비필수 아미노산 | 5 mL | 100 배 | 1 x |
| 인슐린-트랜스페인-셀레늄 | 5 mL | 100 배 | 1 x |
표 4: B 세포 배양 배지.
| 시약 | 희석 | 주식 | 최종 농도 |
| 메가CD40L | 1:1000 | 100μg/mL | 100ng/mL |
| CpG ODN | 1:300 | 1 밀리그램/mL | 3.33μg/mL |
| 휴먼 BAFF | 1:1000 | 40 μg/mL | 40의 ng / mL |
| 인간 IL-2 | 1:1000 | 50 μg/mL | 50ng/mL |
| 인간 IL-10 | 1:1000 | 50 μg/mL | 50ng/mL |
표 5: B 세포 자극제.
| 항체 | 클론 | 희석 | 최종 결론. |
| 항인간 CD3 | 에프엔-18 | 1:40 | 2.5μg/mL |
| 항인간 CD8a | RPA-T8 시리즈 | 1:200 | 2.5μg/mL |
| 항인간 CD14 | M5E2 시리즈 | 1:200 | 2.5μg/mL |
| 항인간 CD16 | 3G8 (3G8) | 1:200 | 2.5μg/mL |
| 항인간 CD33 | AC104.3E3 시리즈 | 1:50 | 1 테스트 |
| 항인간 CD64 | 10.1 | 1:800 | 0.625 μg/mL |
| 항인간 CD66 | 테트2 | 1:11 | 1 테스트 |
| 항인간 CD89 | 대답 59 | 1:800 | 0.625 μg/mL |
표 6: 비-B 세포의 선택적 고갈을 위한 항체.
| 시약 | 유형/클론 | 작동 희석/농도 |
| 항인간 CD14 AlexaFluor647 | M5E2 시리즈 | 1:50 |
| 항인간 CD16 AlexaFluor700 | 3G8 (3G8) | 1:50 |
| 항인간 CD20 PECy7 | 2시간 7분 | 1:50 |
| 항인간 CD3 PE | SP34-2 시리즈 | 1:50 |
| 좀비-NIR | - | 1:500 |
| 항인간 HLA-DR BV605 | L243 (영문) | 1:200 |
| 항-인간 Ig 경쇄 람다 APC | MHL-38 시리즈 | 1:50 |
| 반인간 카파 경쇄 FITC | 다클론 | 1:500 |
| 항인간 IgM BV421 | MHM-88 시리즈 | 1:50 |
| 무작위로 비오티닐화된 RC1 항원 | - | 5 μg/mL |
| 스트렙타비딘-PE | - | 1:500 |
표 7: 분석을 위한 유세포 분석 시약.
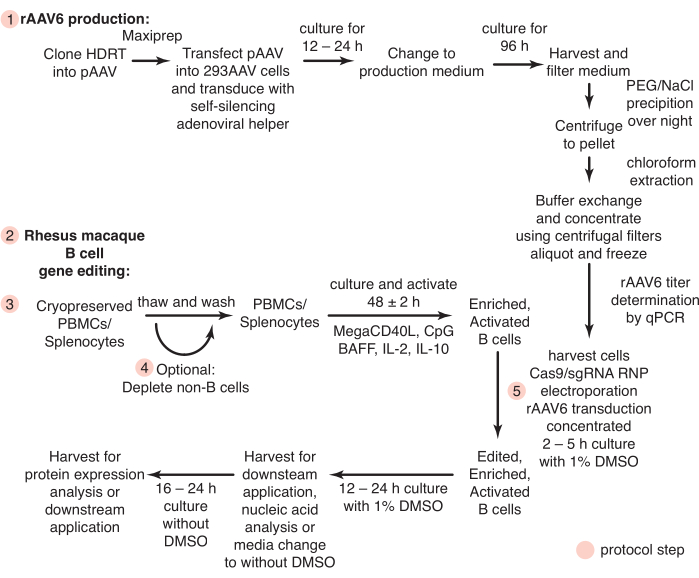
그림 1 : rAAV6 생산의 개략도 및 일차 붉은털 원숭이 B 세포의 유전자 편집. 프로토콜은 rAAV6 생산(단계 1)과 붉은털 원숭이 B 세포의 유전자 편집(단계 2-5)으로 나뉘며, 여기에는 비-B 세포의 고갈을 위한 선택적 단계(단계 4)가 포함됩니다. 프로토콜의 단계는 빨간색 원으로 표시됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
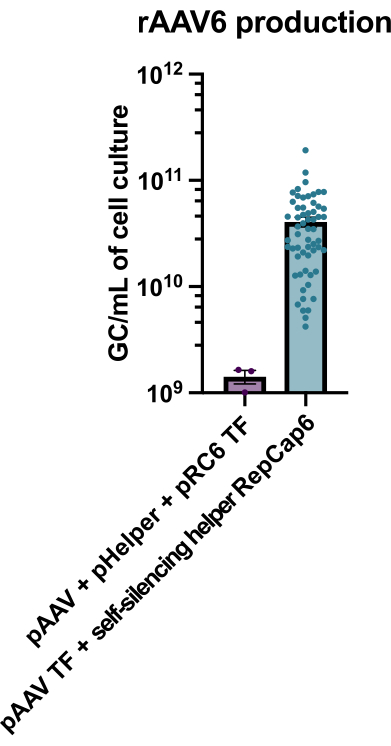
그림 2: 자가 침묵 아데노바이러스 헬퍼를 사용한 높은 rAAV6 수율. rAAV6는 여기에 기술된 방법(pAAV 형질감염[TF] + 자가-침묵 헬퍼 RepCap6, 자가-침묵 아데노바이러스 헬퍼) 또는 pAAV, pHelper 및 pRepCap6 (pRC6)의 전형적인 헬퍼 없는 삼중 형질감염을 사용하여 생산되었다. rAAV6는 세포 상청액에서만 정제되었습니다. 자가-침묵 아데노바이러스 헬퍼 벡터를 사용하는 방법은 전술한 바와 같이 qPCR에 의해 역가된 rAAV를 30-40배 더 생성하였다. 각각의 점은 2 내지 20개의 독립적인 실험에서 다양한 pAAV 구축물을 사용한 개별적인 rAAV 생산을 나타낸다. SEM± 평균이 플로팅됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
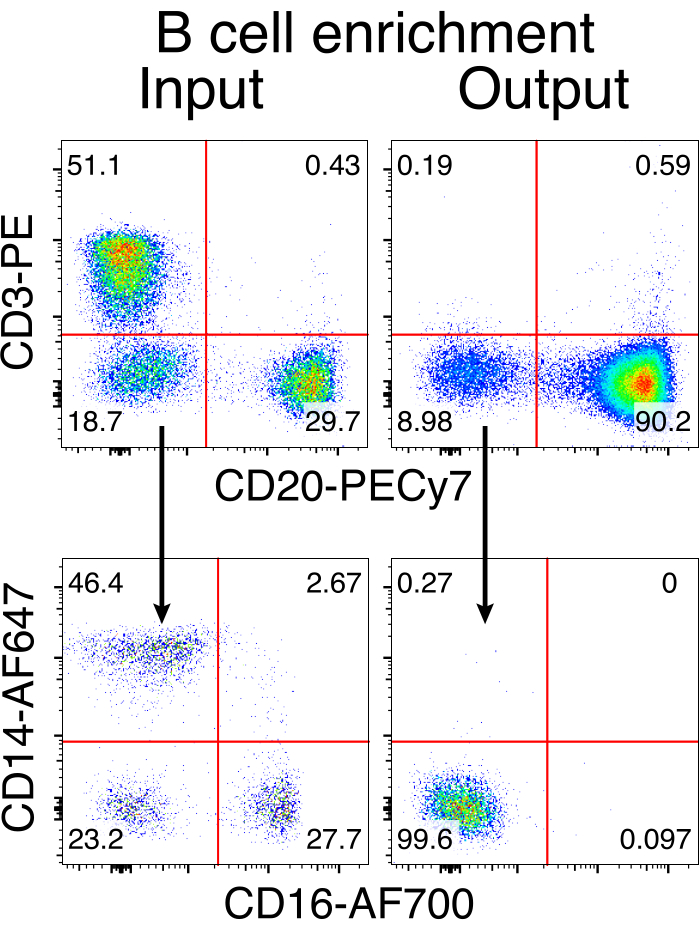
그림 3: non-B 세포의 음성 고갈에 의한 B 세포 농축. 붉은털 원숭이 B 세포는 기술된 프로토콜을 사용하여 PBMC로부터 농축되었고 90% 순도로 농축되었다. 보강 전 입력과 보강 후의 출력이 표시됩니다. 라이브, 단일 PBMC에 대한 게이트. 5 개의 독립적 인 실험을 대표합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
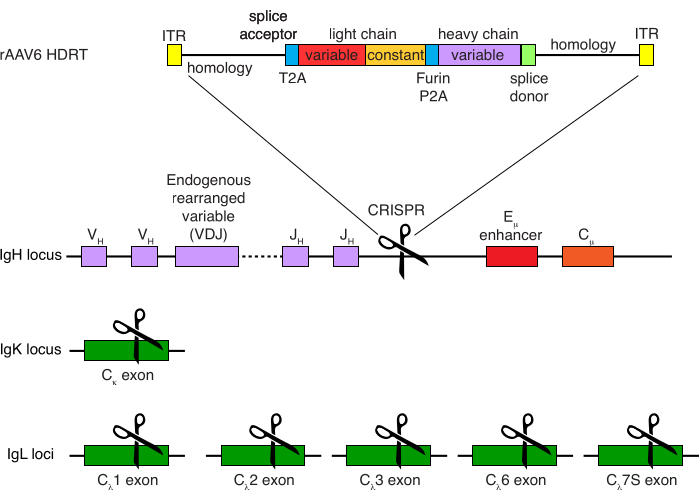
그림 4: 붉은털원숭이 B 세포의 B 세포 수용체 특이성을 편집하는 데 사용되는 표적화 전략. rAAV6는 묘사된 HDRT를 함유하여 생산되었다. HDRT는 266 bp 5' 상동성 암, 111 bp의 붉은털 원숭이 IGHM 엑손 1 스플라이스 수용체, 그 다음 Thosea asigna 바이러스 자가 절단 2A 펩티드 서열(T2A)이 있는 GSG-링커, 리더 서열 및 붉은털 원숭이 항체 Ab1485의 완전한 경쇄를 붉은털 원숭이 IGLC1로 구성합니다. 그 다음에는 푸린 절단 부위, GSG 링커, 및 돼지 테스코바이러스 자가-절단 2A 펩티드 서열 (Furin-P2A)이 뒤따르고, 또 다른 리더 서열 및 Ab1485 중쇄 가변성, 붉은털 원숭이 IGHJ4 스플라이스 공여체 서열의 52 bp가 뒤따르며, 이는 하류 항체 중쇄 불변 영역으로의 스플라이싱을 허용하고, 514 bp 상동성 아암을 포함한다. 이 구축물은 sgRNA 표적 서열 GAGATGCCAGAGCAAACCAG를 사용하여 마지막 IGHJ 유전자와 Eμ 인핸서 사이의 IGH 유전자좌를 표적화하였다. 두 상동성 아암은 이 sgRNA의 절단 부위에서 끝나도록 설계되어 표적 서열을 제거하고 최적의 통합 효율성을 허용합니다. 동시에, 대립유전자 배제 및 단일 B 세포 수용체의 발현을 유지하기 위해, 우리는 표적 서열 GGCGGGAAGATGAAGACAGA 및 IGLC1, IGLC2, IGLC3, IGLC6 및 IGLC7S를 표적으로 하는 붉은털 원숭이 IGKC를 표적으로 하는 sgRNA를 사용하여 내인성 경쇄를 결실시켰다. HDRT는 이 sgRNA에 의한 IGLC1 서열의 절단을 방지하는 침묵 돌연변이를 포함했습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
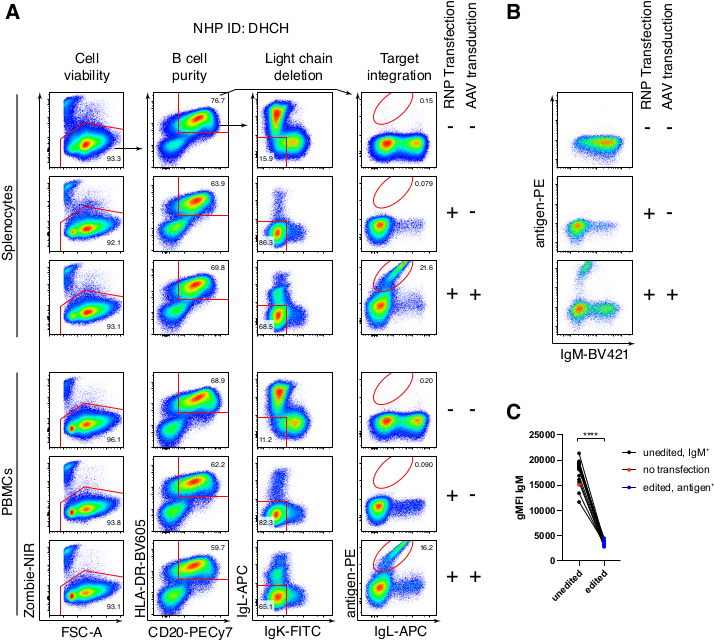
그림 5: 일차 붉은털 원숭이 B 세포의 유전자 편집. (A) 동일한 붉은털 원숭이로부터의 일차 비장세포(상부 패널) 또는 PBMC(하부 패널)를 비-B 세포의 고갈 없이 배양하고, 상기 기재된 바와 같이 편집하였다. 타겟팅 전략은 그림 4와 같습니다. 전기천공 이틀 후, 세포를 수확하고, 유세포 분석을 위해 표면 염색하였다. 왼쪽 열은 단일 항 셀에 게이트되었고 다른 열은 맨 위 행에 표시된대로 게이트되었습니다. 세포의 생존력, B 세포의 순도, 경쇄의 결실 효율, 및 특정 항원 RC141로 염색한 Ab1485의 knock-in 효율은 미처리, RNP 형질감염, 또는 RNP 형질주입 + rAAV6 형질도입 샘플(MOI = 5 x 105)에서 나타난다. 다른 붉은털 원숭이의 세포를 사용한 6개의 독립적인 실험을 대표합니다. (B) 배양된 붉은털 원숭이 B 세포 대조군 또는 편집 후 IgM 발현 및 (C) IgLC 및 IgKC 표적화로 인해 Ig 발현을 잃지 않은 B 세포(편집되지 않음) 또는 예상되는 항원에 결합하는(편집됨) B 세포에 대한 IgM의 기하 평균 형광 강도(gMFI). 적색 점은 형질주입되지 않은 배양된 대조군 B 세포의 gMFI를 나타낸다. 쌍체 t-검정에서 p < 0.0001을 나타냅니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
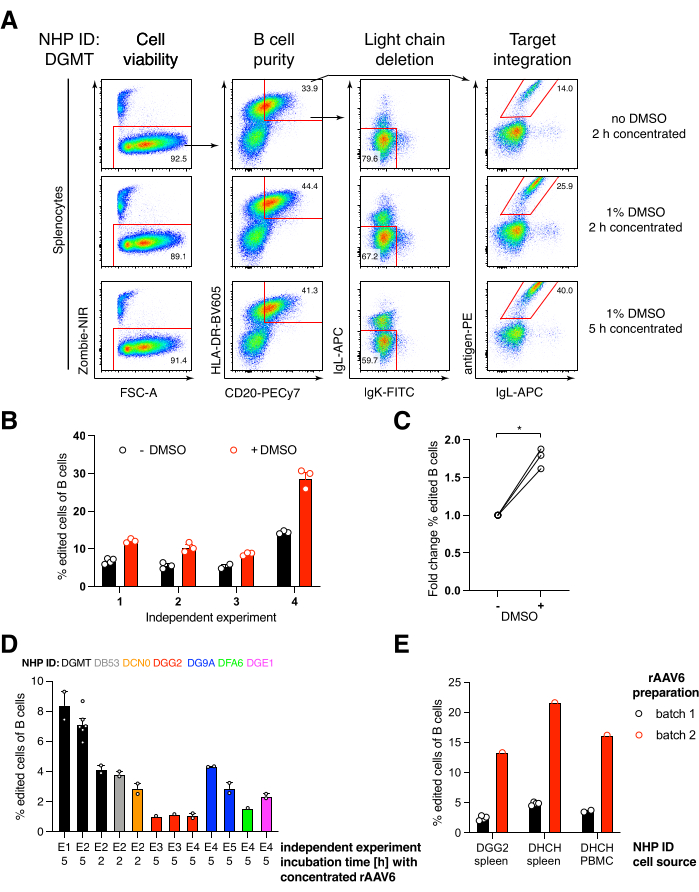
그림 6: DMSO, rAAV6 HDRT를 사용한 장기간 농축 배양, rAAV 배치 품질 및 다양한 기증자 NHP 간의 재현성이 일차 붉은털 원숭이 B 세포의 유전자 편집 효율에 미치는 영향. (A) 비장세포를 배양하고 기재된 바와 같이 편집하였다. 전기천공 후, 5 x 10 5 세포를 1% DMSO를 포함하거나 포함하지 않는 배지에서 배양하고, 또 다른 450 μL의 배지를 첨가하기 전에 5 x 10 5의 MOI에서 5 x 105의 MOI로 rAAV6 HDRT를 함유하는 배지 50 μL에서 배양하였다. 전기천공 2일 후 세포를 도 5와 같이 유세포 분석기로 분석하였다. 4 개의 독립적 인 실험을 대표합니다. (B) 4개의 독립적인 실험에 걸친 (A)의 정량화. 점은 1,350V, 10-20ms 및 1 펄스 전기천공 기간의 형질주입 설정과 0.75%-1.25% 범위의 DMSO 농도를 갖는 기술적 복제물을 나타냅니다. (C) (B)에서 편집 효율의 평균 접기 변화. * Mann-Whitney U 테스트에서 p > 0.05. (D) 저효율 상용 rAAV6 배치를 사용하여 다른 원숭이를 대상으로 한 독립적 인 실험에 대한 편집 효율성. (E) 동일한 실험에서 동일한 구축물이 2개의 상이한 NHP의 B 세포에 패키징된 rAAV6의 2개의 상이한 상업적 배치를 사용한 편집 효율. 점은 1,350 V, 10-20 ms 및 1 펄스 전기천공의 transfection 설정을 가진 기술적 반복실험을 나타냅니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
여기에 제시된 프로토콜은 HDRT로서 rAAV6의 높은 수율과 역가를 생성하는 빠르고 효율적인 방법과 시험관 내에서 1차 붉은털 원숭이 B 세포를 효율적으로 유전자 편집하는 새로운 방법을 제공합니다.
rAAV6 생산 프로토콜은 비교적 간단하고 빠르기 때문에 과도한 노동없이 다양한 구조물을 동시에 생산하고 테스트 할 수 있습니다. 원한다면, rAAV6은 완충액 교환 및 농축 전에 요오드옥사놀 구배 초원심분리(34 ) 또는 수성 2상 분할(35 )과 같은 확립된 프로토콜을 사용하여 추가로 정제할 수 있다.
전체 수율이 감소했지만, 대부분의 rAAV6가 배지36으로 방출되고 세포 펠릿에서 정제하는 데 더 많은 비용과 노동력이 추가되기 때문에 세포 펠릿에서 정제하는 대신 rAAV6 정제를 위해 혈청 환원 세포 배양 배지만 사용하기로 결정했습니다. 자가 비활성화 아데노바이러스 헬퍼를 사용하면 평균 수율이 30-40배 증가하여 단일 15cm 접시에 AAV6으로 포장된 구조물을 테스트할 수 있습니다. 우리의 정제 방법은 기본적이지만 이 방법을 사용하면 다양한 세포주 또는 기타 1차 세포를 사용하여 형질도입 후 유전자 편집 효율 또는 세포 생존율에서 배치 간 변동이 상대적으로 적습니다(데이터는 표시되지 않음).
우리는 바람직하지 않은 집단의 음성 고갈을 사용하여 손대지 않은 1차 B 세포를 얻기 위해 붉은털 원숭이 B 세포 정제 프로토콜을 개발했습니다. 이들 세포를 유전자 편집하는 데 필요한 것은 아니지만, 다른 세포 유형이 실험 목표를 방해하는 경우 이 응용 분야 또는 다른 적용을 위해 1차 붉은털 원숭이 B 세포의 비교적 순수한 집단을 얻을 수 있는 방법을 제공합니다. 그러나 순도는 전체 B 세포 수율을 감소시키는 대가를 치르게 됩니다. 특히, 농축 및 비농축 B 세포 배양 모두에서 초기 PBMC 또는 비장세포 제제에서 B 세포의 분획이 중요합니다. 특히 PBMC의 경우, 이 값은 개인마다 크게 다를 수 있으므로 실험을 위해 많은 수의 B 세포를 얻기 위해 말초 혈액에서 B 세포 비율이 높은 개인에 대해 다른 원숭이를 선별하는 것이 좋습니다27. PBMC는 규칙적인 출혈 또는 백혈구 성분채집술에 의해 얻어질 수 있다42.
유전자 편집 프로토콜은 일반적으로 녹아웃의 60%-80%와 녹인 B 세포의 5%-20% 사이에서 효율적인 유전자 편집으로 이어지지만, 최대 90%의 BCR 녹아웃 및 40%의 BCR 녹인 B 세포를 달성했습니다(그림 5 및 그림 6).
붉은털원숭이 B 세포의 효율적인 편집을 위한 주요 파라미터는 sgRNA의 절단 효율, 전기천공 파라미터, MOI 및 rAAV6 제제의 품질입니다. 후보 sgRNA의 절단 효율은 HDRT의 최적 편집 및 설계를 허용하기 위해 경험적으로 결정되어야 합니다. 여기에 제시된 전기천공 파라미터는 효율성과 생존 가능성의 균형을 유지하여 편집된 B 세포의 가장 높은 비율이 아닌 편집된 B 세포의 최대 총 수를 얻습니다. 더 높은 비율의 편집된 셀이 필요한 경우 더 많은 세포 사멸이 관찰될 수 있지만 증가된 전압(최대 1,750V) 또는 변경된 펄스 길이(10-30ms)가 권장됩니다. 우리는 또한 동일한 개인의 PBMC의 B 세포에 비해 비장 B 세포에서 약간 더 높은 편집 효율을 발견했습니다(그림 5). 그러나 이에 대한 근본적인 이유는 현재 알려져 있지 않습니다.
우리는 전기천공 후 1% DMSO를 첨가하면다른 세포의 보고와 일치하여 세포 생존율에 영향을 미치지 않으면서 붉은털 원숭이 B 세포에서 유전자 편집 효율이 ~40%까지 유의하게 증가한다는 것을 발견했습니다(그림 6A-C). 그러나 1% DMSO에서 장기간 배양하는 것은 피해야 하며 세포 생존력에 영향을 미칠 수 있습니다. 원하는 경우 DMSO를 완전히 생략할 수 있습니다.
rAAV6와 함께 몇 시간 동안 전기천공한 후 소량의 세포 배양은 아마도 rAAV6에 의한 HDRT의 더 나은 형질도입으로 인해 더 높은 편집 효율을 가져오고, 따라서 Cas9이 활성화되는 해당 시간에 HDRT의 세포 내 농도가 더 높기 때문일 것입니다. 이러한 방식으로 최대 8시간 동안 세포를 배양해도 세포 생존율에 영향을 미치지 않았지만 편집 효율은 5시간 이상 크게 증가하지 않았습니다(그림 6). knock-in 대신 knock-out만 필요한 경우 이 단계를 생략할 수 있습니다.
결론적으로, 우리는 시험관 내에서 붉은털 원숭이 B 세포의 유전자 편집 및 원하는 구성물의 효율적인 knock-in에 필요한 rAAV6 HDRT의 생산을 위한 포괄적인 프로토콜을 제시합니다. 이러한 프로토콜을 통해 rAAV6로 패키징된 많은 구조물을 빠르고 비용 효율적으로 테스트할 수 있으며 보다 관련성이 높은 비인간 영장류 모델에서 B 세포 요법의 타당성 및 확장성에 대한 전임상 테스트를 수행할 수 있습니다.
공개
경쟁 이익은 선언되지 않습니다.
감사의 말
RC1 항원을 제공한 Harry B. Gristick과 Pamela Bjorkman과 비판적인 토론을 위해 전체 Nussenzweig 및 Martin 실험실에 감사드립니다. 이 연구는 빌 앤 멜린다 게이츠 재단 보조금 INV-002777 (MCN에) 및 국립 보건원 (National Institutes of Health)의 국립 알레르기 및 전염병 연구소 (National Institute of Allergy and Infectious Diseases)의 교내 연구 프로그램 (Intramural Research Program)의 지원을 받았다. (R.G. 및 M.A.M). MCN은 HHMI 조사관입니다.
자료
| Name | Company | Catalog Number | Comments |
| 1.5 mL tube sterile, Dnase, Rnase and purogen free | Stellar Scientific | T17-125 | or similar |
| 10 mL serological pipette, polystyrene, sterile, nonpyrogenic, DNase-/RNase-free, and Human DNA-free | Corning | 4488 | or similar |
| 15 cm tissue culture dish | Falcon | 353025 | or similar |
| 15 mL polypropylene conical tybe | Falcon | 352097 | or similar |
| 25 mL serological pipette, polystyrene, sterile, nonpyrogenic, DNase-/RNase-free, and Human DNA-free | Corning | 4489 | or similar |
| 250 mL polypropylene conical tybe | Corning | 430776 | or similar |
| 293AAV cell line | Cell Biolabs | AAV-100 | |
| 2-B-mercapto-ethanol, 55mM (1000x) | Gibco | 21985-023 | |
| 48-well tissue culture plate | Corning | 3548 | or similar |
| 5 mL serological pipette, polystyrene, sterile, nonpyrogenic, DNase-/RNase-free, and Human DNA-free | Corning | 4487 | or similar |
| 5 mL syringes with Luer-Lok Tip | BD | 309646 | or similar |
| 50 mL polypropylene conical tybe | Falcon | 352070 | or similar |
| 50 mL serological pipette, polystyrene, sterile, nonpyrogenic, DNase-/RNase-free, and Human DNA-free | Corning | 4490 | or similar |
| 6-well tissue culture plate | Falcon | 353046 | or similar |
| AAV-6 Packaging System (plasmids) | Cell Biolabs | VPK-406 | |
| AAV6 Reference Materials (full capsids) | Charles River | RS-AAV6-FL | |
| Accu-jet S Pipette Controller | Brand | 26350 | or similar pipette controller |
| Antibiotic/Antimycotic 100x | Gibco | 15260-062 | |
| anti-human CD14 AlexaFluor647 | Biolegend | 301812 | |
| anti-human CD14 biotin | BioLegend | 301826 | |
| anti-human CD16 AlexaFluor700 | BD Biosciences | 557920 | |
| anti-human CD16 biotin | BioLegend | 302004 | |
| anti-human CD20 PECy7 | Biolegend | 302312 | |
| anti-human CD3 biotin | Thermo Fisher | APS0309 | |
| anti-human CD3 PE | BD Biosciences | 552127 | |
| anti-human CD33 biotin | Miltenyi | 130-113-347 | |
| anti-human CD64 biotin | BioLegend | 305004 | |
| anti-human CD66 biotin | Miltenyi | 130-100-143 | |
| anti-human CD89 biotin | BioLegend | 354112 | |
| anti-human CD8a biotin | BioLegend | 301004 | |
| anti-human HLA-DR BV605 | Biolegend | 307640 | |
| anti-human Ig light chain lambda APC | Biolegend | 316610 | |
| anti-human IgM BV421 | Biolegend | 314516 | |
| anti-Human Kappa Light Chain FITC | Fisher Scientific | A18854 | |
| Autoclave | Steris | Amsco Lab 250 | or similar |
| Cell culture CO2 incubator | Fisher Scientific | 51026331 | or similar |
| Centrifugal Filter Unit (Amicon Ultra - 4, 100 kDa) | Millipore | UFC810024 | |
| Centrifuge 5920 R | Eppendorf | EP022628188 | or any other, coolable swinging bucket centrifuge with inserts for 96-well plates, 15, 50 and 250 mL size tubes |
| Chloroform | Fisher Scientific | C298SK-4 | |
| Cpg ODN | Invivogen | tlrl-2395 | |
| Dimethyl sulfoxide (DMSO) | Sigma-Aldrich | 34869-500ML | |
| DMEM, High Glucose | Gibco | 11965092 | |
| DNaseI (RNase-free) | New England Biolabs | M0303L | |
| DPBS, no calcium, no magnesium | Gibco | 14190144 | |
| Electroporation kit (Neon Transfection System 10 µL) | Fisher Scientific | MPK1096 | or other sizes or 100 uL transfection kit MPK 10096 |
| Electroporation system (Neon Transfection System) | Fisher Scientific | MPK5000 | |
| FCS | Hyclone | SH30910.03* | |
| Ficoll-PM400 (Ficoll-Paque PLUS) | Cytiva | 17144002 | or similar |
| Fume Hood | Fisher Scientific | FH3943810244 | or similar |
| Glutamine 200 mM | Gibco | 25030-081 | |
| Graduated Cylinder 1L | Corning | 3022-1L | or similar |
| Hemocytometer | Sigma-Aldrich | Z375357-1EA | or similar |
| HEPES 1M | Gibco | 15630-080 | |
| HEPES 1M | Gibco | 15630-080 | |
| Hot Plate Magnetic Stirrer | Fisher Scientific | SP88857200 | or similar |
| Human BAFF | Peprotech | 310-13 | |
| Human BD Fc Block | BD | 564220 | |
| Human IL-10 | Peprotech | 200-10 | |
| Human IL-2 | Peprotech | 200-02 | |
| Hydrochloric acid | Fisher Scientific | A144S-500 | |
| Hydrophilic Polyethersulfone Syringe Filters, (Supor membrane), Sterile - 0.2 µm, 25 mm | Pall | 4612 | |
| Insulin-Transferin-Selenium, 100x | Gibco | 41400-045 | |
| ITR primer forward: GGAACCCCTAGTGATGGAGTT | Integrated DNA Technologies | custom | |
| ITR primer reverse: CGGCCTCAGTGAGCGA | Integrated DNA Technologies | custom | |
| Laminar flow biosafety cabinet | The Baker Company | SG403A | or similar |
| Large magnetic depletion (LD) Column | Miltenyi Biotec | 130-042-901 | |
| Magentic seperator (MidiMACS separator and multistand) | Miltenyi Biotec | 130-090-329 | |
| Magnetic stir bar | Fisher Scientific | 14-512-127 | or similar |
| Magnetic streptavidin beads (Streptavidin MicroBeads) | Miltenyi Biotec | 130-048-101 | |
| Maxiprep kit | Machery-Nagel | 740414.5 | or similar |
| Media Bottles 2L with cap | Cole-Parmer | UX-34514-26 | or similar |
| MegaCD40L | Enzo | ALX-522-110-C010 | |
| MicroAmp Optical 384-well Reaction Plate | Fisher Scientific | 4309849 | |
| MicroAmp Optical Adhesive Film | Fisher Scientific | 4311971 | |
| Microcentrifuge 5424 R | Eppendorf | 5404000014 | or any other table top centrifuge for 1.5 mL tubes |
| Microwave oven | Panasonic | NN-SD987SA | or similar |
| Nikon TMS Inverted Phase Contrast Microscope | Nikon | TMS | or any other Inverted phase-contrast microscope for cell culture |
| Non-essential amino acids, 100x | Gibco | 11140-050 | |
| Nuclease-free Duplex buffer | Integrated DNA Technologies | 11-01-03-01 | |
| Nuclease-free Water | Qiagen | 129115 | |
| pH meter | Mettler Toledo | 30019028 | or similar |
| Pipetman Classic Starter Kit, 4 Pipette Kit, P2, P20, P200, P1000 and tips | Gilson | F167380 | or similar set of pipettes and tips |
| Pluronic F-68 10 % | Gibco | 24040-032 | |
| Polyethylene Glycol 8000 | Fisher Scientific | BP233-1 | |
| Polyethylenimine, Linear, MW 25000, Transfection Grade (PEI 25K | Polysciences | 23966-100 | |
| Precision Balance | Mettler Toledo | ME4001TE | or similar |
| Pre-Separation Filters (30 µm) | Miltenyi Biotec | 130-041-407 | |
| Pyrex glass beaker 2 L | Cole-Parmer | UX-34502-13 | or similar |
| Pyrex glass beaker 250 mL | Millipore Sigma | CLS1000250 | or similar |
| qPCR Instrument | Fisher Scientific | 4485691 | or similar |
| RC1 antigen randomly biotinylated | Bjorkman lab, CalTech | in house | |
| RPMI-1640 | Gibco | 11875-093 | |
| S.p. Cas9 Nuclease | Integrated DNA Technologies | 1081059 | |
| Scientific 1203 Water Bath | VWR | 24118 | or any water bath set to 37 °C |
| Sodium chloride | Sigma-Aldrich | S7653-5KG | |
| Sodium hydroxide | Sigma-Aldrich | S8045-500G | |
| Sodium Pyruvate 100 mM | Gibco | 11360-070 | |
| Sterile Disposable Filter Units with PES Membranes | Thermo Scientific Nalgene | 567-0020 | |
| Streptavidin-PE | BD Biosciences | 554061 | |
| SYBR Green Master Mix | Fisher Scientific | A25742 | |
| Tetracycline-enabled, self-silencing adenoviral vector RepCap6 | Oxgene | TESSA-RepCap6 | |
| Trypan Blue Solution, 0.4% | Gibco | 15250061 | |
| Trypsin-EDTA (0.05%), phenol red | Gibco | 25300054 | |
| Water Purification System | Millipore Sigma | ZEQ7000TR | or similar |
| Zombie-NIR | Biolegend | 423106 |
참고문헌
- Victora, G. D., Nussenzweig, M. C. Germinal centers. Annual Review of Immunology. 40, 413-442 (2022).
- Plotkin, S. A. Correlates of protection induced by vaccination. Clinical and Vaccine Immunology. 17 (7), 1055-1065 (2010).
- Brinkmann, V., Heusser, C. H. T cell-dependent differentiation of human B cells into IgM, IgG, IgA, or IgE plasma cells: High rate of antibody production by IgE plasma cells, but limited clonal expansion of IgE precursors. Cellular Immunology. 152 (2), 323-332 (1993).
- Chernecky, C. C., Berger, B. J. . Protein Electrophoresis - Serum., 6th edition. , 917-920 (2013).
- Balazs, A. B., et al. Antibody-based protection against HIV infection by vectored immunoprophylaxis. Nature. 481 (7379), 81-84 (2011).
- Greiner, V., et al. CRISPR-mediated editing of the B cell receptor in primary human B cells. iScience. 12, 369-378 (2019).
- Hartweger, H., et al. HIV-specific humoral immune responses by CRISPR/Cas9-edited B cells. Journal of Experimental Medicine. 216 (6), 1301-1310 (2019).
- Huang, D., et al. Vaccine elicitation of HIV broadly neutralizing antibodies from engineered B cells. Nature Communications. 11, 5850 (2020).
- Jeske, A. M., Boucher, P., Curiel, D. T., Voss, J. E. Vector strategies to actualize B cell-based gene therapies. Journal of Immunology. 207 (3), 755-764 (2021).
- Nahmad, A. D., et al. In vivo engineered B cells secrete high titers of broadly neutralizing anti-HIV antibodies in mice. Nature Biotechnology. 40 (8), 1241-1249 (2022).
- Nahmad, A. D., et al. Engineered B cells expressing an anti-HIV antibody enable memory retention, isotype switching and clonal expansion. Nature Communications. 11, 5851 (2020).
- Voss, J. E., et al. Reprogramming the antigen specificity of B cells using genome-editing technologies. eLife. 8, 42995 (2019).
- Pesch, T., et al. Molecular design, optimization, and genomic integration of chimeric B cell receptors in murine B cells. Frontiers in Immunology. 10, 2630 (2019).
- Cheong, T. C., Compagno, M., Chiarle, R. Editing of mouse and human immunoglobulin genes by CRISPR-Cas9 system. Nature Communications. 7, 10934 (2016).
- Rogers, G. L., Cannon, P. M. Genome edited B cells: A new frontier in immune cell therapies. Molecular Therapy. 29 (11), 3192-3204 (2021).
- Hung, K. L., et al. Engineering protein-secreting plasma cells by homology-directed repair in primary human B cells. Molecular Therapy. 26 (2), 456-467 (2018).
- Johnson, M. J., Laoharawee, K., Lahr, W. S., Webber, B. R., Moriarity, B. S. Engineering of primary human B cells with CRISPR/Cas9 targeted nuclease. Scientific Reports. 8, 12144 (2018).
- Wu, C. M., et al. Genetic engineering in primary human B cells with CRISPR-Cas9 ribonucleoproteins. Journal of Immunological Methods. 457, 33-40 (2018).
- Luo, B., et al. Engineering of alpha-PD-1 antibody-expressing long-lived plasma cells by CRISPR/Cas9-mediated targeted gene integration. Cell Death and Disease. 11 (11), 973 (2020).
- Laoharawee, K., et al. Genome engineering of primary human B cells using CRISPR/Cas9. Journal of Visualized Experiments. (165), e61855 (2020).
- Laoharawee, K., Johnson, M. J., Moriarity, B. S. CRISPR/Cas9-mediated genome engineering of primary human B cells. Methods in Molecular Biology. 2115, 435-444 (2020).
- Moffett, H. F., et al. B cells engineered to express pathogen-specific antibodies protect against infection. Science Immunology. 4 (35), (2019).
- Hartweger, H., Nussenzweig, M. C. CRISPR comes a-knock-in to reprogram antibodies in vivo. Nature Biotechnology. 40 (8), 1183-1184 (2022).
- Nishimura, Y., Martin, M. A. Of mice, macaques, and men: Broadly neutralizing antibody immunotherapy for HIV-1. Cell Host & Microbe. 22 (2), 207-216 (2017).
- Shedlock, D. J., Silvestri, G., Weiner, D. B. Monkeying around with HIV vaccines: Using rhesus macaques to define 'gatekeepers' for clinical trials. Nature Reviews Immunology. 9 (10), 717-728 (2009).
- Kreuser, S., et al. Efficient methods for generation and expansion of, and gene delivery to rhesus macaque plasma B cells. bioRxiv. , (2021).
- Gujer, C., Sundling, C., Seder, R. A., Karlsson Hedestam, G. B., Lore, K. Human and rhesus plasmacytoid dendritic cell and B-cell responses to Toll-like receptor stimulation. Immunology. 134 (3), 257-269 (2011).
- Kim, J. S., et al. Cell enrichment-free massive ex-vivo expansion of peripheral CD20(+) B cells via CD40-CD40L signals in non-human primates. Biochemical and Biophysical Research Communications. 473 (1), 92-98 (2016).
- Su, W., et al. Self-attenuating adenovirus enables production of recombinant adeno-associated virus for high manufacturing yield without contamination. Nature Communications. 13, 1182 (2022).
- Endo, Y., et al. Short- and long-term clinical outcomes in rhesus monkeys inoculated with a highly pathogenic chimeric simian/human immunodeficiency virus. Journal of Virology. 74 (15), 6935-6945 (2000).
- Balaphas, A., Buchs, N. C., Meyer, J., Hagen, M. E., Morel, P. Partial splenectomy in the era of minimally invasive surgery: The current laparoscopic and robotic experiences. Surgical Endoscopy. 29 (12), 3618-3627 (2015).
- Gibson, D. G., et al. Enzymatic assembly of DNA molecules up to several hundred kilobases. Nature Methods. 6 (5), 343-345 (2009).
- Labun, K., et al. CHOPCHOP v3: Expanding the CRISPR web toolbox beyond genome editing. Nucleic Acids Research. 47, 171-174 (2019).
- Strobel, B., Miller, F. D., Rist, W., Lamla, T. Comparative analysis of cesium chloride- and iodixanol-based purification of recombinant adeno-associated viral vectors for preclinical applications. Human Gene Therapy Methods. 26 (4), 147-157 (2015).
- Guo, P., et al. Rapid and simplified purification of recombinant adeno-associated virus. Journal of Virological Methods. 183 (2), 139-146 (2012).
- Vandenberghe, L. H., et al. Efficient serotype-dependent release of functional vector into the culture medium during adeno-associated virus manufacturing. Human Gene Therapy. 21 (10), 1251-1257 (2010).
- Brinkman, E. K., Chen, T., Amendola, M., van Steensel, B. Easy quantitative assessment of genome editing by sequence trace decomposition. Nucleic Acids Research. 42 (22), 168 (2014).
- Conant, D., et al. Inference of CRISPR edits from Sanger trace data. The CRISPR Journal. 5 (1), 123-130 (2022).
- Wilkinson, A. C., et al. Cas9-AAV6 gene correction of beta-globin in autologous HSCs improves sickle cell disease erythropoiesis in mice. Nature Communications. 12, 686 (2021).
- Wang, Z., et al. A broadly neutralizing macaque monoclonal antibody against the HIV-1 V3-Glycan patch. eLife. 9, 61991 (2020).
- Escolano, A., et al. Immunization expands B cells specific to HIV-1 V3 glycan in mice and macaques. Nature. 570 (7762), 468-473 (2019).
- Pathiraja, V., Matar, A. J., Gusha, A., Huang, C. A., Duran-Struuck, R. Leukapheresis protocol for nonhuman primates weighing less than 10 kg. Journal of the American Association for Laboratory Animal Science. 52 (1), 70-77 (2013).
- Stratigopoulos, G., De Rosa, M. C., LeDuc, C. A., Leibel, R. L., Doege, C. A. DMSO increases efficiency of genome editing at two non-coding loci. PLoS One. 13 (6), 0198637 (2018).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유