JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
X선 컴퓨터 단층 촬영을 사용한 나무 코어 분석
요약
여기에서는 X선 컴퓨터 단층 촬영 도구 체인을 사용하여 나무 코어를 처리하는 방법을 보여줍니다. 일부 목적을 위한 화학적 추출을 제외하고는 추가적인 물리적 실험실 처리가 필요하지 않습니다. 툴체인은 바이오매스 추정, MXD/나이테 너비 데이터 획득 및 정량적 목재 해부학 데이터 획득에 사용할 수 있습니다.
초록
X선 컴퓨터 단층 촬영(CT) 툴체인을 사용하면 노동 집약적인 표면 처리나 물리적 샘플 준비 없이 나이테 너비(TRW), 최대 레이트우드 밀도(MXD), 기타 밀도 매개변수 및 정량적 목재 해부학(QWA) 데이터를 얻을 수 있습니다. 여기서 초점은 60 μm에서 4 μm 범위의 해상도에서 증분 코어와 스캐닝 절차에 있습니다. 목재를 살펴봐야 하는 세 가지 척도가 정의되어 있습니다: (i) 나이테 간 스케일, (ii) 나이테 스케일, 즉 나이테 분석 및 밀도 측정 스케일, (iii) 해부학적 스케일, 후자는 기존의 얇은 단면 품질에 가깝습니다. 이러한 각 스케일에 대해 맞춤형으로 설계된 샘플 홀더를 사용하면 여러 증분 코어의 고처리량 스캔이 가능합니다. TRW 및 밀도 측정을 위해 나무 코어의 3차원 X선 CT 이미지를 효율적으로 처리하기 위해 일련의 소프트웨어 루틴이 특별히 개발되었습니다. 이 작업은 프로토콜에 대한 올바른 이해를 위해 필요한 CT의 기본 원리를 간략하게 설명합니다. 이 프로토콜은 dendrochronology에서 일반적으로 사용되는 일부 알려진 종에 대해 제시됩니다. 대략적인 밀도 추정치, TRW 및 MXD 데이터, 정량적 해부학 데이터의 조합을 통해 기후 재구성 또는 나무 반응에 대한 현재 분석을 넓히고 심화할 수 있을 뿐만 아니라 덴드로생태학/기후학 및 고고학 분야를 더욱 발전시킬 수 있습니다.
서문
목재 밀도는 목재의 해부학적 및 화학적 특성을 모두 반영하는 측정하기 쉬운 변수1이다2. 지상 바이오매스의 바이오매스 추정에서, 목재 밀도는 중요한 계량 변수 3,4,5이며, 이는 나무의 치수와 목재의 탄소 함량을 나타내는 계수와 곱해집니다. 목재의 밀도는 목재6의 기계적 성질과 밀접하게 연결되어 있으며, 나무7의 생활사를 반영한다.
세포벽 밀도는 약 1500kg/m³로 측정되며 상당히 일정한것으로 간주되지만8 고리 내 세포벽 밀도 변화도 고려해야 합니다 8,9. 목질 세포(일반적으로 침엽수의 기관, 혈관, 실질 및 활엽수의 섬유)는 다양한 방식으로 방향/모양이 지정되며 이러한 세포의 세포벽 두께와 내강 크기는10 다양합니다. 그러므로, 목재 밀도는 나무들 사이에서, 나무 내에서(축 방향 및 횡단면) 그리고 나이테 내에서 짧은 간격 내에서 변화한다(11,12). 많은 경우에, 나이테 스케일에서의 목재 밀도 변화는 또한 나이테 경계(13)를 구분한다. 목재 밀도와 궁극적으로 조직 분율이 생성되며, 이 논문에서는 아래에 설명된 대로 연구 목표(그림 1)에 따라 크게 세 가지 범주(즉, 세 가지 다른 해상도 척도)로 나뉩니다.
Inter-ring scale: 나무 조각을 측정하여 해당 샘플에 대한 단일 값을 얻습니다. 이것은 물에 담그거나 기하학적으로14를 통해 수행 할 수 있습니다. 이러한 방식으로 일반적인 바이오매스 또는 목재 기술 변수를 얻을 수 있습니다. 속-껍질 변화를 포함하기 위해, 이러한 나무 조각들은 생활사 전략(life history strategy) 15에 대한 정보를 얻기 위해 수동으로 측정되는 블록으로 더 나눌 수 있다. 의료용 스캐너(17,18)와 같은 저해상도 X-선 CT로 전환할 때, 많은 샘플(18,19,20)에서 중-와이드 링에 대한 TRW 데이터를 효율적인 방식으로 만들 수 있다. 이것은 또한 온대 및 열대 나무 모두의 속에서 껍질까지 바이오매스를 평가하는 데 사용할 수 있는 척도입니다 4,22, 일반적으로 50 μm에서 200 μm까지의 해상도 범위.
반지 눈금: 나무는 과거 환경 조건의 기록자입니다. 가장 잘 알려진 매개변수는 나이테 너비(TRW)이지만, 지구 온도 재구성의 경우 최대 후목 밀도(MXD) 기록이 온도22에 대한 더 나은 대용물임이 입증되었습니다. MXD는 측정하기 쉬운 변수(23)이며, 나이테의 마지막 세포에 대한 세포벽 두께 및 세포 크기에 대한 대리물이며, 계절적 기온(24)과 긍정적으로 연결된 수목 계통 및 아한대 부위에 있다: 여름이 따뜻하고 길수록 더 많은 세포벽 점화가 일어나 이러한 마지막 세포의 밀도가 증가한다. 침지 및 기하학적 구조와 같은 기존 측정은 이 링 수준 밀도를 결정하기 위해 덜 정확합니다. 이전 연구에서는 얇은 절단 샘플에 X선 필름을 사용하기 위한 툴체인을 개발했습니다25. 이것은 임업학과 후기 고기후학15,18 모두에서 혁명을 일으켰으며, 최대 latewood 밀도 (MXD), 즉 여름 온도의 대용물로 종종 고리 끝에있는 피크 밀도 값을 정의했습니다. 기본 원리는 샘플이 축 방향과 완벽하게 평행하도록 절단(대략 1.2mm -7mm13)하고 샘플을 X선 소스에 노출된 민감한 필름에 놓는 것입니다. 그런 다음 이러한 방사선 촬영 필름은 강도를 감지하고 프로필과 연간 나이테 매개변수를 저장하는 광원을 통해 판독됩니다. 그러나 이러한 도구에는 상당한 양의 시료 준비와 수동 작업이 필요합니다. 최근에는 X-ray CT를 위해 보다 표준화된 방식으로 또는 장착된 코어(26)를 기반으로 개발되었다. 여기서 분해능은 10 μm에서 20 μm 사이이며, TRW는 특히 더 작은 고리를 다룰 때 이 척도로 측정됩니다.
해부학적 규모: 이 규모(해상도 < 4μm)에서는 주요 해부학적 특징이 시각화되고 너비와 비율을 측정할 수 있으므로 평균 밀도 수준이 관련성이 떨어집니다. 일반적으로 이것은 미세 절편이나 고해상도 광학 스캔 또는 μ-CT 스캔을 통해 수행됩니다. 세포벽의 미세구조를 시각화해야 하는 경우, 주사전자현미경이 가장 일반적으로 사용되는 방법이다27. 해부학적 규모에서는 개별 조직 분획이 가시화되어 이미지에서 생리학적 매개변수를 도출할 수 있습니다. 개별적인 해부학적 매개변수와 목재의 세포벽 밀도에 기초하여, 목재 밀도의 종래의 추정기와 비교하기 위해 해부학적 밀도를 도출할 수 있다24.
개선된 단면 기법 및 이미지 소프트웨어(29,30)로 인해, 덴드로-해부학(dendro-anatomy)(30)은 침엽수에서 MXD를 보다 가깝게 추정하고 활엽수로부터 여러 해부학적 변수를 측정하기 위해 목재에 대한 보다 정확한 기록을 갖도록 개발되었다. 이 척도에서 실제 해부학적 매개변수가 측정되고 환경적 매개변수(31)와 관련된다. μCT를 사용하면 이 수준도 얻을 수 있습니다32,33.
목재는 본질적으로 흡습성 및 이방성이기 때문에 목재 밀도를 신중하게 정의해야 하며 측정 조건을 오븐 건조, 조건화(일반적으로 수분 함량 12%) 또는 녹색(숲에서 벌목된 상태)으로 지정해야 합니다34. 큰 샘플과 기술적 목적을 위해, 목재 밀도는 주어진 조건에서 무게를 부피로 나눈 값으로 정의됩니다. 그러나 목재 밀도의 값은 측정되는 척도에 따라 크게 달라지며, 예를 들어 속나무에서 나무 껍질까지의 목재 밀도는 두 배가 될 수 있으며, 고리 척도 (침엽수에서)에서 earlywood에서 latewood로의 전환은 목재 밀도도 크게 상승하며 고리 경계에서 피크를 띱니다.
여기에서는 앞서 언급한 3가지 척도에서 특징을 측정하기 위해 증분 코어의 X선 CT 스캐닝 프로토콜이 제시됩니다(그림 1). X-ray CT의 최근 개발은 유연한 설정으로 인해 이러한 스케일의 대부분을 커버할 수 있습니다. 연구 목표는 스캐닝을 위한 최종 프로토콜을 결정합니다.
중요한 제한 요소(일반적으로 목재 밀도 및 목재의 스케일된 특성과 본질적으로 연결됨)는 스캔에 필요한 해상도와 시간입니다. 예를 들어 (i) 콩고 분지의 Terminalia superba에서 바이오매스 추정을 위한 나이테 간 나무 스케일 목재 밀도 프로파일을 얻고, (ii) HECTOR 시스템35의 나선형 스캐닝을 기반으로 Clanwilliam cedar(Widdringtonia cedarbergensis)에서 밀도 기록을 얻고, (iii) Nanowood 시스템에서 고착 참나무에서 용기 매개변수를 측정하는 방법을 보여줍니다. 두 스캐너 모두 UGent Center for X-ray Tomography(UGCT,

그림 1: X선 CT 스캔을 위한 일반적인 방법론적 의사 결정 트리. 행은 연구 목표부터 최종 데이터 형식까지 수행해야 할 단계를 나타냅니다. 흰색 상자는 이 도구 체인과 관련된 단계입니다. 회색으로 표시된 상자는 나이테 분석을 위한 dplr47 및 Treeclim48 , ROXAS44 및 ImageJ42 또는 CT 이미지를 기반으로 목재 해부학적 매개변수를 유도하기 위한 기타 (상용) 애플리케이션과 같은 다른 소프트웨어 또는 R 패키지와 함께 수행할 수 있는 단계입니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
목재에 대한 X-CT 연구
스캐너 설정: 표준 X선 CT 스캐너는 X선관, X선 검출기, 회전 스테이지 및 회전 스테이지를 이동시키는 모터 세트로 구성되며 대부분의 경우 검출기도 앞뒤로 움직입니다(그림 2).

그림 2. 헥터 스캐닝 시스템. 시스템(35)은 소스 검출기 거리(SDD) 및 소스 오브젝트 거리(SOD)를 나타낸다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
대부분의 실험실 기반 시스템에는 원뿔 빔 형상이 있는데, 이는 생성된 X선이 튜브의 출구 창에서 원뿔 빔 모양으로 분포된다는 것을 의미하며, 이는 물체와 튜브 사이의 거리(SOD = Source-Object-Distance) 및 검출기와 튜브 사이의 거리(SDD = Source-Detector-Distance)를 변경하여 배율이 제어됨을 의미합니다(해상도에 대한 논의 참조). X선의 투과력으로 인해 물체를 통과하며 감쇠 빔의 강도는 X선 빔의 에너지, 물체의 화학적 조성(존재하는 원소의 원자 번호) 및 물질의 밀도의 함수입니다. 일정한 에너지 스펙트럼과 일정한 목재의 재료 구성을 감안할 때 X선 빔의 감쇠는 재료의 밀도에 크게 의존하며, 이는 밀도 측정에 사용되는 이유를 설명합니다. 감쇠(또는 전송)는 Beer-Lambert 법칙으로 표현할 수 있습니다.
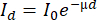
I0을 사용하면 들어오는 X선 빔이 기하급수적으로 감소하며, 이는 거리 d에 걸쳐 물질을 통해 전파될 때 투과된 X선 빔 Id로 감소합니다. 선형 감쇠 계수 μ 물체의 재료와의 일련의 상호 작용에 따라 달라집니다. 따라서 투영은 전송된 빔의 기록입니다.
실제로, 물체는 회전 스테이지에 장착되고, 적절한 SOD 및 SDD가 선택되고, 특정 전력(물체 크기, 밀도 및 구성과 관련됨)도 선택되고, 물체는 360° 회전하고, 그 회전 동안 여러 투영이 수행됩니다. 그런 다음 이러한 투영은 물체의 내부 구조를 재구성하는 데 사용됩니다. 몇 가지 재구성 알고리즘을 사용할 수 있으며, 그 중 가장 많이 사용되는 알고리즘은 여전히 라돈 변환과 푸리에 슬라이스 정리에 의존하여 수십 년 전에 개발된 분석 프레임워크를 기반으로 합니다. 보다 자세한 내용은 전문 문헌36을 참조한다.
해상도, 데이터 부피 및 샘플 크기의 난제: 해상도는 X선 CT 스캔의 핵심입니다. 역기하학 또는 싱크로트론 빔라인과 같은 평행 빔 기하학이 있는 시스템에서는 다른 고려 사항이 중요한 역할을 합니다. 이 프로토콜은 콘 빔 형상을 사용한 표준 실험실 기반 X선 CT 스캔에 대해서만 설명합니다. 여기서 배율, 검출기 픽셀 크기 및 스폿 크기의 개념이 필수적입니다. 배율은 SDD/SOD의 비율로 정의됩니다. 다음으로, 검출기의 픽셀 크기도 분명히 해상도에 영향을 미칩니다: 픽셀 크기가 작을수록 해상도가 높아지지만, 대부분의 경우 시야(FoV)는 픽셀 크기 및 검출기의 크기와도 직접적인 관련이 있습니다(동일한 픽셀 수에 대해 더 작은 픽셀 크기, 더 작은 FoV). 또한, X선 빔의 스폿 크기도 중요합니다: 스폿 크기가 클수록 해상도가 낮아져 더 적은 세부 사항을 볼 수 있습니다.
위에서 언급한 제한에 따라 가능한 것보다 높은 해상도를 얻을 수 있다는 점을 언급하는 것이 중요하므로 해상도 대신 복셀 크기(복셀은 볼륨 픽셀)라는 용어를 사용하는 것이 좋습니다. 또한 검출기 선명도와 같은 다른 요인이 작용하여 물체가 스캔되는 실제 해상도를 더욱 제한합니다. 설정된 목표를 사용하여 시스템을 올바르게 조정하는 것만이 진정한 해답을 제공합니다.
그러나 대부분의 경우 개체를 스캔할 수 있는 복셀 크기는 대부분 개체의 크기에 의해 제한됩니다. 이것은 물체가 클수록 복셀 크기가 낮아진다는 것을 의미합니다. 물체가 특정 복셀 크기에 대해 검출기의 FoV 내에 맞지 않는 경우, 예를 들어 배율을 제한하여 복셀 크기를 줄일 수 있습니다.
스캔 시간과 데이터 볼륨은 원하는 복셀 크기를 결정할 때 고려해야 할 중요한 사항입니다. 일반적으로 복셀 크기가 작을수록 보고 싶은 디테일이 높을수록, 샘플이 작을수록 또는 한 번에 스캔할 수 있는 샘플이 적을수록 더 많은 시간이 필요하고 더 많은 데이터 볼륨이 수집됩니다. 다음과 같은 이론적 인 예를 상상해보십시오 : 특정 X 선 CT 시스템을 사용하여 50 μm에서 10cm x 10cm x 10 cm 크기의 샘플을 한 번에 스캔 할 수 있으며 10 μm에서 동일한 부피를 스캔하려는 경우 FoV에 맞는 부피는 2cm x 2cm x 2cm에 불과합니다. 이것이 물리적으로 가능하다고 가정합니다. 이는 전체 부피를 다루기 위해 125개의 스캔이 필요하며(5³ = 5배 더 높은 해상도, 이미징 기술의 부피 특성으로 인해 3의 거듭제곱으로 확장됨) 데이터 볼륨도 마찬가지로 증가한다는 것을 의미합니다. 물론, 이것은 단지 사고 실험일 뿐이며, 단지 해결책을 찾는 것 이상을 고려해야 합니다. 더 많은 정보를 위해, 판독기는 스캐닝 가능성(37)의 개요를 참조한다.
목재 물체 스캔을 위한 기기의 유연성: 지난 10년 동안 많은 회사에서 HECTOR35와 유사한 어셈블리를 가진 X선 CT 시스템을 출시했습니다. 특히 시간적 해상도로 평가되는 여러 CT 시스템에 대한 개요가38에 나와 있습니다.
전체적으로 X-ray CT 시스템의 유연성과 사용자 친화성이 크게 향상되었습니다. 많은 시스템에서 다양한 물체를 스캔할 수 있으며, 이는 UGCT의 시스템에서도 마찬가지입니다. 아래 프로토콜은 나이테 분석에 적합한 HECTOR 시스템에 대해 시연된 것입니다. 그러나 프로토콜은 해상도 및 데이터 형식이 허용하는 경우 사용 가능한 다른 시스템에 유효합니다.
이러한 시스템을 사용하면 다양한 물체를 스캔할 수 있습니다. HECTOR 시스템으로 스캔한 다양한 목재 물체의 몇 가지 사진이 그림 3에 나와 있습니다. 이러한 유연성은 그림 1에 제시된 세 가지 스케일을 구성하며, 그 범위는 거친 해상도에서 매우 미세한 해상도에 이르기까지 다양합니다.

그림 3. 스캔 설정 예시. (A) 통나무, (B) 첼로49, (C) 배치 스캔용 트리 코어가 있는 샘플 홀더(유형 1) 및 (D) HECTOR의 회전 스테이지에 장착된 나선형 스캐닝용 증분 코어가 있는 샘플 홀더 유형 2. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
Access restricted. Please log in or start a trial to view this content.
프로토콜
1. 코어 샘플링
- Pressler 보어로 나무를 샘플링하십시오. 트리를 수동으로 코어링하는 방법에 대한 참고 문헌 참조39. 이 툴체인은 5.15mm 코어용으로 제공됩니다.
- 나무 코어를 6mm 종이 빨대나 접착제가 필요하지 않은 다른 수용체에 풀지 않은 상태로 넣습니다. 나무 지지대에 나무 코어를 붙이지 마십시오. 코어가 이미 장착된 경우 접착제 유형에 따라 메스/톱 또는 솔벤트로 코어를 분리합니다.
- 플라스틱 튜브로 싸지 말고 곰팡이 성장과 곰팡이 부패를 방지하기 위해 먼저 말리십시오.
- 연필을 사용하여 종이 빨대에 글을 쓰십시오., 추출하면 마커 글씨가 퇴색될 수 있습니다.
참고: 이 툴체인은 4mm 코어에도 적합합니다. 이미 장착되고 샌딩된 코어를 사용할 수 있지만 먼저 마운트를 해제해야 합니다. 고고학 또는 잔존목의 경우 스캔을 위해 코어 크기의 샘플을 만들어야 합니다(톱질/크기 축소).
2. 스캔하기 전 핵심 준비
- 최소 24시간 동안 에탄올/톨루엔 또는 에탄올 또는 아세톤40 Soxhlet 추출을 수행합니다(그림 4A,B). 이는 정확한 밀도 계산을 위해 수지가 없는 목재 부피를 보장하는 데 필요합니다(수지는 신호를 감쇠시킵니다, 그림 4C13,41).
- 1000mL의 에탄올과 427mL의 톨루엔(예: ASTM D 1107 - 96에 따름) 또는 순수 에탄올 또는 아세톤의 용액을 만듭니다. 많은 대학에는 나무 코어를 위한 Soxhlet 장치의 개조된 버전을 만들 수 있는 실험실 유리 작업장이 있습니다(그림 4B).
- 바닥이 둥근 플라스크에 용매를 채우고 실험실 히터의 쿨러가 있는 Soxhlet 장치의 스테인리스 스틸 지지대에 있는 빨대 내의 샘플을 넣습니다. 시간당 최소 6번의 사이펀을 허용합니다.
알림: 폐쇄 된 물 회로는 냉각 (또는 기타 최신 냉각 시스템)에 사용하는 것이 바람직합니다. 이 경우 워터 펌프는 염소 정제 (조류 발생을 피하기 위해)와 함께 100L 대야에 저장된 물을 120L / h로 순환시킵니다 (그러나 이는 Soxhlet 장치의 크기와 발열체에 의해 가해지는 열에 따라 다름). 공기 냉각기는 100L 수조의 물을 냉각하는 데 사용됩니다. 용매를 절약하기 위해 유리 비드를 사용하여 Soxhlet 장치의 빈 부피를 채울 수 있습니다. - 온도와 사이펀 횟수를 정기적으로 확인하십시오. 화학 후드 아래에서 코어를 건조시키고(이에 대한 실험실 정책 확인) 용매 잔류물을 제거하거나 화학 후드 아래에 건조 오븐을 놓습니다.
- 배기 환기 하에 건조 오븐(103.5°C)에서 코어를 24시간 동안 건조하고 위에서 설명한 대로 온수 수조(90°C) 또는 온수 Soxhlet 추출을 24시간 동안 수행합니다.
- 강철 샘플 홀더의 종이 빨대에 샘플을 보관하십시오. 103.5°C에서 24시간 동안 건조 오븐에서 다시 건조시킨 다음 스캔하기 전에 60% 상대 습도(RH)로 조절합니다.
참고: 이 경우 60% 값이 선택되는데, 이는 X선 CT 스캐닝실의 주변 평균 상대 습도 조건과 대략적으로 일치하기 때문입니다. 오븐 건조 샘플도 사용할 수 있습니다. 가장 중요한 요소는 모든 샘플이 동일한 조건에서 스캔된다는 것입니다. - 물 추출로 인해 종이 빨대가 변질되는 경우 나무 코어를 새 6mm 종이 빨대21에 다시 넣으십시오. 5.15mm 및 4mm 코어를 모두 6mm 종이 빨대에 넣을 수 있습니다.
- 종이 빨대 전체가 나무로 채워져 있는지 확인하십시오. 양쪽 밀짚 끝을 위로 감고 끝을 자릅니다. 이렇게 하면 원통형 홀더에 빨대를 쉽게 삽입할 수 있습니다.
- CoreProcessor 및 RingIndicator는 나무 껍질 면이 아래로 있다고 가정하기 때문에 형성층(나무 껍질) 면이 코어에 명확하게 표시되어 있는지 확인하십시오. 균열이 있는 코어는 작업하기 어렵므로 조각과 조각을 제거하십시오.
- 강철 샘플 홀더의 종이 빨대에 샘플을 보관하십시오. 103.5°C에서 24시간 동안 건조 오븐에서 다시 건조시킨 다음 스캔하기 전에 60% 상대 습도(RH)로 조절합니다.
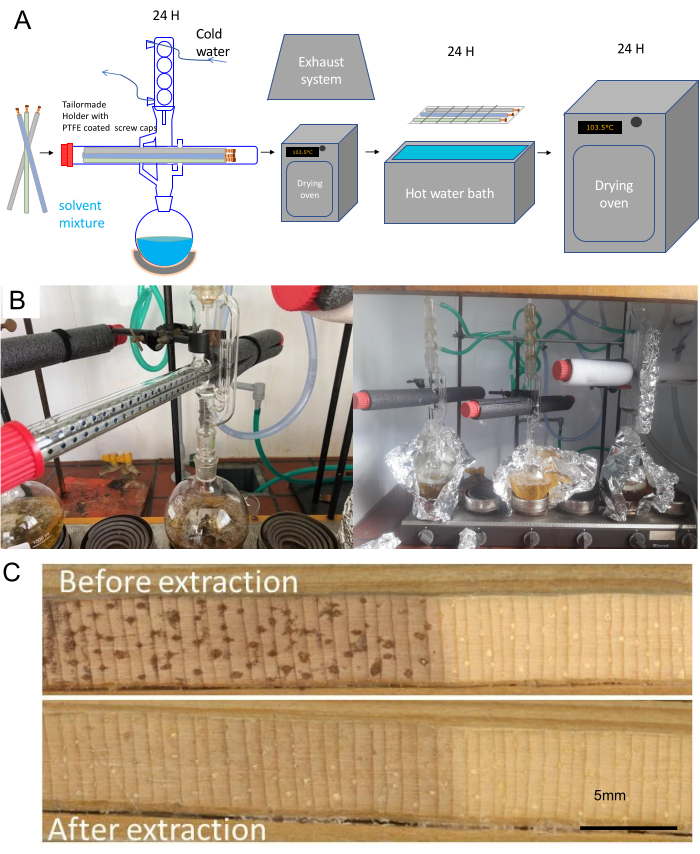
그림 4. 스캔하기 전에 코어를 추출하고 건조하기 위한 작업 흐름. (A) 종이 빨대의 증분 코어를 먼저 온수 수조에 넣은 다음 Soxhlet 장치와 함께 뜨거운 에탄올-톨루엔 혼합물에 24시간 동안 넣은 다음 건조시키고 24시간 동안 온수 수조에 넣은 다음 103.5°C에서 다시 건조시킨 다음 스캔하기 전에 컨디셔닝합니다. (B) 겐트 대학교(Ghent University)에 설치된 개조된 Soxhlet의 이미지. 여러 개의 개조된 Soxhlet 장치가 직렬로 부착됩니다. 알루미늄 호일과 절연 튜브를 사용하여 용매 또는 용매 혼합물을 추출할 수 있을 만큼 충분히 따뜻하게 유지하십시오. (C) 추출 전후 의 Pinus longaeva 의 증분 코어 표면의 예. 수지 및 기타 추출물은 X선의 감쇠로 인해 실제 밀도 신호를 마스킹합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
3. 코어 스캐닝
- 그림 1에 설명된 연구 목적에 따라 아래 설명된 대로 적절한 샘플 홀더 유형(그림 5)을 선택합니다.
- 반지 간 가늠자 목적을 위해, 홀더 유형 1 - 마분지와 구멍이 뚫린 꽃 거품을 사용하십시오.
- MXD 데이터의 경우 홀더 유형 2 - 길이가 1-15cm이고 직경이 3cm인 6개의 코어를 고정하는 플라스틱 샘플 홀더를 사용합니다.
- 홀더 유형 3 사용 - 종이 빨대를 단순히 함께 묶는 것으로 구성된 dendro-anatomy 목적을 위해.
- 종이 빨대에 담긴 나무 코어를 샘플 홀더에 로드하고 https://dendrochronomics.ugent.be/#software 에서 다운로드할 수 있는 스프레드시트 템플릿을 입력합니다. 각 숫자는 샘플 홀더의 지정된 위치에 해당합니다.
- X-ray μCT 시설에서 스캔: 적절한 설정 및 스캐닝 프로토콜에 대해 X-ray CT 전문가와 상담하십시오. 이 프로토콜에 사용된 스캐너에 대한 내용은37을 참조하십시오.
- 스캔한 이미지의 재구성: 재구성의 적절한 설정 또는 CT 스캐너(X-ray CT 스캐너의 소프트웨어 패키지)와 함께 제공되는 설정에 대해서는 X-ray CT 전문가에게 문의하십시오. 이 프로토콜에 대한 재구성 매개변수는37을 참조하십시오.
그림 5. 시료 홀더 유형 및 분해능. (A) 반지 간 규모, (B) 나무 반지 규모 및 (C) 해부학적 규모에 해당하는 세 가지 주요 홀더 유형의 디자인. 결과 크기 때문에 분리능 요구 사항이 증가함에 따라 샘플 수가 줄어듭니다. (D) 링 간 스케일(홀더 1), (E) 링 너비 및 MXD(홀더 유형 2) 및 (F) 해부학적 매개변수(홀더 유형 3)에 대한 해당 3D 렌더링. 축척 막대 = 5mm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
4. TRW 데이터, 밀도 데이터 및 해부학적 데이터 얻기
- 소프트웨어 시작하기.
- 밀도 값(홀더 유형 1 및 2)을 얻으려면 (i) CoreProcessor, (ii) RingIndicator 및 (iii) CoreComparison 도구 상자의 세 가지 소프트웨어 패키지를 설치하십시오.
- 이러한 툴박스는 MATLAB에서 만들어졌으므로 다음에서 사용할 수 있는 올바른 MATLAB 컴파일러 런타임(MCR)을 설치하십시오. http://nl.mathworks.com/products/compiler/mcr/. 현재 필요한 버전은 MATLAB2022B입니다. MCR은 3개의 소프트웨어 패키지와 마찬가지로 무료입니다.
- 재구성 된 볼륨의 폴더 옆에 MAT 파일 (변수 등을 저장하는 MATLAB의 파일 형식)을위한 새로운 빈 폴더를 만듭니다 (예 : matfiles_useful_name_sample_holder, 이것은 임시 매개 변수를 저장하는 데 필요합니다).
- 이후 단계에서 샘플을 채울 수 있도록 스프레드시트가 재구성된 볼륨의 폴더에 있는지 확인합니다.
- CoreProcessor를 사용하여 코어 볼륨을 전처리합니다.
참고: 고해상도 해부학 데이터의 경우 다음 처리 단계가 필요하지 않습니다(그림 1)에서 재구성된 볼륨을 사용할 수 있게 되면 3D 이미지에 대한 ImageJ 지침을 참조하십시오42. 세그멘테이션은 Weka 플러그인을 통해 수행할 수 있습니다.43 예를 들어 개별 슬라이스에 vessel을 표시하기 위해12또는 ROXAS와 같은 소프트웨어 플러그인에서 사용할 수 있습니다.44.- 코어 추출 준비: 아래 설명된 대로 증분 코어의 자동 추출을 준비합니다(링 간 스케일 그림 6A 또는 링 스케일 그림 6B에 따라 다름).
- 재구성된 파일(16비트 단면 TIFF 슬라이스)이 있는 폴더와 스프레드시트 파일(XrayForm.xlsx)을 선택합니다.
- 4.1.3에서 빈 폴더를 선택합니다. CoreProcessor가 4.2.2에서 사용할 MAT 파일을 만드는 폴더입니다. 대량 코어 추출용.
- 새로 만든 빈 MAT 파일 폴더를 선택하거나, 만들지 않은 경우 다른 폴더를 선택합니다. 볼륨이 로드되고 실린더의 세로 단면이 나타나면 몇 개의 수평 슬라이스를 확인하여 모든 코어와 참조가 실린더에 올바르게 장착되었는지 확인합니다.
- 아래쪽에서 위쪽으로 클릭하여 이를 평가할 조각을 선택합니다. 이 횡단면은 다음 단계에 사용되므로 전체 길이를 클릭합니다. 어두운 (공기) 및 흰색 참조 (그림 6)를 스프레드 시트에 표시된 횟수만큼 표시하십시오. 각 선택 후 두 번 클릭합니다.
- 샘플 홀더 1의 경우, 참조 물질을 통해 생성된 9개의 단면이 있는 멀티스크린을 검사하여 밀도 계산이 목재에 대해 수행되었는지 확인합니다(종이 빨대 또는 기타 비목재 재료가 아님). 이것은 실제 목재 밀도 값으로 올바르게 변환하는 데 필수적입니다.
- 새 팝업 창에서 주위에 원/타원을 그려 모든 코어를 개별적으로 선택합니다. 스프레드시트 파일의 정보를 기반으로 라벨링을 수행하고 이름이 올바른지 확인합니다. 템플릿이 채워지는 순서를 준수합니다. 모든 정보는 MAT 파일에 저장되며, 이 파일은 다음 단계에서 모든 코어를 한 번에 추출하는 데 사용됩니다.
- Mass Core Extraction을 클릭하여 메타데이터와 스프레드시트 파일이 동일한 폴더에 있는 경우 지정된 실린더(4.2.1.2에 표시됨)의 모든 코어에 대해 코어 추출을 수행합니다.
참고: Mass core extraction을 사용할 때 모든 코어는 사용자의 레이블(mat 파일 폴더에 저장됨)에 따라 추출됩니다. 이 작업의 결과로 모든 개별 코어가 포함된 Extracted 라는 새 폴더가 생성됩니다. 첫 번째 단계에서 여러 샘플 홀더를 준비하고 모든 MAT 파일이 동일한 폴더에 저장되면 이 폴더의 모든 MAT 파일이 처리됩니다. - CoreProcessor 도구 상자에서 Manual Tg Correction을 클릭한 다음 Extracted 폴더를 선택하여 모든 코어 볼륨의 횡단 평면 및 방사형 평면의 올바른 방향을 확인합니다. 이는 횡단 평면을 시야에 유지한 상태로 샌딩하기 전에 샘플 홀더에 물리적 샘플을 장착하는 것과 유사합니다(그림 7B).
- 사용자가 결 방향을 볼 수 있도록 일부 단면이 표시됩니다. 마지막 플롯(오른쪽 하단)에서 제시된 슬라이스를 검사하고 결 방향을 나타내는 선을 그립니다. 두 번 클릭하면 코어가 자동으로 회전합니다.
- 그런 다음 화면이 나타나면 여기에서 코어의 부피를 자르고(그림 7C) 사각형이 전체 코어 직경을 포함하는지 확인합니다. 이는 사각형의 중심점이 코어 축에 가능한 한 가까워야 하기 때문에 필요합니다(RingIndicator 모듈에서 올바른 정렬을 위해).
참고: 고해상도로 스캔하는 경우 이 단계에서 코어 내의 재료만 선택하고 변환기를 사용하여 샘플 홀더 유형 2로 전환하십시오. 이것은 예를 들어 고리 다공성 종에 확실히 도움이 됩니다.
- 코어가 잘못 정렬되거나, 뒤집히거나, 깨지거나, 호환되지 않는 이미지 형식의 경우 다음 선택적 단계를 수행합니다.
- 코어 기울기 보정(샘플 홀더 1에만 해당): 코어 기울기를 자동으로 보정합니다(예: 코어가 실린더에서 약간 기울어져 있을 때; 그림 7A). 이는 이후 단계에서 중요합니다. 이전 단계에서 만든 추출된 폴더를 선택합니다.
참고: 샘플 홀더 유형 2 또는 유형 3(그림 5)이 있거나 모든 샘플 및 샘플 홀더를 완벽하게 똑바로 세운 경우에는 일반적으로 필요하지 않습니다. - 볼륨 뒤집기: 샘플이 나무 껍질 면이 아래로 향하게 놓지 않은 경우(속껍질 방향이 왼쪽에서 오른쪽이 아님) 코어를 뒤집어 방향을 변경합니다. 이 함수는 폴더를 요청하고 새 폴더를 만듭니다.
- 글루 코어: 개별 코어의 많은 부분을 가상으로 함께 꿰맬 수 있습니다. 아이디어는 완벽하게 연결하는 것이 아니라 필요한 경우 단일 코어가 동일한 다중 페이지 TIFF 볼륨에 있는지 확인하는 것입니다. 부러진 코어 표시(4.3.4.9단계 참조)를 사용하여 코어 조각 사이의 공간을 극복하십시오.
- 변환기: 볼륨이 다른 소프트웨어 패키지에서 조작되어 도구 상자 외부(예: ImageJ) 외부에 저장된 경우 이 단계를 수행하여 헤더 정보를 올바르게 가져옵니다. 다른 CT 스캐너에서 오는 16비트 다중 페이지 TIFF 볼륨과 RingIndicator 도구 상자를 사용하는 경우에도 이 단계를 사용합니다.
참고: 여기의 모든 단계는 구조 방향 수정과 마지막으로 밀도 측정 및 나이테 분석을 위한 것입니다.
- 코어 기울기 보정(샘플 홀더 1에만 해당): 코어 기울기를 자동으로 보정합니다(예: 코어가 실린더에서 약간 기울어져 있을 때; 그림 7A). 이는 이후 단계에서 중요합니다. 이전 단계에서 만든 추출된 폴더를 선택합니다.
- 코어 추출 준비: 아래 설명된 대로 증분 코어의 자동 추출을 준비합니다(링 간 스케일 그림 6A 또는 링 스케일 그림 6B에 따라 다름).
- 각도를 수정하고 RingIndicator에서 링을 표시합니다.
참고: RingIndicator 모듈에서 (i) 횡단 및 방사형 평면의 시각화, (ii) 구조 수정, (iii) 밀도 프로필 생성, (iv) 수동 또는 반자동 링 표시와 같은 단계를 시간순으로 수행해야 합니다.- 아래 설명된 대로 transversal 및 radial plane의 시각화를 수행합니다.
- GUI에 익숙해지려면 도구 상자를 열고 여러 페이지로 된 TIFF 파일 (추출 후 tg 수정 후 생성된 파일이므로 폴더 이름 Tg 수정)을 선택합니다.
- 슬라이스 이미지의 절반 두께를 선택하여 중앙 X 슬라이스의 평균 이미지를 표시하며, X의 범위는 1-10이며, 1은 평균화되지 않고(즉, 중앙 슬라이스만 표시), 10은 10개의 중앙 슬라이스의 평균 이미지입니다.
알림: 평균화는 링 테두리를 더 잘 강조하고 노이즈를 억제하는 데 도움이 될 수 있지만, 특히 섬유 각도가 상당한 경우 링 테두리가 덜 뚜렷하게 보일 수도 있습니다. 필요에 따라 이 값을 조정하십시오. 이것은 단지 표시하기 위한 것이며 기본 볼륨에 영향을 미치지 않으며 최종 계산/결과에도 영향을 미치지 않는다는 점을 언급하는 것이 중요합니다. - 그래픽 사용자 인터페이스(GUI)를 검사합니다. GUI에는 코어의 횡단 평면이 있는 상단 그림과 코어의 방사형 평면이 있는 하단 그림과 메뉴가 포함되어 있습니다(그림 8).
- 새 코어 볼륨을 로드하려면 Volume > Load Volume 기능을 검색하여 디렉토리에서 새 다중 페이지 TIFF 파일을 선택합니다. 이제 사용자는 실제 나이테를 나타내기 위해 구조 방향을 나타낼 준비가 되었습니다.
- 자동 나이테 표시를 용이하게 하기 위한 구조 수정.
- 이미지를 수동으로 클릭하여 구조 수정을 위한 녹색 막대를 삽입합니다. 속(또는 사용 가능한 가장 오래된 링)으로 시작하여 가장 최근의 링으로 끝납니다. 코어를 따라 transversal plane과 radial plane 모두에서 구조적 편차를 보정합니다.
- 링과 섬유 각도를 올바르게 표시해야 합니다., 모든 후속 표시는 해당 표시 사이에 보간된 각도를 취하기 때문입니다.
- 한 평면에 녹색 막대를 삽입하면 다른 평면에 막대가 자동으로 생성됩니다. 바를 삽입한 후 바 끝에 있는 노드(흰색 사각형)를 이동하여 각도를 변경합니다. 중간 노드를 사용하여 막대 위치를 변경합니다. 쉽게 사용할 수 있도록 노드의 크기를 조정합니다.
- 모든 단계가 끝나면 Data > Export 및 Rings > Export Rings를 눌러 링 및 파이버 표시가 적절한 .txt 파일에 기록되었는지 확인하십시오. 모든 수정을 수행하는 동안 항상 이 두 가지 작업을 수행해야 합니다.
- 밀도 프로파일 계산.
- Densitometry > Densitometry 플롯을 사용하여 밀도 프로파일을 계산합니다. Plot Density Profile > Overlay Plot을 선택하여 코어 평면에서 오버레이 역할을 할 수 있는 밀도 프로파일을 생성하고 플롯합니다.
- MXD 계산의 경우 수지 덕트, 얼리우드 등에서 더 낮은 값을 제외하기 위해 백분율(권장은 20%, 예: 20%는 가장 높은 밀도 값의 20%만 포함됨을 의미)을 표시하십시오. 평균 밀도 값의 경우 100%를 사용합니다. 최소 밀도의 경우에도 100%를 사용합니다.
- 아래 설명된 대로 링당 한 번의 마우스 왼쪽 클릭을 사용하여 링 경계의 수동 및/또는 자동 표시를 수행합니다.
참고: 4.3.2.1 단계에서와 동일한 녹색 막대를 삽입하면 이번에는 사용자가 이 작업을 수행해야 합니다(그림 9).- Overlay Plotting > Plot Density Profile을 사용하여 이미지의 밀도 프로파일을 시각화할 수 있습니다. 이 프로파일과 함께 링 경계를 표시하는 것이 가장 좋습니다.
참고: CoreComparison 툴박스와 함께 툴박스에서 필요한 만큼 인스턴스를 엽니다(추가 참조). - 자동 표시의 경우(예: 침엽수에 권장됨) Auto > Max/Min/Inflection detection을 사용합니다. 이 기능은 이전 단계에서 생성된 밀도 측정 프로파일을 기반으로 나무 나이테 경계를 자동으로 표시합니다. 자동 표시(밀도 프로파일에 의해 정의된 명확한 고리 경계가 있는 아한대 침엽수 또는 종에 가장 적합)의 경우 Auto > Max/Min/Inflection detection을 사용합니다. 이 기능은 이전 단계에서 생성된 밀도 측정 프로파일을 기반으로 나무 나이테 경계를 자동으로 표시합니다.
- 종(확산-다공성/고리-다공성 또는 침엽수)에 따라 최대/최소 또는 곡선 굴절(밀도 피크 직후)을 나이테 경계 기준으로 사용합니다. 첫 번째 매개변수는 피크 함수에 대한 임계값이고 두 번째 매개변수는 더 부드러운 함수입니다.
- 자동화된 링 표시를 수행한 후 자동 이동(창 크기 1픽셀 및 사용자 정의 반복 포함)을 수행하면서 이 이동으로 인해 링 표시가 서로 플롯되지 않는지 확인하고 밀도 측정 플롯을 다시 실행합니다.
- 벌목 날짜를 살아있는 나무에 증분 코어를 채취한 연도 또는 적합한 다른 날짜로 변경합니다. 기본값은 1900으로 설정됩니다.
- Overlay Plotting에서 Plot Rings를 선택하면 연도가 표시됩니다. 또한 링 및/또는 밀도 프로파일을 플롯할 평면을 선택합니다.
- 두 개의 코어가 완전히 표시되면(예: 동일한 트리에서) CoreComparison 도구 상자를 열어 코어 링 너비 곡선을 쌍으로 비교합니다. 코어당 하나의 RingIndicator 인스턴스를 열고 필요한 경우 표시를 편집합니다. 다시 내보내고 이 반복적이고 상호 작용적인 접근 방식을 사용하여 좋은 품질의 데이터를 얻을 수 있습니다. 다음 단계(단계 4.4.1)에서 모든 코어에 대해 이 작업을 수행하여 TRW 데이터와 해당 밀도 값을 모두 내보냅니다.
- Rings > Check Rings 옵션에서 이중 링 위치를 확인하십시오. 이렇게 하면 표시가 이미지 외부에 위치하는지 여부와 겹치는 링이 있는지 확인합니다(예: 동일한 위치에서 두 번 클릭이 발생한 경우).
- 조각과 조각이 있는 파손된 코어의 경우 속부터 시작하여 이상(파손된 코어로 인한 공기, 수지 포켓으로 인한 밝은 점, 오염 및 부식된 부품)을 나중에 삭제할 고리처럼 구분합니다. 마지막으로 형성된 링의 트리 링 경계로 끝나고 데이터를 내보냅니다. 샘플링 중에 코어가 깨지지 않도록 하십시오(1.1. 및39단계 참조).
알림: 누락된 링과 파손된 링을 모두 표시할 수 있습니다( 그림 10 참조). 두 가지 경우가 정의되는데, 하나는 코어가 링 중간에서 끊어지는 경우이고 다른 하나는 코어가 링 경계에서 끊어지는 경우입니다. 첫 번째 간격(그림 10A)의 경우 간격을 표시하고 해당 간격의 번호와 숫자 1을 기록한 다음 괄호를 닫습니다. 그런 다음 프로그램은 링의 두 부분을 합산하여 올바른 TRW 값을 얻습니다. 두 번째 경우에는 갭 번호 뒤에 숫자 2가 표시되고 프로그램은이 섹션을 생략합니다 (그림 10B). - 링을 표시하고 밀도 프로파일을 생성하면 여러 .txt 파일이 생성되어 다중 페이지 TIFF 파일과 동일한 폴더에 저장되며 가장 중요한 파일이 표 1에 나열되어 있습니다. CoreComparison 모듈(5.4단계)에서 추가로 처리하기 위해 이러한 .txt 파일을 TIFF 이미지와 동일한 폴더에 보관합니다.
참고: 원시 밀도 프로파일에 따라 다른 방식으로 밀도 값을 계산하려면(예: latewood 너비 대 earlywood 너비45 또는 CoreComparison 및 CoreProcessor 도구 상자에서 지원하지 않는 기타 메트릭) zpos_corr 및 density_corr 텍스트 파일을 사용하고 이러한 계산에 사용합니다.
- Overlay Plotting > Plot Density Profile을 사용하여 이미지의 밀도 프로파일을 시각화할 수 있습니다. 이 프로파일과 함께 링 경계를 표시하는 것이 가장 좋습니다.
- 아래 설명된 대로 transversal 및 radial plane의 시각화를 수행합니다.
- TRW 시리즈를 비교하고 CoreComparison을 통해 데이터를 내보내려면 아래 단계를 따르십시오.
참고: 이 도구 상자를 사용하면 CoreComparison 및 PatternMatching 모듈이라는 두 개의 창이 동시에 열립니다. CoreComparison은 TRW 데이터의 교차 연대 측정 및 내보내기를 처리하는 반면, PatternMatching 모듈은 밀도 프로필 및 밀도 값(MXD, 최소 밀도(MND), 평균 밀도 및 4사분위수 값)을 내보내는 데 사용할 수 있습니다. CoreComparison의 주요 목표는 TRW 값과 밀도 값을 생성하고, 링이 누락되거나 잘못된 표시가 있는 경우 RindIndicator에 대한 커플링을 사용하여 교차 연대 측정 품질을 대략적으로 추정하는 것입니다.- 교차 연대 측정 또는 링 너비 패턴을 다른 시리즈와 일치시키려면 다음 단계를 수행하십시오.
- RingIndicator 섹션이 완료되면 비교할 텍스트 파일을 선택하면 Gleichlaüfigkeit (GLK)46 및 개별 계열 간의 Spearman 상관 관계와 같은 교차 연대 측정 또는 통계 매개변수와 함께 링 너비가 포함된 화면이 열립니다(그림 11).
- 링 표시를 변경하려면(예: 교차 데이트 중) RingIndicator를 다시 열고, 데이터를 가져오고, 수정된 데이터 및 링을 내보내고, CoreComparison 모듈(왼쪽 상단 참조)의 새로 고침 단추를 사용하여 변경 사항을 확인합니다.
- 여러 RingIndicator 인스턴스를 열어 다른 트리 링 시리즈를 변경하고 여러 화면 모니터를 사용하여 이 작업을 수행합니다.
- GLK 및 CORR 메뉴(그림 11)에서 그림 임계값 설정, GLK 값을 스프레드시트로 내보내고 순위를 매기는 등 GLK와 관련된 일련의 작업을 수행합니다.
- 아래 설명된 대로 CoreComparison에서 TRW 값을 가져옵니다.
- CoreComparison의 플로팅 및 내보내기 함수를 사용하여 곡선 사이의 오프셋을 변경합니다(값이 클수록 오프셋이 작아짐). 링 너비 플로팅 및 내보내기를 선택하여 플롯에서 TRW 데이터를 시각화>.
- 플로팅 및 내보내기(Plotting and Exporting) > RW 데이터 내보내기(Export RW Data)를 클릭하여 TRW 데이터를 내보냅니다. 링 너비를 스프레드시트 형식 또는 Tucson 형식으로 내보낼 수 있습니다.
- 아래 설명된 대로 PatternMatching 모듈에서 밀도 프로필을 가져옵니다.
- 스프레드시트에서 밀도 프로파일을 얻으려면 PatternMatching 모듈로 이동하여 프로파일을 로드한 후 기타 메뉴에서 플로팅 > 수정된 밀도 프로파일 내보내기를 선택합니다.
- 프로필을 일괄 처리하거나 다른 방법을 사용하여 데이터를 평가하려면 표 1 의 .txt 파일을 직접 사용하십시오(4.3.4.11단계 참조).
- 아래 설명된 대로 PatternMatching 모듈에서 MXD, MND 및 기타 밀도 값을 가져옵니다.
- 나이테당 평균 밀도, MXD, MND 및 사분위수 데이터를 얻으려면 기타 플로팅 > 클러스터형 데이터 내보내기를 사용하십시오. 스프레드시트가 생성되고 TIFF 파일과 동일한 폴더에서 찾을 수 있습니다.
- 스프레드시트의 탭은 표 2에 자세히 설명되어 있습니다. 추가 분석을 위해 이러한 트리 링 변수를 Rstudio 또는 다른 소프트웨어로 내보냅니다.
- 교차 연대 측정 또는 링 너비 패턴을 다른 시리즈와 일치시키려면 다음 단계를 수행하십시오.

그림 6. 회색 값에서 목재 밀도 값을 얻습니다. 이미지의 회색 값을 표준 물질로 보정을 통해 실제 목재 밀도 추정치로 변환합니다. (A) 샘플 홀더 1, 60μm 해상도에서 공기 기준, 흰색 기준 및 코어를 보여줍니다. (B) 20 μm에서 시료 홀더, 공기, 기준 및 코어도 표시됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 7. 3D 코어 볼륨의 전처리 단계. 시각화 전에 3D 코어 볼륨의 전처리 단계를 수행하고 나이테를 표시합니다. (A) 기울기(축) 보정, (B) 접선 보정, 섬유 방향을 나타내는 회색 막대, (C) 우디 복셀만 있는 볼륨을 얻기 위해 코어 볼륨을 자릅니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 8. 코어의 스크린샷. RingIndicator 도구 상자에 열린 코어(접선 폭 약 3mm, 해상도 μm)의 스크린샷. 위쪽 창은 횡단 보기이고 아래쪽 창은 방사형 보기입니다. 녹색 막대는 구조 표시(이 경우 링 경계)를 나타내고 빨간색 선은 밀도 프로파일입니다. 노란색 숫자는 달력 연도를 나타내고 파란색 숫자는 일반 링 번호(첫 번째 표시부터 계산)를 나타냅니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
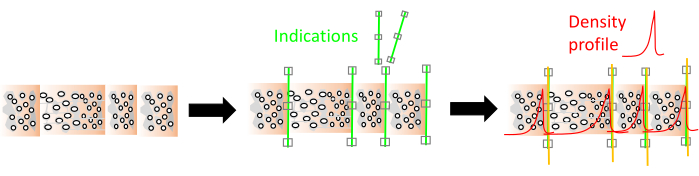
그림 9. RingIndicator 모듈의 링 표시 및 밀도 프로파일 시각화. 녹색 선은 표시이고 빨간색 선은 목재 밀도 프로필입니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
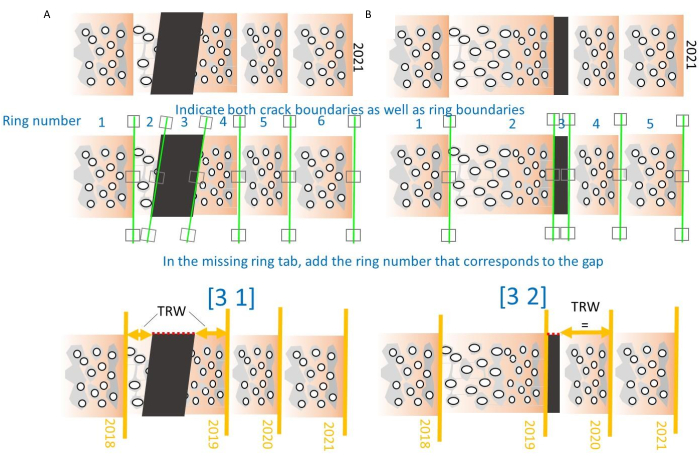
그림 10. 코어의 균열을 처리하는 방법. (A) 링 중간에 균열이 발생하면 일반 링 번호(속부터 시작)가 갭으로 표시되고 TRW는 두 링 부품의 너비를 합산하여 계산됩니다. 매개변수는 3(링의 수)과 1(사례 1: 링의 중간 균열)31입니다. (B) 링 경계에서 균열이 발생하면 간격이 TRW 계산에서 생략됩니다. 매개변수는 3(링의 수)과 2(사례 2: 링 경계의 균열)31입니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
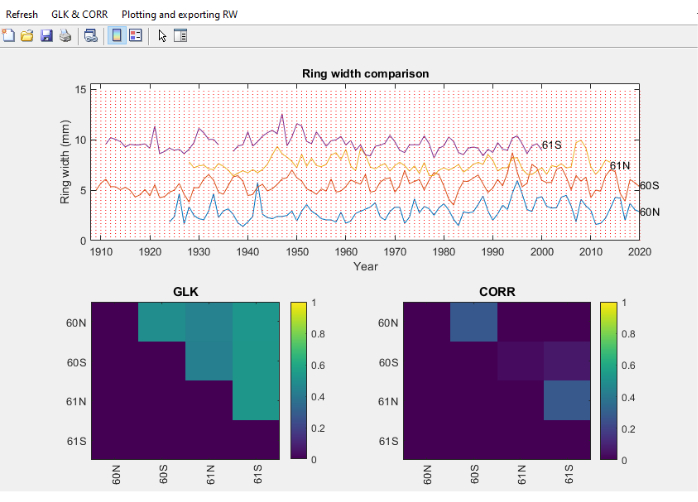
그림 11. 코어 비교 모듈의 스크린샷. Core Comparison 모듈의 스크린샷으로, 링 너비 시리즈가 시각적으로 쉽게 비교할 수 있도록 세로로 분포되어 있습니다. 위쪽 창에는 Fagus sylvatica의 4개 코어의 링 너비가 표시되고, 왼쪽 하단 창에는 GLK(Gleichlaüfigkeit)가 표시되고, 오른쪽 하단 창에는 Spearman 상관 계수가 표시됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
| 파일 이름 | 설명 | ||
| SAMPLENAME_density.txt | 이미지의 전체 길이에 대해 보정되지 않은 밀도 값으로, 링 및 섬유 각도에 대해 보정되지 않습니다. | ||
| SAMPLENAME _density_corr.txt | cf. 이전 txt이지만 수정된 밀도 값이 있는 경우 | ||
| SAMPLENAME _ring-and-fibre.txt | 링 및 섬유 표시 위치 및 각도 | ||
| SAMPLENAME _zpos.txt | 나이테 경계의 코어의 위치, 나이테 및 섬유 보정 없음 | ||
| SAMPLENAME _zpos.corr.txt | IDEM을 ZPO로 사용하지만 링 및 파이버 각도에 대해 수정되었습니다. | ||
| SAMPLENAME _ringwidth.txt | 링과 섬유 각도를 고려한 계산된 링 너비 | ||
표 1. RingIndicator에 의해 생성된 텍스트 파일. 링을 표시하고 RingIndicator에서 밀도 프로파일을 내보낸 후 생성되는 텍스트 파일 목록입니다. CoreComparison 모듈에서 열리려면 .tiff 파일과 동일한 폴더에 있어야 합니다.
| 나이테 변수 | 설명 | ||
| 평균 밀도 | Mean Density per Tree Ring (나이테당 평균 밀도) | ||
| 최대 밀도 절반 기반 | MXD는 전년도의 고밀도 값이 포함되지 않도록 트리 나이테의 두 번째 절반만을 기준으로 합니다. | ||
| 최소 밀도 | 나이테당 최소 밀도 | ||
| 1분기-4분기 | intra-annual ring profile의 각 사분위수에 대한 평균 및 최대값 | ||
표 2. 스프레드시트 세부 정보. export clustered data라는 스프레드시트로 내보낸 트리 링 변수입니다.
Access restricted. Please log in or start a trial to view this content.
결과
목표가 많은 샘플의 바이오매스 추정 또는 나무 성장 증가, 즉 고리 간 스케일(그림 1)인 경우, 샘플 홀더 1(그림 5)을 사용하여 샘플을 스캔하여 밀도 프로필(단계 5.4.3 참조) 및 나무 성장 추정치(예: TRW가 크고 빠르게 자라는 나무의 경우)를 얻어 더 거친 분해능을 허용합니다. 그림 12 는 콩고 분지의 종인 T. superba의 속-껍질 ...
Access restricted. Please log in or start a trial to view this content.
토론
프로토콜 내의 중요한 단계
프로토콜 내의 중요한 단계에는 비트 앤 피스를 방지하기 위해 고품질 증분 코어(1.1단계 및39 참조)를 얻기 위한 증분 보어의 적절한 처리가 포함됩니다. 다음으로, 샘플 홀더에 삽입하고(그림 5,21 참조) 적절한 수지 추출(50) 및 가능한 미래 분석을 위해 코어를 장착하지 않은 상태로 두는 것?...
Access restricted. Please log in or start a trial to view this content.
공개
저자는 공개할 이해 상충이 없습니다.
감사의 말
세 명의 익명 검토자의 피드백과 제안에 감사드립니다. 이 연구는 JVdB를 위한 BOF 특별 연구 기금(BOF Starting Grant BOF. STG.2018.0007.01), UGCT의 전문지식센터(BOF. EXP.2017.0007) 및 핵심설비(BOF. COR.2022.008), 저자들은 또한 플랑드르 연구 재단(G019521N 및 G009720N)과 UGent Industrial Research Fund(IOF)가 보조금 IOF를 통해 인프라에 대한 재정적 지원을 제공한 것에 대해 감사를 표합니다. APP.2021.0005 (프로젝트 FaCT F2021/IOF-Equip/021).
Access restricted. Please log in or start a trial to view this content.
자료
| Name | Company | Catalog Number | Comments |
| 6 mm paper straws | http://artstraws.com/education/product/artstraws-thick-asst-cols/ | Coring | |
| Aluminium core holders | |||
| ASTM standard ASTM D 1107 – 96 | |||
| Cardboard postal tubes | https://www.rajapack.co.uk/envelopes-mailing-bags/postal-tubes/1-5-2mm-brown-cardboard-postal-tubes_PDT05623.html | ||
| Column drill | |||
| Computer hardware for reconstruction and analysis | X-ray CT scanning | ||
| Cooling | |||
| Drying oven | |||
| Ethanol | |||
| Flask for under soxhlet (2000 ml) | |||
| Floral foam | https://www.oasisfloral.eu/ | Sample holder type 1 | |
| Glass beads to fill void volume of Soxhlet to save solvent | |||
| Glue | |||
| Hot water bath | https://www.memmert.com/products/water-baths/water-bath/#!filters=%7B%7D | Soxhlet extraction | |
| Increment borer | https://haglofsweden.com/project/increment-borers/ | ||
| Plastic cylinder | Moonen et al. 2022 | Sample holder type 2 | |
| Plastic cylinders | |||
| Reservoir | |||
| Tailored soxhlet apparatus | |||
| Toluene | |||
| Water pump | |||
| X-ray CT scanner |
참고문헌
- Björklund, J., et al. The utility of bulk wood density for tree-ring research. Dendrochronologia. 69 (September), 125880(2021).
- Lachenbruch, B., Mcculloh, K. A. Traits, properties, and performance: How woody plants combine hydraulic and mechanical functions in a cell, tissue, or whole plant. New Phytologist. 204 (4), 747-764 (2014).
- Baker, T. R., et al. Variation in wood density determines spatial patterns in Amazonian forest biomass. Global Change Biology. 10 (5), 545-562 (2004).
- Bastin, J. F., et al. Wood specific gravity variations and biomass of central African tree species: The simple choice of the outer wood. PLoS ONE. 10 (11), 1-16 (2015).
- Chave, J., et al. Improved allometric models to estimate the aboveground biomass of tropical trees. Global Change Biology. 20 (10), 3177-3190 (2014).
- Chave, J., et al. Towards a worldwide wood economics spectrum. Ecology letters. 12, 351-366 (2009).
- Plourde, B. T., Boukili, V. K., Chazdon, R. L. Radial changes in wood specific gravity of tropical trees: inter- and intraspecific variation during secondary succession. Functional Ecology. 29 (1), 111-120 (2015).
- Decoux, V., Varcin, É, Leban, J. -M. Relationships between the intra-ring wood density assessed by X-ray densitometry and optical anatomical measurements in conifers. Consequences for the cell wall apparent density determination. Annals of Forest Science. 61, 251-262 (2004).
- Rathgeber, C. B. K., Decoux, V., Leban, J. M. Linking intra-tree-ring wood density variations and tracheid anatomical characteristics in Douglas fir (Pseudotsuga menziesii (Mirb.) Franco). Annals of Forest Science. 63 (7), 699-706 (2006).
- Ziemińska, K., Butler, D. W., Gleason, S. M., Wright, I. J., Westoby, M. Fibre wall and lumen fractions drive wood density variation across 24 Australian angiosperms. AoB PLANTS. 5, plt046(2013).
- Ziemińska, K., Westoby, M., Wright, I. J. Broad anatomical variation within a narrow wood density range - A study of twig wood across 69 Australian angiosperms. PLoS ONE. 10 (4), 1-25 (2015).
- De Mil, T., et al. Wood density profiles and their corresponding tissue fractions in tropical angiosperm trees. Forests. 9 (12), 763(2018).
- Björklund, J., et al. Scientific Merits and Analytical Challenges of Tree-Ring Densitometry. Reviews of Geophysics. 57 (4), 1224-1264 (2019).
- Maniatis, D., Saint André, L., Temmerman, M., Malhi, Y., Beeckman, H. The potential of using xylarium wood samples for wood density calculations: A comparison of approaches for volume measurement. IForest. 4 (1), 150-159 (2011).
- Lehnebach, R., et al. Wood density variations of legume trees in French Guiana along the shade tolerance continuum: Heartwood effects on radial patterns and gradients. Forests. 10 (2), 1-22 (2019).
- Longuetaud, F., et al. Within-stem maps of wood density and water content for characterization of species: a case study on three hardwood and two softwood species. Annals of Forest Science. 73 (3), 601-614 (2016).
- Steffenrem, A., Kvaalen, H., Dalen, K. S., Høibø, O. A. A high-throughput X-ray-based method for measurements of relative wood density from unprepared increment cores from Picea abies. Scandinavian Journal of Forest Research. 29 (5), 506-514 (2014).
- Vannoppen, A., et al. Dendrochronologia Using X-ray CT based tree-ring width data for tree growth trend analysis. Dendrochronologia. 44, 66-75 (2017).
- Maes, S. L., et al. Evaluating the robustness of three ring-width measurement methods for growth release reconstruction. Dendrochronologia. 46 (May), 67-76 (2017).
- Van Den Berge, S., et al. Biomass increment and carbon sequestration in hedgerow-grown trees. Dendrochronologia. 70 (September), 125894(2021).
- De Mil, T., Vannoppen, A., Beeckman, H., Van Acker, J., Van den Bulcke, J. A field-to-desktop toolchain for X-ray CT densitometry enables tree ring analysis. Annals of Botany. 117 (7), 1187-1196 (2016).
- St. George, S., Esper, J. Concord and discord among Northern Hemisphere paleotemperature reconstructions from tree rings. Quaternary Science Reviews. 203, 278-281 (2018).
- Schweingruber, F., Fritts, H., Braker, O., Drew, L., Schar, E. The X-ray technique as applied to dendroclimatology. Tree-Ring Bulletin. 38, 61-91 (1978).
- Björklund, J., et al. Cell size and wall dimensions drive distinct variability of earlywood and latewood density in Northern Hemisphere conifers. New Phytologist. 216 (3), 728-740 (2017).
- Polge, H. Applications dans les domaines Technologique et Physiologique. Annales des sciences forestières. 23 (1), 215(1966).
- De Mil, T., et al. A lonely dot on the map: Exploring the climate signal in tree-ring density and stable isotopes of clanwilliam cedar, South Africa. Dendrochronologia. 69 (November 2020), 125879(2021).
- Jansen, S., et al. Preparation of wood specimens for transmitted light microscopy and scanning electron microscopy. Belgian Journal of Botany. 131 (1), 41-49 (1998).
- Gärtner, H., Nievergelt, D. The core-microtome: A new tool for surface preparation on cores and time series analysis of varying cell parameters. Dendrochronologia. 28 (2), 85-92 (2010).
- von Arx, G., Crivellaro, A., Prendin, A. L., Čufar, K., Carrer, M. Quantitative Wood Anatomy-Practical Guidelines. Frontiers in Plant Science. 7 (June), 781(2016).
- Seftigen, K., et al. Prospects for dendroanatomy in paleoclimatology -- a case study on Picea engelmannii from the Canadian Rockies. Climate of the Past. 18 (5), 1151-1168 (2022).
- Castagneri, D., Regev, L., Boaretto, E., Carrer, M. Xylem anatomical traits reveal different strategies of two Mediterranean oaks to cope with drought and warming. Environmental and Experimental Botany. 133 (October), 128-138 (2017).
- Brodersen, C. R., et al. Automated analysis of three-dimensional xylem networks using high-resolution computed tomography. The New phytologist. 191 (4), 1168-1179 (2011).
- Van den Bulcke, J., et al. X-ray tomography as a tool for detailed anatomical analysis. Annals of Forest Science. 66 (5), 508(2009).
- Williamson, G. B., Wiemann, M. C. Measuring wood specific gravity...Correctly. American journal of botany. 97 (3), 519-524 (2010).
- Masschaele, B., et al. HECTOR: A 240kV micro-CT setup optimized for research. Journal of Physics: Conference Series. 463 (1), 012012(2013).
- Kak, A. C., Slaney, M. Principles of Computerized Tomographic Imaging. , Society for Industrial and Applied Mathematics. (2001).
- Van Den Bulcke, J., et al. Advanced X-ray CT scanning can boost tree ring research for earth system sciences. Annals of Botany. 124 (5), 837-847 (2019).
- Zwanenburg, E. A., Williams, M. A., Warnett, J. M. Review of high-speed imaging with lab-based x-ray computed tomography. Measurement Science and Technology. 33 (1), 012003(2022).
- Gärtner, H., Cherubini, P., Schneider, L., Lucchinetti, S. Advanced Workflow for Taking High-Quality Increment Cores - New Techniques and Devices. JoVE. (193), e64747(2023).
- Schweingruber, F. H., Fritts, H. C., Bräker, O. U. The X-ray technique as applied to dendroclimatology. Tree-Ring Bulletin. 38, (1978).
- Grabner, M., Wimmer, R., Gierlinger, N., Evans, R., Downes, G. M. Heartwood extractives in larch and effects on X-ray densitometry. Canadian Journal of Forest Research. 35 (12), 2781-2786 (2005).
- Schneider, C. A., Rasband, W. S., Eliceiri, K. W. NIH Image to ImageJ: 25 years of image analysis. Nature Methods. 9 (7), 671-675 (2012).
- Arganda-Carreras, I., et al. Trainable Weka Segmentation: A machine learning tool for microscopy pixel classification. Bioinformatics. 33 (15), 2424-2426 (2017).
- von Arx, G., Carrer, M. ROXAS - A new tool to build centuries-long tracheid-lumen chronologies in conifers. Dendrochronologia. 32 (3), 290-293 (2014).
- Koubaa, A., Zhang, S. Y. T., Makni, S. Defining the transition from earlywood to latewood in black spruce based on intra-ring wood density profiles from X-ray densitometry. Annals of Forest Science. 59 (5-6), 511-518 (2002).
- Buras, A., Wilmking, M. Correcting the calculation of Gleichläufigkeit. Dendrochronologia. 34, 29-30 (2015).
- Bunn, A. G. Statistical and visual crossdating in R using the dplR library. Dendrochronologia. 28 (4), 251-258 (2010).
- Zang, C., Biondi, F. Treeclim: an R package for the numerical calibration of proxy-climate relationships. Ecography. (November 2014), 1-6 (2014).
- Van den Bulcke, J., et al. Nondestructive research on wooden musical instruments: From macro- to microscale imaging with lab-based X-ray CT systems. Journal of Cultural Heritage. 27, S78-S87 (2017).
- Helama, S., Vartiainen, M., Kolström, T., Meriläinen, J. Dendrochronological investigation of wood extractives. Wood Science and Technology. 44 (2), 335-351 (2010).
- Black, B. A., et al. The value of crossdating to retain high-frequency variability, climate signals, and extreme events in environmental proxies. Global Change Biology. 22 (7), 2582-2595 (2016).
- Hubau, W., et al. The persistence of carbon in the African forest understory. Nature plants. 5 (2), 133-140 (2019).
- Stoffel, M., Klinkmüller, M. 3D analysis of anatomical reactions in conifers after mechanical wounding: First qualitative insights from X-ray computed tomography. Trees - Structure and Function. 27 (6), 1805-1811 (2013).
- Van den Bulcke, J., et al. Advanced X-ray CT scanning can boost tree-ring research for earth-system sciences. Annals of Botany. , 1-11 (2019).
- Ziaco, E., Biondi, F., Heinrich, I. Wood Cellular Dendroclimatology: Testing New Proxies in Great Basin Bristlecone Pine. Frontiers in Plant Science. 7 (October), 1-13 (2016).
- De Ridder, M., et al. High-resolution proxies for wood density variations in Terminalia superba. Annals of botany. 107 (2), 293-302 (2011).
- Resente, G., et al. Repeat! Artificial Intelligence for Quantitative Wood Anatomy. Frontiers in Plant Science. 12 (November), 1-14 (2021).
Access restricted. Please log in or start a trial to view this content.
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유