JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
클린룸 환경 및 세포 치료를 위한 미생물 제어 및 모니터링 전략
요약
이 프로토콜은 클린룸 환경에서 미생물 바이오버든을 최소화하기 위한 모범 사례를 요약하고 환경 모니터링, 공정 모니터링 및 제품 멸균 테스트와 같은 전략을 포함합니다. 이는 현재 우수 조직 관행 표준 및 현재 우수 제조 관행 표준을 충족하는 데 필요한 제조 및 테스트 시설과 관련이 있습니다.
초록
강력한 가운, 세척, 환경 모니터링 및 인력 모니터링 조치를 통합하는 잘 검증되고 전체적인 프로그램은 세포 치료제 제조 제품군 및 해당 테스트 실험실에서 미생물 바이오버든을 최소화하여 시설이 통제 상태로 운영되고 있는지 확인하는 데 중요합니다. 멸균 테스트와 같은 품질 관리 조치를 통해 제품 안전을 보장하는 것은 최소 조작(섹션 361) 및 최소 조작 이상(섹션 351) 인간 세포, 조직, 세포 및 조직 기반 제품(HCT/P) 모두에 대한 규제 요구 사항입니다. 이 비디오에서는 미국 약전(USP<71>) 및 미국 국립보건원(NIH) 대체 멸균 테스트 방법에서 제공하는 가운, 세척, 재료 스테이징, 환경 모니터링, 공정 모니터링 및 직접 접종을 사용한 제품 멸균 테스트를 포함하여 클린룸 환경에서 작동하기 위한 최상의 무균 관행을 개발하고 통합하는 방법에 대한 단계별 가이드를 제공합니다. 이 프로토콜은 현행 우수 조직 관리 기준(cGTP) 및 현행 우수 제조 관리 기준(cGMP)을 충족할 것으로 예상되는 시설에 대한 참조 가이드입니다.
서문
환경 모니터링(EM), 공정 모니터링 및 제품 멸균 테스트를 통해 강력한 미생물 모니터링 프로그램을 구현하는 것은 세포 치료 실험실에서 현행 우수 조직 관리 기준(cGTP) 및 현행 우수 제조 관리 기준(cGMP)에 대한 규제 요건입니다1. 또한 미국 식품의약국(FDA)은 제품의 품질 관리(QC) 테스트를 수행하는 실험실에서도 무균 충전 작업에 사용되는 것과 유사한 시설 및 관리 기능을 사용해야 한다고 예상합니다2.
이 프로토콜에는 네 가지 주요 섹션이 있습니다 : 1) 직원 가운, 청소 및 재료 스테이징을 포함한 무균 관행; 2) 생존 가능한 공기 및 표면 배양 및 생존 불가능한 입자 공기 모니터링을 포함한 EM; 3) 침전 플레이트 및 장갑을 낀 손가락 끝 샘플링을 포함한 공정 모니터링; 4) 미국 약전(USP) <71> 방법3 또는 NIH 대체 무균 테스트 방법4를 통한 제품 무균 테스트. 이러한 조치를 함께 사용하면 시설이 통제 상태를 유지하도록 하는 효과적인 방법이 될 수 있습니다.
여기에 설명된 기술은 새로운 것이 아닙니다. 그러나 규제 기관 및 전문 기관의 현재 표준은 세부 사항이 부족하여 미생물 모니터링이 부재하거나 표준화되지 않은 관행을 구현하고 있으며, 특히 현장 제조 및 제품 멸균 테스트가 빠른 속도로 부상하고 있는 학술 센터에서 발생합니다 1,5,6 . 이 프로토콜은 최종 사용자 검증 및 위험 평가와 함께 사용할 때 규제 요구 사항을 충족하는 미생물 모니터링 및 제어 프로그램을 만들기 위한 가이드로 사용할 수 있습니다.
프로토콜
1. 무균 관행
- 클린룸 공간을 위한 직원 가운
참고: 이 절차는 분류되지 않은 공간에서 가운을 처음 착용한 후 국제 표준화 기구(ISO) 8 영역에 진입한 다음 ISO7 영역에 진입하는 것을 기반으로 합니다. 이 절차는 기존 공간을 클린룸 기능으로 전환하려는 실험실과 관련이 있습니다. 이상적으로, 모든 초기 가운은 ISO8 분류 공간 (분류되지 않은 공간이 아님)에서 발생합니다.- 느슨한 머리카락을 고정하십시오. 손을 씻고 스크럽으로 갈아입습니다(긴팔 스크럽 상의와 전신 스크럽 바지가 바람직함). 신발 커버를 씌운 클린룸 신발로 갈아입습니다.
- 처음에는 알코올 성분의 손 소독제를 사용하여 손을 소독한 다음 다음 각 단계 사이에 다시 소독합니다: 비멸균 장갑을 착용한 다음 해당되는 경우 수염 덮개(눈에 보이는 수염의 양에 대하여)를 착용합니다. 비멸균 부팡을 착용하고 긴팔 스크럽 탑을 사용하지 않은 경우 비멸균 슬리브로 팔뚝을 덮습니다.
- 신발 커버를 제거한 후 ISO8 대기실 문 앞의 끈적끈적한 매트를 각 발로 밟아 신발 커버를 제거합니다. 입장하기 전에 발 전체가 끈적끈적한 매트에 닿도록 하십시오. 신발 커버를 버리고 장갑과 도어 핸들을 70% 멸균 이소프로필 알코올(sIPA)로 오염을 제거합니다. ISO8 대기실에 입장하십시오.
- 멸균 후드, 멸균 안면 마스크, 멸균 작업복, 멸균 부츠 커버 및 보안경을 준비하십시오. 70% sIPA로 장갑의 오염을 제거합니다. 보안경을 착용하고 stage 1.5단계에 따라 재료를 깨끗한 표면에 놓습니다.
- 전용 클린룸 신발 위에 새 비멸균 신발 커버를 착용하고 보조 대기실 앞의 끈적끈적한 매트를 밟습니다. 각 발 전체가 끈적끈적한 매트에 닿는지 확인하십시오. 70% sIPA로 장갑의 오염을 제거합니다. 무대 가운 용품을 챙기고 경계선의 더러운 쪽에 남아 있는 보조 ISO7 대기실로 들어갑니다.
- 멸균 후드와 멸균 작업복을 착용하고 가운 재료의 내부만 만지고 후드의 목이 작업복 안에 끼워져 완전한 밀봉을 만듭니다. 보조 멸균 부츠 커버를 착용하십시오. 각 착용 단계 사이에 70% sIPA로 장갑의 오염을 제거합니다.
- 가운이 적절하게 착용되었는지 확인하고 70% sIPA로 장갑의 오염을 제거한 다음 ISO7 공간에 들어갑니다.
알림: 가운 재료의 무결성을 주기적으로 검사하십시오. 손상된 경우 즉시 클린룸을 종료하고 가운을 다시 입으십시오.
- 생물 안전 작업대(BSC) 착용
- 위의 1.1 단계에 따라 가운을 입고 이러한 추가 관행을 수행하십시오.
- 멸균 장갑과 멸균 슬리브를 모으십시오. 1.4단계에 따라 BSC를 청소하고 stag1.5단계에 따라 재료를 사용합니다. 70% sIPA로 장갑의 오염을 제거합니다.
- 작업복 위에 멸균 슬리브를 무균 상태로 착용하고 있는 경우 엄지손가락 고리를 사용합니다. 기존 장갑 위에 멸균 장갑을 착용하여 장갑의 커프가 멸균 슬리브 위로 확장되도록 합니다. 각 단계 사이에 70% sIPA로 장갑의 오염을 제거합니다. BSC를 입력합니다.
알림: 가운 재료의 무결성을 주기적으로 검사하십시오. 손상된 경우 즉시 클린룸을 종료하고 가운을 다시 입으십시오.
- 가운 재료의 탈의
- BSC를 종료하고 상단 장갑과 멸균 슬리브를 조심스럽게 제거합니다. 70% sIPA로 내부 장갑의 오염을 제거합니다.
- 보조 대기실로 들어간 다음 기본 대기실로 들어가 각 단계 사이에 문이 완전히 닫힐 때까지 기다립니다. 외부 멸균 부트 커버, 작업복, 후드 및 안면 마스크의 순서로 재료를 제거합니다.
- 주 대기실을 나가 비멸균 가운을 벗습니다.
참고: 분류되지 않은 공간에서의 제거 순서는 중요하지 않습니다. 그러나 내부 비멸균 신발 커버는 분류되지 않은 공간에 보관하기 위해 클린룸 신발에 남아 있어야 합니다. - 알코올 성분의 손 소독제를 사용하여 손을 소독하고 길거리 옷으로 돌아갑니다.
- 클린룸 표면 및 BSC 청소
- 휴대용 청소용 걸레를 조립하거나 깨끗한 보푸라기가 적은 물티슈를 구하십시오. 보푸라기가 적은 물티슈를 사용하는 경우 물티슈를 4등분하고 각 표면 사이를 회전합니다. 걸레 헤드나 보푸라기가 적은 물티슈를 승인된 소독제로 적십니다.
- 뒤에서 앞으로(또는 위에서 아래로) 작업하면서 HEPA 디퓨저 그릴(BSC 상단), BSC 후면 벽, BSC 양쪽 벽, 새시 및 작업 표면의 순서로 겹치는 물티슈를 사용하여 BSC를 청소합니다. 마지막으로 70% sIPA를 사용하여 BSC의 새시를 닦아 잔류 소독제를 제거합니다. 일반적인 BSC 청소 패턴은 그림 1 을 참조하십시오.
- 기밀 환경으로 재료 및 장비 준비
- 미생물의 이동을 최소화하기 위해 분류되지 않거나 더 낮은 분류 영역에서 더 높은 분류 영역으로(예: ISO8에서 ISO7 공간으로) 이동해야 하는 모든 물질의 오염을 제거(즉, 단계화)합니다. 동일한 ISO 분류 수준의 영역 간에 재료를 전송할 때는 스테이징이 필요하지 않습니다.
알림: 재료가 최종적으로 멸균되어 여러 개의 백에 들어 있는 경우 외부 백/파우치를 제거하고 재료를 분류된 공간으로 옮깁니다. 내부 가방/파우치를 닦을 필요가 없습니다. - 보푸라기가 적은 물티슈를 구하고 물티슈가 더러워지면 물티슈를 4등분하여 깨끗한 면으로 돌립니다. 70% sIPA 또는 승인된 소독제로 물티슈를 포화시킵니다.
- 겹치는 물티슈를 사용하여 재료/장비의 외부를 닦습니다. 분리형 패키지 씰 내부와 장비의 구석/움푹 들어간 곳 및 기타 불규칙한 모양의 소모품을 포함하여 품목의 모든 영역이 닦여졌는지 확인하십시오. 바퀴가 달린 장비의 경우 s에서 전체 바퀴가 닦여졌는지 확인하십시오.tag전자 과정(바퀴가 회전할 수 있도록 장비를 부드럽게 기울여야 할 수도 있음).
- 미생물의 이동을 최소화하기 위해 분류되지 않거나 더 낮은 분류 영역에서 더 높은 분류 영역으로(예: ISO8에서 ISO7 공간으로) 이동해야 하는 모든 물질의 오염을 제거(즉, 단계화)합니다. 동일한 ISO 분류 수준의 영역 간에 재료를 전송할 때는 스테이징이 필요하지 않습니다.

그림 1: BSC 세척 패턴의 예. 뒤에서 앞으로(또는 위에서 아래로) 작업하면서 HEPA 디퓨저 그릴(BSC 상단), BSC 후면 벽, BSC 양쪽 벽, 새시 및 작업 표면의 순서로 겹치는 물티슈를 사용하여 BSC를 청소합니다. 마지막으로 70% sIPA를 사용하여 BSC의 새시를 닦아 잔류 소독제를 제거합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
2. 환경 모니터링(EM)
- 실행 가능한 표면 샘플링
- 단계 1.5에 따라 샘플링 세션에 필요한 재료를 준비하고 섹션 1에 따라 분류된 공간으로 가운을 입습니다.
알림: 표면 샘플링은 공기 샘플링 전에 수행해야 합니다.amp지정된 위치에서. 여러 플레이트를 사용하여 영역을 표면 샘플링하는 경우 정확히 동일한 위치를 샘플링하지 마십시오. 접촉 플레이트를 사용하여 평평한 표면을 샘플링하여 완전한 접촉을 보장하고 한천의 잠재적인 손상을 방지하십시오. - 각 샘플링 부위에 대해 레시티나제 및 트윈(TSALT) 플레이트가 포함된 트립신 대두 한천 1개와 레시티나제 및 트윈(SABLT) 플레이트가 포함된 Sabouraud 덱스트로스 한천 1개를 수집하고 라벨을 붙입니다. 한 손으로 접시의 바닥을 잡고 뚜껑을 무균 적으로 제거하고 돌출 된 한천 표면을 만지지 않도록주의하십시오.
- 돌출된 한천을 샘플링되는 표면에 대고 전체 표면이 접촉되도록 하고 플레이트에 확고한 압력을 가합니다. 플레이트를 최소 5초 동안 표면에 접촉하도록 두십시오.
- 중요: 샘플링되는 표면 위로 플레이트를 측면으로 이동하지 마십시오., 이는 표면적에 잠재적인 성장을 퍼뜨려 개별 콜로니의 분해를 어렵게 만들 수 있기 때문입니다. samp링 중에 접촉판에 과도한 힘을 가하지 마십시오.amp한천 표면에 균열이 생길 수 있습니다.
- 돌출된 한천 표면을 만지지 않도록 주의하면서 덮개를 무균적으로 교체하십시오. 접촉판에 잠금 시스템이 있는 경우 덮개를 제자리에 잠급니다. 70% sIPA로 샘플링 영역을 청소하여 표면에서 잔류 매체를 제거합니다. 플레이트를 느슨하게 백에 넣고, 표 1에 기재된 바와 같이 배양물을 배양한다. TSALT 표면 샘플링 플레이트에서 두 개의 뚜렷한 콜로니 형태를 가진 세 개의 콜로니 형성 단위(CFU)의 성장을 보여주는 대표적인 이미지가 그림 2에 나와 있습니다. 그림 3은 시료 채취 중 열악한 무균 기술로 인한 플레이트 가장자리의 성장으로 인한 TSALT 플레이트의 오염을 보여줍니다.
- 단계 1.5에 따라 샘플링 세션에 필요한 재료를 준비하고 섹션 1에 따라 분류된 공간으로 가운을 입습니다.
- 생존 가능한 공기 샘플링
- 단계 1.5에 따라 샘플링 세션에 필요한 재료를 준비하고 섹션 1에 따라 분류된 공간으로 가운을 입습니다.
- 각 샘플링 부위에 대해 트립신 대두 한천(TSA) 플레이트 1개와 Sabouraud 포도당 한천(SAB) 플레이트 1개를 수집하고 라벨을 붙입니다. 공기 준비amp헤드가 오염되지 않도록 바깥쪽 가장자리만 잡고 s를 무균적으로 제거합니다.amp헤드 헤드.
- 샘플링 헤드를 한 손으로 잡고 샘플을 통해 매체를 플레이트 홀더에 무균적으로 놓습니다. 다른 갈래보다 긴 갈래가 있는 경우 먼저 긴 갈래에 매체를 삽입한 다음 판을 나머지 갈래로 밀어 넣어 판을 고정합니다.
- 플레이트 뚜껑을 무균 상태로 제거하고 샘플링이 완료될 때까지 방해가 되지 않는 깨끗한 표면에 놓습니다. 샘플링 헤드를 무균적으로 교체하고 고정하고 헤드가 오염되지 않도록 바깥쪽 가장자리만 잡습니다. 다중 헤드 에어 샘플을 사용하는 경우 나머지 매체에 대해 2.2.2-2.2.4단계를 반복합니다.
- 공기 배치amp링 s가 s에 있는 samp링 위치amp링 헤드는 공기 흐름 이동의 주요 방향을 향합니다. 생존할 수 없는 공기 샘플러의 배기(샘플링 동시에)가 생존 가능한 샘플러를 방해하지 않는지 확인하십시오. 공기 샘플러가 검증된 설정으로 설정되어 있는지 확인하고 샘플링 주기를 시작합니다.
- 샘플링 주기가 완료되면 s에서 s를 무균적으로 제거합니다.amp헤드가 오염되지 않도록 바깥쪽 가장자리만 잡고 samp러에서 헤드. 한 손으로 샘플링 헤드를 잡고 한천 플레이트의 뚜껑을 무균 상태로 교체합니다. 플레이트 홀더에서 플레이트를 제거합니다. 플레이트를 느슨하게 백에 넣고, 표 1에 기재된 바와 같이 배양물을 배양한다.
- 샘플링 헤드와 플레이트 홀더 주변을 70% sIPA로 소독합니다. 샘플링 헤드를 무균 상태로 고정하고 바깥쪽 가장자리만 잡습니다. 다중 헤드 공기 샘플러를 사용하는 경우 나머지 매체에 대해 2.2.6단계와 2.2.7단계를 반복합니다.
참고: 그림 4는 오염된 샘플링 헤드로 인한 성장이 있는 TSA 활성 공기 샘플링 배양을 보여줍니다. 반대로, 그림 5는 성장이 없는 TSA 활성 공기 샘플링 배양을 나타냅니다. 샘플링 헤드의 공기 충격 움푹 들어간 곳을 이미지에서 볼 수 있습니다.
- 실행 불가능한 샘플링
- 샘플링 전에 레이저 입자 계수기에서 영점 확인을 수행하십시오.amp매일 사용하는 활동. 등속성 헤드를 s에 부착amp입자 계수기의 링 포트에 직접 또는 샘플링 위치에 필요한 길이의 튜브에 부착합니다.
- 튜빙을 적용하는 경우 >1m 길이의 튜빙은 ≥1μm의 입자를 열거하는 데 문제를 일으킬 수 있고 튜브가 불필요하게 구부러질 수 있으므로 짧은 길이를 사용하십시오. 파티클 카운터가 검증된 설정으로 설정되어 있는지 확인합니다. 샘플링 중 공기 흐름 중단을 방지하기 위해 샘플링 영역을 빠져나갈 수 있도록 약 30초의 지연을 설정하는 것이 좋습니다.
- 레이저 입자 계수기의 등속성 헤드를 s에 배치amp등속성 헤드가 공기 흐름 이동의 주요 방향을 향하도록 합니다. 실행 가능한 공기 샘플러의 배기(샘플링 동시에)가 실행 불가능한 샘플러를 방해하지 않는지 확인하십시오. 공기 흐름이 단방향이 아니거나 공기 흐름 패턴을 알 수 없는 영역의 경우 등속성 헤드가 수직으로 위쪽을 향하도록 합니다.
알림: 회전 소독제 또는 70% sIPA가 공기 근처에서 에어로졸화된 경우ampler, s를 시작하기 전에 최소 5분 정도 기다리십시오.amp링 주기. - 샘플링 사이클을 시작하고 공기 흐름을 방해하지 않도록 샘플링 영역을 천천히 종료합니다.
중요 : 공기 근처에서 액체를 에어로졸화하지 마십시오.amp링 주기 동안 samp링 주기는 생존 불가능한 수치를 높일 수 있습니다. - 샘플링이 완료되면 레이저 입자 계수기를 검색합니다. 0.5μm의 평균 입자 수를 기록합니다. 일부 시설에서는 5.0μm를 추적하고 추세를 나타낼 수도 있습니다.
- 다음 샘플링 위치에 대해 2.3.3-2.3.6단계를 반복합니다. 방이나 BSC 사이를 이동하는 경우 생존할 수 없는 입자 샘플러의 외부를 70% sIPA 또는 승인된 소독제로 닦으십시오. 등속성 헤드 내부에 소독제가 들어오면 입자 수가 부정확해질 수 있으므로 피하십시오.
| 범주 | 미디어 | 문화 조건 | 문화 관찰 | 결과 | ||||||
| 환경 모니터링 | TSA(실행 가능한 공기) | 30 °C-35 °C, 공기, 최소 3일 동안 | 배양 종료 | 각 시설의 QA 그룹은 각 샘플링 유형 및 위치에 대한 경고 및 조치 제한을 설정해야 합니다. ISO 분류를 기반으로 한 생존 가능한 샘플에 대한 작용 한계는 PIC/S 009-16(부록) 18 및 ISO-14644-1 7을 사용하여 안내할 수 있습니다. 생존 불가능한 공기 샘플에 대한 작용 한계는 일반적으로 ISO 한계의 백분율(예: 99%)로 설정됩니다. 생존 가능한 샘플에 대한 경고 한계는 일반적으로 조치 한계 또는 ISO 한계의 백분율(예: 95%)로 설정됩니다. PDA TR-13 및 USP<1116> 및 경고 및 조치 수준 설정 및 선택된 배양 조건 검증 8,9에 대한 자세한 내용은 참조하십시오. | ||||||
| SAB (생존 가능한 공기) | 20 °C-25 °C, 공기, 최소 7일 동안 | |||||||||
| TSALT (생존 가능한 표면) | 30 °C-35 °C, 공기, 최소 3일 동안 | EM 플레이트의 대표 이미지는 그림 2, 그림 3, 그림 4 및 그림 5에 나와 있습니다. | ||||||||
| SABLT (실행 가능한 표면) | 20 °C-25 °C, 공기, 최소 7일 동안 | |||||||||
| 공정 모니터링 | TSA(침전 플레이트) | 30 °C-35 °C, 공기, 최소 3일 동안 | 참고용입니다. 실패한 제품 멸균 테스트에 대한 응답으로 OOS 조사가 진행되는 경우 유용한 정보를 제공합니다. | |||||||
| SAB(침전판) | 20 °C-25 °C, 공기, 최소 7일 동안 | 포지티브 침전판의 예는 그림 6 을 참조하십시오. | ||||||||
| 장갑을 낀 손가락 끝 샘플링 | TSALT | 30°C-35°C, 공기, 48시간 이상 일수, 이어서 20°C-25°C에서 5일 이상 19일. | GFS의 허용 기준은 PIC/S 009-16(부록) 18에 따라 <1 CFU/플레이트(즉, 성장 없음)입니다. 수용 기준은 시설 QA의 재량에 따라 수정될 수 있습니다. | |||||||
| 제품 무균 테스트 | TSB (USP<71>) | 20 °C-25 °C, 공기, 최소 14일 동안 | 잠복기 동안 주기적으로(3일, 5일, 7일, 14일) | 성장이 없습니다. | ||||||
| FTM (USP<71>) | 30 °C-35 °C, 공기, 최소 14일 동안 | |||||||||
| iFA+(NIH 방식) | 30 °C-35 °C, 공기, 최소 14일 동안 | BacT/ALERT Dual-T 기기에 의한 자동 모니터링. 곰팡이 볼에 대한 배양이 끝날 때 각 병을 육안으로 확인하는 것이 좋습니다. | 그림 8의 예를 들어 BacT/ALERT에서 자동으로 감지하지 못한 눈에 보이는 몰드 볼의 예를 볼 수 있습니다. | |||||||
| iFN+(NIH 방식) | ||||||||||
| SAB(NIH 방식) | 최소 14일 동안 20°C-25°C | 잠복기 동안 주기적으로(3일, 5일, 7일, 14일) | ||||||||
표 1: 권장 배양 조건 및 예상 결과 요약. 여기에 설명된 배양 조건은 NIH에서 사용되는 검증된 프로그램을 기반으로 한 권장 사항입니다. 각 최종 사용자는 자신의 미생물학 테스트 프로그램을 검증해야 합니다. 미생물 제어 및 테스트 전략은 시설 설계, 시설 식물상 및 제품 위험 분류를 포함한 변수에 따라 기관마다 다를 수 있습니다.
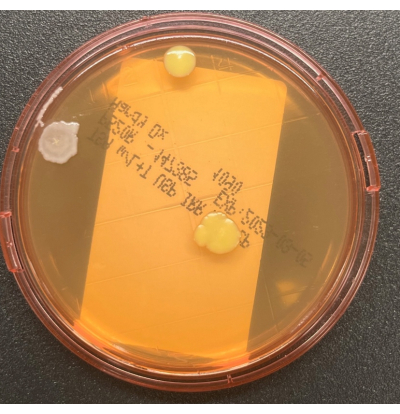
그림 2: TSALT 플레이트의 성장. 두 개의 뚜렷한 콜로니 형태의 3개의 CFU를 보여주는 TSALT 표면 샘플링 플레이트. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
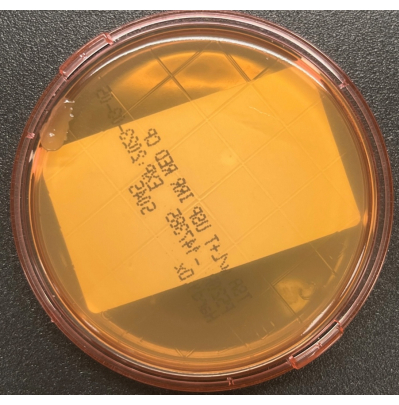
그림 3: 수집 중 TSALT 플레이트의 오염. TSALT 표면 배양은 플레이트의 가장자리에 단일 콜로니를 나타내며, 이는 샘플링 공정 동안 열악한 무균 취급을 나타냅니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 4: 오염된 공기 샘플링 헤드를 사용하여 얻은 배양물. 혼합 형태의 >100 집락 형성 단위(CFU)를 보여주는 TSA 활성 공기 샘플링 배양의 예. 성장 패턴은 샘플링 헤드의 오염을 나타냅니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 5: TSA 활성 생존 가능한 공기 플레이트에서 성장하지 않음. 배양 후 성장이 없음을 보여주는 TSA 활성 생존 가능한 공기 플레이트. 활성 공기 샘플러 헤드의 움푹 들어간 곳을 이미지에서 볼 수 있습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
3. 공정 모니터링
- 침전 플레이트(수동 공기 모니터링)
- 라벨이 붙은 TSA 및 SAB 플레이트를 작업 영역 근처에 배치하되 테스트를 방해하지 않는 영역에 배치하십시오. 샘플링 시작 시간을 기록하고 두 플레이트를 무균 상태로 열어 작업 영역에서 떨어진 BSC의 깨끗한 표면에 뚜껑을 놓습니다.
- 침전 플레이트는 한천이 마르는 것을 방지하기 위해 최대 4시간 동안 열려 있을 수 있습니다. 처리가 끝나면 플레이트의 뚜껑을 닫으십시오. 플레이트를 느슨하게 백에 넣고, 표 1에 기재된 바와 같이 배양물을 배양한다. 그림 6은 TSA 공기 침전 플레이트의 단일 콜로니 오염 물질을 보여줍니다.
- 장갑을 낀 손가락 끝 샘플링(GFS)
- 두 개의 TSALT 플레이트를 준비합니다. 한 판의 뚜껑을 무균 상태로 제거하고 샘플링 영역에서 떨어진 깨끗한 작업 표면에 놓습니다.
- 각 손가락의 패드와 한 손의 엄지손가락을 플레이트 표면에서 부드럽게 굴립니다(그림 7). 팁이 아닌 각 손가락/엄지손가락의 가장 큰 표면적을 샘플링합니다. 한천 표면에 균열이 생기지 않고 한천에 약간의 함몰부를 만들기 위해 충분한 힘을 사용하십시오.
- 무균 상태로 뚜껑을 접시에 다시 놓고 다른 손으로 3.2.2 단계를 반복합니다. 샘플링 완료시 70 % sIPA로 손을 소독하십시오. 플레이트를 느슨하게 백에 넣고, 표 1에 기재된 바와 같이 배양물을 배양한다.
그림 6: TSA 공기 침전 플레이트의 성장. BSC에서 수동 공기 공정 모니터링 중에 배양된 오염 물질의 단일 콜로니를 보여주는 TSA 공기 침전 플레이트. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 7: 장갑을 낀 손가락 끝 샘플링. 각 손가락/엄지손가락의 가장 큰 표면적(또는 패드)을 사용하여 장갑을 낀 손가락 끝 샘플을 얻는 올바른 방법이 왼쪽에 나와 있습니다. 손가락 끝만 샘플링되는 잘못된 프로세스가 오른쪽에 표시됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
4. 직접 제품 접종에 의한 무균 시험
- USP<71에 따른 직접 접종>
- 제출된 각 테스트 항목에 대해 라벨이 붙은 트립신 대두 브로스(TSB) 병 1개와 라벨이 붙은 유체 티오글리콜레이트 배지(FTM) 병 1개를 얻습니다. 테스트 세션의 경우 실행 가능한 표면 샘플링을 위한 TSALT 1개와 SABLT 1개, 침전 플레이트용 TSA 플레이트 1개와 SAB 플레이트 1개, GFS용 TSALT 플레이트 2개를 확보합니다.
- 1.2단계에 따라 BSC 내부 작업을 위한 가운. 1.4단계에 따라 BSC를 청소합니다. 스테이지 1.5에 따라 재료를 BSC에 넣습니다. 접촉 수행 samp2.1단계에 따라 중요한 작업 영역의 s, 70% sIPA로 표면을 닦아amp링 후amp링. 3.1단계에 따라 작업 영역 근처에 TSA 및 SAB 침전판을 준비합니다.
- 테스트 항목과 관련 TSB 및 FTM 병을 얻습니다. TSB 및 FTM 병에 격막이 있는 경우 각 병에서 보호 캡을 제거하고 멸균 알코올 물티슈로 격막을 닦습니다. TSB 및 FTM 병에 나사 상단이 있는 경우 병에서 캡을 풉니다(캡을 제거하지는 않음).
- 균질한 현탁액을 보장하기 위해 테스트 항목을 소용돌이. 멸균 주사기와 피하 주사 바늘(중격 캡용) 또는 피펫터(스크류 캡용)를 사용하여 검증된 부피의 테스트 항목(최대 10mL/병)으로 병에 접종합니다.
- 접종 후 멸균 알코올 물티슈로 중격을 닦고 배양 중에 공기 교환이 가능하도록 멸균 환기 장치를 삽입합니다. 스크류 탑 병의 경우 병을 닫고 배양 중에 공기 교환을 허용하기 위해 캡을 1/4에서 1/2 바퀴 느슨하게 두십시오. 해당 세션 내에서 테스트할 각 테스트 항목에 대해 4.1.3-4.1.5단계를 반복합니다.
- TSA 및 SAB 침전판을 무균 상태로 닫고 샘플링 종료 시간을 문서화합니다. 3.2단계에 따라 GFS를 수행하고 샘플링 후 70% sIPA로 장갑을 닦습니다. 플레이트를 느슨하게 백에 넣고, 표 1에 기재된 바와 같이 배양물을 배양한다.
- BSC에서 모든 테스트 재료를 옮기고 1.4단계에 따라 BSC를 청소합니다.
- NIH 대체 무균 검사 방법에 따른 직접 접종
- 각 테스트 항목에 대해 i FA+로 표시된 1개, iFN+로 표시된 1개, SAB 플레이트 1개를 얻습니다. 테스트 세션의 경우 실행 가능한 표면 샘플링을 위한 TSALT 1개와 SABLT 1개, 침전 플레이트용 TSA 플레이트 1개와 SAB 플레이트 1개, GFS용 TSALT 플레이트 2개를 확보합니다.
- 1.2단계에 따라 BSC 내부 작업을 위한 가운. 1.4단계에 따라 BSC를 청소합니다. 스테이지 1.5에 따라 재료를 BSC에 넣습니다. 접촉 수행 samp2.1단계에 따라 중요한 작업 영역의 s, 70% sIPA로 표면을 닦아amp링 후amp링. 3.1단계에 따라 작업 영역 근처에 TSA 및 SAB 침전판을 준비합니다.
- 테스트 항목과 관련 iFA+, iFN+ 및 SAB 플레이트를 얻습니다. iFA+ 및 iFN+ 병에서 보호 캡을 제거하고 멸균 알코올 물티슈로 중격을 닦습니다.
- 균질한 현탁액을 보장하기 위해 테스트 항목을 소용돌이. 멸균 주사기와 피하 주사 바늘을 사용하여 검증된 용량의 테스트 항목(최대 10mL/병)으로 병을 접종합니다. 접종 후 멸균 알코올 물티슈로 중격을 닦으십시오. 표 1에 설명된 대로 BacT/ALERT Dual-T 기기에서 병을 배양합니다.
- 피펫터를 사용하여 SAB 플레이트에 검증된 양의 테스트 항목(500μL/플레이트 이하)을 접종하고 멸균 루프를 사용하여 격리를 위한 줄무늬를 만듭니다. 배양을 위해 뒤집었을 때 샘플이 플레이트 뚜껑 위로 흘러가지 않도록 10분 동안 그대로 두십시오. 테스트 항목이 접종된 각 SAB 플레이트를 비닐 봉지에 넣고 느슨하게 묶고 표 1에 설명된 대로 배양합니다.
- TSA 및 SAB 침전판을 무균 상태로 닫고 샘플링 종료 시간을 문서화합니다. 3.2단계에 설명된 대로 GFS를 수행하고 샘플링 후 70% sIPA로 장갑을 닦습니다. 플레이트를 느슨하게 백에 넣고, 표 1에 기재된 바와 같이 배양물을 배양한다. 배양 기간이 끝날 때 BacT/ALERT 병의 육안 검사는 기기에서 감지되지 않았을 수 있는 몰드 볼을 검출하는 데 필수적입니다(그림 8).
- BSC에서 모든 테스트 재료를 옮기고 1.4단계에 따라 BSC를 청소합니다.
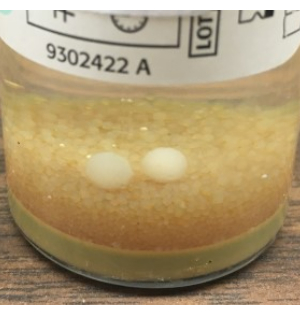
그림 8: BacT/ALERT에서 감지하지 못한 곰팡이의 성장. 육안으로 볼 수 있지만 BacT/ALERT 시스템에서 자동으로 감지하지 못하는 몰드 볼의 예. 이러한 결과를 바탕으로 모든 BacT/ALERT 병의 최종 육안 검사와 NIH 대체 멸균 테스트 방법을 사용하여 곰팡이 배양을 위한 SAB 플레이트를 추가할 것을 권장합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
결과
예상 결과는 표 1에 설명되어 있습니다. EM 데이터를 검토하고 조치, 경고 또는 ISO 한계 이탈에 대한 적절한 조사 및 대응을 통해 후속 조치를 취해야 합니다. 생존 불가능한 입자에 대해 편위가 발생하는 경우 ISO 14644-Annex A, sec A.5.57에 따라 진행해야 합니다. 이탈이 즉시 식별 가능한 비정상 발생에 기인할 수 있는 경우 원래 샘플링 결과를 문서화하고 원래 결과를 무?...
토론
이 프로토콜에는 무균 기술의 유지 관리와 클린룸 및 BSC 내의 단방향 공기 흐름을 포함하여 몇 가지 중요한 영역이 있습니다. 모범 사례에는 난기류를 최소화하기 위해 천천히 의도적으로 이동하는 것이 포함됩니다. 무균 조작은 위에서가 아니라 제품 측면에서 수행해야합니다. 폐쇄 시스템 처리 및 최종 멸균 된 원료의 사용이 권장됩니다. 중요한 영역에서 말하고 벽이나 장비에 기대는 것은 피?...
공개
저자는 이해 상충을 선언하지 않습니다.
감사의 말
이 연구는 국립 보건원 임상 센터 (National Institutes of Health Clinical Center)의 교내 연구 프로그램 (Intramural Research Program)의 지원을 받았다. 내용은 전적으로 저자의 책임이며 국립 보건원의 공식 견해를 나타내지 않습니다.
자료
| Name | Company | Catalog Number | Comments |
| 20-25°C Incubator | Lab preference | ||
| 30-35°C Incubator | Lab preference | ||
| Alcohol-based hand sanitizer | Lab preference | ||
| BacT/ALERT Dual-T instrument | BioMerieux Industry | ||
| Beard cover | Lab preference | ||
| Biosafety cabinet (BSC) | Lab preference | ||
| Cleanroom shoes | Lab preference | ||
| Fluidthioglycollate medium (FTM) | Hardy Diagnostics | U84 | USP |
| Handheld cleaning mop | Contec | 2665LF | |
| Hypodermic needle | Lab preference | ||
| iFA+ BacT/ALERT bottle | Biomerieux | 412990 | |
| iFN+ BacT/ALERT bottle | Biomerieux | 412991 | |
| Isokinetic head | Lab preference | ||
| Laser particle counter | TSI Incorporated | 9500-01 | |
| LpH III | Steris | 1S16CX | |
| Mirror | Lab preference | ||
| Non-sterile bouffant | Lab preference | ||
| Non-sterile gloves | Lab preference | ||
| Non-sterile shoe covers | Lab preference | ||
| Non-sterile sleeve covers | Lab preference | ||
| Parafilm | Lab preference | ||
| Peridox RTU | Contec | CR85335IR | |
| Plastic bag | Lab preference | ||
| Sabouraud Dextrose Agar with Lecithinase and Tween (SABLT) | Hardy Diagnostics | P595 | USP, irradiated |
| Sabouraurd Dextrose Agar (SAB) | Hardy Diagnostics | W565 | USP, irradiated |
| Safety glasses | Lab preference | ||
| Scrubs (top and bottom) | Lab preference | ||
| Spor-Klenx RTU | Steris | 6525M2 | |
| Sterile 70% isopropyl alcohol (IPA) | Decon CiDehol | 8316 | |
| Sterile alcohol wipe | Lab preference | ||
| Sterile boot covers | Kimberly Clark | Cat# varies based on size | |
| Sterile coveralls | Kimberly Clark | Cat# varies based on size | |
| Sterile face mask | Lab preference | ||
| Sterile gloves | Lab preference | ||
| Sterile hood | Kimberly Clark | Cat# varies based on size | |
| Sterile low-lint wipes | Texwipe | TX3210 | |
| Sterile mop cleaning pads | Contec | MEQT0002SZ | |
| Sterile sleeve covers | Kimberly Clark | 36077 | |
| Sterile spreading rod | Fisher Scientific | 14665231 | |
| Sterile syringe | Lab preference | ||
| Tacky mats | Lab preference | ||
| Tryptic Soy Agar (TSA) | Hardy Diagnostics | W570R | USP, irradiated |
| Tryptic Soy Agar with Lecithinase and Tween (TSALT) | Hardy Diagnostics | P520R | USP, irradiated |
| Tryptic Soy Broth (TSB) | Hardy Diagnostics | U46 | USP |
| Tubing | Lab preference | ||
| Vesphene III | Steris | 1S15CX | |
| Viable air sampler | Hardy Diagnostics | BAS22K | |
| Vortex | Lab preference |
참고문헌
- Cundell, T., Atkins, J. W., Lau, A. F. Sterility testing for hematopoietic stem cells. Journal of Clinical Microbiology. , (2023).
- United States Food and Drug Administration. Guidance for Industry. Sterile Drug Products Produced by Aseptic Processing - Current Good Manufacturing Practice. United States Food and Drug Administration. , (2004).
- United States Pharmacopeia - National Formulary. USP<71> Sterility Tests in USP43-NF38. United States Pharmacopeia - National Formulary. , (2022).
- England, M. R., Stock, F., Gebo, J. E. T., Frank, K. M., Lau, A. F. Comprehensive evaluation of compendial USP<71>, BacT/Alert Dual-T, and Bactec FX for detection of product sterility testing contaminants. Journal of Clinical Microbiology. 57 (2), 01548 (2019).
- Gebo, J. E. T., East, A. D., Lau, A. F. A side-by-side comparison of clinical versus current good manufacturing practices (cGMP) microbiology laboratory requirements for sterility testing of cellular and gene therapy products. Clinical Microbiology Newsletter. 43 (21), 181-191 (2021).
- Gebo, J. E. T., Lau, A. F. Sterility testing for cellular therapies: What is the role of the clinical microbiology laboratory. Journal of Clinical Microbiology. 58 (7), 01492 (2020).
- International Organization for Standardization. ISO 14644-1:2015 Cleanrooms and associated controlled environments - Part 1: Classification of air cleanliness by particle concentration. International Organization for Standardization. , (2015).
- Parenteral Drug Association. PDA Technical Report No. 13 Revised 2022 (TR 13) Fundamentals of an Environmental Monitoring Program. Parenteral Drug Association, Inc. , (2022).
- United States Pharmacopeia - National Formulary. USP<1116> Microbiological Evaluation of Cleanrooms and Other Controlled Environments in USP43-NF38 2S. United States Pharmacopeia - National Formulary. , (2020).
- Guinet, R., et al. Multicenter study on incubation conditions for environmental monitoring and aseptic process simulation. PDA journal of pharmaceutical science and technology. 71 (1), 43-49 (2017).
- Gordon, O., Berchtold, M., Staerk, A., Roesti, D. Comparison of different incubation conditions for microbiological environmental monitoring. PDA Journal of Pharmaceutical Science and Technology. 68 (5), 394-406 (2014).
- Anders, H. J., et al. Multisite qualification of an automated incubator and colony counter for environmental and bioburden applications in pharmaceutical microbiology. PDA Journal of Pharmaceutical Science and Technology. , (2022).
- United States Pharmacopeia - National Formulary. USP<1072> Disinfectants and Antiseptics. United States Pharmacopeia - National Formulary. , (2020).
- United States Pharmacopeia - National Formulary. USP<1071> Rapid Microbial Tests for Release of Sterile Short-Life Products: A Risk-Based Approach in USP43-NF38 2S. United States Pharmacopeia - National Formulary. , (2020).
- United States Pharmacopeia - National Formulary. PUSP<1223> Validation of Alternative Microbiological Methods in USP43-NF38 2S. United States Pharmacopeia - National Formulary. , (2020).
- Parenteral Drug Association. PDA Technical Report No. 33, Revised 2013 (TR 33) Evaluation, Validation and Implementation of Alternative and Rapid Microbiological Methods. Parenteral Drug Association, Inc. , (2013).
- Putnam, N. E., Lau, A. F. Comprehensive study identifies a sensitive, low-risk, closed-system model for detection of fungal contaminants in cell and gene therapy products. Journal of Clinical Microbiology. 59 (11), 0135721 (2021).
- Pharmaceutical Inspection Convention & Pharmaceutical Inspection Co-operation. Guide to Good Manufacturing Practice for Medicinal Products Annexes (PE 009-16 (Annexes)). Pharmaceutical Inspection Convention & Pharmaceutical Inspection Co-operation Scheme. , (2022).
- United States Pharmacopeia - National Formulary. USP<825> Radiopharmaceuticals - Preparation, Compounding, Dispensing, and Repackaging in USP43-NF38 2S. United States Pharmacopeia - National Formulary. , (2020).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유