Microcomputed Tomography 혈관 조영술을 활용한 마우스의 성공적인 Orthotopic 간 이식
요약
이 프로토콜에서는 마우스에서 성공적인 orthotopic 간 이식(OLT) 모델의 구현에 대해 논의합니다. 또한 마우스에서 성공적인 OLT 후 동종이식 개통을 추가로 분석하기 위한 보조제, 특히 microcomputationd tomography(microCT) 스캔을 활용하는 보조제에 대해서도 논의합니다.
초록
마이크로 컴퓨터 단층 촬영(microCT) 혈관 조영술은 연구자에게 매우 귀중한 리소스입니다. 이 기술의 새로운 발전으로 미세 혈관 구조의 고품질 이미지를 얻을 수 있게 되었으며 장기 이식 분야에서 충실도가 높은 도구입니다. 생쥐의 기립성 간 이식(OLT) 모델에서 microCT는 동종이식 문합을 실시간으로 평가할 수 있는 기회를 제공하며 연구 동물을 희생할 필요가 없다는 추가 이점이 있습니다. 콘트라스트의 선택과 이미지 획득 설정을 통해 고화질 이미지를 생성할 수 있으며, 이는 연구자들에게 매우 귀중한 정보를 제공합니다. 이를 통해 절차의 기술적 측면을 평가할 수 있을 뿐만 아니라 장기간에 걸쳐 다양한 치료법을 잠재적으로 평가할 수 있습니다. 이 프로토콜에서는 마우스의 OLT 모델을 단계적으로 자세히 설명하고 마지막으로 고품질 이미지를 제공할 수 있는 microCT 프로토콜을 설명하여 연구자들이 고형 장기 이식에 대한 심층 분석을 수행하는 데 도움이 됩니다. 생쥐의 간 이식에 대한 단계별 가이드를 제공하고 microCT 혈관 조영술을 통해 이식편의 개통을 평가하기 위한 프로토콜에 대해 간략하게 논의합니다.
서문
이식은 말기 간 질환에 대한 유일하게 효과적인 치료법입니다. 간 이식의 이점은 부인할 수 없으며, 대기자 명단에 있는 3.1년에 비해 평균 생존 기간은 11.6년이다1. 그러나 간 이식의 광범위한 적용을 제한하는 상당한 제약이 있으며, 가장 중요한 것은 적합한 고품질 기증 장기의 부족을 포함합니다. 따라서 기증자 장기 풀을 확장하려면 현재 부적합하다고 간주되는 동종 이식편을 사용할 수 있는 혁신적인 전략이 필요하며, 이식에 대한 안전 마진을 높일 수 있습니다. 따라서 간 이식에 대한 접근성을 높이려면 소동물을 대상으로 전임상 연구를 수행하는 것이 필수적입니다.
이식 연구에서 특히 중요한 것은 이식의 생체 내 모델입니다. 생쥐 기형간 이식(OLT)은 거의 30년 동안 사용되어 왔으며 2 면역 반응의 특성화, 허혈 재관류 손상, 급성 거부 반응, 새로운 약제의 치료 효과 및 장기 생존을 포함하여 이식의 여러 측면을 연구하는 데 필수적입니다 3,4,5,6,7. 이식을 연구하기 위해 마우스를 사용하는 것은 이식 결과에 대한 특정 분자 경로의 영향을 연구하기 위해 형질전환 마우스 라인을 사용할 수 있기 때문에 매우 중요합니다. 마우스의 간 이식에 대한 확립된 프로토콜은 이전에 잘 기술되어 있다 8,9.
상부 및 하부 간 하대정맥(IVC), 문맥(PV) 및 총담관(CBD)에 대해 여러 가지 문합 방법이 있습니다. 그들은 전형적으로 손 문합술 또는 쥐 폐 이식과 유사한 수정된 혈관 커프 기술에 의존한다 10,11,12. 이식 마우스의 장기 연구 및 생존과 지속적인 마우스 간 이식 프로그램 개발의 중요한 단계는 이러한 중요한 문합을 평가할 수 있는 능력입니다. 간 동종이식 개통을 평가하기 위한 영상 양식은 임상 환경에서 초음파와 컴퓨터 단층 촬영(CT)에 의존하는 경우가 많다13,14. CT는 모든 문합을 포함하여 복부 전체를 볼 수 있기 때문에 초음파에 비해 뚜렷한 이점이 있지만 초음파로 이러한 시야를 얻는 것은 작은 동물의 경우 특히 어려울 수 있습니다. 동물 연구를 강화하고 이러한 부상 및 질병 모델에서 수집할 수 있는 정보를 향상시키기 위해 정확한 microCT를 개발하는 데 상당한 연구와 자원이 투입되었습니다15,16. 여기서는 orthotopic 마우스 간 이식을 위한 프로토콜(그림 1)을 설명하고, 동종이식 개통성 및 문합 내구성을 평가하기 위한 microCT용 프로토콜에 대해 간략하게 설명합니다.
프로토콜
수컷 C57BL/6J 마우스(체중 30g)는 Nationwide Children's Hospital Animal Facility에서 병원체가 없는 조건에서 수용되었습니다. 모든 절차는 NIH 및 National Research Council의 Guide for the Humane Care and Use of Laboratory Animals에 따라 Nationwide Children's Hospital Institutional Animal Care and Use Committee(IACUC 프로토콜 AR17-00045)의 승인을 받아 인도적으로 수행되었습니다. 이 프로토콜에 사용된 모든 재료, 도구 및 장비와 관련된 자세한 내용은 재료 표를 참조하십시오.
1. 이식 수술을 위한 초기 설정
- 수술 장치를 설정합니다.
- 수술 모니터링 장치(예: 심박수 모니터링 장치, 맥박수, 모듈식 모니터 시스템) 및 마취 기계를 설정합니다.
- 가능한 경우 수술용 온열 보드를 42°C로 켭니다.
- 이소플루란 증발기를 따뜻하게 하기 위해 환기 및 마취 기계가 켜져 있는지 확인하십시오. 마취 저장소에 30mL의 액체 이소플루란을 채우고 인공호흡기가 산소에 연결되어 있는지 확인합니다.
참고: 이 프로토콜에서는 동물을 삽관하지 않습니다. 산소 공급을 위해서만 노즈콘을 사용하십시오.
- 수혜자와 기증자 마우스의 체중을 기록합니다.
- 고출력 수술용 현미경을 켜고 외과의의 선호도에 맞게 높이와 초점을 조정합니다. 나머지 수술 장치(예: 전기 소작 장치)가 켜져 있는지 확인합니다.
- 수술 기구와 10-0 나일론의 수술 넥타이를 준비하고 배치합니다(그림 2).
참고: 모든 수술 기구는 121°C에서 30분 동안 고압멸균되었습니다. 또한 수술 기구의 다양한 구성도 똑같이 효과적일 수 있습니다. - 문맥(PV) 및 총담관(CBD) 스텐트를 위한 커프를 준비합니다(그림 3). 혈관 카테터와 PE10을 고출력 현미경 아래의 멸균 표면에 놓습니다. #11 수술용 칼날을 사용하여 혈관 카테터를 절단하여 커프 본체 상단에 약 0.75mm의 탭이 있는 1.5mm 길이의 커프를 형성합니다. 폴리에틸렌 튜브(PE10)를 2.5mm 길이로 자릅니다. 커프와 스텐트를 사용할 준비가 될 때까지 멸균 식염수로 보관하십시오.
알림: 이 이식 모델은 20G 혈관 카테터를 사용하여 PV 재건을 위한 커프를 만들고 CBD 재건을 위한 폴리에틸렌 튜브 10(PE10)을 사용합니다. 다른 모든 문합은 손으로 꿰매어집니다. - 솔루션을 준비합니다. 히스티딘-트립토판-케토글루타레이트(HTK) 용액 0.5mL에 100U로 전달될 헤파린 주사를 준비합니다. 식염수, 헤파린 식염수, PBS 및 HTK 보존 용액을 얼음에 보관하십시오.
2. 기증자 마우스 조달
- 기증자 마우스를 이소플루란 흡입실에 넣어 마취를 유도합니다. 산소 유량이 2mL/min이고 이소플루란 농도가 약 2.5%인지 확인합니다. 마취 수술면이 발달할 때까지 5분 동안 기다립니다. 적절한 수준의 마취를 보장하려면 발가락을 쥐를 꼬집어 반응을 유도합니다. 반응이 없다는 것은 적절한 수준의 마취가 충족되었음을 나타냅니다.
- 전자 가위를 사용하여 마우스의 복부를 면도하고 보온판의 누운 자세에 마우스를 놓습니다. 포비돈 요오드로 복부를 청소한 다음 70% 에탄올로 청소합니다. 건조를 방지하기 위해 쥐의 눈 밑에 안과 연고를 바르십시오.
- 마우스를 고출력 현미경 아래에 놓고 2mL/min의 산소 흐름으로 2% 농도의 이소플루란 흡입을 사용하여 마우스를 마취 상태로 유지합니다.
- xiphoid process에서 치골 symphysis까지 가위 (외과 의사 선호)로 정중선 개복술을 수행합니다. 그런 다음 갈비뼈보다 아래쪽에 '십자형' 패턴을 만들기 위해 추가 가로 절개를 수행합니다. 모기 지혈 겸자를 사용하여 복부 내용물이 적절하게 노출되도록 xiphoid 과정을 수축시킵니다.
알림: 집게는 외과 의사의 선호도에 따라 고정할 수 있습니다. - 내장을 절제하고 젖은 거즈 스폰지로 복강 왼쪽에 놓습니다. 모든 인대 부착물을 제거하여 간을 동원하십시오.
- 적절한 간동맥(pHA)을 노출시킵니다. 곡선 집게를 사용하여 혈관을 골격화하고 10-0 나일론 봉합사로 결찰합니다.
- 날카롭고 뭉툭한 해부의 조합을 사용하여 CBD의 전체 길이를 해부합니다. 향후 사용을 위해 적절한 길이를 제공하기 위해 가능한 한 췌장의 상부 경계에 가깝게 유관 절개술(CBD 스텐트를 위해 충분히 큼)을 수행합니다(간의 하부 경계에서 ~1cm). 담관 스텐트를 미세한 집게로 CBD에 삽입하고 10-0 나일론 봉합사로 고정합니다. 10-0 나일론 봉합사를 사용하여 CBD의 원위 측면을 결찰합니다(그림 4).
- 젖은 거즈 스폰지를 사용하여 오른쪽 간엽을 xiphoid 쪽으로 수축시키고 IVC를 노출시킵니다. 후복막에서 멀리 떨어진 간하부 IVC(IHIVC)를 동원하고 휴대용 소작 장치를 사용하여 오른쪽 부신 정맥을 소작합니다( 재료 표 참조).
- 오른쪽 신장 동맥과 정맥을 절개하고 각각 7-0 및 10-0 나일론으로 결찰합니다. 오른쪽 신장 정맥과 동맥 및 나머지 인대 부착물을 절단합니다. 마지막으로 오른쪽 신장을 제거합니다.
알림: 이것은 최종적으로 IHIVC를 절단할 때 더 나은 노출을 위해 수행됩니다. - 30G 바늘로 PV를 통해 100U 헤파린 용액과 함께 0.5mL의 차가운 HTK를 주입합니다. 헤파린이 체계적으로 분포될 때까지 1분 동안 기다립니다. 비장 정맥과 상장간막 정맥보다 약간 위쪽에 있는 문맥을 자릅니다.
- 30G 바늘로 IHIVC에 헤파린이 포함된 차가운 HTK 보존 용액을 천천히 주입하여 기증자의 간을 관류합니다. PV에서 나오는 유체가 깨끗해지면 용액 주입을 중지하십시오. 주사가 완료되면 오른쪽 신장 정맥 바로 위에 있는 IHIVC에 마이크로 클램프를 놓고 클램프 바로 아래를 절단합니다. 이 단계가 완료되면 인공호흡기를 끄고 동물이 방금 안락사되었으므로 이소플루란을 중단하십시오.
- 이전에 2.7 단계에서 배치 한 스텐트에 CBD를 원위부로 자릅니다. 또한 낭포관을 확인하고 10-0 나일론 봉합사로 관을 결찰합니다. 그런 다음 겸자로 담낭의 돔을 잡고 날카롭고 둔한 해부를 조합하여 담낭 포사에서 자유롭게 절개합니다. 담낭이 적절하게 움직이면 스프링 가위를 사용하여 이전에 배치한 봉합사 위의 낭포관을 절단하여 담낭 절제술을 완료합니다.
- 간상IVC(SHIVC)를 노출시키기 위해 간을 하부로 수축시킵니다. 수용 동물의 문합을 위한 적절한 길이를 제공하기 위해 특별한 주의를 기울여 SHIVC를 자릅니다.
- 간에 부착된 인대를 해부하고 기증자의 간을 생체 외 로 전달하고 장기를 차가운 식염수가 담긴 용기에 넣습니다.
3. 간 동종 이식편을 위한 백테이블 준비
- 단열 용기에 얼음을 넣고 얼음 위에 페트리 접시를 놓습니다. 페트리 접시에 차가운 식염수를 채웁니다. 내장 표면이 드러나도록 간 동종 이식편을 접시에 넣습니다.
- 이전에 선택한 커프를 통해 PV를 놓고 내부 내피 표면이 노출되도록 정맥을 제거합니다. 10-0 나일론 봉합사로 커프를 고정합니다. 최상의 결과를 위해 봉합사가 커프의 홈 안에 있는지 확인하십시오(그림 5).
- 간 동종이식편을 조정하여 SHIVC를 노출시키고 두 개의 8-0을 배치합니다. 나일론은 각각 3' 및 9'시 방향에서 봉합을 유지하여 수용 동물의 궁극적인 문합을 수행합니다. 간 동종이식편을 다시 조정하여 IHIVC를 노출시키고 두 개를 8-0으로 배치합니다. 나일론은 각각 3' 및 9'시 방향에서 봉합을 유지하여 수용 동물의 궁극적인 문합을 수행합니다.
4. 수신자 작업
알림: 멸균 작업이므로 장갑과 적절한 개인 보호 장비를 사용하고 항생제를 투여하십시오. 수술 시 수술 전 진통으로 부프레노르핀 0.1mg/kg을 피하 투여합니다.
- 기증자 작업에서와 같이 pHA를 노출시킵니다. 앞서 설명한 복부 절개 대신 정중선 개복술만 사용합니다.
- 간을 동원하고 모든 인대 부착물을 절단하십시오. 또한 왼쪽 횡격막과 식도 주위 혈관을 10-0 나일론 봉합사로 결찰합니다.
- 간을 하등하게 수축시키고 후복막에서 SHIVC를 해방하십시오. 다음으로, 간을 상부적으로 수축시키고 후복막에서 IHIVC를 해방시킵니다. 이전에 설명한 것과 동일한 기술을 사용하여 필요에 따라 작은 가교 정맥과 요추 정맥을 소작합니다.
- 휴대용 소작으로 오른쪽 부신 정맥을 소작하고 간 hilum을 노출시킵니다. pHA를 10-0 나일론 봉합사로 결찰합니다. 다음으로, PV에서 자유롭게 CBD를 해부하고 CBD 문합을 위한 적절한 길이를 제공하기 위해 CBD의 분기에 가까운 7-0 봉합사로 CBD를 결찰합니다.
- 마이크로 클램프를 사용하여 간하부 IVC를 고정하고 PV를 7-0 봉합사로 임시로 결찰합니다. 간을 간으로 시작하는 단계. 이소플루란 흡입을 중단하십시오.
알림: 문맥과 IVC를 클램핑한 후 간정맥 복귀는 무간단계에서 완전히 차단됩니다. 흡입된 마취제 isoflurane는 간에 의해 물질 대사로 변화됩니다; 따라서 축적되면 심폐 허탈로 이어질 수 있으므로 흡입이 일시적으로 중단됩니다. - 천연 간의 PV를 통해 0.5mL의 헤파린-식염수를 30G 바늘로 주입하여 장기를 세척합니다.
- 미세 혈관 cl 배치amp문합을 위한 적절한 길이를 남기기 위해 가능한 한 근위 및 원위부에 SHIVC 및 IHIVC에 s를 설치합니다. 천연 SHIVC, IHIVC, PV(이전에 배치된 봉합사에 가까움) 및 수혜자의 본래 간에 남아 있는 인대 부착물을 절단하고 생체 외 본래 간을 전달합니다.
알림: IHIVC clamp 오른쪽 신장 정맥 위에 있어야 합니다. - 기증자 간 동종이식편을 복강 내부에 놓고 기증자 동종이식의 힐럼을 수축시켜 PV를 노출시킵니다. 공기 색전증을 방지하기 위해 30G 바늘을 사용하여 0.5mL의 헤파린 식염수로 기증자와 네이티브 PV를 모두 씻어내고 혈관의 공기를 제거합니다. 그런 다음 이전에 만든 기증자 PV의 커프를 수혜자 간 PV의 내강에 삽입하고 필요한 경우 문합을 돕기 위해 스테이 봉합사를 배치합니다(8-0 봉합사). 7-0 봉합사로 문합을 고정합니다(그림 6).
- 보드를 180° 회전합니다. 기증자와 네이티브 SHIVC와 함께 10-0 나일론 봉합사로 손으로 꿰매는 문합을 수행합니다. 후벽 문합을 마친 후 공기 색전증을 방지하기 위해 0.5mL의 헤파린 식염수로 씻어내어 공기를 제거합니다. 상벽의 완전한 문합(그림 7).
- 먼저 PV의 결찰 봉합사를 제거하십시오. 그런 다음 혈관 cl을 제거하십시오.amps를 SHIVC에서 재관류를 시작합니다. 간을 끝내고 이소플루란 흡입을 다시 시작합니다. IHIVC를 재건하기 위해 SHIVC 문합과 동일한 방식으로 10-0 나일론 봉합사로 손바느질 문합을 수행합니다. 재구성을 완료한 후 재관류를 위해 네이티브 및 기증자 IHIVC에서 마이크로 클램프를 제거합니다(그림 8).
- 이전에 배치된 봉합사 근처의 수혜자 CBD에 유관 절개술을 만들어 CBD 문합을 수행합니다. 기증자 CBD의 스텐트를 수혜자 CBD 내강에 삽입하고 10-0 봉합사로 문합을 고정합니다(그림 9).
- 1mL의 식염수로 복강을 관개하십시오. 지혈을 확인하고 남아 있는 출혈 혈관을 소작합니다. 6-0 봉합사를 사용하여 복부 절개 부위를 두 겹으로 봉합합니다.
- 회복을 위해 동물을 따뜻한 인큐베이터(42°C)에 넣고 의식이 회복되고 충분한 활동을 할 때까지 동물을 방치하지 마십시오. 수술 후 0.1mg/kg의 부프레노르핀을 피하 투여하고 수술 후 48시간 동안 8-12시간마다 투여를 계속합니다. 또한 수술 후 최대 7일 동안 카프로펜(400mL의 물에 녹인 0.2mL)을 수용 동물의 물병을 통해 투여합니다. 4-5시간 동안 수용 동물을 관찰하고 완전히 회복되면 이제 다른 동물과 함께 있어도 안전하므로 주거 위치로 돌려보냅니다.
참고: 진통제와 항생제는 지역 동물 윤리 위원회의 권고에 따라 투여할 수 있습니다.
5. 마우스 microCT 혈관 조영술 영상
- 미리 결정된 연구 간격 동안 마우스를 관찰한 후 microCT 혈관 조영술을 사용하여 동종 이식편의 개통성을 평가할 수 있도록 마우스를 준비합니다.
- 이소플루란 증발기를 따뜻하게 하기 위해 환기 및 마취 기계가 켜져 있는지 확인하십시오. 마취 저장소에 액체 이소플루란 30mL를 채우고 인공호흡기가 산소에 연결되어 있는지 확인합니다. microCT 스캐너를 켜고 모든 소프트웨어가 제대로 작동하는지 확인합니다.
- microCT 스캐너 시스템에서 수집 소프트웨어를 시작합니다.
- microCT 장치의 모니터에서 시스템 초기화 를 클릭하고 CT 스캔 모드를 선택합니다.
- 침대를 꺼내십시오. 마우스 베드를 부착하고 잠급니다.
- 회수 케이지의 보온 보드를 42°C로 켭니다.
- 1mL 주사기에 100μL의 CT 조영제를 채웁니다. 향후 조영제 정맥 투여를 위해 30게이지 바늘을 부착합니다. 주사기에 기포가 없는지 확인하십시오.
- 꼬리 정맥 구속 시스템에 마우스를 놓습니다. 마우스가 구속 시스템 내부에 완전히 들어가면 시스템 게이트를 닫고 꼬리가 수직으로 떨어지도록 한 다음 알코올 용액(70% 에탄올)으로 조심스럽게 닦습니다.
알림: 꼬리 정맥의 캐뉼레이션 성공률은 장갑을 낀 손으로 몇 분 동안 동물의 꼬리를 잡고 따뜻하게 함으로써 증가할 수 있습니다. - 꼬리를 말단부 쪽으로 잡고 계획된 주사 부위에 가까운 꼬리 주위에 두 손가락(검지 및 가운데)을 놓습니다. 엄지와 약지 사이에 꼬리의 원위부(주사 부위 아래)를 놓습니다.
- 두 손가락 세트로 압력을 약간 가하고 주사기와 바늘이 꼬리와 평행이 되도록 얕은 깊이를 사용하여 바늘을 정맥에 삽입합니다. 근위 꼬리에서 검지 손가락의 압력을 해제하면서 CT 조영제를 정맥 주사합니다. 주사기로 흡인하면 정맥이 무너질 수 있으므로 피하십시오.
알림: 바늘이 정맥에 적절하게 위치하면 주사 중에 저항이 느껴지지 않아야 합니다. 저항이 있으면 바늘을 제거하고 원래 주사 부위 위에 다시 삽입하십시오. 두 번의 시도 후에도 정맥의 캐뉼레이션이 실패하면 바늘을 교체하십시오. - 조영제를 성공적으로 주입하고 바늘을 제거한 후 멸균 거즈를 사용하여 주사 부위를 부드럽게 압박하여 출혈을 멈춥니다.
- 마우스를 이소플루란 흡입 챔버로 옮기고 산소 흐름이 2mL/min인 농도를 2.5%로 설정하고 3-4분 동안 기다립니다. 마취면이 설정되면 마우스를 microCT 스캐너 침대로 빠르게 옮기고 스캐너 테이블의 엎드린 자세로 놓습니다(그림 10).
- 적절한 양의 안과 연고로 동물의 눈을 덮으십시오. 노즈콘을 동물 위에 적절하게 놓고 공기와 이소플루란이 노즈콘을 통해 제대로 흐르도록 합니다. 앞에서 설명한 것과 동일한 마취 매개변수를 사용합니다(5.12단계). 촬영 중에 동물의 체온을 지속적으로 모니터링하기 위해 직장 온도 프로브에 윤활유를 바르고 삽입합니다.
- 호흡기를 마우스에 접촉시킵니다.
- 테이프를 사용하여 ECG 패드를 왼쪽, 오른쪽 앞다리 및 왼쪽 뒷다리에 부착합니다. 초음파 젤을 사용하여 ECG 패드와 피부 사이의 신호를 개선하십시오.
- 컴퓨터 소프트웨어에서 ECG 및 호흡 신호를 확인하여 모니터에 적절한 QRS 복합체가 보이는지 확인합니다. 이렇게 하려면 Source Set Up 탭에서 Logic Lead를 선택하고 가장 명확한 ECG 곡선을 제공하는 리드를 선택합니다.
알림: 로직 리드는 오른쪽, 왼쪽 가슴 및 다리 아래쪽에 연결된 3개의 ECG 패드에 해당합니다. 모든 리드는 ECG 곡선을 나타냅니다. - 적절한 신호 높이를 위해 게인을 설정하고 일반적으로 4 또는 8 이 좋습니다. 이중 게이팅을 선택합니다. 디스플레이 설정 탭에서 명확한 신호 보기를 위해 디스플레이 설정을 조정합니다: ECG 및 RESP 옆의 상자를 선택하고 각각 500으로 설정합니다. 트리거 설정 탭에서 채널 A, 채널 B 및 DualTrig 가 선택되어 있는지 확인합니다.
- 다음 매개 변수도 설정되어 있는지 확인합니다. 임계값: 신호가 이 값 아래로 떨어질 때; 값을 2,500으로 설정합니다. 히스테리시스: 신호가 히스테리시스를 교차하여 새로운 트리거링 사이클이 시작되는 소프트웨어 트리거 포인트를 생성하는지 확인합니다. 값을 300으로 설정합니다. 지연: 트리거가 전송되기 전에 기다립니다. 값을 100으로 설정합니다. 금지: 이 기간 동안 신호를 생성할 수 없으므로 값을 200으로 설정합니다.
- ECG의 임계값이 히스테리시스 값보다 낮고 디스플레이 화면의 sT 세그먼트 피크보다 높은지 확인합니다.
- 동물을 스캐너로 이동시키고 이미지 업데이트를 누릅니다. 동물의 X선 스카우트 이미지를 획득하여 후속 microCT 이미지에 대한 적절한 시야 및 해부학적 스캔 범위를 선택합니다.
- 다음 매개변수를 사용하여 microCT 혈관 조영술 이미지 획득을 수행합니다: 배율: 울트라 포커스, 스캔 각도: 전체(360) 스캔, 에너지: 단일, 스캔 모드: 게이트, 설정: 기본값(전체 360° 회전, X선관 기본 설정 0.33mA 및 55kV, 단계당 0.750°도, 단계당 1개의 프로젝션, 1 x 1 비닝, 40ms 노출 시간, 이중 게이팅 은 심장 및 호흡기 게이팅을 의미함)(그림 11).
- 스캔이 완료되면 동물을 예열된 회수 케이지로 옮깁니다. 동물이 완전히 회복되면 기본 케이지로 다시 옮깁니다.
- 시스템 소프트웨어를 사용하여 microCT 영상을 재구성합니다. 이미지를 업로드한 후 파란색 막대가 해부학적 관심 영역에 걸치도록 설정합니다. 슬라이스를 미리 보고 볼륨을 더 작게 만들고 마우스에 최대한 제한합니다(이 단계는 재구성된 이미지의 크기를 줄이는 데 도움이 됩니다).
- 관심 있는 윤곽선의 볼륨을 켜서 이미지 경계를 최적화합니다. 40μm 복셀 크기, Hann 투영 필터 및 가우스 부피 필터(80μm)를 선택할 수 있습니다. Advanced(고급) | 이미지 기반 게이팅을 선택하고 트리거 창과 위상을 각각 0.5 및 0.6으로 조정하고 심장 게이팅을 위해 10단계를 선택한 다음 볼륨 재구성 버튼을 누릅니다.
대표적 결과
외과 의사가 아니거나, 해부학에 익숙하지 않거나, 방사선학적 결과를 해석하는 데 불편한 연구자의 경우 적절한 교육을 받은 직원이 적절한 이미지 분석을 수행해야 합니다. 마우스에서 OLT의 성공은 위의 프로토콜에서 입증됩니다. 또한 연구 지표를 개선하고 이식 성공에 대한 실시간 피드백을 제공하고 괴사의 필요성을 없애기 위해 microCT 혈관 조영 스캔을 사용하여 정확하고 선명한 이미지를 제공할 수 있습니다. 이 원고에는 대표적인 이미지가 포함되어 있습니다(그림 11). in vivo 실패한 문합술의 대표적인 이미지는 그림 12에서 볼 수 있습니다.
간 해부학과 혈관 구조에 익숙한 사람들은 IVC의 특허 정맥 문합을 볼 수 있습니다. 어떤 상황에서는 문맥도 시각화할 수 있는데, 이는 문맥 커프로 인해 이 모델에서 쉽게 만들 수 있습니다. 개방 문합을 보는 것은 수술의 기술적 성공을 나타냅니다. 또한 이러한 이미지의 3D 재구성은 연구자에게 추가 정보와 혈관 해부학에 대한 보다 자세한 이미지를 제공할 수 있습니다. 위의 모델을 활용하면 OLT 마우스 코호트의 사망률은 ~40-45%입니다.

그림 1: orthotopic 간 이식의 개요. (A) 4개의 다른 문합을 묘사한 그래픽 그림: i) suprahepatic IVC 문합, ii) infrahepatic IVC 문합, iii) 문맥 문합, iv) 총담관 문합. 각 화살표는 혈관 또는 덕트가 절단-간상-IVC(프로토콜 단계 2.13), 간하 IVC(프로토콜 단계 2.11), 문맥(프로토콜 단계 2.10) 및 총담관(프로토콜 단계 2.7)이어야 하는 상대적 위치를 나타냅니다. (B) 문합체의 생체 내 다이어그램. 축척 막대 = 2mm. 약어: IVC = 하대정맥. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
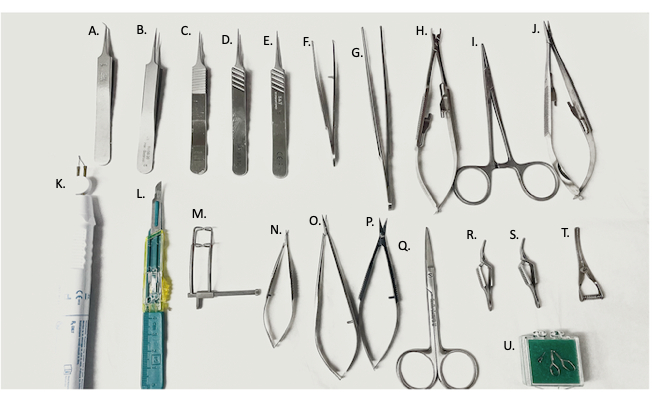
그림 2: 수술에 사용되는 수술 도구. (A) 45° 미세 겸자, (B-E) 미세 겸자, (F) 곡선형 바늘 홀더/겸자, (G) 직선 겸자, (H) 혈관 클램프 도포자, (I) 지혈기, (J) 바늘 홀더, (K) 전기 소작 장치, (L) #11 블레이드, (M) 복부 견인기, (N,O) 마이크로 가위, (P) 미세 가위, (Q) 수술용 가위, (R,S) Yasargil 클램프, (T) 불독 정맥 클램프, (U) 미세 혈관 클램프. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 3: 문맥 커프 및 담관 스텐트. 사용 전 스텐트 및 커프의 생체 외 이미지. 축척 막대 = 3.5mm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
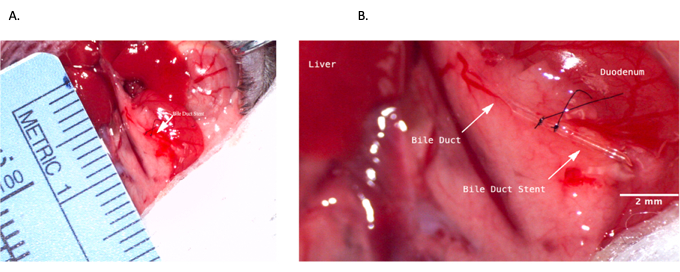
그림 4: 기증자 수술 중 총담관 스텐트 삽입. (A) 담관 스텐트가 총담관에 삽입되는 경우. (B) 담관 내에 고정된 담관 스텐트. 축척 막대 = 2mm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
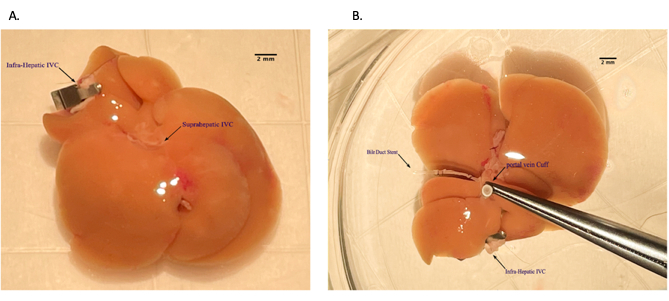
그림 5: 간 동종 이식편을 백테이블 준비 중 문맥 커프 배치. (A) 정맥 커프를 통해 문맥을 실을 꿰는 것. (B) 커프 위의 정맥. 축척 막대 = 2mm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
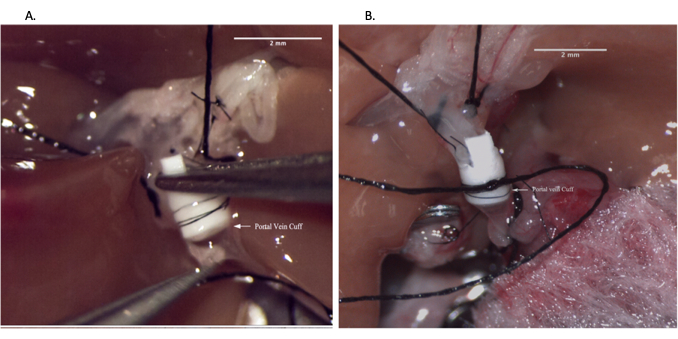
그림 6: 이식자 수술 중 문맥 문합. (A) 정맥 커프를 수취인 문맥에 삽입. (B) 봉합사로 고정된 문맥 문합. 축척 막대 = 2mm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
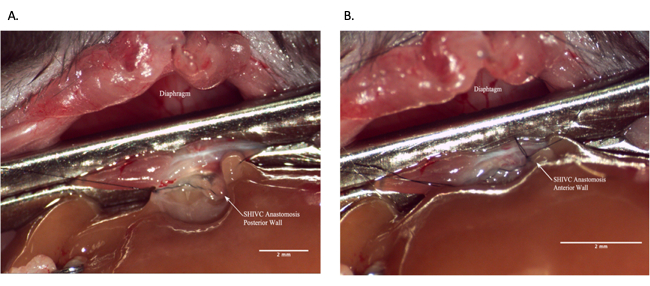
그림 7: 수혜자 수술 중 Suprahepatic IVC 문합 . (A) 문합술의 후방벽이 완전합니다. (B) SHIVC 문합을 완료했습니다. 축척 막대 = 2mm. 약어: IVC = 하대정맥; SHIVC = suprahepatic IVC. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
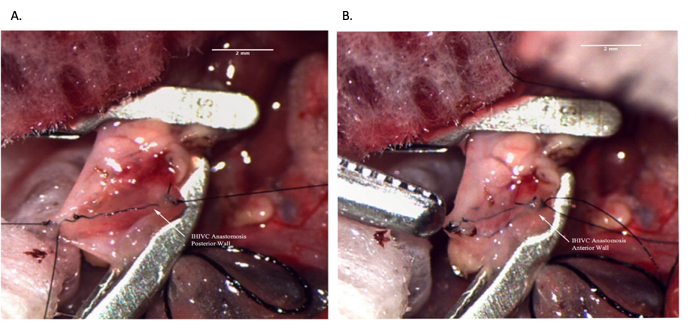
그림 8: 수혜자 수술 중 Infrahepatic IVC 문합 . (A) 문합체의 후방벽이 완전합니다. (B) IHIVC 문합을 완료했습니다. 축척 막대 = 2mm. 약어: IVC = 하대정맥; IHIVC = infrahepatic IVC. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
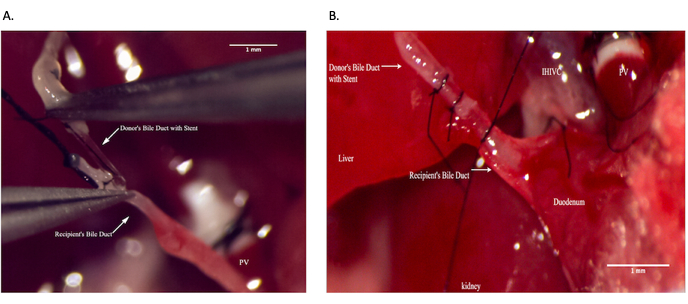
그림 9: 수용자 수술 중 총담관 문합 . (A) 수용자 총담관 내에 담관 스텐트를 삽입합니다. (B) 담관 문합 확보. 축척 막대 = 1mm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 10: 마우스 microCT 혈관 조영술 동물 준비. (A) 조영제를 투여하기 위한 쥐 꼬리 정맥 주사. (B) 마우스가 microCT 기계를 통과하고 있습니다. 약어: microCT = microcomputed tomography. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
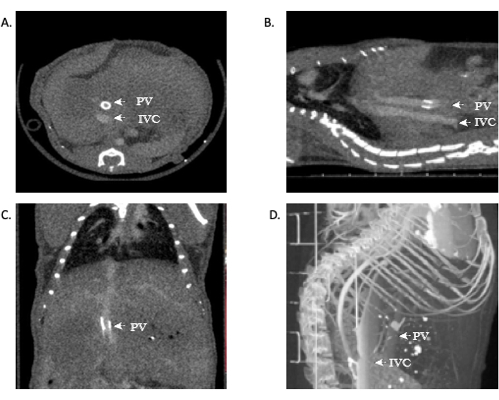
그림 11: 동종이식 개통의 microCT 혈관 조영술을 보여주는 대표 이미지. (A,B) IVC 전체에서 대비를 볼 수 있으며, 이는 상부 및 하부 문합체의 개통성을 보여줍니다. (C) 문맥의 대비, 다시 개통을 보여줍니다. (D) 혈관 구조의 3D 재구성. 약어: microCT = microcomputed tomography; IVC = 하대정맥; PV = 포털 정맥. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
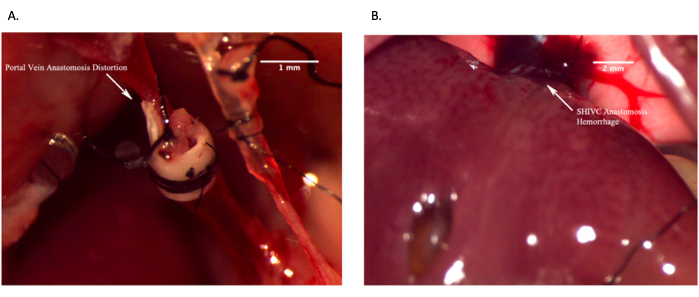
그림 12: 실패한 생체 내 문합을 보여주는 대표적인 이미지. (A) 정맥의 왜곡으로 인해 혈류가 부족하여 문맥 문합이 실패한 경우. (B) 과다 출혈로 인한 상부 IVC 문합 실패. 축척 막대 = 2mm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
설치류의 OLT는 문헌 2,8에 잘 설명되어 있습니다. 기술적으로 까다로운 이 시술을 수행하려면 해부학적 구조와 기술적 능력에 대한 확실한 이해가 필요하기 때문에 수년간의 미세 수술(또는 일반적인 수술)이 필요한 경우가 많습니다. 이 모델을 개발하는 과정에서 우리는 문합과 관련된 몇 가지 기술적 문제에 직면했습니다. 특히 PV 문합술의 경우 문합을 위해 정맥을 안정화하는 것이 어려운 경우가 많습니다. 우리는 하나 또는 두 개의 봉합사(외과 의사 선호)를 배치하는 것이 커프 배치를 용이하게 하는 데 도움이 된다는 것을 발견했습니다. 더 많은 스테이 봉합사를 배치하면 수술 시간이 늘어난다는 점에 유의해야 합니다.
또한 SHIVC는 복강 깊숙이 있어 적절한 노출을 제공하기 위해 클램프를 배치하기가 어렵습니다. 우리는 쥐가 구속 상태에서 가능한 한 이완되면 정맥의 유연성이 추가된다는 것을 발견했습니다. 궁극적으로, 연습을 통해 적절한 배치를 결정하는 것은 외과 의사의 몫입니다. 또한 CBD 문합으로 덕트는 다시 매우 섬세합니다. 덕트를 안정화하기 위해 스테이 봉합사를 배치하는 것은 어려울 수 있으며, 작은 거즈 조각에 놓으면 안정화에 도움이 될 수 있습니다. 마지막으로, 모든 작은 포유류는 마취 시간과 관련하여 독특하게 섬세하기 때문에 가능한 한 빨리 수술을 수행하는 것이 중요합니다. 이상적인 수술 시간은 다음과 같습니다: 1) 기증자 수술, 45-60분; 2) 백 테이블 준비, 15분; 3) 수신자 작업, 60-80분. 연습은 낭비되는 움직임을 줄이는 데 도움이 됩니다.
동물 모델이 발전함에 따라 연구 개입의 성공을 평가하는 능력도 발전했습니다. MicroCT는 1990년대 후반 쥐의 혈관 구조에 대한 연구를 수행하는 데 처음 사용되었습니다17. 설치류에서 정확하고 명확한 microCT 혈관 조영술 연구를 수행하는 데는 많은 어려움이 있습니다. 그러나 대부분의 문제는 이러한 포유류의 짧은 심장 및 호흡 주기에서 발생합니다. 이는 짧은 노출을 사용하여 모션 아티팩트를 제한하고 더 높은 광자 플루언스 비율(photon fluence rate)을 제한함으로써 극복된다 18. 일반적으로 심장 게이팅을 사용하고 호흡수를 줄이기 위해 이소플루란 농도를 조정하면 가장 선명한 이미지가 생성된다는 것을 발견했습니다. 또한 간동맥기(hepatic arterial phase), 문맥상(portal-venous phase) 및 지연기(delayed phase)와 같은 특정 단계에 설치류 특이적 대비 타이밍을 활용하면 시각화가 향상되는 것으로 나타났습니다19. ExiTron nano 12000 콘트라스트를 사용하면 몇 가지 장점이 있으며 전반적인 이미지 품질을 향상시킬 수 있습니다. 그것은 간20 및 혈액21에 있는 가장 강한 대조 증진을 제안한다. 또 다른 이점은 대조가 처음 주입 후 최대 120시간 동안 간에 존재한다는 것인데, 이는 반복 스캔이 필요한 경우 더 적은 대비가 필요하기 때문에 관련 간 독성을 줄일 수 있다는 것입니다20.
더욱이, 스캔은 이소플루란(isoflurane)으로 진정된 마우스로 수행되기 때문에, 생리학(physiology)20의 이러한 변화와 함께 대비 향상이 변경되지 않는다. 이러한 이미징 기술과 ExiTron 조영제를 사용하면 OLT에서 성공적인 문합을 명확하게 평가할 수 있습니다. MicroCT를 사용하면 장기간에 걸쳐 생체 내 동종이식편에 대한 비침습적 평가가 가능합니다. 이 프로토콜은 혈관 문합을 평가하기 위해 희생해야 하는 동물의 수를 줄이고 몇 주에 걸쳐 치료법과 혈관 구조에 미치는 영향을 연구할 수 있는 기회를 제공합니다.
제한
기술을 완성하기 위해 OLT 모델의 여러 수정이 이루어졌지만 microCT를 활용한 문합체의 시각화는 여전히 진행 중인 프로세스입니다. 또한 마우스 OLT는 이식 의학에 대한 독특한 통찰력을 제공합니다. 그러나 이 마우스를 1주일 이상 생존시키는 것이 어렵기 때문에 포괄적인 모델은 아닙니다. 전임상 실험을 더욱 구체화하기 위해 추가 이식 모델도 사용해야 합니다.
결론
microCT의 발전은 지난 10년 동안 빠르게 발전하여 연구자들에게 동물 모델 및 이식 분야에서 매우 귀중한 새로운 도구를 제공했습니다. 미래에는 더 상세한 3D 이미징을 통해 연구 및 발견에 대한 더 많은 통찰력을 얻을 수 있을 것입니다.
공개
저자는 선언할 이해 상충이 없습니다.
감사의 말
SMB는 NIDDK(National Institute of Diabetes and Digestive and Kidney Diseases) 보조금 R01DK1234750의 지원을 받습니다. BAW는 미국 국립보건원(National Institutes of Health)의 국립 심장, 폐 및 혈액 연구소(National Heart Lung and Blood Institute) 보조금 R01HL143000 통해 지원됩니다.
자료
| Name | Company | Catalog Number | Comments |
| #11 Blade | Fisher Scientific | 3120030 | |
| 4-0 silk suture | Surgical Specialties Corp. | SP116 | |
| 6-0 nylon suture | AD Surgical | S-N618R13 | |
| 7-0 nylon suture | AD Surgical | S-N718SP13 | |
| 8-0 nylon suture | AD Surgical | XXS-N807T6 | |
| 10-0 nylon suture | AD Surgical | M-N510R19-B | |
| 20 G Angiocath | Boundtree | 602032D | |
| 30 G Needle | Med Needles | BD-305106 | |
| Baytril (enrofloxacin) Antibacterial Tablets | Elanco | NA | |
| Bovie Chang-A-Tip High Temp Cauterizer | USA Medical and Surgical Supplies | BM-DEL1 | |
| Bulldog Vein Clamp 1 1/8 | Ambler Surgical USA | 18-181 | |
| C57BL/6J mice | Jackson Labs | ||
| Castroviejo Micro Dissecting Spring Scissors | Roboz Surgical Store | RS-5668 | |
| Dumont #5 - Fine Forceps | Fine Science tools | 11254-20 | |
| Dumont #5 Forceps | Fine Science tools | 11252-50 | |
| Dumont Medical #5/45 Forceps - Angled 45° | Fine Science tools | 11253-25 | |
| ExiTron nano 12000 | Miltenyi Biotec | 130 - 095 - 698 | CT contrast agent |
| Forceps | Fine Science tools | 11027-12 | |
| Halsted-Mosquito Hemostat | Roboz Surgical | RS-7112 | |
| heparin | Fresnius Lab, Lake Zurich, IL | C504701 | |
| histidine-trypotophan-ketoglutarate | University Pharmacy | NA | |
| Insulated Container | YETI | ROADIE 24 HARD COOLER | https://www.yeti.com/coolers/hard-coolers/roadie/10022350000.html |
| Isoflurane | Piramal Critical Care | NDC 66794-017-25 | |
| ketamine | Hikma Pharmaceuticals PLC | NDC 0413-9505-10 | |
| Mirco Serrefines | Fine Science tools | 18055-05 | |
| Mouse Rectal Temperature Probe | WPI Inc | NA | |
| NEEDLE HOLDER/FORCEPS straight | Micrins | MI1540 | |
| PE10 Tubing | Fisher Scientific | BD 427400 | |
| perfadex | XVIVO Perfusion AB | REF99450 | |
| PhysioSuite | Kent Scientific | PS-MSTAT-RT | |
| Puralube Ophthalmic Ointment | Dechra | NA | |
| saline | PP Pharmaceuticals LLC | NDC 63323-186-10 | |
| Scissors | Fine Science tools | 14090-11 | |
| Small Mouse Restraint – 1” inner diameter | Pro Lab Corp | MH-100 | |
| SomnoSuite Small Animal Anesthesia System | Kent scientific | SS-MVG-Module | |
| Surgical microscope | Leica | M500-N w/ OHS | |
| U-CTHR | MI Labs | NA | CT Scanner software |
| Vannas-Tubingen Spring Scissors | Fine Science Tools | 15008-08 | |
| xylazine | Korn Pharmaceuticals Corp | NDC 59399-110-20 | |
| Yasagil clamp | Aesculap | FT351T | |
| Yasagil clamp | Aesculap | FT261T | |
| Yasagil clamp applicator | Aesculap | FT484T |
참고문헌
- Rana, A., et al. Survival benefit of solid-organ transplant in the United States. JAMA Surgery. 150 (3), 252-259 (2015).
- Qian, S. G., Fung, J. J., Demetris, A. V., Ildstad, S. T., Starzl, T. E. Orthotopic liver transplantation in the mouse. Transplantation. 52 (3), 562-564 (1991).
- Nakano, R., et al. Dendritic cell-mediated regulation of liver ischemia-reperfusion injury and liver transplant rejection. Frontiers in Immunology. 12, 705465 (2021).
- Nakamura, K., et al. Antibiotic pretreatment alleviates liver transplant damage in mice and humans. Journal of Clinical Investigation. 129 (8), 3420-3434 (2019).
- Lee, S. K., et al. Patient-derived Avatar mouse model to predict the liver immune homeostasis of long-term stable liver transplant patients. Frontiers in Immunology. 13, 817006 (2022).
- Li, S. P., et al. Characterization and proteomic analyses of proinflammatory cytokines in a mouse model of liver transplant rejection. Oxidative Medicine and Cellular Longevity. 2022, 5188584 (2022).
- Huang, D. R., Wu, Z. J., Zhu, Y. Modified arterialization of orthotopic liver transplantation in a mouse model. Hepatobiliary Pancreatic Disease International. 9 (3), 264-268 (2010).
- Yokota, S., et al. Orthotopic mouse liver transplantation to study liver biology and allograft tolerance. Nature Protocols. 11 (7), 1163-1174 (2016).
- Chen, X. C., et al. Reduced complications after arterial reconnection in a rat model of orthotopic liver transplantation. Journal of Visual Experiments. (165), e60628 (2020).
- Nelson, K., et al. Method of isolated ex vivo lung perfusion in a rat model: lessons learned from developing a rat EVLP program. Journal of Visual Experiments. (96), e52309 (2015).
- Nelson, K., et al. Animal models of ex vivo lung perfusion as a platform for transplantation research. World Journal of Experimental Medicine. 4 (2), 7-15 (2014).
- Lee, Y. G., et al. A rat lung transplantation model of warm ischemia/reperfusion injury: optimizations to improve outcomes. Journal of Visual Experiments. (176), e62445 (2021).
- Di Martino, M., et al. Imaging follow-up after liver transplantation. British Journal of Radiology. 89 (1064), 20151025 (2016).
- Vardar, B. U., Dupuis, C. S., Goldstein, A. J., Vardar, Z., Kim, Y. H. Ultrasonographic evaluation of patients with abnormal liver function tests in the emergency department. Ultrasonography. 41 (2), 243-262 (2022).
- Marx, J. Imaging. Animal models: live and in color. Science. 302 (5652), 1880-1882 (2003).
- Maehara, N. Experimental microcomputed tomography study of the 3D microangioarchitecture of tumors. European Radiology. 13 (7), 1559-1565 (2003).
- Garcia-Sanz, A., Rodriguez-Barbero, A., Bentley, M. D., Ritman, E. L., Romero, J. C. Three-dimensional microcomputed tomography of renal vasculature in rats. Hypertension. 31, 440-444 (1998).
- Badea, C., Hedlund, L. W., Johnson, G. A. Micro-CT with respiratory and cardiac gating. Medical Physics. 31 (12), 3324-3329 (2004).
- Ma, G., et al. Assessment of hemodynamics in a rat model of liver cirrhosis with precancerous lesions using multislice spiral CT perfusion imaging. BioMed Research International. 2013, 813174 (2013).
- Mannheim, J. G., et al. Comparison of small animal CT contrast agents. Contrast Media and Molecular Imaging. 11 (4), 272-284 (2016).
- Rothe, J. H., et al. Time course of contrast enhancement by micro-CT with dedicated contrast agents in normal mice and mice with hepatocellular carcinoma: comparison of one iodinated and two nanoparticle-based agents. Academic Radiology. 22 (2), 169-178 (2015).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유