JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
섬유아세포 활성화를 연구하기 위한 3D 바이오프린팅 광조정 가능 하이드로겔
요약
이 기사에서는 세포외 기질 경화 및 섬유아세포 활성화를 연구하기 위해 광조정 가능 하이드로겔을 3D 바이오프린팅하는 방법을 설명합니다.
초록
광조정 가능한 하이드로겔은 빛 노출에 반응하여 공간적, 시간적으로 변형될 수 있습니다. 이러한 유형의 생체 재료를 세포 배양 플랫폼에 통합하고 미세환경 강성 증가와 같은 변화를 동적으로 유발함으로써 연구자들은 섬유화 질환 진행 중에 발생하는 세포외 기질(ECM)의 변화를 모델링할 수 있습니다. 여기에서, 젤라틴 지지 수조 내에서 2개의 순차적 중합 반응이 가능한 광조정 가능한 하이드로겔 생체 재료를 3D 바이오프린팅하기 위한 방법이 제시된다. 부유 하이드로겔의 자유형 가역적 임베딩(FRESH) 바이오프린팅 기술은 마이클 첨가 반응을 촉진하기 위해 지지 수조의 pH를 조정하여 조정되었습니다. 먼저, 폴리(에틸렌글리콜)-알파메타크릴레이트(PEGαMA)를 함유하는 바이오잉크를 세포분해성 가교제와 화학량론적으로 반응시켜 연질 하이드로겔을 형성하였다. 이 연질 하이드로겔은 나중에 광자극제와 빛에 노출되어 미반응기의 동질중합을 유도하고 하이드로겔을 경화시켰습니다. 이 프로토콜은 하이드로겔 합성, 3D 바이오프린팅, 광보강 및 3D 구조 내에서 섬유아세포 활성화를 평가하기 위한 종말점 특성 분석을 다룹니다. 여기에 제시된 방법을 통해 연구자들은 pH 촉매 중합 반응을 겪는 다양한 물질을 3D 바이오프린팅할 수 있으며 조직 항상성, 질병 및 복구의 다양한 모델을 엔지니어링하는 데 구현할 수 있습니다.
서문
3D 바이오프린팅은 연구자들이 3D 부피 내에 세포와 생체 재료를 정밀하게 증착하고 생체 조직의 복잡한 계층 구조를 재현할 수 있도록 하는 혁신적인 기술입니다. 지난 10년 동안 3D 바이오프린팅의 발전으로 박동하는 인간 심장 조직1, 신장 조직의 기능적 모델2, 폐 내 가스 교환 모델3, 암 연구를 위한 종양 모델4이 개발되었다. FRESH(Freeform Reversible Embedding of Suspended Hydrogel) 바이오프린팅과 같은 임베디드 3D 바이오프린팅 기술의 발명으로 폐 혈관(pulmonary blood vessel)5 및 심지어 인간의 심장( human heart)6 과 같은 복잡한 연조직 구조를 3D로 재현할 수 있게 되었습니다. FRESH 3D 바이오프린팅은 전단 담화 지지 수조로의 압출을 통해 부드러운 바이오잉크와 저점도 바이오잉크의 층별 프린팅을 용이하게 합니다. 서포트 수조는 Bingham 플라스틱 역할을 하고 인쇄 후 바이오잉크의 의도된 모양과 구조를 유지하는 밀접하게 포장된 젤라틴 미세 입자와 같은 재료로 구성됩니다. 인쇄된 구조체가 응고되면, 온도를 37°C7로 높여서 지지 수조를 용해시킬 수 있다.
최근 리뷰 기사는 FRESH 기술을 사용하여 다양한 출판물에서 3D 바이오프린팅된 재료를 요약했습니다. 이러한 천연 유래 물질은 콜라겐 유형 I에서 메타크릴레이트 히알루론산에 이르기까지 다양하며 여러 가지 겔화 메커니즘을 나타냅니다7. 이 3D 바이오프린팅 기술을 사용하여 수행된 대부분의 연구는 외부 자극에 반응하여 변하지 않는 정적 생체 재료를 사용합니다. 동적 광화 하이드로겔 생체 재료는 다양한 섬유화 질환을 모델링하기 위해 우리 연구실 및 기타 8,9,10,11,12에서 사용되었습니다. 정적 생체 재료와 달리 광조정 가능 바이오잉크를 사용하면 탄성 계수 값이 낮은 연화 모델을 생성하고 나중에 경질하여 미세 환경 경직 증가에 대한 세포 반응을 탐색할 수 있습니다.
섬유화 질환은 흉터와 경직을 유발할 수 있는 세포외 기질 생성의 증가를 특징으로 한다13. 조직 경직은 영향을 받은 조직의 추가 손상과 파괴를 시작하여 영구적인 장기 손상과 심지어 사망을 유발할 수 있습니다. 섬유화 질환은 전 세계 사망의 1/3을 차지합니다. 섬유아세포는 이 질병 상태에서 과잉 및 비정상적인 세포외 기질을 생성한다14,15. 증가된 섬유아세포 증식 및 세포외 기질 침착은 조직을 더욱 단단하게 하고 섬유화 양성 피드백 루프(profibrotic positive feedback loop)를 활성화시킨다16,17,18,19. 섬유아세포 활성화를 연구하는 것은 섬유화 질환을 이해하는 데 매우 중요합니다. 여기서는 3D 바이오프린팅을 사용하여 혈관의 3D 형상을 모방하는 것이 중요한 한 가지 섬유화 질환의 예로 인간 폐동맥 고혈압(PAH)을 제시하고 광조정 가능 하이드로겔의 동적 경화 기능을 소개합니다. PAH는 주요 폐동맥의 압력이 정상 수준을 초과하여 심장에 부담을 가하여 인간 폐동맥 외래 섬유아세포(HPAAF) 활성화를 증가시키고 혈관 조직을 경직시키는 상태입니다16,17,18,19. 광조정 가능한 폴리(에틸렌 글리콜)-알파 메타크릴레이트(PEGαMA) 바이오잉크 제형은 구조물의 시간적 경화를 허용하고 건강한 조직과 질병 진행을 모두 모델링하는 데 도움이 됩니다 5,8,9,10. 이 고유한 기능을 활용하면 미세환경 경화에 대한 반응으로 HPAAF 활성화 및 증식을 3D로 정량화할 수 있으며 이 질병과 관련된 세포 메커니즘에 대한 귀중한 통찰력을 제공할 수 있습니다. 여기에 설명된 프로토콜을 통해 연구자들은 질병 진행 또는 조직 복구 중 세포 외 미세환경의 변화를 요약하는 3D 모델을 만들고 섬유아세포 활성화를 연구할 수 있습니다.
프로토콜
1. PEGαMA 합성 및 특성화
참고 : 폴리 (에틸렌 글리콜) - 알파 메타 크릴 레이트 (PEGαMA) 합성은 Hewawasam et al .에서 채택되었으며 습기가없는 조건에서 수행되었습니다9.
- 반응물의 무게를 잰다.
알림: 예를 들어ample, 5g 10kg/mol 8암 PEG-하이드록실(PEG-OH) 및 0.38g 수소화나트륨(NaH)의 무게를 잰다( 재료 표 참조). - 250mL 슐렝크 플라스크에 교반 막대를 넣고 아르곤으로 퍼지합니다.
- 슐렝크 플라스크 내에서 용해하는 데 필요한 가장 적은 양의 무수 테트라히드로푸란(THF)에 PEG-OH를 용해시킵니다.
참고: 약 80mL의 THF는 5g의 PEG-OH를 용해시킵니다. PEG-OH를 용해하는 데 필요한 최소량의 THF를 추가합니다. - 반응 혼합물에 몰 초과 NaH의 3배를 첨가하고 실온(RT)에서 30분 동안 교반합니다.
- 과잉 몰 에틸 2-(브로모메틸)아크릴레이트(EBrMA, 재료표 참조)를 슐렝크 플라스크에 6배 적가하고 반응 용기를 알루미늄 호일로 덮어 빛으로부터 보호합니다. 실온에서 약 48시간 동안 반응을 저어줍니다.
참고: 5g의 PEG-OH 및 0.38g의 NaH의 경우 이 반응에 3.68mL EBrMA를 사용합니다. - 반응을 소멸시키기 위해 1N 아세트산 몇 방울을 첨가합니다. 여과 보조제를 통해 용액을 진공 여과합니다.
알림: 아세트산을 첨가하면 기포가 생성됩니다. 혼합물이 성공적으로 담금질되었음을 나타내므로 기포 형성이 중지되면 아세트산 방울 추가를 중지하십시오. - 여과액을 회전 증발기에 농축하고 4°C 디에틸 에테르에 침전시킵니다. 침전물을 4-12시간 동안 18°C에서 빛으로부터 보호하십시오.
- Whatman 필터 용지를 Buchner 깔때기에 추가합니다. 반응 혼합물을 여과지 위에 천천히 붓고 진공 흡입을 사용하여 침전물을 디에틸 에테르에서 분리합니다. 건조하고 깨끗한 여과 플라스크에 침전물을 수집합니다.
- 제품을 실온에서 최소 5시간 또는 밤새 진공 건조하고 필요한 최소한의 탈이온수로 녹입니다. 용해된 제품을 투석 튜브( 재료 표 참조)에 옮기고 최소 4일 동안 3.5L의 탈이온수에 대해 투석합니다. 12시간마다 투석수를 교체하십시오.
알림: 제품은 진공 건조 후 완전히 건조된 순백색 고체 분말로 나타납니다. - 제품을 급속 냉동하고 약 72시간 동안 또는 완전히 건조될 때까지 동결 건조합니다.
- 제품을 클로로포름 D(CDCl3)에 녹입니다. 2.5초의 완화 시간으로 248개의 스캔을 수행하는 프로토콜과 함께 1HNMR을 사용하여 샘플을 실행합니다.
- CDCl3 용매 피크를 7.26PPM으로 보정하여 제품의 기능화 및 순도를 확인합니다. PEG 백본 양성자에 대한 피크를 적분하고(d3.71) 적분을 114로 보정합니다.
- 나머지 피크를 적분: PEGαMA 1H NMR (300 MHz, CDCl 3): d (ppm) 1.36 (t, 3H, CH 3-),3.71 (s, 114H, PEG CH 2-CH 2), 4.29 (t, s, 4H, -CH 2-C(O)-O-O, -O-CH2-C(=CH 2)-), 5.93 (q, 1H, -C=CH 2), 6.34 (q, 1H, -C=CH 2) 및 αMA 알켄 말단기 피크에 대한 적분을 PEG 백본 보정(그림 1).
참고: "a"로 표시된 두 피크의 평균을 구하고 100을 곱하여 평균 PEGαMA 기능화 백분율을 구합니다.
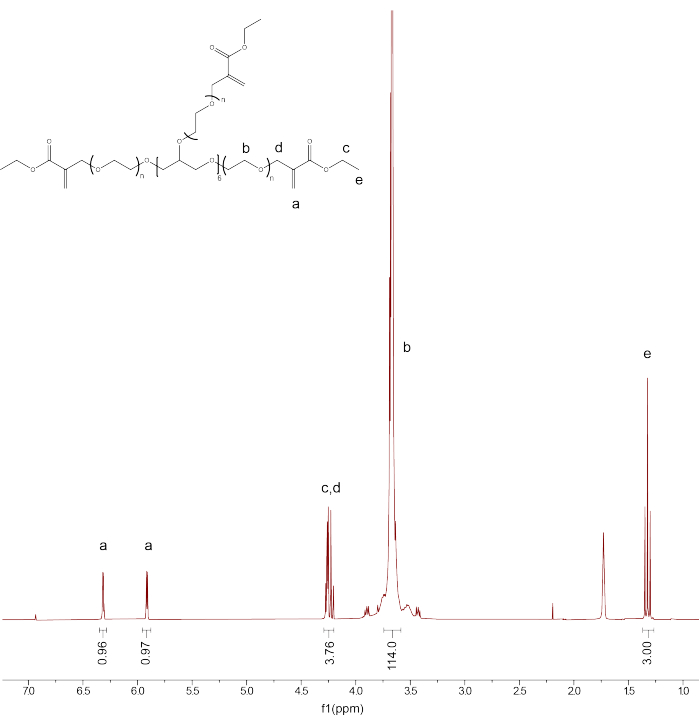
그림 1: 양성자 NMR은 성공적인 PEGαMA 기능화를 확인했습니다. NMR 분석은 클로로포름-D(CDCl3)에서 수행되었으며 96.5%의 기능화를 보여주었습니다. PEGαMA 1 H NMR (300 MHz, CDCl3): d (ppm) 1.36(t, 3H, CH 3-),3.71 (s, 114H, PEG CH 2-CH 2), 4.29 (t, s, 4H, -CH 2-C(O)-O-O, -O-CH2-C(=CH 2)-), 5.93 (q, 1H, -C=CH 2), 6.34 (q, 1H, -C=CH 2). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
2. 모델 설계 및 3D 바이오프린터 설정
참고: 시중에서 판매되는 3D 프린터(재료 표 참조)는 열가소성 압출기를 맞춤형 주사기 펌프 압출기로 교체하여 수정되었으며 Hinton et al.20에서 수정되었습니다. 오픈 소스 디자인은 온라인에서 사용할 수 있습니다 : https://3d.nih.gov/users/awfeinberg.
- Fusion 360 소프트웨어( 재료 목차 참조)를 열고 3D 컴퓨터 지원 중공 원통 설계를 만듭니다.
참고: 이 단계에 사용할 수 있고 혈관 형상을 모방하는 다운로드 가능한 파일은 보충 파일 1에서 찾을 수 있습니다. - 저장 file Slic3r 소프트웨어 내에서 엽니다( 재료 표 참조). 모든 매개변수가 원하는 대로인지 다시 확인한 다음 G 코드 내보내기 버튼을 누릅니다. G 코드를 컴퓨터에 저장합니다.
- Pronterface 소프트웨어( 재료 표 참조)를 열고 G 코드 파일을 업로드합니다.
알림: Pronterface 소프트웨어는 바이오프린터와 인터페이스하고 충분한 하드웨어 입력 제어를 제공합니다. 사용 가능한 G 코드 파일은 보충 파일 2에서 찾을 수 있습니다. - 바이오프린터 및 모든 관련 부품을 무균 기술을 사용하여 생물안전 작업대(BSC)로 옮깁니다.
- 30G 0.5" 길이의 뭉툭한 바늘 끝( 재료 표 참조)을 인쇄 유리 주사기에 조립하고 따로 보관합니다.
- 바이오프린터의 전원 코드를 콘센트에 꽂습니다. 바이오프린터 전면에 있는 빨간색 전원 버튼을 눌러 전원을 켭니다. 컴퓨터와 바이오프린터 사이에 범용 직렬 버스(USB) 코드를 연결하고 모든 전선 연결이 설정되고 꽂혀 있는지 확인합니다.
3. 지지 수조 및 시약의 준비
알림: 무균 기술을 사용하여 생물 안전 캐비닛의 모든 단계를 수행하십시오.
- 제조업체의 지침에 따라 소 태아 혈청(FBS)을 제외한 SmBM 기초 배지(CC-3181) 및 SmGM-2 SingleQuots 보충제(CC-4149)로 구성된 세포 배양 배지를 준비합니다. 사용할 때까지 4 °C에서 보관하십시오.
- 세포 배양 배지 50mL를 분취하고 FBS(CC-4149)의 1% v/v를 첨가하여( 재료 표 참조) 저혈청 배지를 만듭니다. 사용할 때까지 4 °C에서 보관하십시오.
- FBS를 용매로 사용하지 않는 멸균 세포 배양 배지를 사용하여 제조업체의 지침에 따라 젤라틴 슬러리 분말을 재현탁시킵니다( 재료 표 참조). 사용 직전에 젤라틴 슬러리의 최종 pH를 9M 수산화칼륨(KOH) 및/또는 2M 염산(HCl)을 사용하여 pH 2로 조정하여 pH 측정기를 사용하여 필요에 따라 용액 pH를 조정합니다.
- 바늘 없이 주사기를 사용하여 웰당 1mL의 젤라틴 슬러리를 사용하여 각각 약 절반으로 채워진 24웰 플레이트의 원하는 수의 웰을 채웁니다.
알림: 웰 중앙을 균일하게 채우고 공기 주머니가 없는지 확인하십시오. 플레이트를 두드리면 미세 입자 슬러리가 고르게 분포됩니다. 각 바이오프린트 크기와 모양을 수용하기 위해 필요에 따라 우물당 슬러리의 높이와 부피를 조정합니다. 사용자는 젤라틴 슬러리를 각 웰로 옮기기 위해 수제 주사기를 만들 수 있습니다. 이는 바닥에 이미 압축된 젤라틴 슬러리가 들어 있는 50mL 시험관에 올바른 크기의 주사기 플런저를 추가하여 수행할 수 있습니다. 플런저를 삽입하는 동안 시험관 옆에 작은 가이드 와이어를 삽입하여 공기가 빠져나갈 수 있도록 한 다음 플런저가 젤라틴 슬러리와 접촉하면 제거합니다. 사용 직전에 면도날로 시험관의 끝을 잘라 젤라틴 슬러리가 튀어나올 구멍을 만들고 플런저를 누릅니다. - 채워진 24웰 플레이트를 바이오프린터 s의 중앙에 놓습니다.tage 그리고 s에 고정tage.
참고: 그림 2 는 일반적인 바이오프린터 설정을 보여줍니다. 프린트 스테이지 주위에 고무 밴드를 배치하여 24웰 플레이트를 플랫폼에 고정하고 움직임을 방지합니다.

그림 2: 기본 3D 바이오프린팅 설정. 바이오프린터는 생물안전 캐비닛과 같은 멸균 환경 내에 설치되었으며, 프린트 헤드는 유리 주사기와 바늘이 아래의 지지 수조 인쇄 영역으로 수직으로 내려가도록 조립되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
4. 세포 배양
알림: 무균 기술을 사용하여 생물 안전 캐비닛의 모든 단계를 수행하십시오.
- HPAAF 세포(상업적으로 획득, 재료 표 참조)를 해동하고 제조업체의 지침(재료 표 참조)에 따라 SmBM 기초 배지(CC-3181) 및 모든 SmGM-2 SingleQuots 보충제(CC-4149)를 포함하는 T-75 조직 배양 처리된 플라스틱 플라스크에서 확장합니다(재료 표 참조).
참고: 부착 세포에 대한 표준 세포 배양 프로토콜을 사용하여 세포를 37°C 및 5%CO2 로 유지하고 며칠마다 배지를 보충해야 합니다. - HPAAF가 ~80-90% 밀도에 도달하면 배지를 흡인하고 인산염 완충 식염수(PBS)로 세포를 한 번 헹굽니다.
- 각 T-75 플라스크에 약 4mL의 예열된 0.05% 트립신-EDTA를 추가합니다. 플라스크를 기울여 전체 세포 배양 표면이 0.05% 트립신-EDTA 용액으로 덮이도록 합니다. 플라스크를 37°C에서 3-5분 동안 배양하고 세포 분리를 확인합니다.
- 세포가 떠 있으면 각 플라스크에 최소 6mL의 Dulbecco's Modified Eagle Medium(DMEM)을 넣고 세포를 50mL 원뿔형 튜브에 옮깁니다.
- 세포 현탁액을 실온에서 300 x g 에서 5분 동안 원심분리하여 세포를 펠렛화합니다. 세포 펠릿에서 상층액을 흡인하고 1000μL 피펫을 사용하여 FBS로 1-3mL 배지에 세포를 재현탁시켜 단일 세포 현탁액을 보장합니다.
- 셀 현탁액 10μL를 마이크로 원심분리 튜브로 옮깁니다. 트리판 블루 용액 10μL를 넣고 잘 섞는다. 이 혼합물 10μL를 사용하여 도립 광학 현미경을 사용하여 혈구계 내의 세포를 계수합니다.
참고: 4 x 106 cells/mL 최종 바이오잉크 농도를 달성하기 위해 바이오잉크 200μL당 800,000개의 섬유아세포를 따로 떼어 놓았습니다.
5. 하이드로겔 바이오잉크의 제조
참고: 바이오잉크 제제는 Davis-Hall et al.5에서 채택되었습니다. 5.1-5.2단계는 4.1-4.3단계와 병행하여 완료하여 바이오잉크에서 세포 수집과 재현탁 사이의 시간을 최소화할 수 있습니다. 무균 기술을 사용하여 생물 안전 작업대에서 단계를 수행합니다.
- 0.2μm 주사기 필터를 사용하여 20mM 트리스(2-카르복시에틸) 포스핀(TCEP, 재료 표 참조) pH 7 용액과 멸균 필터를 준비합니다. 사용 직전에 2M KOH 및/또는 2M HCl을 추가하여 필요에 따라 용액 pH를 조정하십시오. pH 측정기로 측정하고 그에 따라 조정하십시오.
알림: TCEP는 이황화물 결합을 감소시킵니다. - FBS가 없는 멸균 세포 배양 배지에 재현탁된 PEGαMA 0.25mg/mL 원액, 1,4-디티오트레이톨(DTT), MMP2 분해성 가교제 및 CGRGDS(RGD) 펩타이드의 250mM 원액( 재료 표 참조)을 준비하고, 모두 20mM 멸균 TCEP에 재현탁하고, 필요에 따라 피펫을 사용하여 증류수(DI)에 폴리(에틸렌옥사이드)(PEO)의 15wt% 원액을 준비합니다.
- 표 1을 기준으로 PEGαMA, DTT, MMP2 분해성 교차결합제, PEO, CGRGDS 및 저혈청 세포 배양 배지에 필요한 각 양을 섬유아세포와 함께 50mL 코니컬 튜브에 결합합니다.
알림: 이 조합은 pH가 6.2에 매우 가까워야 하므로 세포 배양 배지를 제외한 모든 것을 추가한 후 pH 스트립으로 pH를 확인하는 것이 좋습니다. 추가 pH 조정이 필요한 경우 전구체 용액의 pH를 조정하기 위해 필요한 추가 부피의 양을 추적하십시오. 남은 세포 배양 배지 부피에서 최종 pH 조정 중에 추가된 부피를 뺀 값을 추가하여 총 부피를 200μL로 올립니다. - 간접 치환 피펫을 사용하여 바이오잉크를 함께 혼합하여 세포가 단일 세포인지 확인하고 최종 전구체 용액이 pH 6.2인지 확인하여 3D 바이오프린팅 중 염기 촉매 중합을 방지합니다.
- 용액 내에 기포가 형성되지 않도록 주의하면서 플런저를 제거하고 15게이지 1.5인치 길이의 뭉툭한 바늘 팁( 재료 표 참조)이 부착된 별도의 주사기를 사용하여 바이오잉크를 원심분리 튜브에서 주사기로 옮겨 바이오잉크를 유리 주사기에 로드합니다.
- 유리 주사기를 프린트 헤드 안에 넣고 프린트 헤드 구성 요소를 부착하여 모든 것이 단단히 조립되고 인쇄할 준비가 되도록 합니다.
참고: 이 시점에서 프린트 헤드 내의 유리 주사기에는 인쇄를 위해 30게이지 0.5인치 길이의 뭉툭한 바늘 끝이 부착되어 있어야 합니다.
| 구성 요소 | 원액 농도 | 추가할 금액 |
| PEGαMA | 0.25 밀리그램 / 밀리람베르트 | 140 μL |
| 디티에이치티 | 250 밀리미터 | 12.24 마이크로리터 |
| MMP2 분해성 교차결합제 | 250 밀리미터 | 5.25 마이크로리터 |
| RGD (RGD) | 250 밀리미터 | 1.6 μL |
| 고용전문회사(PEO) | 15중량% | 33.33 마이크로리터 |
| 활성화 배지 및/또는 pH 조정 시약 | - | 7.58 마이크로리터 |
| 섬유아세포(Fibroblasts) | - | 800000 셀 |
표 1: 200μL의 바이오잉크(하이드로겔 전구체 용액 및 섬유아세포 세포)를 준비하는 데 필요한 부피의 예.
6.3D 바이오프린팅
알림: 무균 기술을 사용하여 생물 안전 캐비닛의 모든 단계를 수행하십시오.
- Pronterface 소프트웨어 내의 방향 화살표를 사용하여 압출 바늘의 위치를 웰 중앙과 지지 수조 슬러리 내에서 수동으로 조정합니다. 바늘 끝 아래에 최소 1mm의 지지 수조 슬러리를 남겨 두십시오.
알림: 소프트웨어는 공간 내에서 바늘이 어디에 있는지 알 수 없습니다. 소프트웨어 내에서 수동으로 화살표를 클릭하여 바늘을 이동하는 것은 전적으로 사용자의 몫입니다(예: 위쪽 화살표를 클릭하면 바늘이 인쇄 플랫폼에서 위 또는 멀어짐 등). 바늘이 우물의 경계에 부딪히지 않도록 조심스럽게 움직입니다. - 바늘 끝이 웰 내 슬러리 중앙에 위치하면 Pronterface 내의 시작 버튼을 누르고 그림 3A와 같이 인쇄가 완료될 때까지 기다렸다가 구성을 달성합니다.
참고: 제공된 파일(보충 파일 1)을 사용하여 하나의 구조물을 바이오프린팅하려면 약 3분이 소요됩니다. 바늘의 방향을 정하고 이동한 다음 하나의 구성을 처음부터 끝까지 완전히 인쇄하는 데 약 5분이 걸립니다. - 원하는 바이오프린팅 구성물의 수가 충족될 때까지 6.1-6.2단계를 반복합니다.
참고: 실패한 인쇄를 설명하기 위해 필요한 것보다 더 많은 구성을 만드는 것이 좋습니다. 실패가 발생하면 다음 웰로 이동하여 모든 것을 재설정하고 6.1-6.2단계를 다시 반복하십시오. - 웰 플레이트를 실온에 두고 인쇄가 완료된 후 BSC에서 1시간 동안 덮어 광조정 가능 하이드로겔의 염기 촉매 중합을 허용합니다.
- 3D 바이오프린팅 구조물이 들어 있는 웰 플레이트를 37°C 멸균 인큐베이터에 넣고 12-18시간 동안 그대로 두어 지지 수조 슬러리를 녹입니다.
그림 3: 실험적 회로도. 이 프로토콜은 세 가지 주요 단계로 설명되었습니다: (A) 폐 혈관을 모방하기 위해 세포가 내장된 3D 바이오프린팅 PEGαMA 중공 튜브. (B) 세포 미세환경을 강화하기 위한 단일중합 반응의 광개시. (C) 증식 및 활성화를 위한 세포 마커 평가. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
7.3D 바이오프린팅 구조물 배양 및 광보강
알림: 모든 단계는 무균 기술을 사용하여 생물 안전 캐비닛에서 수행해야 합니다.
- 0.2μm 주사기 필터를 사용하여 PBS 및 멸균 필터에 2.2mM 리튬 페닐-2,4,6-트리메틸벤조일포스피네이트(LAP)( 재료 표 참조) 원액을 준비합니다. LAP 솔루션을 빛으로부터 보호하십시오.
- 12-18시간 후, 바이오프린팅된 구조물 주변의 매체를 교체합니다. 웰 내에서 배지와 녹인 젤라틴 지지 수조를 수동으로 제거하고 바이오프린팅된 구조물을 방해하지 않도록 주의하십시오.
알림: 플레이트를 45° 각도로 잡고 매체를 천천히 제거하여 구조물이 웰 내에서 나타나고 볼 수 있도록 하는 것이 좋습니다. 투명한 하이드로겔 실린더는 성공적인 인쇄를 통해 각 웰에서 식별할 수 있어야 합니다(그림 4A). - 각 웰에 적절한 양의 저혈청 배지를 추가합니다.
참고: 24웰 플레이트의 경우 웰당 700μL 배지가 바이오프린팅된 구조물을 완전히 덮어야 합니다. 필요에 따라 조정합니다. - 플레이트를 인큐베이터로 되돌리고 3일마다 또는 실험 설계에 따라 샘플의 배지를 교체합니다.
- 원하는 경화 시점 24시간 전에 샘플에서 배지를 제거하고 2.2mM 멸균 LAP가 보충된 저혈청 배지로 교체합니다.
참고: 구조를 형광 라벨링하려면 10μM 메타크릴옥시에틸 티오카르바모일 로다민 B(T able of Materials)가 보충된 PBS의 3D 바이오프린팅 구조물을 밤새 팽창시킨 다음 7.6단계에 설명된 대로 강화하여 구조를 형광 라벨링합니다. 4°C에서 2일 동안 PBS로 옮겨 TRITC 필터를 사용하여 과도한 로다민과 이미지를 제거합니다(그림 4B,C). - 원하는 경화 시점에 경화할 웰에서 매체의 절반을 제거하고 UV 광선 아래에서 뚜껑을 닫은 상태로 플레이트를 놓습니다. UV 광선을 켜고 Omnicure(재료 표 참조)와 365nm 대역통과 필터(그림 3B)를 사용하여 10mW/cm2 365nm 빛을 5분 동안 적용하여 이러한 구조물을 강화합니다.
알림: 세포를 UV 광선에 노출시키기 전에 복사계/광도계를 사용하여 광도가 올바른지 확인하십시오. - 이 웰에서 남아 있는 배지를 제거하고 각 웰에 새로운 저혈청 배지를 추가합니다. 플레이트를 인큐베이터로 되돌립니다.
- 인큐베이터에서 플레이트를 꺼내고 9단계에 이어 원하는 시점에 섬유아세포 활성화 연구를 수행합니다.
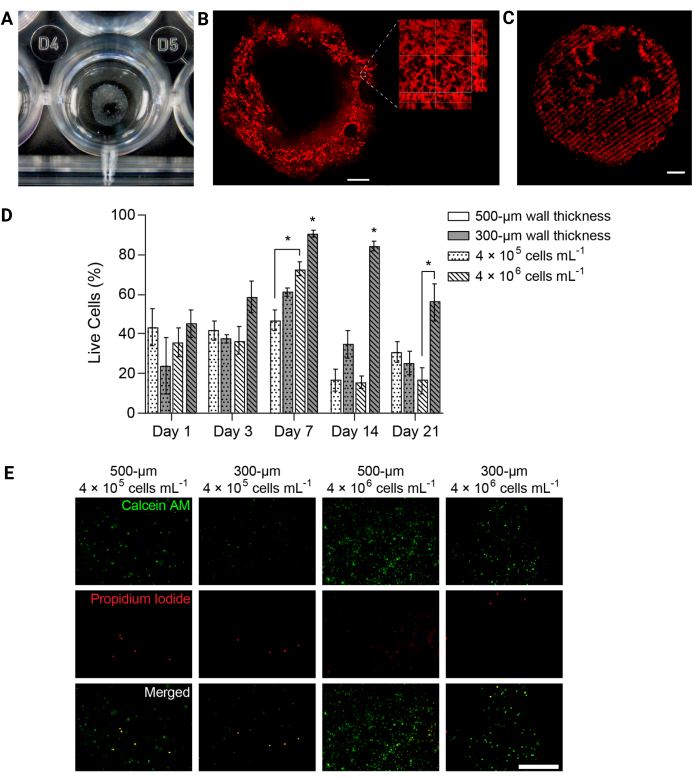
그림 4: 3D 바이오프린팅 하이드로겔 구조는 시간 경과에 따른 세포 생존력을 지원했습니다. (A) 24웰 플레이트의 3D 프린팅 하이드로겔 구조 사진. (B) 형광 표지된 PEGαMA 3D 프린팅 하이드로겔의 최대 강도 투영. 축척 막대 = 1mm. 고배율 현미경 검사는 FRESH 바이오프린팅 지지 수조에서 젤라틴 미세 입자에 의해 유도된 하이드로겔 구조 내의 기공을 보여주었습니다. (C) 컨포칼 현미경(최대 강도 투영으로 표시된 100μm z-stack)에서 형광 표지된 경화 영역이 있는 3D 프린팅 PEGαMA 튜브는 3D에서 경화에 대한 공간적 제어를 보여주었습니다. 스케일 바 = 500 μm. (D) Live/Dead 분석으로 측정한 3D 바이오프린팅 구조물의 HPAAF 생존력. 두께가 300μm이고 4 × 106 cells/mL의 구성물은 모든 시점에서 다른 모든 조건을 능가했습니다. 생존력은 7일째에 최고조에 달했습니다. 이 조건과 시점은 향후 실험을 위해 선택되었습니다. 열은 평균 ± SEM, n = 3을 표시합니다. *, p < 0.05, ANOVA, 터키 HSD. (E) 전체 생존율이 가장 높은 시점인 7일째에 살아있는/죽은 시약으로 염색된 3D 구조에서 세포의 대표 공초점 이미지. Calcein AM은 살아있는 세포를 녹색으로 표시하고 프로피듐 요오드화물은 죽은 세포를 빨간색으로 표시했습니다. 가장 오른쪽 열은 가장 성능이 좋은 조건이 균일한 세포 분포와 높은 비율의 살아있는 세포를 가지고 있음을 보여줍니다. 스케일 바 = 500μm. Davis-Hall et al.5의 허가를 받아 복제했습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
8. 섬유아세포 생존력 평가
- 원하는 생존 시간 시점에서 칼세인 AM 및 프로피듐 요오드화물을 사용하여 염색합니다( 재료 표 참조).
참고: 요약하자면, 각 웰에서 배지를 제거하고 멸균 PBS로 구조물을 헹궈야 합니다. 로커에서 37°C에서 40분 동안 살아있는/죽은 염색 용액에서 조성물을 배양합니다. 염색 용액에는 이미징 시 살아있는 세포와 죽은 세포를 식별하기 위해 칼세인 AM(1:1000 희석)과 프로피듐 요오드화물(1:1000 희석)이 포함되어야 합니다. - 구조물을 멸균 PBS로 옮기고 컨포칼 형광 현미경에서 즉시 이미지를 생성합니다. 시점별로 샘플당 3개의 서로 다른 100μm z-stack 이미지를 획득하고 생존율을 살아있는 세포의 평균 백분율로 표현합니다(그림 4D,E).
9. 섬유아세포 활성화 평가
- PBS에서 3% w/v 소 혈청 알부민(BSA) 및 0.1% v/v 트윈 20을 준비합니다. 이 용액을 면역형광(IF) 용액이라고 합니다.
- 원하는 시점에 샘플 웰에서 배지를 제거하고 PBS로 구조물을 헹굽니다. PBS를 4% 파라포름알데히드(PFA)로 교체하고 이 샘플을 로커에서 37분 동안 30°C로 유지합니다. 그런 다음 PBS에서 4% PFA를 100mM 글리신으로 교체하고 이 샘플을 실온(RT)의 로커에 15분 더 둡니다.
- 그런 다음 이 샘플을 Tissue-Tek 크라이오몰드로 옮기고 최적의 절단 온도(OCT) 용액으로 샘플을 완전히 덮고( 재료 표 참조) OCT가 4°C에서 12-18시간 동안 샘플에 확산되도록 합니다.
- 액체 질소를 사용하여 OCT에 담근 샘플을 2-메틸부탄에 급속 동결합니다. 스티로폼 상자 또는 기타 적절한 용기에 액체 질소를 채운 다음 액체 질소 안에 2-메틸부탄으로 채워진 두 번째 용기를 넣어 적어도 절반 이상 잠기도록 합니다. 겸자를 사용하여 OCT로 덮인 샘플이 포함된 각 냉동 몰드를 액체 질소 냉각 2-메틸부탄에 눈에 띄게 얼릴 때까지 유지합니다. 이 샘플은 극저온 절개 준비가 될 때까지 -80°C에서 보관할 수 있습니다.
주의 : 액체 질소를 취급하는 동안 극저온 안전 키트( 재료 표 참조)에 제공된 방한 장갑, 방한 앞치마 및 안면 보호대와 같은 개인 보호 장비(PPE)를 사용해야 합니다. - -22°C에서 동결된 OCT 샘플을 냉동 절편하고 10μm 두께의 슬라이스를 양전하를 띤 유리 현미경 슬라이드에 부착합니다. 각 3D 하이드로겔 샘플에 대해 슬라이드당 최소 3-5개의 극저온 절편이 있는 3개의 현미경 슬라이드를 준비합니다.
알림: 현미경 슬라이드는 정지 지점으로 필요한 경우 -80°C의 이 지점에서 보관할 수 있습니다. - 극저온 절편이 슬라이드에 부착되도록 얼음처럼 차가운 아세톤에 극저온 절편을 15분 동안 고정합니다. RT 물로 극저온 절편을 부드럽게 헹구어 남아 있는 OCT를 제거합니다. 이 샘플을 건조시키고 소수성 펜으로 극저온 절편의 윤곽을 그립니다( 재료 표 참조).
- PBS에서 0.2% v/v Triton X-100으로 실온에서 10분 동안 샘플을 투과시킨 다음 RT에서 1시간 동안 PBS에서 5% BSA w/v로 섹션을 차단합니다.
- 1차 마우스 항인간 알파 평활근 액틴(αSMA) 항체(1:250 희석)( 재료 표 참조)를 IF 용액에 추가합니다. 이 절편된 샘플은 1차 항체와 함께 4°C에서 밤새 보관합니다. 샘플을 IF 용액으로 3번 헹굽니다.
- IF 용액 1밀리리터당 2차 염소 항-마우스 Alexa Fluor 555 항체(1:250 희석)와 ActinGreen 488 ReadyProbe 2방울( 재료 표 참조)을 포함하는 IF 용액에서 절편을 배양합니다. 모든 후속 단계의 검체를 알루미늄 호일로 덮어 빛으로부터 보호하고 2차 항체 용액이 RT에서 1시간 동안 검체에 머물도록 합니다.
- IF 용액으로 섹션을 3번 헹굽니다. RT에서 15분 동안 DI 물에 300nM 4',6-diamidino-2-phylindole(DAPI)에서 배양합니다. DI 물로 섹션을 3번 최종 헹굽니다.
- 시중에서 판매되는 10μL의 퇴색 방지 시약( 재료 표 참조)을 사용하여 표준 방법을 사용하여 섹션을 커버슬립합니다.
알림: 장착된 슬라이드는 이미징에 필요할 때까지 -80°C 냉동고에서 빛으로부터 보호하여 보관할 수 있습니다. - 형광 현미경을 사용하여 cryosection을 이미지화합니다(그림 3C 및 그림 5B). 10x 대물렌즈를 사용하여 슬라이드당 3개의 무작위 섹션을 이미지화합니다.
참고: 이미지는 DAPI, FITC 및 TRITC 채널에서 촬영해야 합니다. - 이미지를 ImageJ(NIH)에 업로드합니다. 섬유아세포 활성화 측정으로 αSMA 양성 세포의 비율을 정량화합니다(그림 5A).
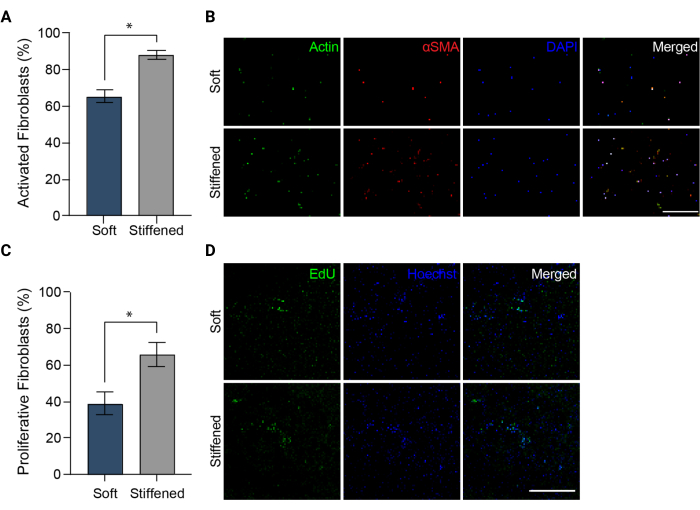
그림 5: 폐동맥 외막증의 3D 바이오프린팅 모델에서의 섬유아세포 활성화. (A) αSMA 발현으로 측정한 연질 및 경직 3D 하이드로겔의 섬유화 활성화. 경화된 구조체의 HPAAF는 부드러운 구조체의 세포보다 αSMA에 대해 유의하게 더 양성이었습니다. 열은 평균± SEM, n = 3을 나타냅니다. *, p < 0.05, Mann-Whitney U 검정. (B) 연질 및 경화 3D 하이드로겔에서 αSMA, 액틴 및 DAPI에 대한 면역염색의 대표적인 컨포칼 이미지. 경화된 구조체의 HPAAF는 부드러운 구조체의 세포보다 더 흔한 αSMA 면역형광을 보여주었습니다. 스케일 바 = 250 μm. (C) EdU 양성으로 측정된 연질 및 경화 3D 바이오프린팅 구조물의 섬유아세포 증식. 경화된 구조체의 HPAAF는 연성 구조체의 세포보다 EdU에 대해 유의하게 더 긍정적이었습니다. 열은 평균± SEM, n = 3을 나타냅니다. *, p < 0.05, Mann-Whitney U 검정. (D) 부드럽고 경화된 3D 하이드로겔에서 EdU 및 Hoechst 염료에 대한 면역염색의 대표적인 컨포칼 이미지. 경화된 구조물의 HPAAF는 연성 구조물의 세포보다 더 흔한 EdU 면역형광을 보여주었습니다. 눈금 막대 = 300μm. Davis-Hall et al.5의 허가를 받아 복제했습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
10. 섬유아세포 증식의 평가
- 원하는 증식 시점 24시간 전에 각 웰에서 세포 배양 배지를 제거하고 시판되는 세포 증식 키트에서 10μM EdU 용액이 보충된 저혈청 배지로 교체합니다( 재료 표 참조). 하룻밤 배양을 위해 샘플을 인큐베이터로 되돌립니다.
- 원하는 증식 시점에 4% PFA를 사용하여 EdU로 배양한 샘플을 37°C에서 30분 동안 로커에 고정합니다. PBS에서 4% PFA 용액을 100mM 글리신으로 교체하고 37°C에서 최소 15분 동안 샘플을 배양합니다. Hoechst를 적절한 농도로 30분 동안 첨가한 다음 PBS로 구조물을 2번 헹굽니다.
참고: 샘플은 이미징할 때까지 4°C에서 빛으로부터 보호하여 보관할 수 있습니다. - 형광 현미경과 제안된 세포 증식 키트 제조업체 설정 및 필터를 사용하여 고정 및 저장된 모든 EdU 샘플을 이미지화합니다(그림 3C 및 그림 5D). 샘플당 3개의 서로 다른 100μm z-stack 이미지를 획득하고 각 z-stack에서 최대 투영을 생성합니다. EdU 양성 세포의 수를 계산하고 최대 투영 이미지 내에서 Hoechst 대조염색으로 식별된 총 세포 수로 나누어 HPAAF 증식을 측정합니다(그림 5C).
결과
이 프로토콜은 인체 조직을 모방한 형상에서 섬유아세포 활성화를 연구하기 위해 동적 및 시간적 경화가 가능한 구조를 만들기 위해 지지 수조 내에서 광조정 가능한 하이드로겔을 3D 바이오프린팅하는 방법을 설명합니다. 먼저, 이 프로토콜은 이 광조정 가능 폴리머 시스템의 중추인 PEGαMA를 합성하는 방법을 설명했습니다. 핵 자기 공명(NMR) 분광법 측정은 96.5%에서 성공적인 PEGαMA 기능화를 보여...
토론
제어된 빛 노출에 대한 반응으로 2단계 중합 반응은 공간적 및 시간적 제어를 통해 생체 재료를 강화할 수 있습니다. 여러 연구에서 이 기술을 활용하여 다양한 플랫폼 5,8,9,10,11,21,22,23에서 세포-매트릭스 상호작용을 평가했습니다.
공개
저자는 공개할 이해 상충이 없습니다. 이 원고의 일부는 IOP Publishing https://doi.org/10.1088/1758-5090/aca8cf 의 © 허가를 받아 복제되었습니다. 5 판권 소유.
감사의 말
저자는 Adam Feinberg 박사(카네기 멜론 대학교)와 3D 바이오프린팅 오픈 소스 워크숍을 주최한 사람들에게 감사의 뜻을 전합니다. 이 사람들은 FRESH 바이오프린팅 기술을 배우고 이러한 연구에 사용되는 3D 바이오프린터를 구축할 수 있었습니다. 덧붙여, 저자들은 이 원고에서 인물을 생산하는 데 사용된 Biorender.com 인정하고 싶다. 이 연구는 Rose Community Foundation(DDH 및 CMM), Colorado Pulmonary Vascular Disease Research Award(DDH 및 CMM), Award 1941401(CMM)의 National Science Foundation, Award W81XWH-20-1-0037(CMM)의 미 육군부, Award R21 CA252172(CMM)의 NIH 국립 암 연구소, University of Colorado Anschutz Medical Campus의 Ludeman Family Center for Women's Health Research(DDH 및 CMM), R01 HL080396(CMM), R01 HL153096(CMM), F31 HL151122(DDH) 및 T32 HL072738(DDH 및 AT).
자료
| Name | Company | Catalog Number | Comments |
| AccuMax Radiometer/Photometer Kit | Spectronics Corporation | XPR-3000 | To measure light intensity, used for photostiffening |
| Acetic Acid | Fisher Scientific | BP2401-500 | Used during PEGaMA synthesis |
| Acetone | Fisher Scientific | A184 | Used with the cryosections |
| ActinGreen 488 ReadyProbes | Fisher Scientific | R37110 | Used for staining |
| Aluminum Foil | Reynolds | F28028 | |
| Anhydrous Tetrahydrofuran (THF) | Sigma-Aldrich | 401757-1L | Used during PEGaMA synthesis |
| Argon Compressed Gas | Airgas | AR R300 | Used during PEGaMA synthesis |
| 8 Arm Poly(ethylene glycol)-hydroxyl (PEG-OH) | JenKem Technology | 8ARM-PEG-10K | Used during PEGaMA synthesis |
| 365 nm Bandpass Filter | Edmund Optics | 65-191 | Used for photostiffening |
| Bovine Serum Albumin (BSA) | Fisher Scientific | BP9700-100 | Used during staining process |
| Buchner Funnel | Quark Glass | QFN-8-14 | Used during PEGaMA synthesis |
| Calcein AM | Invitrogen | 65-0853-39 | Used during staining process |
| Celite 545 (Filtration Aid) | EMD Millipore | CX0574-1 | Used during PEGaMA synthesis |
| Charged Microscope Slides | Globe Scientific | 1358W | |
| Chloroform-d | Sigma-Aldrich | 151823-10X0.75ML | Used to characterize PEGaMA |
| Click-iT Plus EdU Cell Proliferation Kit | Invitrogen | C10637 | Used for staining |
| 50 mL Conical Tubes | CELLTREAT | 667050B | |
| Cryogenic Safety Kit | Cole-Parmer | EW-25000-85 | |
| Cryostat | Leica | CM 1850-3-1 | |
| Dialysis Tubing | Repligen | 132105 | |
| 4’,6-Diamidino-2-Phylindole (DAPI) | Sigma-Aldrich | D9542-1MG | Used for staining |
| Diethyl Ether | Fisher Scientific | E1384 | Used during PEGaMA synthesis |
| 1,4-Dithiothreitol (DTT) | Sigma-Aldrich | 10197777001 | Bioink component |
| Dulbecco's Modified Eagle's Medium (DMEM) | Cytiva | SH30271.FS | |
| Filter Paper | Whatman | 1001-090 | Used during PEGaMA synthesis |
| Freezone 2.5L Freeze Dry System | Labconco | LA-2.5LR | Lyophilizer |
| Fusion 360 | Autodesk | N/A | Software download |
| 2.5 mL Gastight Syringe | Hamilton | 81420 | Used for bioprinting |
| 15 Gauge 1.5" IT Series Tip | Jensen Global | JG15-1.5X | Used for bioprinting |
| 30 Gauge 0.5" HP Series Tip | Jensen Global | JG30-0.5HPX | Used for bioprinting |
| Goat Anti-Mouse Alexa Fluor 555 Antibody | Fisher Scientific | A21422 | Used for staining |
| Glycine | Fisher Scientific | C2H5NO2 | Used during staining process |
| Hemocytometer | Fisher Scientific | 1461 | |
| Hoechst | Thermo Scientific | 62249 | Used during staining process |
| Human Pulmonary Artery Adventitial Fibroblasts (HPAAFs) | AcceGen | ABC-TC3773 | From a 2-year-old male patient |
| Hydrochloric Acid (HCl) | Fisher Scientific | A144-500 | Used to pH adjust solutions |
| ImageJ | National Institutes of Health (NIH) | N/A | Free software download |
| ImmEdge® Pen | Vector Laboratories | H-4000 | Used during staining process |
| Incubator | VWR | VWR51014991 | |
| LifeSupport Gelatin Microparticle Slurry (Gelatin Slurry) | Advanced Biomatrix | 5244-10GM | Used for bioprinting |
| Light Microscope | Olympus | CKX53 | Inverted light microscope |
| Lithium Phenyl-2,4,6-Trimethylbenzoylphosphinate (LAP) | Sigma-Aldrich | 900889-5G | Photoinitiator used for photostiffening |
| Liquid Nitrogen | N/A | N/A | |
| LulzBot Mini 2 | LulzBot | N/A | Bioprinter adapted |
| Methacryloxyethyl Thiocarbamoyl Rhodamine B | Polysciences Inc. | 669775-30-8 | |
| 2-Methylbutane | Sigma-Aldrich | M32631-4L | |
| Microman Capillary Pistons CP1000 | VWR | 76178-166 | Positive displacement pipette tips |
| MMP2 Degradable Crosslinker (KCGGPQGIWGQGCK) | GL Biochem | N/A | Bioink component |
| Mouse Anti-Human αSMA Monoclonal Antibody | Fisher Scientific | MA5-11547 | Used for staining |
| OmniCure Series 2000 | Lumen Dynamics | S2000-XLA | UV light source used for photostiffening |
| Paraformaldehyde (PFA) | Electron Microscopy Sciences | 15710 | Used to fix samples |
| pH Meter | Mettler Toledo | FP20 | |
| pH Strips | Cytiva | 10362010 | |
| Phosphate Buffered Saline (PBS) | Hyclone Laboratories, Inc. | Cytiva SH30256.FS | |
| Pipette Set | Fisher Scientific | 14-388-100 | |
| 10 µL Pipette Tips | USA Scientific | 1120-3710 | |
| 20 µL Pipette Tips | USA Scientific | 1183-1510 | |
| 200 µL Pipette Tips | USA Scientific | 1111-0700 | |
| 1000 µL Pipette Tips | USA Scientific | 1111-2721 | |
| Poly(Ethylene Glycol)-Alpha Methacrylate (PEGαMA) | N/A | N/A | Refer to manuscript for synthesis steps |
| Poly(Ethylene Oxide) (PEO) | Sigma-Aldrich | 372773-250G | Bioink component |
| Positive Displacement Pipette | Fisher Scientific | FD10004G | 100-1000 µL |
| Potassium Hydroxide (KOH) | Sigma-Aldrich | 221473-500G | Used to pH adjust solutions |
| ProLong Gold Antifade Reagent | Invitrogen | P36930 | Used during staining process |
| Pronterface | All3DP | N/A | Software download |
| Propidium Iodide | Sigma-Aldrich | P4864-10ML | Used for staining |
| RGD Peptide (CGRGDS) | GL Biochem | N/A | Bioink component |
| Rocker | VWR | 10127-876 | |
| Rotary Evaporator | Thomas Scientific | 11100V2022 | Used during PEGaMA synthesis |
| Rubber Band | Staples | 808659 | |
| Schlenk Flask | Kemtech America | F902450 | Used during PEGaMA synthesis |
| Slic3r | Slic3r | N/A | Software download |
| Smooth Muscle Cell Growth Medium-2 (SmGM-2) BulletKit | Lonza | CC-3182 | Kit contains CC-3181 and CC-4149 components |
| Sodium Hydride | Sigma-Aldrich | 223441-50G | Used during PEGaMA synthesis |
| Sorvall ST 40R Centrifuge | Fisher Scientific | 75-004-525 | |
| Stir Bar | VWR | 58948-091 | |
| Syringe Filter | VWR | 28145-483 | Used to sterile filter solutions |
| T-75 Tissue-Cultured Treated Flask | VWR | 82050-856 | Used for cell culture work |
| Tissue-Tek Cyromold | Sakura | 4557 | |
| Tissue-Tek O.C.T Compound (OCT) | Sakura | 4583 | |
| Tris(2-Carboxyethyl) Phosphine (TCEP) | Sigma-Aldrich | C4706-2G | |
| Triton X-100 | Fisher Bioreagents | C34H622O11 | Used during staining process |
| Trypan Blue | Sigma-Aldrich | T8154-20ML | Used for cell culture work |
| 0.05% Trypsin-EDTA | Gibco | 25-300-062 | Used for cell culture work |
| Tween 20 | Fisher Bioreagents | C58H114O26 | Used during staining process |
| Upright Microscope | Olympus | BX63F | Fluorescent microscope capabilities |
| Water Bath | PolyScience | WBE20A11B | |
| 24-Well Tissue Culture Plates | Corning | 3527 |
참고문헌
- Ahrens, J. H., et al. Programming cellular alignment in engineered cardiac tissue via bioprinting anisotropic organ building blocks. Advanced Materials. 34 (26), e2200217 (2022).
- Lin, N. Y. C., et al. Renal reabsorption in 3D vascularized proximal tubule models. Proceedings of the National Academy of Sciences of the United States of America. 116 (12), 5399-5404 (2019).
- Grigoryan, B., et al. Multivascular networks and functional intravascular topologies within biocompatible hydrogels. Science. 364 (6439), 458-464 (2019).
- Kang, Y., Datta, P., Shanmughapriya, S., Ozbolat, I. T. 3D bioprinting of tumor models for cancer research. ACS Applied Biomaterials. 3 (9), 5552-5573 (2020).
- Davis-Hall, D., Thomas, E., Pena, B., Magin, C. M. 3D-bioprinted, phototunable hydrogel models for studying adventitial fibroblast activation in pulmonary arterial hypertension. Biofabrication. 15 (1), (2022).
- Mirdamadi, E., Tashman, J. W., Shiwarski, D. J., Palchesko, R. N., Feinberg, A. W. FRESH 3D bioprinting of a full-size model of the human heart. ACS Biomaterials Science & Engineering. 6 (11), 6453-6459 (2020).
- Shiwarski, D. J., Hudson, A. R., Tashman, J. W., Feinberg, A. W. Emergence of FRESH 3D printing as a platform for advanced tissue biofabrication. APL Bioengineering. 5 (1), 010904 (2021).
- Petrou, C. L., et al. Clickable decellularized extracellular matrix as a new tool for building hybrid hydrogels to model chronic fibrotic diseases in vitro. Journal of Materials Chemistry B. 8 (31), 6814-6826 (2020).
- Hewawasam, R. S., Blomberg, R., Serbedzija, P., Magin, C. M. Chemical modification of human decellularized extracellular matrix for incorporation into phototunable hybrid hydrogel models of tissue fibrosis. ACS Applied Materials & Interfaces. 15 (12), 15071-15083 (2023).
- Saleh, K. S., et al. Engineering hybrid hydrogels comprised healthy or diseased decellularized extracellular matrix to study pulmonary fibrosis. Cellular and Molecular Bioengineering. 15 (5), 505-519 (2022).
- Guvendiren, M., Burdick, J. A. Stiffening hydrogels to probe short- and long-term cellular responses to dynamic mechanics. Nature Communications. 3, 792 (2012).
- Rosales, A. M., Vega, S. L., DelRio, F. W., Burdick, J. A., Anseth, K. S. Hydrogels with reversible mechanics to probe dynamic cell microenvironments. Angewandte Chemie International Edition English. 56 (40), 12132-12136 (2017).
- Wynn, T. A., Ramalingam, T. R. Mechanisms of fibrosis: therapeutic translation for fibrotic disease. Nature Medicine. 18 (7), 1028-1040 (2012).
- Huertas, A., Tu, L., Humbert, M., Guignabert, C. Chronic inflammation within the vascular wall in pulmonary arterial hypertension: more than a spectator. Cardiovascular Research. 116 (5), 885-893 (2020).
- Kendall, R. T., Feghali-Bostwick, C. A. Fibroblasts in fibrosis: novel roles and mediators. Frontiers in Pharmacology. 5, 123 (2014).
- Parker, M. W., et al. Fibrotic extracellular matrix activates a profibrotic positive feedback loop. The Journal of Clinical Investigation. 124 (4), 1622-1635 (2014).
- Habiel, D. M., Hogaboam, C. Heterogeneity in fibroblast proliferation and survival in idiopathic pulmonary fibrosis. Frontiers in Pharmacology. 5, 2 (2014).
- Hu, C. J., Zhang, H., Laux, A., Pullamsetti, S. S., Stenmark, K. R. Mechanisms contributing to persistently activated cell phenotypes in pulmonary hypertension. The Journal of Physiology. 597 (4), 1103-1119 (2019).
- Li, M., et al. Emergence of fibroblasts with a proinflammatory epigenetically altered phenotype in severe hypoxic pulmonary hypertension. The Journal of Immunology. 187 (5), 2711-2722 (2011).
- Hinton, T. J., et al. Three-dimensional printing of complex biological structures by freeform-reversible embedding of suspended hydrogels. Science Advances. 1 (9), e1500758 (2015).
- Brown, T. E., et al. Secondary photocrosslinking of click hydrogels to probe myoblast mechanotransduction in three dimensions. Journal of the American Chemical Society. 140 (37), 11585-11588 (2018).
- Ondeck, M. G., et al. Dynamically stiffened matrix promotes malignant transformation of mammary epithelial cells via collective mechanical signaling. Proceedings of the National Academy of Sciences of the United States of America. 116 (9), 3502-3507 (2019).
- Caliari, S. R., et al. Stiffening hydrogels for investigating the dynamics of hepatic stellate cell mechanotransduction during myofibroblast activation. Scientific Reports. 6, 21387 (2016).
- Liu, F., et al. Feedback amplification of fibrosis through matrix stiffening and COX-2 suppression. Journal of Cell Biology. 190 (4), 693-706 (2010).
- Tschumperlin, D. J., Ligresti, G., Hilscher, M. B., Shah, V. H. Mechanosensing and fibrosis. The Journal of Clinical Investigation. 128 (1), 74-84 (2018).
- Chelladurai, P., Seeger, W., Pullamsetti, S. S. Matrix metalloproteinases and their inhibitors in pulmonary hypertension. European Respiratory Journal. 40 (3), 766-782 (2012).
- Caracena, T., et al. Alveolar epithelial cells and microenvironmental stiffness synergistically drive fibroblast activation in three-dimensional hydrogel lung models. Biomaterials Science. 10 (24), 7133-7148 (2022).
- Ruskowitz, E. R., DeForest, C. A. Proteome-wide analysis of cellular response to ultraviolet light for biomaterial synthesis and modification. ACS Biomaterials Science & Engineering. 5 (5), 2111-2116 (2019).
- Kruse, C. R., et al. The effect of pH on cell viability, cell migration, cell proliferation, wound closure, and wound reepithelialization: In vitro and in vivo study. Wound Repair and Regeneration. 25 (2), 260-269 (2017).
- Filippi, M., et al. Perfusable biohybrid designs for bioprinted skeletal muscle tissue. Advanced Healthcare Materials. , e1500758 (2023).
- Matthiesen, I., et al. Astrocyte 3D culture and bioprinting using peptide-functionalized hyaluronan hydrogels. Science and Technology of Advanced Materials. 24 (1), 2165871 (2023).
- Xu, L., et al. Bioprinting a skin patch with dual-crosslinked gelatin (GelMA) and silk fibroin (SilMA): An approach to accelerating cutaneous wound healing. Materials Today Bio. 18, 100550 (2023).
- Bliley, J. M., Shiwarski, D. J., Feinberg, A. W. 3D-bioprinted human tissue and the path toward clinical translation. Science Translational Medicine. 14 (666), eabo7047 (2022).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유