실험적 자가면역 뇌척수염에서 중추신경계 염증, 탈수초화 및 축삭 손상 채점
요약
실험적 자가면역 뇌척수염(EAE)은 다발성 경화증의 동물 모델 역할을 합니다. 이 기사에서는 EAE에서 척수 염증, 탈수초화 및 축삭 손상을 채점하는 접근 방식을 설명합니다. 또한, 생쥐 혈청에서 용해성 신경 필라멘트 광 수준을 정량화하는 방법이 제시되어 살아있는 생쥐의 축삭 손상 평가를 용이하게 합니다.
초록
실험적 자가면역 뇌척수염(EAE)은 다발성 경화증(MS)의 일반적인 면역 기반 모델입니다. 이 질병은 미엘린 수초의 단백질 성분과 완전한 프로인트 보조제(CFA)를 사용한 적극적인 면역에 의해 또는 미엘린 단백질/CFA를 프라이밍한 설치류에서 미엘린 특이적 T 효과기 세포를 순진한 설치류로 전달하여 설치류에서 유발될 수 있습니다. EAE의 중증도는 일반적으로 상행 마비의 정도를 측정하는 5점 임상 척도로 점수가 매겨지지만 이 척도는 EAE에서 회복 정도를 평가하는 데 최적이 아닙니다. 예를 들어, 일부 EAE 모델(예: EAE의 미엘린 희소돌기아교세포 당단백질[MOG] 펩타이드 유도 모델)에서 임상 점수는 높은 수준을 유지합니다. 따라서 중추 신경계(CNS)에서 세포 손상의 기본 메커니즘을 연구하는 수단을 제공하는 EAE의 조직학적 점수로 임상 점수를 보완하는 것이 중요합니다.
여기에서는 생쥐의 척수 및 뇌 절편을 준비하고 염색하고 척수의 염증, 탈수초화 및 축삭 손상을 점수화하기 위한 간단한 프로토콜이 제시됩니다. 척수에서 백혈구 침윤을 채점하는 방법은 EAE에서 뇌 염증을 채점하는 데에도 적용될 수 있습니다. SIMOA(Small Molecule Assay) 분석을 사용하여 마우스의 혈청에서 용해성 신경필라멘트 광(sNF-L)을 측정하기 위한 프로토콜도 설명되며, 이는 살아있는 마우스의 전체 CNS 손상 정도에 대한 피드백을 제공합니다.
서문
실험적 자가면역 뇌척수염(EAE)은 인간 탈수초성 질환인 다발성 경화증(MS)1에 대한 가장 흔한 쥐 모델입니다. IFN-γ(감마) 및 IL-17 생성 T도우미 세포2의 침윤, 염증성 단핵구의 침윤3, 혈관 주위 및 수막하 염증성 탈수초성 병변4의형성, 중추신경계(CNS)의 축삭 손상4 발생을 포함한 전형적인 다발성경화증 염증 병리학도 EAE 5,6,7,8,9에서 관찰된다. EAE와 다발성경화증 사이 면역 기계장치에 있는 유사성은 EAE를 나탈리주맙, fingolimod, 디메틸 fumarate 및 glatiramer 아세테이트를 포함하여 다발성 경화증을 위한 다수 승인되는 면역 근거한 치료의 효험 그리고 작용의 기계장치 시험을 위한 적당한 전임상 모형 만들었습니다 (1,5에서 검토됨). 특정 EAE 식이요법은 뇌의 수막하 염증, 만성 탈수초화, 척수 위축, 시냅스 및 뉴런 손실의 발달을 포함하여 축삭 손상을 넘어 진행성 다발성경화증 병리학의 다른 측면을 모델링합니다 6,10,11,12. 따라서 EAE는 다발성경화증에 대한 신경 보호 요법의 효능을 선별하는 데 유용합니다.
EAE는 여러 가지 방법으로 설치류에서 유도됩니다. 능동 면역은 가장 일반적인 유도 방법이며, 열사멸 결핵균(Mycobacterium tuberculosis)이 보충된 CFA에서 유화된 미엘린 항원(전체 단백질 또는 펩타이드)으로 설치류를 면역화하는 것을 포함한다 13. 마우스의 균주에 따라 백일해 독소(PTX)도 면역 0일차와 2일차에 투여하여 질병의 침투율을 높인다13. EAE는 또한 미엘린/CFA-프라임 마우스로부터 수득한 미엘린-특이적 T 세포를 건강한 마우스로 입양하여 전달함으로써 유도될 수 있거나, 14 또는 주요 미엘린 항원에 특이적인 T 세포 수용체를 과발현하는 마우스에서 자발적으로 발생할 수 있다5.
EAE 질병의 중증도 및 진행은 일반적으로 1 – 꼬리 절뚝거림, 2 – 뒷다리 또는 발 약화, 3 – 한쪽 또는 양쪽 뒷다리의 완전 마비, 4 – 앞다리 약화, 5 – 사망 또는 사망13. 이 임상 점수 시스템은 질병 발병 시 발생하는 상행 마비의 진행을 문서화하는 데는 건전하지만 중추신경계 염증 발작으로부터의 회복 정도를 포착하는 데는 덜 민감합니다. 예를 들어, 어렵게 보행하는 생쥐와 쉽게 보행하지만 발을 잡는 데 약점을 보이는 생쥐 모두 EAE 척도에서 2점이 할당됩니다. 염증 반응이 해결되었음에도 불구하고 영구적인 축삭 손상 또는 손실이 있기 때문에 EAE의 급성 후 단계에서 점수가 높게 유지될 수 있다9. EAE 9,16,17,18에서 임상적 결함의 차이를 더 잘 포착하기 위해 보다 정교한 채점 시스템, 행동 테스트, 뒷다리 및 악력 측정, 적외선 모니터링 시스템을 개발하기 위한 다양한 시도가 있었습니다. 그러나 이러한 더 복잡한 점수 측정은 근본적인 신경학적 결손에 대한 염증 대 조직 손상의 기여도를 구별하지 못합니다. 따라서 EAE의 중증도를 점수화하는 황금 표준 접근 방식은 임상 및 조직학적 점수를 모두 수행하는 것입니다.
여기에서는 EAE에서 발생하는 병변 형성의 확률적 과정을 포착하는 방식으로 생쥐 척수 및 뇌 표본을 파라핀에 해부하고 삽입하는 방법에 대한 프로토콜을 설명합니다. 또한 중추신경계에서 미엘린을 검출하는 Kluver와 Barrera19가 처음 만든 Luxol fast blue(LFB)로 절편을 염색하는 방법에 대한 프로토콜도 제시됩니다. 절편은 LFB만으로 염색하거나(탈수초화 분석용) 헤마톡실린 및 에오신(H&E)으로 역염색하여 염증성 병변을 시각화하고 점수를 매기는 데 도움이 됩니다. 또한 상업적으로 이용 가능한 항체, 면역조직화학(IHC) 기술 및 공개적으로 액세스할 수 있는 소프트웨어를 사용하여 척수에서 총 백혈구(CD45)의 존재, 미엘린 손실 및 손상된 축삭(SMI-32)의 수를 정량화하기 위한 프로토콜도 제공됩니다. 척수의 백혈구를 정량화하는 데 사용되는 프로토콜은 뇌의 백혈구를 정량화하는 데에도 적용할 수 있습니다.
뇌의 축삭돌기 손실과 손상에 대한 조직학적 평가는 뇌 백질관이 서로 평행하게 흐르지 않기 때문에 척수보다 상대적으로 어렵습니다. 혈청 신경 필라멘트 빛(sNF-L)의 측정은 MS20,21에서 신경 손상에 대한 유망한 바이오마커로 부상했습니다. 최근 연구에서는 이 기술을 EAE 22,23,24로 확장했습니다. 여기에서는 SIMOA(Small Molecule Assay) 분석을 사용하여 살아있는 마우스에서 혈청 신경필라멘트 광(sNF-L)을 측정하는 방법을 제시합니다. 이 방법은 소량의 혈청만 필요하며 살아있는 쥐에서 단 반나절 만에 수행할 수 있어 테스트된 치료법이 전체 CNS 손상에 어떤 영향을 미치는지에 대한 신속한 피드백을 제공합니다. 여기에 설명된 모든 방법은 모든 성별 또는 균주의 마우스에 적용할 수 있습니다.
프로토콜
생쥐를 대상으로 실시한 모든 실험은 캐나다 동물 관리 위원회(Canadian Council on Animal Care)에서 정한 지침에 따라 Unity Health Toronto Animal Care Committee에서 승인한 동물 사용 프로토콜에 따라 수행되었습니다. 실험실 절차 전반에 걸쳐 실험실 가운, 보호 장갑 및 안경을 착용하십시오.
1. 뇌와 척수를 적출하고 고정합니다.
- 제도적 정책에 따라 쥐를 안락사시킨다. 쥐를 해부 테이블에 엎드린 상태로 놓고 수술용 가위(아래쪽으로 절단)를 사용하여 목을 자릅니다.
- Adson 집게(자주 사용하지 않는 손에)를 사용하여 쥐 머리 위쪽의 피부를 잡습니다. 그런 다음 수술용 가위를 사용하여 정수리 피부를 2.5cm 절개합니다.
- 손가락을 사용하여 머리의 피부를 옆으로 밀어 밑에 있는 두개골을 시각화합니다.
- 표준 Adson 집게로 눈구멍을 잡고 쥐의 머리를 고정합니다.
- 가는 가위(주로 사용하는 손)를 사용하여 경추에서 후각구까지 정중선을 따라 두개골을 작게 잘라냅니다.
알림: 밑에 있는 뇌가 손상되지 않도록 한 번에 몇 mm의 가위 끝만 두개골 아래에 삽입하십시오. - 이빨이 있는 Adson 집게를 사용하여 두개골을 측면으로 반사하여 밑에 있는 뇌를 드러냅니다.
- 자주 사용하지 않는 손을 사용하여 머리를 잡습니다. 가위를 닫고(주로 사용하는 손) 경추에서 척수를 퍼내고 두개골에서 뇌를 부드럽게 밀어 뇌 신경을 잘라냅니다.
- 동물의 ID가 표시된 10% 중성 완충 포르말린 10mL가 들어 있는 원뿔형 튜브에 뇌를 넣습니다.
- 목에서 꼬리까지 쥐 몸통의 정중선을 따라 털을 절개합니다.
- 손가락을 사용하여 피부를 옆으로 밀어 척추를 시각화합니다.
- 수술용 가위를 사용하여 대퇴골이 엉덩이에 부착되는 수준에서 척추를 아래쪽으로 자릅니다.
- 수술용 가위를 사용하여 엉덩이에서 목까지 척추 양쪽의 체벽을 자릅니다. 부착된 장기를 모두 잘라냅니다.
- 척수가 들어 있는 척추를 뇌가 들어 있는 포르말린 튜브에 넣습니다. 뇌와 척추를 5-7일 동안 고정시킵니다.
알림: 고정 타이밍이 중요합니다. 일부 항체는 조직이 과도하게 고정되면 작동하지 않습니다. 조직이 제대로 고정되지 않은 경우 2단계에서 척수를 척추에서 압출하기 어렵습니다.
2. 척수와 뇌의 총체적 및 처리
알림: 다음 단계는 흄 후드에서 수행됩니다. 시작하기 전에 2 x 10cm의 깨끗한 페트리 접시, 여과지가 늘어선 깔때기가 장착된 삼각 플라스크, 메스 2개(뼈 절단용 1개, 중추신경계 조직 절단용 1개), 렌즈 종이, 연필, 임베딩 카세트, 10% 포르말린으로 미리 채워진 표본 병을 준비합니다.
- 가위를 사용하여 작은 렌즈 용지 조각(너비는 같지만 카세트 길이의 두 배)을 잘라 하나의 페트리 접시에 넣습니다.
- 연필을 사용하여 플라스틱 카세트에 표본 ID를 라벨링합니다.
- 고정된 뇌와 척추가 들어 있는 튜브를 깔때기에 붓습니다. 척추와 뇌를 빈 페트리 접시로 옮깁니다.
알림: 사용된 포르말린은 삼각 플라스크로 여과되며 2.13단계에서 재사용할 수 있습니다. - 메스를 사용하여 뇌를 6개의 관상 조각으로 심하게 나눕니다. 소뇌에 꼬리 하나를 자르고, 소뇌 중간에 하나, 소뇌에 대해 1개를 자르고, 나머지 뇌에 두 개를 잘라 동일한 두께의 3개의 추가 관상 절편을 만듭니다.
- 집게를 사용하여 뇌 표본을 페트리 접시에 있는 렌즈 종이의 절반에 옮깁니다.
- 메스를 사용하여 척수를 세 조각으로 자릅니다: 첫 번째 절개는 흉곽 바닥에서 이루어지고 두 번째 절개는 경추의 만곡 바로 아래에서 이루어집니다.
- 동일한 메스를 사용하여 척수가 시각화될 때까지 꼬리 끝의 천골 척추 부분을 다듬습니다.
- 흉추(주로 사용하지 않는 손)를 집어 올립니다. 이빨을 꽉 닫은 상태에서 Adson 집게를 잡고(주로 사용하는 손) 부드럽게 비틀어 집게 끝을 척추의 작은 구멍으로 부드럽게 밀어 넣습니다. 코드는 다른 쪽 끝에서 나와야 합니다.
참고 사항 : 척수 크기의 둥근 끝 기구가 이 목적을 위해 작동합니다. 척수가 자연스럽게 튀어나오지 않으면 무리하게 빼지 마십시오. 대신 가는 가위를 사용하여 척추 옆쪽의 뼈를 자르고 반사하여 척수가 드러나도록 합니다. 또는 포르말린으로 며칠 더 척수와 뇌를 고정하십시오. 그러나 항체 염색에 변동성이 발생하지 않도록 모든 검체에 동일한 고정 시간을 적용해야 합니다. - 표준 Adson Forceps(주로 사용하는 손)를 집어 듭니다. 덜 지배적인 손으로 척수 조각을 잡고 집게를 사용하여 컬럼에서 나온 척수를 부드럽게 잡아당깁니다. 렌즈 종이가 들어 있는 페트리 접시에 척수 조각을 놓습니다.
- 요추/천골 및 경추 기둥 조각에 대해 이 과정을 반복합니다.
- 메스를 사용하여 세 개의 척수 조각(경추, 흉추, 요추/천골)을 더 작은 단면 조각으로 나눕니다. 최소 15개의 세그먼트를 자르고 각 세그먼트의 두께는 2mm 미만이어야 합니다.
알림: 세그먼트가 너비보다 짧아야 3단계의 임베딩 프로세스 중에 섹션이 단면에서 더 쉽게 떨어질 수 있습니다. - 뇌 조각이 들어 있는 렌즈 종이의 같은 절반에 척수 조각을 배열합니다. 렌즈 용지를 접어 티슈 조각을 끼우고 라벨이 붙은 카세트에 넣습니다.
참고: 렌즈 용지는 처리 중에 작은 조직 조각이 카세트에서 빠져나가는 것을 방지합니다. - 카세트를 재활용 또는 새 포르말린이 들어 있는 표본 항아리에 옮깁니다.
- 나머지 표본에 대해 2.1–2.13단계를 반복합니다.
- 5-7일 동안 고정한 후 카세트를 검체 용기에서 자동 조직 처리기의 첫 번째 포르말린 수조로 옮깁니다( 재료 표 참조). 보충 표 1에 설명된 프로그램에 따라 조직 처리기를 밤새 실행합니다. 표본은 매립될 때까지 따뜻한 파라핀 왁스에 보관됩니다.
3. 뇌와 척수 절편을 삽입하고 절단합니다
- 프로세서에서 파라핀 임베딩 스테이션의 따뜻한 보관 챔버로 카세트를 옮깁니다( 재료 표 참조).
- 다음과 같이 각 마우스의 척수 및 뇌 단면을 단일 파라핀 블록에 포함합니다(그림 1).
- 먼저 파라핀 왁스를 부어 금형 바닥을 덮습니다. 미세한 집게를 사용하여 뇌 관상동맥 및 척수 단면 조각을 금형 바닥의 파라핀에 넣습니다.
- 뇌와 척수 조각을 제자리에 고정하기 위해 몇 초 동안 곰팡이를 냉각 표면으로 옮깁니다. 금형을 가열된 표면으로 다시 옮기고 뜨거운 파라핀으로 상단까지 채웁니다.
- 카세트 뚜껑(시편 ID로 표시됨)을 금형 위에 놓습니다. 카세트 덮개 위에 파라핀을 더 붓습니다. 금형을 냉각 스테이션으로 옮겨 왁스가 굳을 수 있도록 합니다(30-60분 동안 냉각).
참고: 척수 절편을 삽입하려면 연습이 필요합니다. 성공률을 높이려면 더 짧은 길이의 척수(<2mm)를 사용하면 단면적이 떨어질 가능성이 더 높기 때문입니다. 수술용 안구 확대경을 착용하면 척수 조각이 단면에 있는지 구별하는 데 도움이 됩니다. - 회전식 마이크로톰에 파라핀 블록을 장착합니다. 관심 조직이 파라핀 섹션에 나타날 때까지 블록을 다듬습니다.
- 각 블록의 섹션 5μM 리본을 잘라 42°C 수조에 옮깁니다.
- 슬라이드의 섹션을 모아 유리 슬라이드 랙에 슬라이드를 놓습니다.
- 37°C의 건조 오븐에서 밤새 섹션을 굽습니다. 염색을 진행하기 전에 슬라이드를 식히십시오.
4. 염색을 준비하기 위한 절편의 탈파라핀화 및 재수화
알림: 단계는 흄 후드에서 수행됩니다. 시작하기 전에 용제 수조를 준비하십시오. 모든 세척 단계에 대해 0.05% Tween-20(PBS-T)으로 5L의 1x PBS(1L ddH2O, 8g NaCl, 0.2g KCl, 1.44g Na2HPO4, 0.24g KH2PO4, pH = 7.4)를 준비합니다.
- 슬라이드를 두 개의 연속적인 크실렌 또는 비자일렌 기반 용매에 셰이커에 넣고 각각 5분 동안 부드럽게 교반하여 탈파라핀화합니다.
- 2 x 100% 에탄올(각 5분), 2 x 95% 에탄올(각 3분) 및 1 x 70% 에탄올(3분)과 같은 내림차순 비율의 에탄올 비율의 연속 수조를 통해 슬라이드를 옮겨 조직을 재수화합니다. LFB 염색을 위해 95% 에탄올을 유지하고 70% 에탄올로 재수화하고 면역조직화학(IHC)을 위해 PBS-T를 유지합니다.
5. H&E를 가진 미엘린을 위한 LFB
- 0.1 % LFB (0.2g LFB, 재료 표 참조, 200mL 95 % 에탄올, 0.5mL 빙초산 참조) 용액을 준비합니다. 삼각 플라스크에 혼합하고 여과합니다. 사용할 때까지 어두운 병에 보관하십시오.
- 95% 에탄올의 절편을 LFB가 포함된 염색 접시에 놓인 유리 슬라이드 랙으로 옮깁니다. 접시를 덮고 증발을 방지하기 위해 파라핀 필름으로 밀봉하십시오.
- 절편을 56°C 오븐에서 밤새 배양합니다(최대 16시간).
- 다음날 아침, 슬라이드를 ddH2O 배스에 넣고 유지합니다.
- 한편, (1) 신선한 0.05% 탄산리튬 용액(0.05g 탄산리튬, 100mLddH2O)을 준비하고; (2) 에오신 Y 용액 (40 mL ddH20에 에오신 염 2g을 첨가하고 용해 될 때까지 혼합 한 다음 95 % 에탄올 160 mL와 혼합).
- 1 x 탄산 리튬, 3 x 70 % 에탄올, 3 x 95 % 에탄올, 2 x 100 % 에탄올, 3 x ddH20 수조를 준비하십시오. 사용 순서대로 수조를 놓습니다( 보충 표 2 참조).
- 보충 표 2에 설명된 단계를 따릅니다.
- 슬라이드가 건조되면 현미경으로 탈수초성 병변을 시각화합니다.
6. H&E 없는 미엘린을 위한 LFB
- 미엘린 분석을 위해 이 염색 절차를 수행합니다.
참고: 절차는 5단계( Supplemetary 표 2 참조)와 동일하지만 축약된 작업 흐름이 있습니다. 4단계 후 10단계부터 절차를 계속합니다.
7. 면역조직화학(IHC) 염색을 위한 항원 회수 및 과산화효소 담금질
알림: 시작하기 전에 메탄올에 과산화수소 100mL를 준비합니다(흄 후드에 있는 9부 100% 메탄올에 1부 30% 과산화수소 용액 1부). Tween-20(시트르산 삼나트륨 2.94g, ddH20 1L에 1L에 용해됨)과 함께 10mM 구연산염 완충액 1L를 준비하고, pH를 6.0으로 낮추고, Tween-20 500μl를 추가합니다. PBS-T를 준비합니다(4단계 참조). 모든 세척은 달리 명시되지 않는 한 PBS-T 욕조에서 부드러운 교반(셰이커에서)으로 수행됩니다.
- 메탄올의 3% 과산화수소에 슬라이드를 15분 동안 넣어 내인성 과산화효소를 담금질합니다(흄 후드에서). PBS-T에서 슬라이드를 두 번 세척합니다(각 2분).
- 슬라이드를 금속 슬라이드 홀더로 옮기고 압력솥에 구연산염 완충액 1L를 넣습니다. 뚜껑을 밀봉하고 증기 배출구 상단에 고무 마개를 추가합니다.
- 압력솥의 노란색 탭이 튀어나와 최대 압력에 도달했음을 나타낼 때까지 전자레인지에서 센 불로 요리하세요. 최대 압력에서 5분 더 조리한 후 보호 장갑을 끼고 전자레인지에서 압력솥을 꺼냅니다.
- 스토퍼를 제거하여 감압하십시오. 뚜껑을 제거하고 슬라이드를 구연산염 완충액에서 20분 동안 식힌 다음 원하는 염색 방법으로 진행합니다.
주의 : 화상을 입을 수 있으므로 증기를 방출할 때 뒤로 물러서십시오.
8. CD45 면역조직화학
참고: 이 IHC 방법은 침윤 백혈구를 시각화하는 데 사용됩니다. 아비딘/비오틴 차단 단계는 차단 및 1차 항체 배양 단계와 결합됩니다.
- 차단 완충액(2x PBS에 2% BSA, 2% 토끼 혈청)을 준비합니다.
- 슬라이드를 유리 슬라이드 트레이로 옮기고 PBS-T로 두 번 세척합니다(각 2분). 아비딘/차단 용액을 준비합니다(4 x PBS의 2% BSA/2% 토끼 혈청에 아비딘 1방울/mL, 재료 표 참조).
- 실험실 티슈 페이퍼를 사용하여 조직 주변의 과도한 PBS-T를 건조시킵니다. 소수성 펜을 사용하여 조직 주위에 원을 그리고 습한 챔버에 슬라이드를 놓습니다.
- 각 절편에 아비딘/차단 용액을 바릅니다(400μL/슬라이드).
- 습한 챔버를 덮고 실온에서 30분 동안 배양합니다. 이 단계에서 비오틴을 함유한 차단 완충액(4방울/mL 비오틴, 1x PBS에서 2% BSA/2% 토끼 혈청)에 항-CD45 항체(보충표 3)를 준비합니다.
- 보푸라기가 없는 실험실 물티슈에 밀어 넣은 차단 용액을 두드려 제거합니다. 실험실 물티슈를 사용하여 조직 주위를 두드려 과도한 액체를 제거합니다.
- 슬라이드를 습한 챔버에 다시 놓습니다. 400μL의 CD45 항체 용액( 재료 표 참조)을 섹션에 추가합니다. 뚜껑이 있는 습한 챔버에서 4 °C에서 밤새 배양합니다.
- 다음날 1차 항체를 배출하고 슬라이드를 PBS-T에서 3회(각 5분) 세척합니다.
- 보푸라기가 없는 실험실을 사용하여 절편 주변을 건조시킨 다음 각 절편에 400μL의 2차 항체(차단 완충액에서 1:200 희석)를 추가합니다. 실온에서 1시간 동안 배양합니다.
- 한편, 1x PBS 5mL에 시약 A 2방울을 첨가하여 ABC 시약( 재료 표 참조)을 준비하고 혼합합니다. 같은 용액에 시약 B 2방울을 넣고 섞습니다(사용 전 ~30분 준비).
- 1x PBS-T(각각 5분)를 3번 교체하여 슬라이드를 세척하고 습한 챔버에 슬라이드를 놓습니다.
- 절편에 400μL ABC 시약을 추가합니다. 습한 챔버를 덮고 실온에서 30분 동안 배양합니다.
- 1x PBS-T(각각 5분)를 3번 교체하여 슬라이드를 세척합니다. 한편, 제조업체의 지침에 따라 호일로 덮인 15mL 원심분리기 튜브에 적절한 양의 DAB 용액을 준비합니다( 재료 표 참조).
- 한 슬라이드를 현미경으로 사용하여 척수 절편에 초점을 맞춥니다. 슬라이드에 400μL DAB를 추가하고 실험실 타이머를 시작합니다.
- 백혈구가 발달하는 동안 섹션을 시각화하고 백혈구가 갈색일 때 타이머를 중지합니다. 슬라이드를 ddH20 수조로 옮겨 반응을 멈춥니다. 5분 동안 물에 담그십시오. 나머지 슬라이드에도 동일한 현상 시간이 사용됩니다.
주의: DAB는 발암 물질입니다. DAB 폐기물과 DAB ddH2O 이후는 유해 폐기물로 폐기하십시오. - Mayer의 Hematoxylin으로 ~4-10분 동안 대조염색 슬라이드( 보충 표 2 참조). 흐르는 수돗물에 슬라이드를 10분 동안 헹굽니다.
- 95% 에탄올(1 x 3분)로 탈수한 다음 절대 100% 에탄올(각각 2 x 3분)로 탈수합니다.
- 흄 후드로 이동하여 슬라이드를 자일렌 또는 자일렌 대체 용매로 5분 동안 옮깁니다. 장착 매체로 커버슬립하고 흄 후드에서 슬라이드를 1-2일 동안 건조시킵니다.
주의 : 자일렌을 사용하는 경우 독성이 있고 장갑을 녹일 수 있으므로 덮개가 미끄러질 때 이중 장갑과 집게를 사용하여 슬라이드를 다루십시오. - 자일렌을 사용하여 슬라이드를 청소하고 슬라이드 스캐너를 사용하여 20배 배율로 스캔합니다.
9. 축삭 손상에 대한 SMI-32 IHC
참고: 이 프로토콜은 마우스 SMI-32 항체를 사용하며, 이는 손상된 축삭돌기25에 축적될 수 있는 비인산화된 신경필라멘트에 대해 반응합니다. 이 항체는 마우스에서 키워져 마우스 항원을 검출하기 때문에 MOM(Mouse on Mouse) 키트를 사용하는 것이 좋습니다. 이 절차에서 아비딘/비오틴 차단 단계는 1차 항체 배양과 별도의 단계로 수행됩니다. 이 프로토콜을 시작하기 전에 4단계 및 7단계에 설명된 대로 탈파라핀화, 재수화, 내인성 과산화효소 활성을 소멸시키고 항원 회수를 수행합니다.
- 2 x PBS-T(각각 2분)로 섹션을 두 번 세척합니다. 실험실 티슈를 사용하여 섹션 주변의 여분의 액체를 제거하고 소수성 펜을 사용하여 조직 주위에 원을 그립니다.
- 400μL 차단 완충액(1x PBS-T의 염소 혈청 2%(w/v))과 아비딘(4방울/mL)을 절편에 추가합니다. 실온에서 15분간 배양합니다.
- 슬라이드를 1x PBS-T에 두 번 담그십시오. 비오틴이 함유된 차단 완충액 400μL(4방울/mL)를 슬라이드에 넣고 실온에서 15분 동안 배양합니다.
- 슬라이드를 1 x PBS-T 욕조에서 2분 동안 세척합니다. 한편, 1x PBS 2.5mL에 원액 2방울( 재료 표 참조)을 추가하여 MOM 차단 시약을 준비합니다.
- 섹션에 400μL의 MOM 시약을 추가합니다. 실온에서 1시간 동안 배양합니다.
- 슬라이드를 1x PBS-T 욕조에서 2분 동안 두 번 세척합니다. 한편, 300μL의 단백질 농축액 원액을 3.75mL의 1x PBS에 첨가하여 MOM 희석액을 준비합니다.
- 400μL의 MOM 희석액을 넣고 실온에서 5분 동안 배양합니다. 한편 SMI-32 항체( 재료 표 참조)를 MOM 희석액에 희석한다.
- 슬라이드에서 희석액을 떼어내고 400μL의 SMI-32 항체 용액을 섹션에 추가합니다. 습한 챔버를 덮고 실온에서 30분 동안 배양합니다.
- 1x PBS-T 욕조에서 2분 동안 슬라이드를 두 번 세척하고 각각 부드럽게 저어줍니다. 한편, 희석제(희석제 2.5mL에 스톡 10μL)에 MOM 항마우스 IgG 작용 시약을 희석합니다.
- 슬라이드당 400μL의 항마우스 IgG 작용 시약을 추가합니다. 10분 동안 배양합니다.
- 1x PBS-T 욕조에서 각각 2분 동안 슬라이드를 두 번 세척합니다. CD45 염색 프로토콜(8.11 – 8.19단계)에 설명된 단계에 따라 염색을 계속합니다.
10. 탈수초성 병변의 존재에 대한 LFB 및 H&E 점수 매기기
참고: 다음은 염증성 탈수초화의 중증도에 대한 신속한 통찰력을 얻기 위해 적용할 수 있는 분석 접근 방식입니다. 이 분석은 다양한 수준(경추, 흉부 및 요추, 수준당 최소 3개 섹션)에서 샘플링된 탯줄의 섹션에서 수행됩니다. Allen Brain Atlas for Mouse spinal cord26 을 참조하면 척수의 해부학적 수준을 식별하는 데 도움이 됩니다. 이 분석에는 TIFF 파일이 필요합니다. 스캔한 이미지가 .czi 형식인 경우 보충 표 4 의 지침에 따라 czi 파일을 TIFF 파일로 변환합니다.
- 파일을 ImageJ로 끌어다 놓아 분석할 섹션의 TIFF 이미지를 엽니다. 등쪽, 좌측, 우측, 전방의 4개 사분면에서 척수 단면을 관찰합니다(그림 2A,B).
- 그림 2에 표시된 대로 각 사분면에 탈수초성 병변의 존재에 대한 점수.
참고: 병변이 있으면 해당 사분면에서 1점, 섹션당 총 4점의 점수가 발생합니다. 사분면 내에 여러 병변이 있는 경우에도 점수 1이 할당됩니다. - 각 마우스에 대한 모든 점을 더하고 샘플링된 총 사분면 수로 나누어 수막하 병변이 있는 사분면의 비율을 얻습니다.
11. 척수 백질에서 LFB 염색의 면적 분율 계산
참고: 이 분석은 LFB로 염색된 척수 백질의 면적 비율을 측정합니다.
- 파일을 ImageJ로 끌어다 놓아 TIFF 파일로 저장된 LFB 얼룩 섹션을 엽니다.
- Image > Type(이미지 8비트> 클릭하여 그레이 스케일 이미지를 생성합니다. Image(이미지)> Adjust > Threshold(임계값 조정)를 클릭합니다. 빨간색 오버레이가 눈으로 보이는 모든 어두운 영역(미엘린)을 캡처하도록 아래쪽 슬라이더를 조정합니다(그림 2C–E). Apply(적용)를 클릭합니다.
- Analyze > Tools > ROI Manager을 클릭하여 ROI Manager를 엽니다.
- ImageJ 도구 모음에서 다각형 그리기 도구를 선택합니다. 이 그리기 도구를 사용하면 컴퓨터 마우스로 척수 영역의 윤곽을 그릴 수 있습니다.
- 척수의 등쪽 영역의 윤곽을 그리고 키보드에서 t 를 클릭하여 다각형을 ROI Manager에 추가합니다.
- 척수 백질의 전방 외측 영역을 윤곽을 그리고 다각형을 ROI 매니저에 추가합니다.
참고: 추적할 때 일반적으로 수초화가 덜 된 큰 혈관, 조직의 찢어짐, 인공물 및 등쪽 뿔에 인접한 영역(그림 2A, B 화살표)을 제외하십시오. 흰색 배경을 너무 많이 포함하면 결과가 왜곡되므로 추적할 때 가능한 한 정확해야 합니다. - 분석( Analyze) > 측정 설정(Set Measurements )을 클릭하고 면적 분율(Area Fraction)을 선택합니다.
- ROI Manager(ROI 관리자)에서 Measure(측정 )를 클릭합니다. 이렇게 하면 LFB로 염색된 윤곽선 영역의 비율이 표시됩니다.
- 새로 생성된 결과 상자에서 값을 Excel로 복사하고 이미지 창을 닫습니다. 등쪽 및 복측 영역에 대해 염색된 평균 % 분획 면적을 계산합니다. 평균을 구하여 해당 섹션에 대한 값을 가져옵니다.
- 경추, 흉추 및 요추 섹션에 대해 11.1–11.9단계를 반복합니다(N = 3/수평/마우스).
- 각 마우스의 모든 섹션에 대한 평균 미엘린 분율 백분율을 계산합니다. 탈수초화 비율은 100에서 염색 면적 %를 빼서 추정합니다.
12. CD45+ 세포 및 SMI-32+ 축삭 난형의 수 분석
- CD45 또는 SMI-32 스테인드 TIFF 이미지를 ImageJ로 끌어다 놓습니다. Analyze > Set Scale > Global > Ok 를 클릭하여 모든 이미지에 스케일 바를 설정합니다. 이 작업은 첫 번째 이미지에 대해서만 수행됩니다.
- 다각형 그리기 도구를 선택하고 컴퓨터 마우스를 사용하여 회백질 주위를 추적합니다. 분석 > 측정을 클릭하고 결과를 Excel에 "Grey Matter Area"로 기록합니다.
- 그려진 다각형이 이미지에 남아 있는 상태에서 Delete 키(키보드)를 클릭하여 이미지에서 회백질을 제거합니다. 이 작업은 백질만 분석할 수 있도록 합니다.
- 다각형 그리기 도구를 사용하여 전체 척수 부분의 윤곽을 그립니다. 누락되거나 손상된 조직 부위는 제외합니다.
- Analyze > Measure(분석 측정)를 클릭하고 결과를 Excel 파일에 "Total Tissue Area"로 기록합니다.
- Image > Colour(이미지 컬러) > Colour Deconvolution(컬러 디콘볼루션)을 클릭합니다. 벡터 드롭다운 창에서 H DAB를 선택합니다. 세 개의 새 창이 나타납니다 – 갈색 색조 창(DAB 채널)을 유지하고 다른 이미지 창을 삭제합니다.
- Image( 이미지)> Adjust > Threshold(임계값 조정)를 클릭합니다. 아래쪽 슬라이더를 조정하여 이미지의 임계값을 조정하여 빨간색 오버레이가 눈으로 감지한 것과 동일한 양의 갈색 얼룩을 캡처하도록 합니다. Apply( 적용)를 클릭합니다.
- Process > Binary > Watershed를 클릭합니다. 이 단계에서는 원본 영상과 이진 영상을 비교하여 서로 일치하는지 확인합니다.
- 분석(Analyze) > 입자 분석(Analyze Particles)을 클릭합니다. 오버레이 표시를 선택하고 크기 = 5 - 150 μm2, 원형도 = 0.4 – 1 설정을 수정합니다. 확인을 클릭합니다.
참고: 이러한 설정을 사용하면 Watershed 함수로 분할되지 않은 개별 셀 및 작은 셀 그룹이 분석에서 제외되지 않고 포함될 수 있습니다. - 결과 창에서 Excel의 맨 왼쪽 열에 총 입자 수를 나타내는 마지막 숫자를 기록합니다. 그런 다음 백질 면적(총 조직 면적 – 회백질 면적(mm2))을 계산합니다. 백질 면적당 총 입자 수(count/mm2)를 표현합니다.
- 저장된 각 RGB 이미지에 대해 단계를 반복합니다. 한 마우스에 대한 모든 척수 절편을 분석한 후 해당 마우스에 대한mm2 조직당 입자 수를 평균화합니다.
참고: 척수 백혈구를 분석하는 데 사용되는 워크플로우는 뇌 영역에도 적용할 수 있습니다.
13. SIMOA assay를 이용한 sNF-L 측정
- 모세관 마이크로테이너 튜브를 사용하여 복재정혈을 하거나 주사기와 25G 바늘을 사용한 심장 천자(말단 절차)를 통해 살아있는 마우스에서 100–200μL의 혈액을 수집합니다. 후자의 경우 혈액을 1.5mL 미세 원심분리 튜브로 옮깁니다.
- 실온에서 30-60분 동안 혈액을 응고시킵니다.
- 4°C에서 5분 동안 2660 x g 에서 샘플을 원심분리하고 상부 분획(혈청)을 새 마이크로 원심분리기 튜브에 피펫팅합니다. 사용할 준비가 될 때까지 세럼을 -80 °C에서 보관하십시오.
- 준비: 교정기 및 제어 장치(NF-광 분석 키트, 재료 표 참조)를 사용하기 전에 1시간 동안 실온으로 예열하십시오. 효소 기질(RGP)을 냉장고에서 꺼내 30°C 수조에 최소 30분 동안 넣고 10분마다 소용돌이칩니다.
- 혈청 샘플을 얼음 위에서 해동합니다. 해동되면 샘플을 부드럽게 소용돌이치고 10000 x g 에서 5분 동안 원심분리하여 파편을 펠릿화합니다.
- 플레이트 로드: 캘리브레이터와 컨트롤을 소용돌이칩니다. 교정기를 중복으로, 대조군을 중복으로, 혈청 샘플을 키트와 함께 제공된 96웰 플레이트에 중복으로 로드합니다. 혈청 샘플은 키트에 제공된 희석액을 사용하여 1:3 비율로 희석합니다. 플레이트를 밀봉합니다.
- SIMOA 기계( 자료표 참조)를 컴퓨터, 프로그램, 기계 순으로 켭니다. 컴퓨터가 하루 시작 유지 관리를 초기화하고 실행하도록 허용합니다.
- 30초 동안 마그네틱 비드를 소용돌이치게 합니다.
- 화면에서 시약 로드(Load Reagents ) 탭에서 시약 병을 놓을 랙 위치를 두 번 클릭한 다음 병의 바코드를 스캔합니다.
- 랙의 흔들림 위치(위치 1-3)에 마그네틱 비드를 놓습니다.
- 계속해서 검출기, SBG 시약 및 RGP 시약을 기계에 로드합니다.
- 소프트웨어에서 설정을 클릭합니다. 샘플 모드가 플레이트에 있는지 확인하십시오. 설치 실행 탭에서 실험의 이름을 지정합니다.
- 다음과 같이 교정기를 위해 플레이트에 웰을 할당합니다: 웰을 클릭한 다음 분석을 선택합니다. calibrate A 를 선택한 다음 ascending을 클릭합니다. 웰 A1-8을 강조 표시한 다음 반복(2) 을 클릭하여 교정기가 중복으로 실행될 좌표를 지정합니다. 깔끔한 프로토콜을 사용하여 실행합니다.
알림: 분석 증명서(제조업체 web사이트)를 사용하여 각 특정 로트 번호에 대한 각 교정기의 농도를 확인하십시오. 웰이 할당되면 플레이트가 제자리에 고정될 때까지 작업을 잃지 않고 이 화면에서 벗어날 수 없습니다. - 아래 단계에 따라 샘플을 할당합니다.
- 화면 오른쪽 하단에서 버튼을 클릭하여 샘플을 할당합니다. 샘플이 위치할 웰을 강조 표시합니다.
- 목록에서 실행할 분석을 선택하고, 반복 횟수를 선택하고, 온보드 희석을 4배로 지정합니다.
- 웰이 강조 표시된 상태에서 샘플 ID의 접두사와 시작 번호를 입력한 다음 generate 를 클릭하여 샘플에 대한 순차적 ID를 생성합니다. 대조군에 대해 단계를 반복합니다.amp르.
- 플레이트를 플레이트 홀더(A1 - A12)에 로드합니다.
- 화면 인터페이스에서 완료된 프로그래밍 샘플을 클릭하고 시스템 리소스 탭으로 진행합니다. 모든 시약 용기가 가득 차 있고 폐기물 용기가 비어 있는지 확인하십시오.
- 실행을 클릭합니다.
- 실행이 완료되면 "Data Reduction" 탭에서 분석과 플레이트 이름을 선택하여 검량선을 확인합니다.
- "실행 기록"으로 이동하여 필터를 사용하여 가장 최근 실행을 찾습니다. 실행 을 선택한 다음 모든 결과를 선택합니다. 내보내기를 클릭하고 .csv 파일을 저장합니다. 보고서를 클릭한 다음 배치 보정 보고서를 선택하고 최근 실행을 선택합니다. 보고서를 미리 보고 내보냅니다.
- 제조업체에서 권장하는 일과 종료 유지 관리를 실행합니다. 프로그램, 기기, 컴퓨터를 차례로 끕니다.
대표적 결과
그림 3은 급성(왼쪽) 및 오래된 EAE 병변(오른쪽)의 예와 함께 대표적인 IHC 및 조직화학적 염색을 보여줍니다. 헤마톡실린 대조염색을 사용한 대표적인 CD45 염색은 그림 3A,B에 나와 있습니다. 그림 3C–F는 H&E 대조염색을 사용하거나(그림 3C,D) 사용하지 않거나(그림 3E,F) LFB 염색의 예를 보여줍니다. 헤마톡실린은 면역 세포에 특이적이지는 않지만 면역 세포의 핵은 더 어둡게 염색되며 중추신경계 상주 세포와 구별할 수 있습니다. 그림 3G,H는 헤마톡실린으로 대조염색된 SMI-32+ 축삭의 대표적인 염색을 보여줍니다. 오래된 EAE 병변에서 이 얼룩이 증가한 것을 알 수 있습니다.
수초화 된 트랙의 손상은 활동성 쥐 EAE의 척수에서 가장 널리 퍼져 있으며 이것이이 질병의 마비의 주요 동인입니다 7,9. 따라서 척수의 염증 및 조직 손상 존재에 대한 점수는 조직학적 분석에서 우선시됩니다. EAE 병변은 척수의 다른 부위(전방, 외측 또는 등)(그림 2A,B)와 다른 수준(천골, 요추, 흉추, 경추)에서 산발적으로 발생합니다. 설명된 임베딩 방법은 탯줄 전체의 병변을 잘 샘플링할 수 있도록 합니다. 일부 섹션은 처리 또는 섹션화 프로세스에서 손상될 수 있으므로 분석된 것보다 더 많은 섹션이 포함됩니다. 대표 샘플링을 보장하기 위해 각 마우스에 대한 척수의 경추, 흉부 및 요추 수준에서 최소 3개의 대표 절편을 분석합니다. 분석을 수행하는 사람이 분석을 위해 대표 섹션을 선택할 때 편향되지 않도록 각 표본의 신원을 블라인드합니다.
EAE의 조직학적 중증도의 차이에 대한 빠른 통찰력을 얻기 위해 선택한 섹션의 척수 사분면에 있는 수막하 탈수초 병변의 존재에 대해 점수를 매길 수 있습니다(그림 2A, B). 이것은 스캔한 이미지나 광학 현미경을 사용하여 수행할 수 있는 빠른 방법입니다. 이 분석은 EAE가 한 그룹에서 심각하고 다른 그룹에서 경증일 때 그룹 간 조직학적 EAE 중증도의 차이를 감지할 수 있을 만큼 민감합니다. 예를 들어, 도 4의 실험에서, EAE는 MOG p35-55/CFA와 PTX를 사용하여 OGR1(OGR1 KO)에서 결실이 있는 암컷 야생형(WT) 및 마우스에서 유도되었다. WT 그룹의 마우스는 완전한 마비를 동반한 중증 EAE를 보인 반면, OGR1 녹아웃 그룹은 경미한 질병을 앓았습니다. 이러한 임상 점수의 차이는 수막하 병변이 있는 사분면의 비율 차이와 일치했습니다(그림 4C).
자가면역 공격 중 미엘린 및/또는 수초화 축삭의 손실 정도를 포착하기 위해 미엘린 염색의 백분율 면적 분율로 탈수초성 병변의 점수를 보완하는 것이 중요합니다. 그림 4의 예에서, 미엘린 분율 비율은 OGR1 마우스와 WT 마우스 간에 현저하게 달랐습니다(그림 4D). 퍼센트 미엘린 분율은 또한 EAE를 가진 쥐에 있는 누적 EAE 점수와 두드러지게 상관관계가 있습니다 (그림 4E) 그러므로 이 질병에 있는 전반적인 조직 손상의 좋은 측정으로 봉사합니다. 이 프로토콜은 미엘린 염색의 강도를 구분하지 않습니다. 이것이 원하는 결과인 경우 단백질지질 단백질 또는 미엘린 염기성 단백질과 같은 미엘린 단백질에 대해 면역형광 염색을 수행하고 이 염색의 강도를 측정해야 합니다.
EAE가 두 비교군 모두에서 심한 경우, 척수 사분면의 더 높은 비율은 염증성/탈수초성 병변을 포함합니다. 이 경우 염증을 점수화하는 보다 민감한 접근법은mm2 백질당 CD45+ 백혈구 수를 계산하는 것입니다(그림 3A의 대표 염색 참조). 여기에 설명된 CD45 항체 클론은 모든 침윤 백혈구를 검출하고, EAE에서 CD45 발현을 상향 조절하는 간헐적인 미세아교세포만 염색하므로(그림 3B의 열린 화살표 참조) 말초 면역 세포 침투를 포착하는 데 유용합니다.
장기 EAE 연구 (>20 일)에서는, 사람이 또한 축삭 손상의 분석을 실행한ᄂ다는 것을 추천됩니다. 척수 절편의 SMI-32 염색은 손상된 축삭돌기를 검출하는 민감한 방법입니다. 척수의 염증은 시간이 지남에 따라 가라앉고 보존된 축삭돌기는 다시 수초화될 수 있지만, 살아남은 축삭돌기는 잔류 손상의 정도가 다르다9 (그림 3G,H). 예를 들어, C57BL6/J 마우스에서 EAE의 MOG p35-55 유도 모델에서, 축삭 손상 및 손실의 정도는 염증 과정이 가라앉은 후 임상 점수의 동인이다9. 도 5는 수컷 및 암컷 마우스, WT 마우스, 그리고 골수성 구획(LysMCre: Ppardfl/fl)에서 과산화소체 증식제 활성화 수용체-델타(PPAR-delta)라고 불리는 유전자가 결핍된 마우스에 대한 EAE 실험에서 이의 예를 나타낸다. 수컷에서 WT 마우스는 뒷다리 기능을 회복했지만 수컷 LysMCre: Ppardfl/fl 그룹에서 임상 점수는 높게 유지되었습니다. 대조적으로, 여성을 대상으로 한 실험에서는 두 실험 그룹 모두 전체적으로 높은 점수를 받았습니다. 언뜻 보기에 이 결과는 PPAR-델타가 EAE에서 성별 특이적 효과를 가졌음을 시사했습니다. 그러나 척수의 병리학적 스코어링은 LysMCre: Ppardfl/fl 그룹의 남녀 마우스가 WT 마우스에 비해 축삭 손상이 증가한 것으로 나타났습니다(그림 5B). 임상 점수에 대한 유전자형 효과는 암컷에서 관찰되지 않았을 가능성이 높은데, 이는 WT 암컷 마우스가 만성 신경학적 결손으로 나타나는 축삭 손상이 증가하는 경향이 있었기 때문입니다.
이 동일한 실험에서 암컷 LysMCre: Ppardfl/fl 암컷 마우스는 소뇌에서 더 광범위한 T 세포 침투가 있는 것으로 밝혀져 뇌 염증을 채점하는 것이 EAE에서 유용할 수 있는 방법의 예를 제공했습니다. EAE에서 뇌의 염증은 주로 소뇌와 뇌간(그림 6A, D, G)에서 발견되지만 뇌막( 그림 6C의 해마 아래에서 볼 수 있음), 심실 근처(그림 6F) 및 시신경 및 뇌 콜로섬(그림 6B, E)을 포함한 기타 백질 요로에서도 발견될 수 있습니다. 뇌 염증 점수는 척수 프로토콜에 대해 설명된 것과 동일한 방법론을 사용하여mm2 조직 영역당 CD45 세포 수를 계산하여 특정 뇌 영역(예: 소뇌 백질)에서 수행됩니다. 여기에 설명된 그로스 방법에서 절단은 소뇌 중간에 있으며, 이는 그림 6A와 같이 소뇌와 뇌간의 관점을 제공합니다.
SIMOA 분석을 사용하여 sNF-L을 측정하는 것은 재발-완화 MS20,21,27,28에서 진행중인 축삭 손상 및 치료에 대한 반응을 평가하는 데 유용한 바이오마커가 되었습니다. sNF-L 인간을 측정하는 데 사용되는 동일한 SIMOA 분석 키트를 마우스 sNFL 22,23,24를 측정하는 데 적용할 수 있습니다. 이 분석법이 EAE에 있는 축삭 손상을 검출하는 얼마나 잘 실행하는지 탐구하기 위하여는, sNF-L는 EAE 실험의 끝점에 암컷 C57BL6/J 쥐에서 측정되고 수준은 EAE가 없는 성 일치한 건강한 대조군 쥐에 있는 그들과 비교되었습니다. EAE를 가진 쥐는 건강한 쥐에서 보다는 sNF-L의 매우 더 높은 수준이 있었다는 것을 발견하였으며(그림 7A) 이 수준은 척수에 있는 SMI-32+ 축삭의 조밀도와 상관관계가 있었습니다 (그림 7B). 축삭 손상의 조직학적 점수에 비해 SIMOA 분석은 더 빠르고(출혈 마우스에서 결과에 이르기까지 반나절 이상 달성될 수 있음) 따라서 치료가 살아있는 마우스에서 어떻게 작동하는지에 대한 신속한 피드백을 제공합니다. 이 분석법은 또한 척수와 뇌 모두의 축삭 손상을 반영한다는 장점이 있습니다.

그림 1: 뇌와 척수 절편의 대표적인 파라핀 블록. 5개의 관상동맥 뇌절편과 척수 단면(두께 1.5-2mm)은 한 절편으로 절단할 수 있도록 동일한 블록에 내장되어 있습니다. 최소 15개의 척수 절편을 삽입하여 분석을 위한 절편을 적절하게 선택할 수 있도록 해야 합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
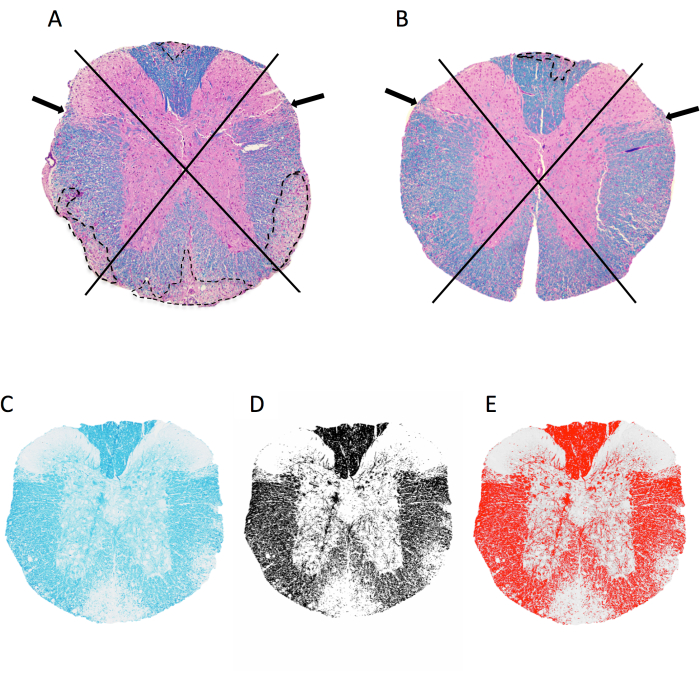
그림 2: 흉부 척수 수준에서 수막 염증 및 미엘린 면적 비율 점수. (A,B)는 LFB/H&E로 염색된 MOG p35-55 유도 EAE가 있는 암컷 C57BL6/J 마우스의 흉부 척수 이미지를 보여줍니다. 사분면과 탈수초성 병변의 예(점선으로 추적)를 시각화하는 데 사용되는 접근 방식이 표시됩니다. A의 마우스는 4개의 사분면 중 4개의 사분면 중 4개의 사분면에 합류하는 탈수초성 병변이 있는 반면, B의 마우스는 4개의 사분면 중 1개가 영향을 받습니다. B의 마우스는 다른 사분면에 약간의 염증이 있지만 이는 합류 병변으로 나타나지 않았으므로 점수가 매겨지지 않습니다. (씨–E) LFB 이미지의 예, imageJ의 그레이스케일 및 임계값 이미지. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
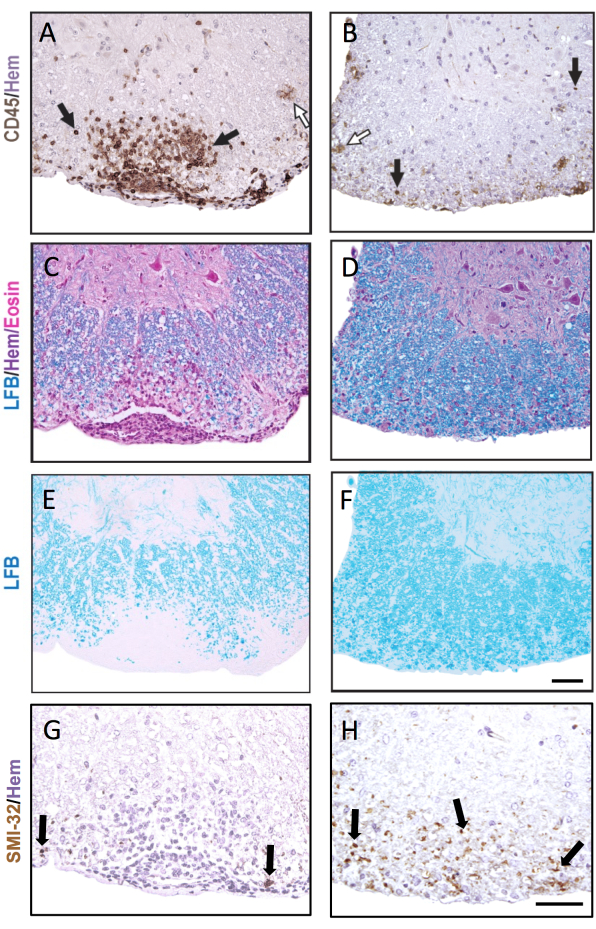
그림 3: CD45, LFB H&E, LFB 및 SMI-32로 염색된 척수 절편. CD45 항체 (A,B), LFB/H&E (C,D), LFB 단독(E,F) 및 SMI-32 항체 (G,H)로 염색된 척수의 초기(A,C,E,G) 및 후기(B,D,F,H) 수막하 병변의 예. 검은색 화살표는 각각의 항체로 염색된 세포의 예를 보여줍니다. 흰색 화살표는 CD45+로 염색된 것으로 추정되는 미세아교세포를 나타냅니다. 눈금 막대 = 50μm. 이 그림은 EAE 중 암컷 C57BL6/J 마우스의 척수 병변의 대표적인 염색을 보여주고 병리학이 다른 척수 절편에 따라 어떻게 다를 수 있는지 강조합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
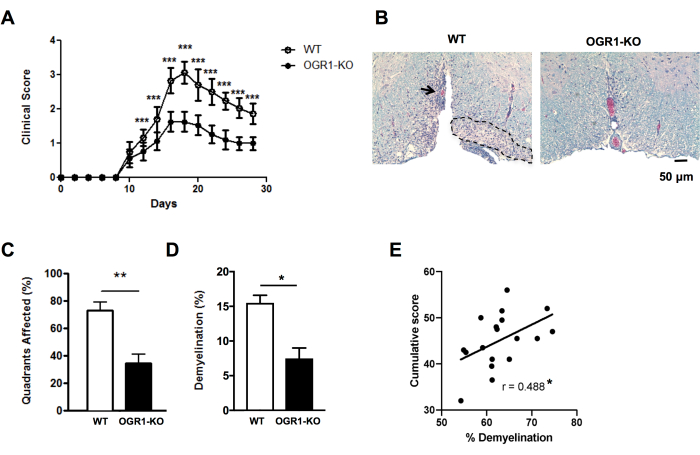
그림 4: EAE에서 병변 및 탈수초화 비율에 대한 점수 적용. C57BL6/J 배경에 난소암 G-단백질 결합 수용체 1(OGR1) 유전자가 결핍된 암컷 마우스가 야생형(WT) 암컷 C57BL6/J 마우스보다 덜 심각한 임상적 EAE를 개발한 EAE 실험의 예가 나타낸 것이다. EAE는 MOG p35-55/CFA와 PTX를 병용한 예방접종에 의해 유도되었고, 마우스는 다음 임상 척도에 따라 점수를 매겼다: 1 = 꼬리 마비. 2 = 뒷다리 및 발 약화, 3 = 뒷다리 마비, 4 = 앞다리 약화, 5 = 사지. (A) 시간 경과에 따른 마우스의 평균 + SEM 임상 점수. (B) 사진은 복부 척수에서 LFB/H&E 염색의 예입니다. 척도 막대 = 50 μm. (C) 탈수초성 병변을 포함하는 평균 + SEM 백분율 사분면. (D) 각 그룹의 평균 + SEM 탈수초화 비율. (E)는 C57BL6/J 마우스에서 MOG p35-55-유도 EAE에 대한 또 다른 실험의 결과를 보여주는데, 여기서 개별 마우스의 EAE 점수는 관찰 30일 동안 합산되고 척수의 탈수초화 비율과 상관관계가 있었습니다. 상관 관계는 Spearman 검정을 사용하여 수행되었습니다. (A-D)의 패널은 Souza C et al.29에서 채택되었습니다. (E)의 데이터는 원본 데이터입니다. *P<0.05, **P<0.01, ***P<0.001입니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
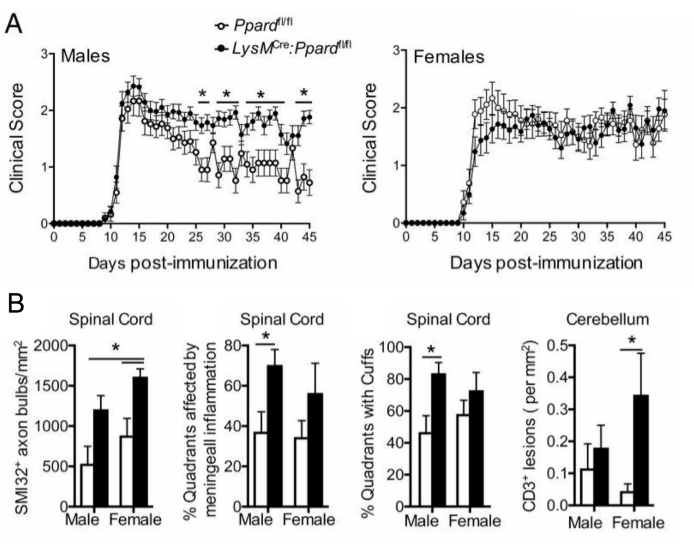
그림 5: 유전자형이 임상 EAE 표현형에 미치는 영향을 이해하기 위한 SMI-32 염색 적용. 이 그림은 C57BL6/J 배경의 수컷 및 암컷 야생형( Ppard의 플록스드 대립유전자 운반) 및 골수성 특이적 Ppard 돌연변이 마우스(LysMCre: Ppardfl/fl)를 MOG p35-55/CFA 및 PTX로 면역하고 45일 동안 추적한 EAE 실험의 예를 보여줍니다. (A)는 마우스의 평균 + SEM 임상 점수를 나타낸다. (B)는 척수의 SMI-32+ 축삭돌기 수, 수막하 병변이 있는 %사분면, 혈관 주위 커프가 있는 백분율 사분면,mm2 조직당 소뇌의 #CD3 병변의 조직학적 스코어링의 평균 + SEM 결과를 보여줍니다. 이 실험은 SMI-32 염색에 대한 유전자형 효과를 보여주었습니다. 이 그림은 Drohomyrecky에서 각색되었습니다. 외.15. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
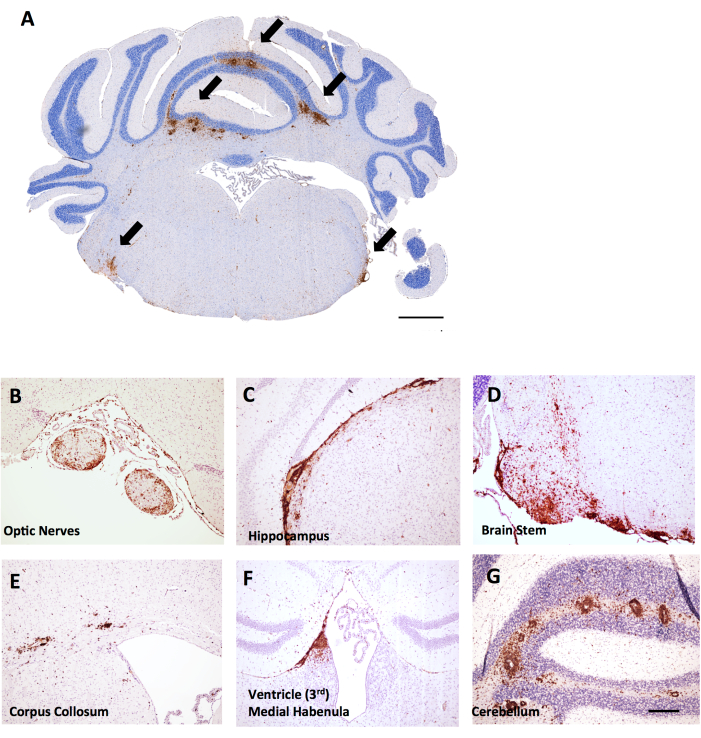
그림 6: 암컷 C57BL6/J 마우스의 MOG p35-55 유도 EAE에서 뇌 관상 절편의 CD45+/헤마톡실린 염색의 예. CD45+ 병변은 갈색으로 나타난다. (A) 관상동맥 절편의 뇌간에 있는 CD45+ 병변. 눈금 막대 = 150μm. (비-지) 시신경(B), 해마 아래의 수막 확장(C), 뇌간(D), 뇌구(E), 심실 근처의 내측 하베눌라(F) 및 소뇌(G)의 CD45+ 병변의 예. 척도 막대: (B–G) = 50 μm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
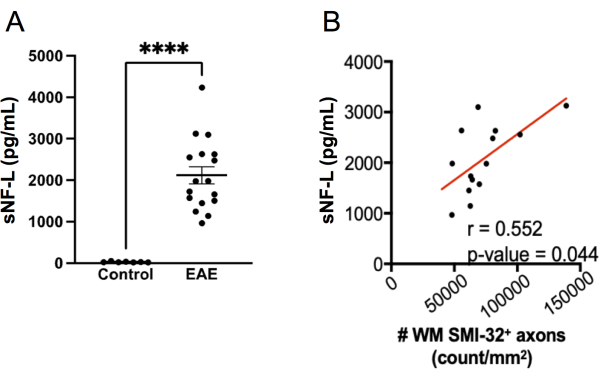
그림 7: MOG p35-55 유도 EAE의 혈청 내 sNF-L 수준. (A) 한 실험의 종점에서 여성 대조군과 EAE 마우스에서 수집된 혈청 NFL 수준. 데이터는 양측 Mann Whitney 검정을 사용하여 분석되었습니다. (****p 값 < 0.0001). (B) 척수 절편을 말단점에서 채취하고 SMI-32로 염색하였다. 백질 조직 영역당 양성 세포의 수는 Spearman 테스트를 사용하여 종점에서 혈청 NF-L과 결정되고 상관 관계가 있습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
보충 표 1: 조직 가공에 사용되는 수조에 대한 설명. 카세트는 자동 프로세서를 사용하여 이러한 일련의 항온조를 통해 자동으로 이동합니다. 이 파일을 다운로드하려면 여기를 클릭하십시오.
보충 표 2: Luxol Fast Blue 및 Hematoxylin 및 Eosin 염색 단계. 이 표는 Luxol Fast Blue와 Hematoxylin 및 Eosin 염색 프로토콜의 단계 순서를 간략하게 설명합니다. 이 파일을 다운로드하려면 여기를 클릭하십시오.
보충표 3: 면역조직화학적 염색에 사용되는 항체. 이 프로토콜에 사용되는 항체와 염증, 미세아교증 및 성상교증을 추가로 탐색하는 데 사용할 수 있는 항체가 설명되어 있습니다. 이 파일을 다운로드하려면 여기를 클릭하십시오.
보충 표 4: .czi를 TIFF 파일로 변환하는 방법. 고해상도 이미지를 사용하는 것이 가장 좋지만 컴퓨터의 작업 메모리가 제한되는 경우 중간 해상도 이미지를 대신 저장할 수 있습니다. 분석 전반에 걸쳐 동일한 해상도의 이미지를 사용해야 합니다. 또한 시리즈의 마지막 이미지는 슬라이드 레이블입니다. 분석이 블라인드 처리되었는지 확인하기 위해 레이블을 읽지 마십시오. 30,31 이 파일을 다운로드하려면 여기를 클릭하십시오.
토론
척수의 조직학적 염색은 EAE 질병의 중증도를 평가하는 데 중요한 도구이며, 특히 질병의 급성기 후 단계에서 질병 회복 정도에 치료 그룹 간에 차이가 있는 경우에 유용합니다. 면역 세포 침윤(CD45), 미엘린(LFB) 및 축삭 손상(SMI-32)에 대한 염색은 마우스에서 변경된 임상 점수의 근본적인 원인을 특성화하는 데 도움이 됩니다. 여기에 설명된 조직학적 염색 프로토콜은 염증의 관점과 미엘린 및 축삭 손상의 정도를 제공합니다. 또한, 표시된 결과는 EAE의 전체 신경 손상 정도를 평가하는 방법으로 sNF-L 측정을 검증합니다.
이 분석의 중요한 매개변수는 조사관이 절편의 정체를 눈멀게 하고 서로 다른 마우스에 걸쳐 척수의 각 수준에서 동일한 샘플링이 있는지 확인하는 것입니다. 이는 탯줄의 낮은 수준에서 염증의 심각성이 더 클 수 있기 때문입니다. 또 다른 중요한 매개변수는 실험 그룹의 크기입니다. 척수와 뇌는 일반적으로 종점에서 그룹당 6-8마리의 마우스에서 수집하여 치료 또는 유전자형이 적당한 효과 크기를 가진 그룹 간에 상당한 차이를 확인합니다. 또한 선택된 마우스의 평균을 구할 때 전체 그룹의 대표 평균 점수를 갖도록 하는 것도 중요합니다. 문제 해결과 관련하여 프로토콜에 익숙하지 않은 사람들이 직면하는 일반적인 문제는 척수가 불충분한 시간 동안 고정되어 있고 척추에서 쉽게 압출되지 않는다는 것입니다. 이 경우 가는 가위를 사용하여 가시 돌기를 따라 자르고 기둥을 열어 척수를 드러내는 방식으로 척수를 수동으로 절개할 수 있습니다. 또는 항체 염색의 성공을 방해하지 않고 며칠 동안 조직을 고정할 수 있습니다. 여기에 기술된 항체 클론은 포르말린에서 최대 2주까지 고정된 조직에서 작용합니다.
척수 조각을 삽입하려면 기술과 연습이 필요합니다. 아이 루프를 착용하고 램프를 임베딩 스테이션 위로 향하게 하여 단면이 단면으로 떨어지는지 세로 단면으로 떨어지는지 더 잘 시각화하는 것이 좋습니다. 그로스잉 시 척수 조각의 길이를 2mm 미만으로 유지하면 단면이 떨어지는 데 도움이 됩니다. 경험이 부족한 사용자에게 발생하는 또 다른 일반적인 문제는 하룻밤 배양 중에 LFB가 증발하여 슬라이드의 절반은 얼룩지고 절반은 염색되지 않은 상태로 남는다는 것입니다. 증발을 방지하려면 유리 염색 접시를 열가소성 필름으로 밀봉한 다음 플라스틱 랩으로 밀봉해야 합니다. 증발이 발생하고 단면이 고르지 않게 염색되면 탄산리튬으로 슬라이드를 완전히 탈청색하고 밤새 LFB에서 다시 염색하는 것이 좋습니다. 또 다른 일반적인 문제는 사용자가 LFB 후 회백질을 완전히 탈청색하지 않는다는 것입니다. 프로토콜의 다른 단계를 진행하기 전에 현미경으로 개별 섹션을 검사하여 충분한 양의 청색 제거에 도달했는지 확인하는 것이 중요합니다. 또한 CD45 및 SMI-32 IHC 염색은 강력한 성능을 보이지만 새로운 항체 로트를 받을 때마다 예비 실험에서 항체 농도를 문제 해결하는 것이 여전히 중요합니다. 이는 양성 대조군(EAE 척수)에서 다양한 농도의 항체를 검사하여 수행할 수 있습니다. 1차 염색에는 1차 항체를 첨가하지 않고 2차 항체만 사용하는 음성 대조군도 포함되어야 합니다. 마지막으로, 슬라이드나 섹션에서 얼룩이 고르지 않을 수 있으므로 이미지 분석에서 개별 이미지를 임계값으로 설정하는 것이 중요합니다.
이 프로토콜은 무료로 사용할 수 있는 소프트웨어를 사용합니다. 프로세서, 임베더 또는 마이크로톰에 액세스할 수 없는 경우 이러한 단계를 이러한 서비스를 제공하는 병원 기반 병리학 코어에 제공할 수 있습니다. 또한 슬라이드 스캐너를 사용할 수 없는 경우 비디오 카메라가 장착된 광학 현미경을 사용하여 척수 또는 뇌 영역의 TIFF 이미지를 저장할 수 있습니다. 현미경 기반 워크플로우의 경우 LFB 또는 LFB/H&E 절편을 저배율(40x 배율)로 캡처하고 CD45 및 SMI-32 염색의 경우 척수의 복부, 등쪽 및 측면 부분의 중앙에 있는 최소 4개의 창을 이미징합니다(CD45의 경우 200배 확대, SMI-32의 경우 400배 확대). 이러한 이미지에 대해 이미지 분석을 수행하여 설명된 것과 유사한 방식으로 염색을 정량화할 수 있습니다.
EAE를 점수화하기 위해 어떤 조직학적 접근 방식을 취해야 하는지에 대한 결정은 임상 점수가 그룹 간에 얼마나 다른지에 따라 달라집니다. 예를 들어, EAE 임상 점수에 급격한 차이가 있는 경우(한 그룹은 EAE를 얻었고 다른 그룹은 그렇지 않음), 이는 일반적으로 말초 매개 염증의 차이와 관련이 있습니다. 이 경우 LFB/H&E 염색 절편에 탈수초성 병변의 존재에 대한 점수는 충분하며 그룹 간의 차이를 드러낼 것입니다. 발병 시 임상 점수가 더 유사하고 임상적 회복 정도에 차이가 있는 경우(예: 그림 5A의 실험), 뇌간과 소뇌의 뇌 염증 점수를 포함하여 여기에 설명된 전체 조직학적 워크플로우를 적용하여 질병 만성의 차이가 염증 또는 조직 손상의 차이와 관련이 있는지 여부를 구별하는 것이 가장 좋습니다. CD45 계수로 평가한 바와 같이 염증의 차이가 발견되면 T 세포(항-CD3), 침윤성 단핵구/대식세포(Mac3) 및 미세아교세포(Iba-1/TMEM119)에 대한 염색을 위해 추가 IHC 연구를 수행할 수 있습니다(권장 항체 클론은 보충 표 3 참조). 미세아교세포 활성화는 이중 표지된 Iba-1+TMEM-19+ 미세아교세포에 대한 Iba-1 염색 강도의 증가와 섹션32에 대한 Sholl 분석으로 평가할 수 있는 미세아교세포 과정의 수축 증가에 의해 반영됩니다. 또한 유세포 분석 또는 단일 세포 RNA 염기서열 분석과 같은 기술을 적용하여 뇌와 척수에서 면역 집단의 빈도와 표현형을 보다 심층적으로 특성화할 수 있습니다.
SMI-32+ 축삭돌기의 계수는 EAE 32,33 및 MS34에서 축삭돌기 손상을 감지하는 민감한 방법입니다. SMI-32는 transected 뉴런의 end-bulbs에 축적된 neurofilament heavy 또는 medium의 non-phosphorylated 형태를 검출합니다. 손상된 축삭돌기를 검출하는 대안은 방해된 축삭 수송의 결과로 축삭에 축적될 수 있는 아밀로이드 전구체 단백질(APP)로 염색하는 것이다33. SMI-32 및 APP에 대한 염색 패턴은 둘 다 축삭 손상을 반영하지만, 일반적으로 겹치지 않으며, 이는 서로 다른 병리학을 검출하고 있음을 나타낸다33. 또한 척수와 뇌 모두에서 진행 중인 축삭 손상의 빠르고 민감한 측정인 sNF-L을 측정하여 축삭 손상의 조직학적 측정을 보완할 수 있습니다. 살아있는 쥐에서 반나절 만에 할 수 있다는 장점이 있습니다. 이 방법의 단점은 키트가 비싸고 기계가 고도로 전문화되어 있다는 것입니다. sNF-L 키트를 판매하는 회사는 SIMOA 기계에 액세스 할 수없는 사람들을 위해 서비스 요금을 제공합니다. 축삭 손상을 평가하는 대안은 척수12의 톨루이딘 청색 염색 부분에서 축삭을 계산하거나 척수 백질32 영역에서 SMI-31에 의해 검출된 신경 필라멘트 다발을 계산하여 축삭 손실에 대한 점수를 매기는 것입니다. 이 두 가지 모두 SMI-32 또는 sNF-L 측정보다 더 힘든 접근 방식입니다.
EAE 임상 점수가 그룹 간에 다르지만 염증, 탈수초화 및 축삭 손상에 대한 점수가 그룹 간의 차이를 나타내지 않는 경우 GFAP를 사용하여 성상세포 활성화를 위해 염색하는 것이 유용할 수 있습니다(권장 항체 클론에 대한 보충 표 3 참조). 성상세포(astrocyte) 활성화는 GFAP 염색의 증가와 연관되어 있으며, 이는 DA 랫트(35)의 만성 EAE를 포함한 일부 EAE 모델에서 EAE 진행과 상관관계가 있는 것으로 나타났다.
결론적으로, 이 프로토콜은 방법을 설명하고 EAE의 조직학적 스코어링을 수행하기 위한 분석 워크플로우를 제공합니다.
공개
Shannon Dunn은 FSD Lucid Psycheceuticals의 컨설팅을 담당합니다.
감사의 말
Raymond Sobel 박사(Stanford University)가 뇌와 척수 절편을 고치는 방법을 알려주셔서 감사합니다. 토론토 현상유전체학 센터(Toronto Centre for Phenogenomics)의 카일 로버턴(Kyle Roberton)과 밀란 강굴리(Milan Ganguly)에게 임베딩 방법을 배우고 뇌와 척수 절편을 많이 잘라낸 것에 대해 감사를 표합니다. 척수의 뇌수막하 및 혈관 주위 염증을 평가하기 위한 프로토콜을 공유해 주신 Matthew Cussick 박사와 Robert Fujinami 박사(유타 대학교)에게 감사드립니다. CD45 항체 클론을 공유해 주신 Shalina Ousman에게 감사드립니다. St. Michael's Hospital의 Keenan Research Centre of Biomedical Research에서 조직 처리기 및 조직 삽입 스테이션에 대한 교육을 제공하고 이 장비를 유지 관리해 주신 Xiofang Lu에게 감사드립니다. 이 연구는 MS Canada(SED)의 생물의학 보조금으로 지원되었습니다. 카르멘 우치페리(Carmen Ucciferri)는 캐나다 정부의 지원을 받고 있습니다. Nuria Alvarez-Sanchez는 Keenan의 박사후 연구원의 지원을 받고 있습니다.
자료
| Name | Company | Catalog Number | Comments |
| 10% Neutral Buffered Formalin | Sigma Aldrich | HT501128-4L | Used to fix spinal cord and brain specimens |
| 1000 mL Glass Beaker | Pyrex | 1000 | |
| 15 mL Falcon Tube | Starstedt | 62.554.100 | Fixing and storing spinal cord and brain |
| 250 mL Erlenmeyer Flask | Pyrex | 4980 | |
| 500 mL Glass Beaker | Pyrex | 1003 | |
| 92 mm x 16 mm Petri Dishes | Starstedt | 82-1473-001 | Used in the tissue grossing procedure |
| 95% Ethyl Alcohol | Commercial Alcohols | P016EA95 | Dehydration and rehydration steps |
| ABC Elite Kit | Vector Labratories | PK6100 | Used for immunohistochemistry labeling |
| Aqua Hold 2 PAP Pen | Cole Parmer | UZ-75955-53 | Used for drawing around tissue sections in Immunohistochemical Staining |
| Avidin/Biotin Blocking Kit | Vector Labratories | SP-2001 | |
| Biosafety Cabinet | Any | ||
| Biotinylated rabbit anti-rat IgG | Vector Labratories | BA-4000 | Used for CD45 staining |
| C57BL6/J Mice | Jackson Laboratory | Stock # 664 | These mice were used in experiments shown in paper. |
| Centrifuge | Thermo Fisher Scientific | Sorvall ST Plus | |
| CitriSolv | Fisher Scientific | 04-355-121 | Used for de-waxing. Is an alternative to xylene |
| DAB Kit | Vector Labratories | SK-4100 | Used for developing in immunohistochemistry |
| ddH2O | - | - | |
| Disposable Scalpel | Magna | M92-10 | Used for grossing spinal cord and brain |
| DWK Life Sciences (Wheaton) glass staining dish | Cole Parmer | UZ-48585-60 | Used for histochemical staining and washes |
| DWK Life Sciences (Wheaton) glass staining rack | Cole Parmer | 10061392 | Used for immunohistochemistry and histochemistry |
| Eosin Y | Bioshop | 173772-87-1 | Stains cytoplasm |
| Feather Microtome Blades | Fisher Scientific | 12-634-1C | Used for sectioning paraffin |
| Filter Paper | Whatman | 1001110 | Used to filter the formalin (during grossing) and the luxol fast blue |
| Fine Surgical Scissors | Fine Science Tools | 14160-10 | Used to snip brain and the skull |
| Fumehood | Any | ||
| Gibco DPBS | Fisher Scientific | 14190944 | |
| Glacial Acetic Acid | BioShop | ACE333.4 | Used in the luxol fast blue staining procedure |
| Histoplex Histology Containers | Starplex Scientific | 565-060-26 | Fixing spinal cord and brain |
| Hydrogen Peroxide | Fisher Chemicals | H325-500 | Used to remove endogenous peroxidase in the tissue |
| ImageJ | NIH | https://imagej.nih.gov/ij/download.html | |
| Kimtech Science Kimwipes | Kimberly Clark Professional | 34155 | Used for immunohistochemistry |
| Lens paper | VWR | 52846-001 | Used for trapping spinal cord species in cassette during processing |
| Light microscope | Any | ||
| Lithium carbonate | Sigma Aldrich | 554-13-3 | De-blueing after luxol fast blue staining |
| Luxol blue | Sigma Aldrich | 1328-51-4 | Stains CNS myelin |
| M.O.M Immunodetection Kit | Vector Labratories | BMK-2202 | Used to stain SMI-32 |
| Methanol | Fisher Chemicals | A454.2 | Used for fixation |
| Mayer's Hematoxylin | Electron Microscopy Sciences | 26381-02 | Stains nuclei |
| Micro-Adson Forceps with Teeth | Fine Science Tools | 11027-12 | Used for reflecting the skull during dissections |
| Microcentrifuge | Eppendorf | Model 5417R | |
| Microvette Capillary Tubes CB 300 Z | Starstedt | 16.440.100 | Used for blood collection |
| Micrscope Cover Glass | Fisher Scientific | 12545A | Used for coverslipping |
| Mini Shaker | VWR | 12620-938 | Used for making buffers |
| NF light kit | Quanterix | 103186 | This kit can be used for detection of mouse or human soluble neurofilament in serum |
| Nitrile Gloves | VWR | 76307-462 | Safety |
| Normal Goat Serum | Vector Labratories | S-1000 | Blocking reagent |
| Normal Rabbit Serum | Vector Labratories | S-5000 | Blocking reagent |
| OmniSette Tissue Cassettes | Fisher Scientific | M4935FS | Used for embedding spinal cord and brain |
| p1000 Pipette and Tips | various | ||
| p200 Pipette and Tips | various | ||
| Paraffin Embedding station | Leica Biosystems | Model EG1160 | |
| Paraplast Tissue Infiltration/Embedding Medium | Leica Biosystems | 39601006 | Used for embedding spinal cord and brain |
| Permount Mounting Medium | Fisher Chemicals | SP15-100 | Used for mounting coverslips on slides |
| pH meter | Fisher Scientific | 13636AB315B | Used for pHing buffers |
| Plastic Transfer Pipettes | Fisher Scientific | 13-711-20 | Used for pHing buffers |
| Potassium Chloride | BioShop | 7447-40-7 | Used for making PBS |
| Potassium Phosphate Monobasic | BioShop | 7778-77-0 | Used for making PBS |
| Pressure Cooker | Nordic Ware | Tender Cooker | |
| Purified rat anti-mouse CD45 | Vector Labratories | 553076 | Detects leukocytes |
| Reagent grade alcohol 100% | VWR | 89370-084 | Dehydration and rehydration steps |
| Reagent grade alcohol 70% | VWR | 64-17-5 | Dehydration and rehydration steps |
| Rotary Microtome | Leica Biosystems | Model RM2235 | |
| Simoa Machine | Quanterix | HD-X | |
| Slide Scanner | Zeiss | AxioScan.Z1 | |
| SMI-32 mouse IgG1 antibody | Biolegend | 801701 | Detects damaged axons |
| Sodium Chloride | BioShop | 7647-14-5 | Used for making PBS |
| Sodium Phosphate Dibasic | Bioshop | 7558-79-4 | Used for making PBS |
| Standard Adson Forceps | Fine Science Tools | 11150-10 | Used for dissection steps |
| Superfrost Plus Microscope slides | Fisher Scientific | 12-550-15 | Used to collect sections |
| Surgical Tough Cuts | Fine Science Tools | 14110-15 | Used to cut through the spine, body wall, and skin |
| Tissue Processor | Leica Biosystems | Model TP1020 | |
| Tri-soldium citrate | Thermo Fisher Scientific | 03-04-6132 | Used for antigen retrieval |
| Tween-20 | BioBasic | 9005-64-5 | Used for washing sections |
| X-P Pierce XP-100 plate seal | Excel Scientific | 12-140 | Used for the sNF-L Assay |
| Xylene | Fisher Chemicals | 1330-20-7 | Used for de-waxing and clearing sections |
| Funnel | Cole Parmer | RK-63100-64 | Used to filter formalin before grossing tissue |
| Stir Plate | Any | Used to make solutions | |
| Oven | Any | Used to bake tissue sections after cutting | |
| Parafilm | Bemis | 13-374-10 | Used to seal LFB staining dish |
| Microwave | Any | Timing may vary depending on the microwave model | |
| Bovine Serum Albumin (BSA) | Sigma Aldrich | 9048-46-8 | Used to make blocking buffer |
| 1.5 mL Microcentrifuge Tubes | Fisher Scientific | 05-408--129 | Used to store mouse serum samples |
| Vortex | Any | Used to prepare samples for sNF-L assay | |
| Waterbath | Any | Used to warm enzyme substrate for sNF-L assay |
참고문헌
- Constantinescu, C. S., Farooqi, N., O'Brien, K., Gran, B. Experimental autoimmune encephalomyelitis (EAE) as a model for multiple sclerosis (MS). Br J Pharmacol. 164 (4), 1079-1106 (2011).
- Rasouli, J., et al. Expression of GM-CSF in T is increased in multiple sclerosis and suppressed by IFN-beta therapy. J Immunol. 194 (11), 5085-5093 (2015).
- Zrzavy, T., et al. Loss of 'homeostatic' microglia and patterns of their activation in active multiple sclerosis. Brain. 140 (7), 1900-1913 (2017).
- Kutzelnigg, A., Lassmann, H. Pathology of multiple sclerosis and related inflammatory demyelinating diseases. Handb Clin Neurol. 122, 15-58 (2014).
- Glatigny, S., Bettelli, E. Experimental autoimmune encephalomyelitis (EAE) as animal models of multiple sclerosis (MS). Cold Spring Harb Perspect Med. 8 (11), (2018).
- Kipp, M., Nyamoya, S., Hochstrasser, T., Amor, S. Multiple sclerosis animal models: A clinical and histopathological perspective. Brain Pathol. 27 (2), 123-137 (2017).
- Nikic, I., et al. A reversible form of axon damage in experimental autoimmune encephalomyelitis and multiple sclerosis. Nat Med. 17 (4), 495-499 (2011).
- Croxford, A. L., et al. The cytokine GM-CSF the inflammatory signature of CCR2+ monocytes and licenses autoimmunity. Immunity. 43 (3), 502-514 (2015).
- Jones, M. V., et al. Behavioral and pathological outcomes in MOG 35-55 experimental autoimmune encephalomyelitis. J Neuroimmunol. 199 (1-2), 83-93 (2008).
- Zuo, M., et al. Age-dependent gray matter demyelination is associated with leptomeningeal neutrophil accumulation. JCI Insight. 7 (12), 158144 (2022).
- Bannerman, P. G., et al. Motor neuron pathology in experimental autoimmune encephalomyelitis: Studies in thy1-yfp transgenic mice. Brain. 128, 1877-1886 (2005).
- Cahill, L. S., et al. Aged hind-limb clasping experimental autoimmune encephalomyelitis models aspects of the neurodegenerative process seen in multiple sclerosis. Proc Natl Acad Sci U S A. 116 (45), 22710-22720 (2019).
- Stromnes, I. M., Goverman, J. M. Active induction of experimental allergic encephalomyelitis. Nat Protoc. 1 (4), 1810-1819 (2006).
- Stromnes, I. M., Goverman, J. M. Passive induction of experimental allergic encephalomyelitis. Nat Protoc. 1 (4), 1952-1960 (2006).
- Drohomyrecky, P. C. Peroxisome proliferator-activated receptor-delta acts within peripheral myeloid cells to limit the expansion of myelin-reactive T cells during experimental autoimmune encephalomyelitis (EAE). J. Immunol. 10, 2588-2601 (2019).
- Osorio-Querejeta, I., et al. The innovative animal monitoring device for experimental autoimmune encephalomyelitis ("I am D EAE"): A more detailed evaluation for improved results. Mult Scler Relat Disord. 63, 103836 (2022).
- Wang, C., et al. Induction and diverse assessment indicators of experimental autoimmune encephalomyelitis. J Vis Exp. (187), e63866 (2022).
- Shahi, S. K., Freedman, S. N., Dahl, R. A., Karandikar, N. J., Mangalam, A. K. Scoring disease in an animal model of multiple sclerosis using a novel infrared-based automated activity-monitoring system. Sci Rep. 9, 19194 (2019).
- Kluver, H., Barrera, E. A method for the combined staining of cells and fibers in the nervous system. J Neuropathol Exp Neurol. 12 (4), 400-403 (1953).
- Disanto, G., et al. Serum neurofilament light: A biomarker of neuronal damage in multiple sclerosis. Ann Neurol. 81 (6), 857-870 (2017).
- Novakova, L., et al. Monitoring disease activity in multiple sclerosis using serum neurofilament light protein. Neurology. 89 (22), 2230-2237 (2017).
- Pouzol, L., et al. Act-1004-1239, a first-in-class CXCR7 antagonist with both immunomodulatory and promyelinating effects for the treatment of inflammatory demyelinating diseases. FASEB J. 35 (3), 21431 (2021).
- Breakell, T., et al. Obinutuzumab-induced B-cell depletion reduces spinal cord pathology in a CD20 double transgenic mouse model of multiple sclerosis. Int J Mol Sci. 21 (18), 6864 (2020).
- Aharoni, R., et al. Neuroprotective effect of glatiramer acetate on neurofilament light chain leakage and glutamate excess in an animal model of multiple sclerosis. Int J Mol Sci. 22 (24), 13419 (2021).
- Sternberger, L. A., Sternberger, N. H. Monoclonal antibodies distinguish phosphorylated and nonphosphorylated forms of neurofilaments in situ. Proc Natl Acad Sci U S A. 80 (19), 6126-6130 (1983).
- Kuhle, J., et al. Serum neurofilament is associated with progression of brain atrophy and disability in early MS. Neurology. 88 (9), 826-831 (2017).
- Benkert, P., et al. Serum neurofilament light chain for individual prognostication of disease activity in people with multiple sclerosis: A retrospective modelling and validation study. Lancet Neurol. 21 (3), 246-257 (2022).
- D'Souza, C. A., et al. OGR1/GPR68 modulates the severity of experimental autoimmune encephalomyelitis and regulates nitric oxide production by macrophages. PLoS One. 11 (2), 0148439 (2016).
- Doroshenko, E. R., et al. Peroxisome proliferator-activated receptor-delta deficiency in microglia results in exacerbated axonal injury and tissue loss in experimental autoimmune encephalomyelitis. Front Immunol. 12, 570425 (2021).
- Soulika, A. M., et al. Initiation and progression of axonopathy in experimental autoimmune encephalomyelitis. J Neurosci. 29 (47), 14965-14979 (2009).
- Trapp, B. D., et al. Axonal transection in the lesions of multiple sclerosis. N Engl J Med. 338 (5), 278-285 (1998).
- Lassmann, H., Bradl, M. Multiple sclerosis: Experimental models and reality. Acta Neuropathol. 133 (2), 223-244 (2017).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유