JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
예쁜꼬마선충(Caenorhabditis elegans)의 글리코겐 축적 및 장 무결성을 시각화하기 위한 저비용 염료 사용
요약
생물학을 가르치는 것은 실험을 통해 학생들에게 더 자극을 줄 수 있습니다. 이 원고는 학생들이 고칼로리 다이어트, 굶주림 및 노화와 관련된 가설을 공식화하고 테스트하도록 장려하기 위해 교실에서 사용할 수 있는 두 가지 다르지만 보완적인 프로토콜을 제시합니다.
초록
예쁜꼬마선충(C. elegans )은 생물학이 간단하여 투명하고 기생충이 없는 선충으로, 세포 또는 세포의 분자 함량을 염색하여 생물학 교육에 유용한 도구입니다. Lugol 염료(요오드-요오드화 칼륨 용액)는 글리코겐 저장을 염색하기 위해 생화학에서 널리 사용되었습니다. 이러한 맥락에서 다른 식단 및 산소 수치와 같은 다른 조건의 영향 외에도 먹이를 먹은 동물과 굶주린 동물 간의 차이를 관찰할 수 있습니다. 에리오글라우신(Erioglaucine)은 장 장벽의 손실을 나타내는 파란색 염료입니다. 장 장벽이 손상되지 않으면 파란색 염료가 내강 내부에 얼룩이 생깁니다. 그러나 이러한 무결성이 파괴되면 염료가 체강 내로 누출됩니다. 교사는 실체현미경이나 현미경을 사용하여 생리학적 및 생화학적 변화를 시연하거나 학생들이 과학적 질문을 하고 이러한 분석을 사용하여 가설을 세우고 테스트하도록 유도할 수 있습니다. 본 프로토콜은 예쁜꼬마선충(C. elegans )에서 학생들이 쉽게 수행할 수 있는 두 가지 염색 기법을 설명합니다.
서문
고등학교에서 생물학을 가르치는 것은 끊임없는 도전입니다. 주목할 만한 점은, 기술의 접근과 사용은 교수-학습 과정에 중요한 발전을 가져왔지만, 인공 지능 챗봇과 같은 도구는 쉽게(때로는 부정확한) 응답을 얻기 때문에 합리화하고 증거를 찾는 것을 더 어렵게 만듭니다1. 그렇기 때문에 교실에서 탐구 기반 접근 방식에서 실제 실험과 함께 과학적 방법을 사용하는 것은 학생들의 비판적 사고, 창의성 및 기술적 기술을 개발하거나 자극하는 중요한 전략입니다2.
이러한 맥락에서, 자유로운 살아있는 선충 Caenorhabditis elegans 는 다음과 같은 특별한장점 때문에 교육 목적3을 위한 실험에 성공적으로 사용되어 왔다: 그것은 기생충이 아니며 먹이에 사용되는 대장균 은 생물안전 레벨 1이므로 생물학적 위험을 거의 0에 가깝게 줄인다. 그것은 우아하고 정량화 가능한 운동 움직임을 가지고 있어 학생들이 관찰하는 것이 흥미롭습니다. 그리고 투명하여 장기 관찰이 가능하지만 생체 분자의 존재 또는 생리적 변화의 발생을 나타낼 수 있는 색소로 염색할 수도 있습니다4. 따라서 생화학 및 노화와 같은 생리적 변화와 관련된 간단한 가정을 교실에서 가설을 세우고 테스트할 수 있습니다.
글리코겐은 (1→4)-α 글리코시드 선형 결합과 (1→6)-α 글리코시드 결합을 가진 글루코실 잔기에 의해 형성된 포도당 분자의 길고 분지된 사슬에 의해 형성된 저장 탄수화물이며, 근육 수축, 세포 분화 및 혈당 유지에 특히 중요하다5. 글리코겐은 글리코겐 합성효소의 인슐린 활성화로 인해 수유 후 합성됩니다. 운동이나 단식 중에는 에피네프린 또는 글루카곤이 각각 글리코겐 인산화효소를 활성화하여 다당류를 분해하여 근육 세포에 포도당-6-인산을 제공하거나 유리 포도당을 방출하여 저혈당을 회피합니다 6,7. 글리코겐 수준의 변화는 암을 포함한 다양한 생리학적 및 병태생리학적 조건에서 세포 분화, 신호전달, 산화 환원 조절 및 줄기에 영향을 미친다8. 예쁜꼬마선충(C. elegans)에서 글리코겐은 주로 식도 근육, 피하, 장, 뉴런 및 주로 체벽 근육에서 발견된다9. 글리코겐 함량은 요오드가 요오드-글리코겐 복합체를 형성하는 나선형 코일에 결합하여 눈에 띄는 선명한 청색-검정색 또는 갈색-검정색을 제공하기 때문에 Lugol의 요오드 용액을 사용하여 측정할 수 있으며, 이는 예쁜꼬마선충10에서 글리코겐 함량을 입증하는 데 성공적으로 사용되었습니다. 높은 포도당 공급으로 인한 글리코겐 축적은 벌레의 수명을 단축시켜 노화 과정을 가속화 할 수 있음이 입증되었습니다11,12. 또한 대사 장애, 기타 호르몬 및 생체 이물(xenobiotics)에 대한 노출은 글리코겐 대사를 변화시킬 수 있습니다13,14. 따라서 예쁜꼬마선충의 글리코겐 함량에 대한 실험은 다양한 요인이 신진대사를 방해할 수 있고 운동, 식이요법, 질병 및 노화와 같은 횡단적 주제와 관련된 기본 생화학에 대한 수업 중 토론을 자극할 수 있기 때문에 매우 흥미롭습니다.
노화는 세포 손상으로 인한 시간에 따른 기능 저하입니다. 이러한 손상은 산화 스트레스, 텔로미어 감소, 단백질 소실, 염증 및 심지어 불용성 다원체(polyglucosan body)15의 축적과 관련될 수 있습니다. 노화의 특징 중 하나는 유기체의 일생 동안 발생하는 여러 만성 질환과 관련된 장 무결성의 감소입니다16. 장 항상성의 유지는 장 상피의 무결성에 달려 있으며, 이는 물리적 장벽을 형성하고 인접한 상피 세포를 연결하는 접합 단백질에 의해 지원됩니다. 이 상피에 손상이 있을 때, 간질로의 발광 함량의 누출이 발생한다17. 이 메커니즘에 기초하여, 스머프 테스트는 이 청색 염료 Erioglaucine disodium salt가 장막을 통과하지 않고 내강18에 남아 있기 때문에 여러 동물 모델에서 장 무결성을 확인하는 데 사용되었습니다. 지렁이가 병원체에 감염되고 일부 독성 물질이나 노화에 오염되어 틈새 무결성이 변경되면 염료가 장벽을 통과하여 지렁이 전체에 퍼져 온통 파란색으로 변합니다. 이 분석을 통해 노화의 생리학에 대해 논의하고 웜을 다양한 조건에 노출시킴으로써 이 과정을 가속화하거나 지연시킬 수 있는 요인에 대해 실험할 수 있습니다. 여기의 프로토콜은 학생들이 생화학 및 생리학과 관련된 가설을 공식화하고 테스트하도록 선동하고 자극하기 위해 수업에서 쉽게 수행할 수 있는 이 두 가지 염료 기반 방법을 자세히 설명합니다.
프로토콜의 첫 번째 부분은 예쁜꼬마선충 모델10의 글리코겐 함량을 정성적 및 정량적으로 분석할 수 있는 적용 가능성을 보여줍니다. 프로토콜의 두 번째 부분의 목적은 예쁜꼬마선충(C. elegans) 장의 무결성을 평가하는 것입니다. 이 기술을 사용하면 예쁜꼬마선충(C. elegans)의 노화를 모니터링할 수 있으며, 장막의 무결성을 평가할 수 있습니다. 또한, 물질이 노화를 가속화하거나 지연시키는지, 그리고 어떤 물질이 장 장벽에 독성 잠재력을 가지고 있는지 여부를 평가할 수 있다(19).
본 연구에 사용된 예쁜꼬마선충(C. elegans ) 균주는 브리스톨 N2 야생형이었다. 그러나 유사한 성장률을 보이는 균주를 사용하여 절차를 복제할 수 있으며, 동일하거나 유사한 기능을 갖는 것을 고려하여 장비 교체의 필요성에 따라 또는 특정 균주에는 특정 유지 및/또는 민감도 요구 사항이 있으므로 사용되는 균주에 따라 방법을 조정해야 합니다. 이 정보는 Caenorhabditis Genetics Center (CGC) 또는 WormBase 웹 사이트에서 얻을 수 있습니다. 이러한 변경은 분석법의 재현성에 영향을 미치지 않아야 합니다.
프로토콜
참고 : 대장균 OP50 (E. coli OP50) 박테리아 및 Bristol N2 야생형 균주는 CGC, University of Minnesota, USA 또는 C. elegans 실험실의 기증을 통해 얻을 수 있습니다. 연구자의 안전을 위해 개인 보호 장비를 사용하는 것이 필수적입니다. 차아염소산염 및 수산화나트륨과 같은 시약의 농도는 낮지만 이러한 화학 물질과 관련된 잠재적 위험을 최소화하기 위해 원고에서 강조한 대로 권장되는 PPE를 착용하는 것이 중요합니다.
1. 글리코겐 함량
- 테스트 플레이트 준비
- 웜 균주당 6개의 60mm x 15mm NGM 한천 플레이트20개( 보충 표 1에 설명된 대로 선충 성장 매체 한천, NGM 10mL)를 준비하고 실온에서 1일 동안 건조시킵니다. 오염을 방지하기 위해 플레이트를 닫아 두십시오.
- 플레이트당 200μL의 E. coli OP50 액체 배양액(광학 밀도 = 0.600, 대략 600nm의 파장에서)을 추가하여 플로우 후드에 균주당 총 4개의 60mm x 15mm NGM 플레이트를 접종합니다. 닫힌 플레이트를 사용하기 37일 전에 1일 동안 C에서 배양합니다.
알림: 6개의 플레이트를 준비하되(1.1단계) 4개에만 대장균 OP50 박테리아를 접종합니다. 웜을 굶주린 상태에 놓을 때 나중에 사용할 수 있도록 나머지 두 플레이트를 4°C에서 예약하십시오. 이 분석은 중복으로 수행될 수 있습니다. - 테스트 당일에는 이전에 E. coli OP50 박테리아로 파종된 균주당 2개(6mm x 15mm) NGM 한천 플레이트에 0.025M D-Glucose 200μL를 추가합니다. 플레이트를 플로우 후드의 실온에서 건조시키십시오.
참고: E. coli OP50 박테리아가 파종된 NGM 한천 플레이트는 플로우 후드를 사용하는 대신 알코올 램프 근처에서 건조할 수도 있습니다.
- 동기화
- 동기화하기 약 3일 전에 예쁜꼬마선충 Bristol N2(야생형)가 있는 유지 보수 NGM 한천에서 다양한 단계(청크당 약 500마리의 웜)에서 3-4개의 덩어리(3cm x 3cm)를 이전에 E. coli OP50 박테리아로 파종한 새 플레이트(150mm x 90mm)로 옮깁니다.
- 웜이 있는 새 플레이트를 20°C의 통제된 환경에 놓고 습도 >95% 3일 동안 유지합니다(72시간은 대부분의 웜이 중력 성인 단계에 도달할 수 있도록 허용).
참고: 사용 중인 예쁜꼬마선충 균주에 따라 성장 온도를 조정해야 할 수도 있습니다. - 파스퇴르 피펫을 사용하여 증류 된 H2O로 준비된 플레이트에서 웜을 수집하고 50mL 원심 분리 튜브로 옮깁니다.
- 중력에 의해 웜이 침전될 때까지 기다린 다음(약 15분) 상층액을 제거합니다. 이 과정을 3번 반복하여 박테리아를 제거합니다. 마지막 세척 후 부피를 5mL로 줄입니다.
- 표백액 10mL( 보충 표 1)를 넣고 약 6분 동안 손을 사용하여 세게 흔듭니다.
- 쉐이킹이 완료된 직후 M9 완충액으로 튜브를 50mL 용량까지 채웁니다.
- 1400 x g 에서 3분 동안 원심분리하고 상층액을 최대 5mL까지 제거한 다음 45mL의 M9 완충액을 다시 추가합니다. 이 과정을 4번 반복합니다.
- 마지막 세척 후 부피를 15mL로 줄이고 약 14시간 동안 제어된 온도(20°C) 및 습도(>95%)에서 유지합니다.
참고: 동기화 과정은 산란을 통해 난자를 얻는 것으로 대체할 수 있습니다: 약 20마리의 성체 임신 웜을 200μL의 E. coli OP50으로 미리 파종한 NGM 플레이트(6mm x 15mm)에 옮깁니다. 벌레가 1일 동안 알을 낳도록 합니다. 그런 다음 임신 한 벌레를 제거하고 알이 부화 할 때까지 기다립니다.
- 웜의 준비
- 자동 피펫을 사용하여 동기화된 웜 10μL(단계 1.2.8)를 현미경 슬라이드에 추가하고 웜의 수를 계산합니다. 500-1000 worms/μL를 얻기 위해 얼마나 많은 부피를 피펫팅해야 하는지 계산하십시오.
- 500-1000 L1 동기화 웜 (단계 1.2.8)을 E. coli OP50 박테리아를 먹이 공급원으로 파종 한 NGM 한천 플레이트 (150mm x 90mm, 보충 표 1)로 20 ° C에서 유충 4 단계 (L4)에 도달 할 때까지 옮깁니다.
알림: 웜은 자동 피펫을 사용하여 이송할 수 있습니다. 자동 피펫을 사용할 수 없는 경우 유리 파스퇴르 피펫을 사용하고 마이크로튜브 라벨 또는 유리 눈금 피펫을 사용하여 부피를 제어할 수 있습니다. - 동기화20의 48시간 후: 플라스틱 파스퇴르 피펫을 사용하여 M9 완충액(보충 표 1)으로 플레이트에서 L4 유충을 수집하고 깨끗한 원추형 튜브 50mL에 넣고 신선한 M9 완충액으로 3배 세척하거나 남아 있는 모든 대장균 OP50 박테리아가 완전히 제거될 때까지(실온에서) 세척을 반복합니다.
알림: 일부 벌레는 절차 중에 굶주림을 경험할 수 있으므로 세척 단계가 중요합니다.
- 어세이 실행
- 이전에 준비한 새로운 NGM 한천 플레이트(60mm x 15mm) 각각(1.1.2 및 1.1.3)에서 500-1000 L4 웜(1.3.1 단계)을 옮깁니다. 시험일까지 20°C에서 48시간 동안 보관하십시오. 이 일정은 다음과 같이 3개의 실험 그룹이 중복됩니다(그림 1).
A-(굶주림): 웜은 E. coli OP50 박테리아가 없는 일반 NGM 한천 플레이트에서 자랍니다.
B-(일반): 웜은 E. coli OP50 박테리아로 파종된 일반 NGM 한천 플레이트에서 자랍니다.
C-(고포도당): 웜은 E. coli OP50 박테리아로 파종되고 0.025M D-포도당을 포함하는 NGM 한천 플레이트에서 자랍니다. - 시험 당일(48시간 후): 웜을 수집하고 M9 버퍼에서 세 번 간단히 세척합니다(1.2.2 및 1.2.3단계).
참고: 여기에서 D-포도당을 첨가하여 NGM 한천 플레이트를 준비하고 (1.3 단계) 웜을 추가할 때까지 따로 보관합니다.- 요오드 염색: 새로운 M9 완충액을 사용하여 5%(v/v) Lugol의 요오드 용액(요오드/요오드화칼륨 용액)을 준비합니다.
알림: Lugol의 요오드 용액은 현지 시약 공급업체나 약국에서 얻을 수 있으므로 초기 농도는 다를 수 있습니다. 필요한 경우 계산하여 5%(v/v) 솔루션을 얻습니다.
- 요오드 염색: 새로운 M9 완충액을 사용하여 5%(v/v) Lugol의 요오드 용액(요오드/요오드화칼륨 용액)을 준비합니다.
- 각 그룹에서 약 100μL의 세척된 웜(단계 4.2)을 희석된 Lugol 용액(5% v/v)이 포함된 1.5mL 마이크로튜브로 옮깁니다. 자동 피펫을 1:5 비율로 사용하여 100μL의 웜을 400μL의 Lugol 용액에 옮긴 다음 믹서에서 5분 동안 부드럽게 교반합니다.
알림: 믹서를 사용할 수 없는 경우 마이크로튜브를 손으로 조심스럽게 흔들 수 있습니다. - 이 5분 직후 1.5mL 마이크로튜브(웜 + Lugol 용액)를 1400 x g 에서 3분 동안 원심분리합니다.
참고: 이 분석이 L4 단계 이상의 웜에 대해 수행되면 원심분리기를 사용하는 대신 중력 침강을 달성할 수 있습니다. 모든 웜이 마이크로튜브 바닥에 가라앉을 때까지 벤치탑의 랙에 마이크로튜브를 열어 둡니다. - 상층액을 제거하고 1.0mL의 새 M9 완충액으로 웜을 세척합니다. 용액에서 남아 있는 모든 요오드가 제거될 때까지 세척을 반복합니다(최소 3회).
- 마지막 세척 단계 후 약 100μL의 잔류물을 제외한 상층액을 제거합니다. 이를 사용하여 웜을 부드럽게 재현탁시키고 현미경 분석을 수행합니다.
- 약 50μL의 재현탁 웜 용액을 현미경 슬라이드에 옮기고 커버 슬립으로 덮습니다. 실체현미경(1.5x)을 사용하여 명시야 이미지를 관찰합니다.
참고: 실체현미경을 사용할 수 없는 경우 일반 현미경을 사용할 수 있으며 어댑터를 사용하여 휴대폰 카메라(3.4x)로 이미지를 캡처할 수 있습니다. 빛/밝기/노출로 인한 오류를 방지하려면 모든 사진에 대해 모든 휴대폰 카메라 설정을 일관되게 유지하는 것이 중요합니다.
- 이전에 준비한 새로운 NGM 한천 플레이트(60mm x 15mm) 각각(1.1.2 및 1.1.3)에서 500-1000 L4 웜(1.3.1 단계)을 옮깁니다. 시험일까지 20°C에서 48시간 동안 보관하십시오. 이 일정은 다음과 같이 3개의 실험 그룹이 중복됩니다(그림 1).
- 데이터 검사
- 정량적 데이터: 벌레의 요오드 염색을 기반으로 글리코겐 함량을 계산합니다.
- 그룹당 최소 10개의 웜이 포함된 실체현미경의 이미지를 추가 처리를 위해 .jpeg 파일로 저장합니다. 이를 위해 무료 ImageJ 소프트웨어를 다운로드하십시오. 자세한 내용은 보충 파일 1, 보충 그림 1, 보충 그림 2에 나와 있습니다.
- ImageJ 소프트웨어(https://imagej.nih.gov/ij/download.html 에서 무료로 다운로드할 수 있음)를 사용하여 .jpeg 이미지를 엽니다. Segmented line(분할된 선 )을 클릭하고 웜의 윤곽을 그립니다(한 번에 하나의 웜). Analyze( 분석)를 클릭한 다음 Measure(측정 )를 선택하여 염색 정량화를 얻습니다. 데이터는 테이블에 평균으로 표시됩니다. 평균은 웜 영역당 염색 밀도에서 계산된 데이터를 나타냅니다.
- 정성적 데이터: 각 그룹의 실체현미경에서 이미지를 얻고 웜의 염색을 시각적으로 비교합니다. 필요한 경우 염색을 분석하기 위해 점수 시스템을 만듭니다 : 0 무색; 1 가볍게 얼룩진; 2개는 얼룩이 있고 3개는 심하게 얼룩져 있습니다. 실체현미경을 사용하여 핸드 카운터로 그룹(최소)당 약 10개의 웜을 수동으로 계산합니다.
- 정량적 데이터: 벌레의 요오드 염색을 기반으로 글리코겐 함량을 계산합니다.
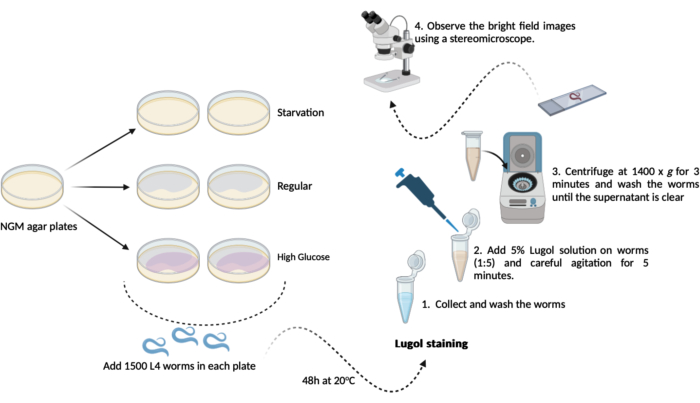
그림 1: 예쁜꼬마선충(C. elegans)의 전체 글리코겐 함량 분석 개략도. 글리코겐 함량 분석을 수행하기 위해 여기에서 수행된 실험의 개략도. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
2. 장 투과성 평가
- 웜의 준비
- 동기화 후 약 14시간 후(단계 1.2.8), 첫 번째 유충 단계(L1)에서 500-1000개의 웜(단계 1.3.1 및 NOTE)을 미리 준비된 각각의 새로운 NGM 한천 플레이트(60mm x 15mm)로 옮기고 테스트 당일까지 20°C에서 유지합니다. 이 일정은 다음과 같이 두 개의 실험 그룹으로 이어집니다(그림 2).
A-(젊은): 벌레는 유충 4단계(L4)까지 박테리아 E. coli OP50으로 파종된 NGM 한천 플레이트에서 자랍니다.
B- (오래된) : 벌레는 성충 7일까지 E. coli OP50 박테리아로 파종 된 NGM 한천 플레이트에서 자랍니다.
참고: 성충7일째 까지 유지된 기생충은 매일 M9 완충액으로 세척하고 식품 대체 및 자손 제거를 위해 이전에 파종된 200μL의 E. coli OP50 박테리아가 있는 새로운 NGM 한천 플레이트(60mm x 15mm)로 옮겨야 합니다. 더 어린 벌레는 디캔테이션 중에 뜨고 상층액을 제거하여 분리할 수 있습니다. 스머프 웜의 비율은 나이가 들면서 증가합니다. 그러나 장 투과성 평가는 연구 목적에 따라 모든 단계와 연령에서 수행할 수 있습니다.
- 동기화 후 약 14시간 후(단계 1.2.8), 첫 번째 유충 단계(L1)에서 500-1000개의 웜(단계 1.3.1 및 NOTE)을 미리 준비된 각각의 새로운 NGM 한천 플레이트(60mm x 15mm)로 옮기고 테스트 당일까지 20°C에서 유지합니다. 이 일정은 다음과 같이 두 개의 실험 그룹으로 이어집니다(그림 2).
- 어세이 실행
- 테스트 당일에는 M9 완충액(보충 표 1)을 사용하여 L4 웜(2.1.1단계 2일 후)과 7일째(현재 9일째)에 성충을 수집하고 라벨이 부착된 1.5mL 마이크로튜브로 옮깁니다.
- 1400 x g 에서 3분 동안 원심분리하고 상층액을 제거하고 M9 1.0mL를 넣고 부드럽게 섞습니다. 이 과정을 3번 반복하여 박테리아를 제거합니다. 마지막 세척 후 부피를 500μL로 줄입니다.
- 자동 피펫을 사용하여 웜 침전물 10μL를 현미경 슬라이드에 추가하고 웜의 수를 세습니다. 100 worms/μL를 얻기 위해 피펫팅할 부피를 계산합니다.
- 스머프 염색: 증류수를 사용하여 25% Erioglaucine disodium salt(보충 표 1) 용액을 준비합니다. 필요한 경우 더 나은 용해를 위해 와류를 사용하십시오.
- 이전에 확인된 새로운 마이크로튜브에 자동 피펫을 사용하여 웜 100개, 25% Erioglaucine 디소듐 염 용액 100μL, E . coli OP50 200μL를 추가하고 M9 완충액을 포함하여 최종 부피 500μL를 만듭니다.
참고: Erioglaucine disodium, E. coli 및 웜의 수는 고정되어 있습니다. M9 버퍼의 부피는 가변적이며 최종 부피를 500μL로 가져오는 데 사용할 수 있습니다. - 실온에서 빛으로부터 보호되는 믹서에서 교반하면서 3시간 동안 배양합니다.
알림: 믹서를 사용할 수 없는 경우 15분마다 마이크로튜브를 손으로 조심스럽게 흔듭니다. - 3시간 후 1.5mL 마이크로튜브를 1400 x g 에서 3분 동안 원심분리합니다. 1.0mL의 상층액을 제거하고 1.0mL의 M9 완충액으로 웜을 세척합니다.
- 남아 있는 Erioglaucine disodium salt 용액이 용액에서 제거될 때까지 세척을 반복합니다. 마지막 세척 단계 후 약 250μL의 잔류물을 제외한 상층액을 제거합니다. 이를 사용하여 웜을 조심스럽게 재현탁하고 현미경 분석을 위해 처리합니다.
- 약 50개의 재현탁 웜 용액을 현미경 슬라이드로 옮기고 커버 슬립으로 덮습니다. 현미경 슬라이드를 -20°C의 냉장고에서 10분 동안 배양하여 벌레를 마비시킵니다.
참고: 웜을 마비시키는 또 다른 대안은 10μL의 레바미솔 염산염 용액(10mM; 보충표 1) 그리고 커버 슬립으로 덮으십시오. - 실체현미경(1.5x)의 명시야를 사용하여 총 벌레 수와 완전히 염색된 벌레의 수를 관찰하고 계산합니다. 어댑터와 연결된 휴대폰 카메라(3.4x)에서 이미지를 얻을 수 있습니다. 빛/밝기/노출로 인한 오류를 방지하려면 모든 사진에 대해 모든 휴대폰 카메라 설정을 일관되게 유지하는 것이 중요합니다.
- 데이터 검사
- 정성적 데이터: 각 그룹(성충 L4 및 7일 째)의 실체현미경에서 이미지를 얻고 벌레의 염색을 육안으로 비교합니다.
- 실체현미경을 사용하여 웜의 총 수와 스머프 웜(파란색 웜)의 수를 계산합니다.
- 어린 웜(L4, 대조군)과 늙은 웜(성충 7일 째)을 비교하여 결과를 스머프 웜의 백분율로 표현합니다.
ᅡ x x = 100 (%) x b
X = 100 x B / A
어디서, A = 총 웜 수
B = 스머프 웜의 수

그림 2: 예쁜꼬마선충(C. elegans)의 전체 장 투과성 분석 개략도. (A) 예쁜꼬마선충 준비. (B) Erioglaucine disodium salt로 염색. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
결과
글리코겐 함량 분석은 글리코겐 합성 또는 분해에 영향을 줄 수 있는 다양한 균주에 대한 비교 연구와 같은 다양한 테스트 조건을 스크리닝하기 위한 강력하고 신속한 방법을 제공합니다. 이 연구에서 L4 웜은 단식, 섭식, 포도당이 풍부한 그룹의 세 가지 뚜렷한 테스트 조건을 받았습니다. 분석은 세 번 수행되었으며 각 분석에서 각 조건이 두 번 복제되었습니다. 대표 이...
토론
요약하면, 이 프로토콜은 Lugol 염색을 사용하여 개별 예쁜꼬마선충(C. elegans worms)의 글리코겐 함량에 대한 정성적 평가를 제공합니다: 간단하고 강력하며 신속한 분석법입니다. Lugol 염색은 세포 내 해상도에서 분자 데이터의 획득을 용이하게 하는 무표지 및 비침습적 접근 방식으로, 단일 웜 내에서 글리코겐 함량 변동을 모니터링할 수 있습니다(10
공개
저자는 밝힐 것이 없습니다.
감사의 말
D.S.A는 Conselho Nacional de Pesquisa e Desenvolvimento(CNPq/브라질), 보조금 번호 #301808/2018-0, #313117/2019-5, Fundação de Amparo à Pesquisa do Estado do Rio Grande do Sul(FAPERGS/Brazil), 보조금 번호, 21/2551-0001963-8, Coordenação de Aperfeiçoamento de Pessoal de Nível Superior(CAPES, N.S.J 및 A.C.S의 경우 금융 코드 001)의 자금 지원을 인정합니다.
자료
| Name | Company | Catalog Number | Comments |
| 1.5 mL microtubes | Local suppliers | - | |
| 37-degree incubator | KS 4000i | 97014-816 | |
| 50 mL conical tube | Local suppliers | - | |
| 6 cm Petri plates | Local suppliers | - | |
| Agar bacteriological | Dinâmica Química Contemporânea Ltda. | 9002-18-0 | |
| C. elegans Bristol N2 (wild type) | Caenorhabditis elegans Genetic Center (CGC, Minnesota, USA) | - | |
| CaCL2 | Dinâmica Química Contemporânea Ltda. | 10035-04-8 | |
| Cholesterol | Sigma-Aldrich Brasil Ltda | 57-88-5 | |
| D-(+)-Glucose anhydrous | Neon | 50-99-7 | |
| Distilled H2O | Local suppliers | - | |
| Erioglaucine disodium salt | Sigma-Aldrich Brasil Ltda | 3844-45-9 | |
| Escherichia coli OP50 | Caenorhabditis elegans Genetic Center (CGC, Minnesota, USA) | - | |
| Flow hood | Mylabor | ||
| Incubator | Panasonic Healthcare company of North America, MIR-254-PA. | - | |
| KH2PO4 | Dinâmica Química Contemporânea Ltda. | 7778-77-0 | |
| Levamisole hydrochloride | RIPERCOL L 150F | - | |
| Lugol solution | Sigma-Aldrich Brasil Ltda | L6146 | |
| MgSO4 | Synth | S1063-01-AH | |
| Microcentrifuge | Centrifuge 5425R Eppendorf SE, Germany | ||
| Na2HPO4 | Dinâmica Química Contemporânea Ltda. | 7558-79-4 | |
| NaCl | Dinâmica Química Contemporânea Ltda. | 7647-14-5 | |
| Nystatin | Sigma-Aldrich Brasil Ltda | N6261 | |
| Peptone bacteriological | êxodo científica | 91079-38-8 | |
| Stereomicroscope | Leica S8 Apo Stereomicroscope (São Paulo, Brazil) | ||
| Streptomycin Sulfate | Estreptomax | - |
참고문헌
- Thorp, H. H. ChatGPT is fun, but not an author. Science. 379 (6630), 313 (2023).
- Lemons, M. L. An inquiry-based approach to study the synapse: Student-driven experiments using C. elegans. J Undergrad Neurosci Educ. 15 (1), A44-A55 (2016).
- Andersen, J., Krichevsky, A., Leheste, J. R., Moloney, D. J. Caenorhabditis elegans as an undergraduate educational tool for teaching RNAi. Biochem Mol Biol Educ. 36 (6), 417-427 (2008).
- Martins, R. R., McCracken, A. W., Simons, M. J. P., Henriques, C. M., Rera, M. How to catch a smurf? - Ageing and beyond... In vivo assessment of intestinal permeability in multiple model organisms. Bio Protoc. 8 (3), e2722 (2018).
- Ellingwood, S. S., Cheng, A. Biochemical and clinical aspects of glycogen storage diseases. J Endocrinol. 238 (3), R131-R141 (2018).
- Cori, C. F., Cori, G. T. Glycogen formation in the liver from d-and l-lactic acid. J Bio Chem. 81 (2), 389-403 (1929).
- Wosilait, W. D., Sutherland, E. W. The relationship of epinephrine and glucagon to liver phosphorylase. II. Enzymatic inactivation of liver phosphorylase. J Biol Chem. 218 (1), 469-481 (1956).
- Zhang, H., Ma, J., Tang, K., Huang, B. Beyond energy storage: roles of glycogen metabolism in health and disease. FEBS J. 288 (12), 3772-3783 (2021).
- Liu, Q., et al. Characterization of glycogen molecular structure in the worm Caenorhabditis elegans. Carbohydr Polym. 237, 116181 (2020).
- Cherkas, A., et al. Label-free molecular mapping and assessment of glycogen in C. elegans.Analyst. 144 (7), 2367-2374 (2019).
- Gusarov, I., et al. Glycogen controls Caenorhabditis elegans lifespan and resistance to oxidative stress. Nat Commun. 8, 15868 (2017).
- Seo, Y., Kingsley, S., Walker, G., Mondoux, M. A., Tissenbaum, H. A. Metabolic shift from glycogen to trehalose promotes lifespan and healthspan in Caenorhabditis elegans. Proc Natl Acad Sci U S A. 115 (12), E2791-E2800 (2018).
- Frazier, H. N., Roth, M. B. Adaptive sugar provisioning controls survival of C. elegans embryos in adverse environments. Curr Biol. 19 (10), 859-863 (2009).
- da Silva, F. N., Zimath, P. L., do Amaral, T. A., Martins, J. R. N., Rafacho, A. Coadministration of olanzapine causes minor impacts on the diabetogenic outcomes induced by dexamethasone treatment in rats. Life Sci. 322, 121660 (2023).
- Gusarov, I., Nudler, E. Glycogen at the crossroad of stress resistance, energy maintenance, and pathophysiology of aging. Bioessays. 40 (9), e1800033 (2018).
- Untersmayr, E., Brandt, A., Koidl, L., Bergheim, I. The intestinal barrier dysfunction as driving factor of inflammaging. Nutrients. 14 (5), 949 (2022).
- Lin, P. Y., Stern, A., Peng, H. H., Chen, J. H., Yang, H. C. Redox and metabolic regulation of intestinal barrier function and associated disorders. Int J Mol Sci. 23 (22), 14463 (2022).
- Dambroise, E., et al. Two phases of aging separated by the Smurf transition as a public path to death. Sci Rep. 6, 23523 (2016).
- Laranjeiro, R., et al. Swim exercise in Caenorhabditis elegans extends neuromuscular and gut healthspan, enhances learning ability, and protects against neurodegeneration. Proc Natl Acad Sci U S A. 116 (47), 23829-23839 (2019).
- Stiernagle, T. Maintenance of C. elegans.WormBook. , 1-11 (2006).
- McGhee, J. D. The C. elegans intestine. WormBook: The Online Review of C. elegans Biology. , (2007).
- McGee, M. D., et al. Loss of intestinal nuclei and intestinal integrity in aging C. elegans. Aging Cell. 10 (4), 699-710 (2011).
- Gelino, S., et al. Intestinal autophagy improves healthspan and longevity in C. elegans during dietary restriction. PLoS genetics. 12 (7), e1006135 (2016).
- Rera, M., Clark, R. I., Walker, D. W. Intestinal barrier dysfunction links metabolic and inflammatory markers of aging to death in Drosophila. Proc Natl Acad Sci U S A. 109 (52), 21528-21533 (2012).
- Zhang, G., Gu, Y., Dai, X. Protective effect of bilberry anthocyanin extracts on dextran sulfate sodium-induced intestinal damage in Drosophila melanogaster. Nutrients. 14 (14), 2875 (2022).
- Gelino, S., et al. Intestinal autophagy improves healthspan and longevity in C. elegans during dietary restriction. PLoS Genet. 12 (7), e1006135 (2016).
- Qu, M., Xu, K., Li, Y., Wong, G., Wang, D. Using acs-22 mutant Caenorhabditis elegans to detect the toxicity of nanopolystyrene particles. Sci Total Environ. 643, 119-126 (2018).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유