Method Article
쥐의 척수강내 카테터 삽입을 위한 수정된 방법
요약
여기에서, 우리는 반복적인 척수강내 약물 투여를 위한 간단하고 편리하며 신뢰할 수 있는 접근법을 나타내는 랫트의 척수강내 카테터 삽입을 위한 수정된 방법을 소개합니다.
초록
척수강내 카테터 삽입은 동물 실험, 특히 신경병증성 통증에 대한 실험에 널리 적용되어 왔습니다. 그러나 전통적인 방법에는 여전히 몇 가지 제한 사항이 있습니다. 일부 연구자들이 전통적인 방법을 개선하려고 시도했지만 사용 가능한 방법은 여전히 수정해야 합니다. 여기에서는 쥐의 척수강내 카테터 삽입을 위한 수정된 방법을 소개합니다.
이 방법은 20cm 길이의 스테인리스 강선(직경 0.2mm), 15cm 길이의 플라스틱 PE10 튜브, 자체 제작 밀봉 캡, 0.3cm × 0.5cm 항알레르기 밴드를 사용합니다. 척수강내 카테터 삽입을 위한 수정된 방법에는 몇 가지 장점이 있습니다. 첫째, PE10 튜브에 스테인리스강선을 도입하면 튜브의 탄성이 증가하고, 척수강내 카테터 삽입의 성공률이 높아지며, 수술에 필요한 공간이 줄어들고, 요추 주변 조직의 손상을 최소화할 수 있습니다. 둘째, PE10 튜브의 길이는 수술 전에 결정되며 카테터 삽입 시간은 1주일 이상일 수 있습니다. 셋째, PE10 튜브는 8자형 봉합사로 4번 고정되어 동물이 움직일 때 튜브의 움직임과 수축을 방지합니다. 넷째, 자체 제작한 밀봉 캡을 사용하여 PE10 튜브를 밀봉하여 뇌척수액 누출을 방지할 뿐만 아니라 PE10 튜브의 반복 절단의 필요성을 줄입니다. 마지막으로, PE10 튜브의 체외 끝은 밴드로 묶여 동물이 움직일 때 튜브가 수축하는 것을 방지합니다.
이 방법은 수술 후 28일째 PE10 튜브의 약 80%가 제자리에 남아 있기 때문에 쥐의 카테터 삽입 성공률을 높일 수 있습니다. 따라서, 이러한 수정된 방법은 반복적인 척수강내 약물 투여를 위한 간단하고 편리하며 신뢰할 수 있는 접근법을 나타낼 수 있다.
서문
쥐에서 척수강내 카테터 삽입(지주막하 카테터 삽입이라고도 함)은 추간공간1을 통해 지주막하 공간에 카테터를 삽입하는 방법입니다. 약물은 카테터를 통해 지주막하 공간에 직접 주입되며, 이는 연구자들이 혈액-뇌 장벽을 관통하는 약물의 효과를 고려하지 않고 척수에 대한 약물의 효과를 조사하는 데 도움이 됩니다 2,3. 또한, 척수강내 카테터 삽입 후 뇌척수액을 채취하여 중추신경계의 미세환경을 조사할 수 있습니다 4,5. 현재 사용되는 척수강내 카테터 삽입법은 1976년 Yaksh와 Rudy6에 의해 처음 확립되었으며, 그 이후로 신경과학, 마취 및 진통제, 척수 매개 심혈관 조절, 특히 신경병증성 통증 분야의 동물 실험에 널리 적용되고 있습니다 2,7. 그러나 이 방법은 여전히 높은 척수 손상 발생률, 지주막하 출혈, 수술 후 감각 및 운동 기능 장애, 높은 수술 후 사망률, 높은 신경 장애 위험과 같은 몇 가지 한계가 있습니다 4,5,8,9,10 . 이러한 한계를 극복하기 위한 노력의 일환으로, 1996년 Størkson et al.에 의해 요추 간공간을 통한 지주막하 공간의 카테터 삽입이 제안되었고,11 수술 후 성공률이 더 높은 것으로 보고되었다. 특히, 유치 카테터의 고정은 이 방법에서 여전히 어려운 과제이며, 동물의 움직임으로 인해 카테터 수축이 일반적이어서 척수강 내 약물 투여가 불편합니다.
위와 같은 한계로 인해, 일부 연구자들(12,13,14,15)은 천자 도구, 카테터 삽입 방법 및 카테터 고정 방법을 개선하려고 시도하였으나, 사용된 비드의 직경을 정량화하는 어려움, 반복적인 천자의 필요성 및 카테터의 짧은 길이로 인해 사용 가능한 방법은 여전히 수정이 필요하고, 등.11
척수강내 카테터 삽입을 위한 요추 접근법(lumbar approach for intrathecal catheterization)1 과 중심 정맥 카테터 삽입을 위한 Seldinger 기법(Seldinger technique)16 에 따라, 우리는 기존 방법을 단순화하기 위해 스테인리스 스틸 와이어, 자체 제작 밀봉 캡 및 항알레르기 밴드를 사용하는 쥐의 척수강내 카테터 삽입 방법을 개발했습니다. 이 방법을 통해 카테터를 지주막하 공간에 쉽게 삽입하고 쥐의 등에 안정적으로 고정할 수 있으며, 반복적인 척수강내 약물 투여를 위한 반복적인 천자의 필요성을 피할 수 있습니다.
본 명세서에서는 쥐에서 척수강내 카테터 삽입의 성공률을 향상시킬 수 있는 수정된 방법을 소개하고, 약물의 반복적인 척수강내 투여를 위한 간단하고 편리하며 신뢰할 수 있는 접근법을 제시한다.
프로토콜
척수강내 카테터 삽입은 미국 국립보건원(National Institutes of Health)의 실험동물 관리 및 사용 지침(Guidelines for the Care and Use of Laboratory Animals)의 권고사항에 따라 엄격하게 수행되었으며, 이 프로토콜은 중국 실험동물 윤리위원회(Ethics Committee of Experimental Animals)의 승인을 받았습니다(No. TJBH15523201). 수컷 Sprague-Dawley (SD) 쥐가 실험에 사용되었습니다. 동물들의 고통과 불편함을 최소화하기 위해 주의를 기울였습니다.
1. 재료 및 기기 준비
참고: 재료 및 기구의 준비는 성공적인 척수강내 카테터 삽입을 위해 매우 중요합니다.
- 15cm 길이의 PE10 튜브(길이는 쥐 머리와 꼬리 끝 사이의 거리에 따라 결정됨)를 준비하고, 두 개의 광택 끝이 있는 20cm 길이의 스테인리스 강선(직경 0.2mm)을 PE10 튜브에 지지대로 삽입하고, 튜브를 한쪽 끝에서 2cm 표시하여 삽입 깊이를 표시합니다(그림 1A에서 검은색 십자가로 표시, B)입니다.
- 22G 바늘의 날카로운 끝을 자르고 말단 끝을 밀봉합니다(그림 1C).
- 경막외 카테터(외경 1.0mm)를 1cm 조각으로 자릅니다. 그런 다음 끝이 뾰족하지 않은 22G 바늘(그림 1D)에 단편을 삽입하고 한 쌍의 가열된 직선 집게로 단편의 말단 끝을 밀봉합니다. 이 장치를 튜브 밀봉 캡이라고 합니다(그림 1E).
- 가위로 실크 테이프(1.25cm × 9.1m)를 잘라 0.3cm × 0.5cm 항알레르기 밴드를 준비합니다(그림 1F).
2. 수술 준비
- 수술 전에 척수강내 카테터 삽입을 위한 기구를 소독하여 준비합니다. 수술에 사용되는 기구는 이빨이 있는 집게, 가위, 가위 장치, 메스 손잡이 및 #10 칼날입니다. (그림 2).
- PE10 튜브와 가이드 와이어를 75% 에탄올에 담그고 약 2시간 동안 살균합니다.
3. 수술
- 3L/min의 유속으로 3% 이소플루란으로 쥐를 마취합니다.
- 쥐를 수술대에 놓고 집게로 뒷발을 꼬집을 때 금단 반사를 관찰합니다. 자극에 대한 반응으로 뒷발을 움직이지 않는 것으로 성공적인 마취가 확인되었습니다. 척수강내 카테터 삽입 전에 1mg/kg meloxicam의 근육 주사로 적절한 진통을 투여합니다.
- 면도기로 등의 요추 부위와 양쪽 귀 사이의 털을 제거합니다.
- 쥐의 복부 아래에 허리-고관절 접합부에 원심분리기 튜브(직경 3cm)를 놓아 요추의 굴곡을 증가시켜 바늘과 카테터가 통과할 수 있는 공간을 더 많이 확보합니다.
- 수술 부위(요추 부위 및 두 귀 사이 부위)를 포비돈-요오드 용액으로 소독한 다음 에탄올 용액으로 세 번 소독합니다. 쥐를 무균 드레싱으로 덮고 수술 부위를 노출시킵니다. 그런 다음 수술 전에 PE10 튜브와 가이드 와이어를 생리 식염수로 세척하십시오.
참고: 척수강내 카테터 삽입 중에 꼬리의 움직임을 관찰할 수 있도록 꼬리를 덮지 않았습니다. - 좌측과 우측 양측 장골능선 사이의 중간 지점에 L6의 가시돌기를 위치시켜 L5와 L6 사이의 추간 공간의 위치를 결정합니다. 시술자의 왼손 엄지와 왼손 검지로 피부를 고정한 후 L4와 S1 사이의 가시돌기 바로 위에 3-4cm 길이의 정중선을 절개합니다.
- 가위로 피하 조직을 뭉툭하게 분리합니다. L5와 L6 사이의 추간 공간을 다시 찾아 L5와 L6 등쪽 돌기의 양쪽을 작게 절개(0.3 - 0.5 cm)합니다.
- 한 쌍의 톱니가 있는 집게로 L5 등쪽 돌기를 클램프 앤 리프트하여 추간 공간을 확장합니다. 그런 다음 L6 등쪽 돌기의 상단이 완전히 노출될 때까지 가위로 척추체 주변의 근육을 둔하게 분리합니다.
참고: 주변 조직의 손상을 최소화하기 위해 척추체와 근육의 일부를 제거하는 것은 피해야 합니다. - 한 쌍의 톱니가 있는 집게로 L5 등쪽 돌기를 들어 올리고 다른 한 쌍의 집게로 추간 공간을 확장할 때 거꾸로 된 "V" 영역이 완전히 노출될 때까지 면봉으로 L5-6 추간 공간을 청소합니다.
- L23 등쪽 돌기 상단 바로 아래의 역"V" 영역에 6G 바늘로 척추를 뚫습니다.
참고: 꼬리 튕김이 관찰되고 무색의 투명한 유체가 지주막하 공간에서 흘러나와 지주막하 공간에 성공적으로 구멍이 뚫렸음을 나타냅니다. - 스테인리스강 와이어가 포함된 PE10 튜브를 꼬리 쪽으로 30° 기울여 천자 부위의 척추관에 조심스럽게 삽입합니다. PE10 튜브가 저항 없이 성공적으로 삽입될 수 있을 때까지 삽입 각도를 조정합니다(이 과정에서 테일 플릭이 관찰됨).
- PE10 튜브의 표시된 영역이 후방근에 도달하면 카테터 삽입이 중단됩니다.
- PE10 튜브에서 스테인리스 와이어를 천천히 제거합니다. 꼬리 튕김이 관찰될 수 있습니다.
알림: 꼬리 튕김이 관찰될 수 있으며 와이어를 제거한 후 투명한 유체(또는 연한 빨간색 유체)가 튜브 밖으로 흘러나올 수 있습니다. - 그런 다음 PE10 튜브를 1mL 주사기에 연결하고 이를 통해 20μL의 생리식염수를 주입합니다. 주사기를 제거한 후 식염수가 PE10 튜브 밖으로 계속 흘러나와 지주막하 공간에 성공적으로 삽입되었음을 나타냅니다.
- PE10 튜브가 막히지 않은 것으로 확인되면 척추체 한쪽 근육을 4-0 봉합사로 봉합하고 매듭을 만듭니다. 그런 다음 PE10 튜브 주위에 봉합사를 묶고 다른 매듭을 만듭니다. 봉합사를 자르지 마십시오. 반대쪽 근육을 봉합합니다. 봉합사를 PE10 튜브에 다시 묶고 세 번째 매듭을 만들고 봉합사를 자릅니다.
알림: 이 프로세스는 PE10 튜브를 그림 8 봉합사로 고정하여 튜브의 변위 및 수축 가능성을 줄입니다. - 귀 사이 중간 지점에서 1cm 아래에 0.5cm 길이로 절개합니다. 가위로 피하 조직을 뭉툭하게 분리하고 요추 절개 부위에 끝이 보일 때까지 꼬리 쪽으로 금속 개관 튜브를 삽입합니다.
- PE10 튜브가 개비지 튜브의 다른 쪽 끝을 빠져나갈 때까지 PE10 튜브의 말단부를 개비지 튜브에 삽입합니다. 그런 다음 gavage를 부드럽게 빼냅니다.
- PE10 튜브가 다시 막히지 않은 것이 확인되면 요추 절개 부위의 나머지 근육을 4-0 봉합사로 봉합하고 PE10 튜브 주위에 봉합사를 묶고 다시 PE10 튜브를 고정하기 위해 다른 매듭을 만듭니다.
- PE10 튜브의 손상을 방지하여 피부를 봉합합니다. 그런 다음 4-0 봉합사로 목 피부를 봉합하고 PE10 튜브 주위에 봉합사를 묶고 PE10 튜브를 고정하는 매듭을 만듭니다.
- PE10 튜브가 다시 막히지 않은 것으로 확인되면 PE10 튜브의 체외 끝을 밀봉 캡으로 밀봉합니다.
- PE10 튜브를 티슈 조각으로 건조시킨 다음 PE10 튜브 주위에 항알레르기 밴드를 여러 번 묶어 쥐가 움직일 때 PE10 튜브가 수축되는 것을 방지합니다.
4. 리도카인 검증 실험
- 수술 후 쥐를 케이지에 넣고(케이지당 하나) 마취에서 회복하는 동안 쥐가 의식을 얻을 때까지 면밀히 모니터링합니다.
- 쥐가 완전히 깨어난 후 밀봉 캡을 제거하고 Hamilton 주사기를 통해 0.02mL/s의 속도로 PE10 튜브에 2% 리도카인 20μL를 주입한 다음 10μL의 생리식염수를 주입합니다.
- 밀봉 캡으로 PE10 튜브를 밀봉합니다.
- 쥐를 테이블 위에 놓고 주의 깊게 관찰하십시오. 리도카인(PE10 튜브에서)을 척수강내 주사한 후 뒷다리 마비가 있다는 것은 성공적인 카테터 삽입을 나타냅니다(그림 3). 뒷다리 마비는 보통 30분 정도 지속된다10.
알림: 다음 실험 전에 쥐가 5-7일 동안 회복되도록 하십시오. - 사지 기능이 완전히 회복될 때까지 회복 기간 동안 쥐를 면밀히 모니터링하십시오.
결과
척수강내 주입을 위해 PE10 튜브의 체외 끝부분을 절단하고 PE10 튜브를 두 개의 약물 주입 사이에 밀봉 캡으로 밀봉했습니다. 우리의 파일럿 연구에서 척수강내 카테터 삽입의 성공률은 약 95%였습니다(20마리 중 19마리). 성공은 절차 중 꼬리 튕김 및/또는 무색 투명 유체의 방출로 표시되었습니다. 튜브의 약 85%는 수술 후 7일 동안 제자리에 있었고 약 80%는 수술 후 28일 동안 제자리에 있었습니다. 쥐는 수술 직후 회복되었으며 수술 후 7일 이내에 합병증이 관찰되지 않았습니다. 일상적인 움직임은 정상이었고 행동 이상은 관찰되지 않았습니다. 이러한 결과는 우리의 방법이 성공률과 장기 체류율 측면에서 이전에 보고된 방법보다 우수하다는 것을 나타냅니다.
카테터를 통한 리도카인 주입 시 하지의 완전한 마비는 성공적인 척수강내 카테터 삽입을 나타낸다15. 척수강내 카테터 삽입의 성공률은 총 쥐 수를 성공적인 카테터 삽입을 한 쥐 수로 나누어 계산합니다. 수정된 방법을 사용한 경우 성공률은 95%로 Hou et al.(88%)이 보고한 방법의 성공률보다 높았습니다15. 이는 그림 4에 나와 있습니다.
척수강내 카테터 삽입 후 2일, 5일, 7일에 척수강관을 모니터링하고, 성공적인 유치 카테터를 삽입한 쥐의 수/총 쥐 수 × 100%로 성공적인 유치 카테터의 비율을 계산하였다. 척수강내 카테터 삽입 후 2일, 5일, 7일째 되는 날에 성공적인 유치 카테터의 비율은 각각 94%, 81%, 65%였다고 StØrkson et al.11의 연구에서 밝혔습니다. 척수강내 카테터 삽입 후 2일, 5일, 7일 후 성공적인 유치 카테터 성공률은 각각 95%, 90%, 85%였습니다(그림 5).

그림 1. 척수강내 카테터 삽입에 사용되는 재료 및 기구. (A) 15cm 길이의 PE10 튜브를 준비하고 튜브의 한쪽 끝에서 2cm를 표시하여 삽입 깊이를 표시했습니다. (B) 두 개의 광택 끝이 있는 20cm 길이의 스테인리스 스틸 와이어를 지지대로 PE10 튜브에 삽입했습니다. (C) 22G 바늘의 날카로운 끝 부분을 가위로 자르고 말단 끝 부분을 한 쌍의 집게로 밀봉했습니다. (D) 경막외 카테터(외경 1.0mm)를 1cm 조각으로 절단한 다음 끝이 없는 날카로운 22G 바늘에 삽입했습니다. (E) 경막외 카테터의 말단 끝은 한 쌍의 가열된 직선 겸자로 밀봉되었습니다. 이 장치는 튜브 밀봉 캡이라고 불렸습니다. (F) 0.3cm × 0.5cm 항알레르기 밴드 (실크 테이프, 1.25cm × 9.1m)를 가위로 준비했습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
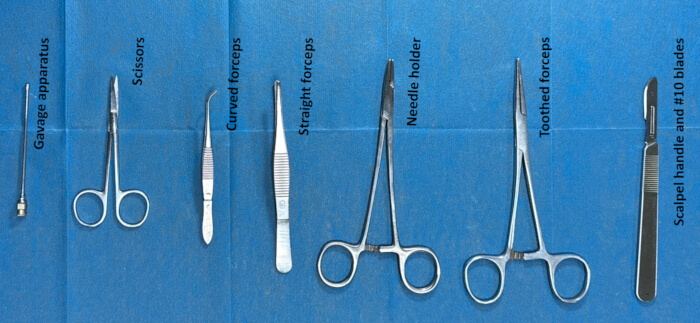
그림 2. 척수강내 카테터 삽입을 위한 기구 준비. 기구(예: 톱니가 있는 집게, 가위, 가위 장치, 메스 손잡이 및 #10 블레이드)를 에탄올로 약 2시간 동안 멸균한 다음 수술 약 30분 전에 생리식염수로 세척했습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
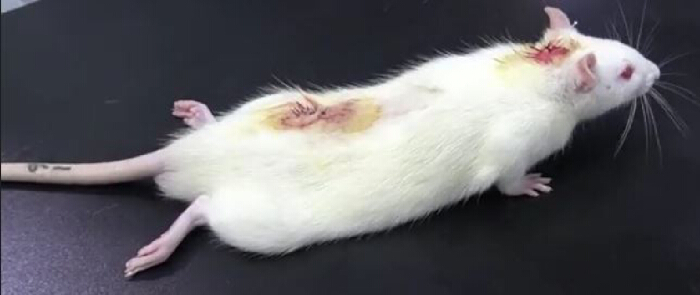
그림 3. 척수강내 카테터 삽입 후 리도카인 검증 실험 결과. 2% 리도카인 20μL를 척수강에 주사한 후 10μL의 생리식염수를 주입한 후 쥐는 일시적으로 마비되었습니다: 하지 마비는 30초 이내에 발생하고 30분 후에 사라졌으며, 이는 성공적인 척수강내 카테터 삽입을 나타냅니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
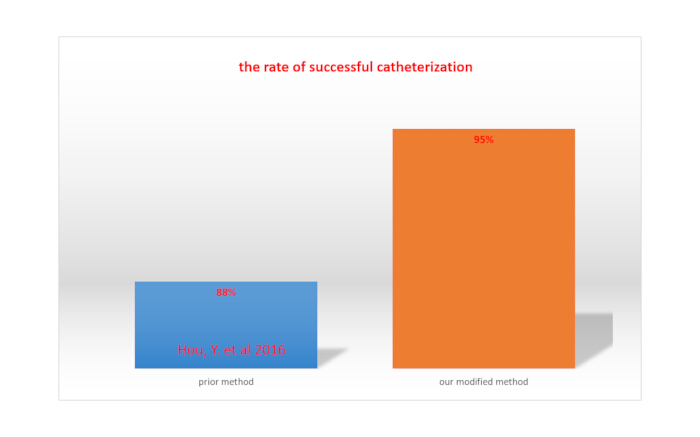
그림 4. 수정된 방법과 이전에 보고된 방법 간의 성공적인 카테터 삽입률 비교. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
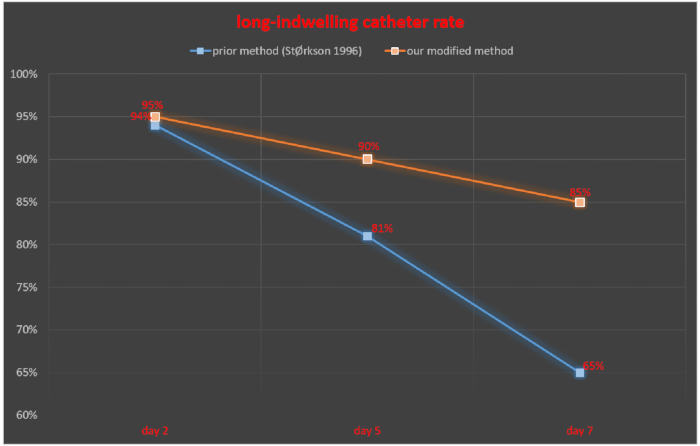
그림 5. 수정된 방법과 이전에 보고된 방법 간의 장기 주입 카테터 속도 비교. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
| 수정된 방법 | 사전 방법 | 수정된 방법의 장점 | 이전 방법의 단점 | |
| 삽입을 위한 안내 방법 | 스테인리스강 와이어 | 가이드 캐뉼라 (20G 0.9× 38mm) | 튜브의 탄성을 증가시키고, | 저항을 느끼기 어려워 작동의 어려움이 높아집니다. |
| 척수강내 카테터 삽입의 성공률을 향상시킵니다. | 반복적인 천자로 인한 조직 손상 | |||
| 작동 공간 요구 사항 감소 | 튜브의 한쪽 끝은 원래 길이의 1.5배로 늘어나 양쪽 끝의 직경이 다릅니다. | |||
| 요추 주변 조직의 손상을 최소화합니다. | 20G 가이드 캐뉼라의 직경이 연신 PE10 튜브의 2배 이상이기 때문에 뇌척수액 누출에 취약합니다. | |||
| PE10 튜브의 길이 | 15cm | 14cm 또는 28cm | 카테터 주입 기간에 관계없이 PE10 튜브의 길이를 쉽게 결정할 수 있습니다. | 카테터 내유의 기간은 더 짧은 PE10 튜브의 경우 더 짧습니다. 긴 PE10 튜브의 경우 신체에서 떨어질 수 있습니다. |
| 정착 방법 | "8" 봉합사와 4회 | 1개 또는 2개의 구슬 | 동물 활동 중 튜브의 움직임과 수축을 피합니다. | 양쪽 끝에서 튜브 직경의 차이와 비드 제작 중 PE10 튜브의 변위에 대한 민감성 |
| 튜브 밀봉 방법 | 자체 제작 캡 | 아니요 | 뇌척수액의 누출을 막는다 | PE10 튜브의 반복 절단 요구 사항 |
| PE10 튜브의 반복적인 절단을 방지합니다. | ||||
| 철회 방지 방법 | 항알레르기 밴드 | 1개 또는 2개의 구슬 | 동물 활동 중 튜브가 수축되는 것을 방지합니다. | 철회에 대한 민감성 |
표 1. 수정된 방법과 이전에 보고된 방법의 장점과 단점.
토론
척수강내 카테터 삽입의 성공률을 극대화하기 위해 이 수정된 방법에 대한 몇 가지 중요한 팁이 있습니다. 먼저 두 개의 광택 끝이 있는 20cm 길이의 스테인리스 강선을 준비하여 지지대로 PE10 튜브에 삽입해야 합니다. 둘째, 시술자는 면봉으로 L5-6 추간공간을 청소한 후 거꾸로 된 "V"자 부분을 완전히 노출시켜야 하며, 톱니집게로 L5 등쪽돌기를 들어 올리면서 다른 겸자로 추간공간을 확장해야 합니다. 셋째, PE10 튜브는 8자형 봉합사로 4회 고정해야 합니다. 마지막으로 PE10 튜브의 체외 끝 부분은 밴드로 묶고 자체 제작 캡으로 밀봉해야 합니다.
척수강내 카테터 삽입의 성공률과 척추체 주변 조직의 손상은 실험 결과의 신뢰성에 유의한 영향을 미칠 수 있다15. 따라서 동물모델 및 관련 실험을 확립하기 위해서는 성공률을 최대한 높이고 주변 조직의 손상을 줄이는 것이 중요하다1. 이 수정된 방법에서는 스테인리스강 와이어를 PE10 튜브에 삽입하여 유도하는데, 이는 튜브의 탄성을 증가시키고 척수강내 카테터 삽입의 성공률을 향상시킵니다. 또한, 이 수정된 방법으로 수술에 필요한 공간이 줄어들고, 주변 조직이 뭉툭하게 분리되지만 절단되지 않기 때문에 요추 주변 조직의 손상이 최소화됩니다. 이에 비해, 이전에 보고된 방법(11)에서는 천공시 저항을 줄이기 위해 20G 가이드 캐뉼라를 사용하며, 반복적인 천공이 종종 필요하여 조직을 손상시킬 수 있다. 또한, 기존에 보고된 방법에서는 PE10 튜브의 직경을 줄이기 위해 따뜻한 물(60°C)에 담근 후 한쪽 끝을 원래 길이의 약 150%까지 늘려 튜브 직경의 일관성을 보장하지 못할 수 있으며, 따라서 20G 가이드 캐뉼라의 직경이 늘어난 PE10 튜브의 직경보다 약 2배 이상 크기 때문에 뇌척수액의 누출을 유발할 수 있다. 더욱이, 우리의 방법에서는 요추 기능이 최대한 보존되어 후속 실험 결과에 대한 수술의 영향을 피할 수 있습니다. 이러한 결과는 Xu et al2에 의해 보고된 것과 일치한다.
이전에 보고된 방법11에서, PE10 튜브의 길이는 튜브가 천자 부위 주변 부위에 고정된 경우 약 14cm이지만, 이러한 조건에서는 카테터 주입 시간이 7일보다 짧은 경우가 많습니다(또는 쥐에 의해 튜브가 신체에서 제거됨). PE10 튜브의 길이는 튜브가 목 뒤쪽에 고정된 경우 약 28cm이며, 이는 이 방법에 사용된 PE10 튜브(15cm)보다 훨씬 깁니다. Størkson et al.11이 보고한 프로토콜에 따라 구슬이 형성되었지만, 일부 튜브는 신체에서 제거되었으며 수술 후 7일이 지난 후에도 튜브의 약 65%만이 여전히 제자리에 고정되어 있어 후속 실험의 결과에 상당한 영향을 미쳤습니다. 우리의 방법에서는 PE10 튜브를 8자 봉합사로 4번 고정하고 PE10 튜브의 체외 끝부분을 밴드로 묶어 변위 및 수축 가능성을 줄입니다. 우리의 방법에 따라 수술 후 7일까지 약 85%의 튜브가 제자리에 있었고 수술 후 28일까지 약 80%의 튜브가 제자리에 있었습니다.
이전에 보고된 방법11에서, 척수강내 카테터의 체외 끝은 각 약물 투여에 대해 절단되어야 합니다. 그러나, 약물의 반복적인 척수강내 투여는 카테터 투여 시간을 단축시킬 수 있으며, 이는 약물의 척수강내 투여를 불편하게 만든다. 따라서 우리의 방법에서는 자체 제작 캡을 사용하여 PE10 튜브를 밀봉하고 하루에 한 번 에탄올로 살균합니다. 이는 뇌척수액의 누출을 방지할 뿐만 아니라 약물의 척수강내 투여를 위해 PE10 튜브를 반복적으로 절단할 필요성을 줄여 약물의 효과적인 전달을 보장합니다.
수정된 방법과 이전에 보고된 방법의 장점과 단점은 표 1에 요약되어 있습니다. 첫째, 수정된 방법의 경우 PE10 튜브에 스테인리스강선을 사용하면 튜브의 탄성이 증가하고 척수강내 카테터 삽입의 성공률이 향상되며 수술에 필요한 공간이 줄어들고 요추 주변 조직의 손상이 최소화됩니다. 이전에 보고된 방법에서는 저항이 느껴질 때까지 20G 가이드 캐뉼라를 삽입하고 반복적인 천공이 필요한 경우가 많아 조직에 손상을 줄 수 있습니다. 또한, 한쪽 끝의 PE10 튜브는 길이가 원래 길이의 약 150%에 도달할 때까지 늘어나는데, 이는 20G 가이드 캐뉼라의 직경이 늘어난 PE10 튜브의 직경보다 2배 이상이기 때문에 뇌척수액 누출을 유발할 수 있습니다. 둘째, 수정된 방법에서는 PE10 튜브의 길이를 수술 전에 결정하고 카테터 주입 시간은 1주일 이상이 될 수 있습니다. 이전에 보고된 방법에서 PE10 튜브의 길이는 천자 부위에 고정된 경우 약 14cm이지만 튜브가 쥐에 의해 몸 밖으로 당겨지기 쉽기 때문에 카테터 주입 시간이 7일보다 짧은 경우가 많습니다. PE10 튜브의 길이는 목 뒤쪽에 고정된 경우 약 28cm이며, 이는 우리 방법에 사용된 튜브의 길이보다 훨씬 깁니다. 셋째, 수정된 방법에서는 PE10 튜브를 그림-8 봉합사로 4번 고정하여 튜브의 움직임과 수축을 방지합니다. 자체 제작한 캡을 사용하여 PE10 튜브를 밀봉하여 뇌척수액의 누출을 방지할 뿐만 아니라 PE10 튜브를 반복적으로 절단할 필요가 없습니다. 이전에 보고된 방법에서는 일관된 직경의 비드를 얻기 어렵고 비드가 형성될 때 PE10 튜브의 변위가 일반적이며 PE10 튜브의 반복 절단이 필요한 경우가 많습니다. 마지막으로, 수정된 방법에서는 PE10 튜브의 체외 끝을 밴드로 묶어 튜브가 이동 중에 수축하는 것을 방지합니다. 그러나 이전 방법에서는 일관된 직경을 가진 비드를 얻기 어렵기 때문에 비드가 PE10 튜브 수축을 확실하게 방지할 수 없습니다.
전반적으로 척수강내 카테터 삽입을 위한 이 수정된 방법은 다음과 같은 장점이 있습니다. 첫째, PE10 튜브에 스테인리스강선을 사용하면 튜브의 탄성이 증가하고 척수강내 카테터 삽입의 성공률이 향상되며, 수술에 필요한 공간이 줄어들고, 요추 주변 조직의 손상이 최소화되어 요추 기능을 최대한 보존하고 수술이 후속 실험 결과에 미치는 영향을 피할 수 있습니다. 둘째, PE10 튜브는 8자 봉합사로 4번 고정되어 튜브의 움직임과 이동 중 수축을 방지합니다. 셋째, 자체 제작한 밀봉 캡을 사용하여 PE10 튜브를 밀봉하여 뇌척수액 누출을 방지할 뿐만 아니라 PE10 튜브를 반복적으로 절단할 필요성을 방지합니다. 카테터를 반복적으로 절단하면 카테터가 짧아져 약물 전달이 불편해질 수 있습니다. 마지막으로, PE10 튜브의 체외 끝은 항알레르기 밴드로 묶여 튜브가 이동 중에 수축되는 것을 방지합니다.
그러나 이 수정된 척수강내 카테터 삽입 기술에는 몇 가지 제한 사항이 있습니다. 첫째, 수술 후 PE10 튜브의 체외 말단이 손상되지 않도록 쥐를 따로따로(케이지당 하나씩) 수용해야 합니다. 둘째, 리도카인의 척수강내 주사 후 5-7일 동안의 회복은 후속 실험 전에 필요합니다.
결론적으로, 척수강내 카테터 삽입을 위한 이 수정된 방법은 약물의 반복적인 척수강내 투여에 유용한 도구가 될 수 있으며, 실험 기간을 단축하는 간단하고 편리하며 신뢰할 수 있는 방법을 나타낼 수 있습니다.
공개
이 원고의 저자는 이해 상충이 없음을 선언합니다.
감사의 말
이 연구는 국가자연과학재단(National Natural Science Foundation, No. 81971042)과 상하이 훙커우(Shanghai Hongkou) 지구 위생건강위원회의 핵심 지원 전문가 프로젝트(Key Support Specialist Projects)의 지원을 받았습니다. HKZK2020A06).
자료
| Name | Company | Catalog Number | Comments |
| 1 cc syringe | Jiangxi Hongda Medical Equipment Co., Ltd | 1 cc | |
| 22 gauge × 1” needles | Jiangxi Hongda Medical Equipment Co., Ltd | 22G | |
| 23 gauge × 1” needles | Jiangxi Hongda Medical Equipment Co., Ltd | 23G | |
| 25 μL Hamilton Syringes | Shanghai Bolige Co.,Ltd | 0.31mm 25 μL | |
| 4-O MERSILK NON-ABSORBABLE SUTURE | ETHICON | SA83G | |
| 50 mL corning centrifuge tubes 3 cm diameter | 430820 | CORNING | |
| Epidural catheter and connector | Henan Tuoren Medical Device Co., Ltd | regular type | |
| Gavage apparatus | Shanghai Bolige Co.,Ltd | 8# | |
| PE-10 Mirco Medical Tubing | BB31695-PE/1 | Scientific Commodities, Inc | |
| Scalpel handle and #10 blades | Jiangsu Songxin Medical Equipment Co., Ltd | 125mm | |
| Scissors | Jiangsu Songxin Medical Equipment Co., Ltd | 100mm | |
| Sprague-Dawley (SD) rats | Shanghai BK/KY Biotechnology Co., Ltd | Male | |
| Stainless steel wire 0.2 mm diameter | Dongguan Jiazhi Metal Products Technology Co., Ltd. | 0.2mm × 1m | |
| Toothed forceps | Jiangsu Songxin Medical Equipment Co., Ltd | 18cm | |
| URGO silk tape | URGO | 1.25cm × 9.1m |
참고문헌
- Kong, G., Huang, Z., Zhu, Q., Wan, Y. Comparison of two modified methods of intrathecal catheterization in rats. Exp Anim. 69 (2), 219-223 (2020).
- Xu, C. S., Sun, P., Lin, C. a new design puncture needle and a device of microcatheter protection for lumbar intrathecal catheterization in rats. Zhongguo Ying Yong Sheng Li Xue Za Zhi. 36 (3), 283-288 (2020).
- Yamamoto, G., et al. Neurosteroid dehydroepiandrosterone sulphate enhances pain transmission in rat spinal cord dorsal horn. Br J Anaesth. 123 (2), e215-e225 (2019).
- Mattioli, T. A., Sutak, M., Milne, B., Jhamandas, K., Cahill, C. M. Intrathecal catheterization influences tolerance to chronic morphine in rats. Anesth Analg. 114 (3), 690-693 (2012).
- Wang, B. C., Hillman, D. E., Li, D., Turndorf, H. Lumbar subarachnoid catheterization in rats. Pharmacol Biochem Behav. 38 (3), 685-688 (1991).
- Yaksh, T. L., Rudy, T. A. Chronic catheterization of the spinal subarachnoid space. Physiol Behav. 17 (6), 1031-1036 (1976).
- Martin, H., Kocher, L., Chery-Croze, S. Chronic lumbar intrathecal catheterization in the rat with reduced-length spinal compression. Physiol Behav. 33 (1), 159-161 (1984).
- Mazur, C., et al. Development of a simple, rapid, and robust intrathecal catheterization method in the rat. J Neurosci Methods. 280, 36-46 (2017).
- Zhang, S. X., Huang, F., Gates, M., White, J., Holmberg, E. G. Extensive scarring induced by chronic intrathecal tubing augmented cord tissue damage and worsened functional recovery after rat spinal cord injury. J Neurosci Methods. 191 (2), 201-207 (2010).
- Ohara, P. T. Long-term intrathecal catheterization in the rat. J Neurosci Methods. 110 (1-2), 81-89 (2001).
- StØrkson, R. V., KjØrsvik, A., TjØlsen, A., Hole, K. Lumbar catheterization of the spinal subarachnoid space in the rat. J Neurosci Methods. 65 (2), 167-172 (1996).
- Poon, Y. Y., Chang, A. Y., Ko, S. F., Chan, S. H. An improved procedure for catheterization of the thoracic spinal subarachnoid space in the rat. Anesth Analg. 101 (1), table of contents 155-160 (2005).
- Xu, F., Li, T., Zhang, B. An improved method for protecting and fixing the lumbar catheters placed in the spinal subarachnoid space of rats. J Neurosci Methods. 183 (2), 114-118 (2009).
- Igawa, Y., Andersson, K. E., Post, C., Uvelius, B., Mattiasson, A. A rat model for investigation of spinal mechanisms in detrusor instability associated with infravesical outflow obstruction. Urol Res. 21 (4), 239-244 (1993).
- Hou, Y., et al. A modified procedure for lumbar intrathecal catheterization in rats. Neurol Res. 38 (8), 725-732 (2016).
- Farhadi, E., et al. Comparison of open and ultrasound-guided placement of central venous catheter in children weighing less than five kilograms; a randomized clinical trial. Acad Radiol. 30 (7), 1419-1425 (2023).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유