더 긴 전극을 사용한 전기 음향 자극을 통한 고주파 청력 손실에서 향상된 달팽이관 적용 범위 및 청력 보존
요약
더 긴 전극을 사용한 전기 음향 자극(EAS)은 고주파 난청의 경우 더 넓은 달팽이관 범위와 다양한 유형의 맵을 제공할 수 있습니다. 덜 침습적인 수술, 유연한 측벽 전극 및 스테로이드 투여를 결합하면 외과적 외상이 거의 또는 전혀 없이 더 깊은 삽입이 가능하여 청력이 잘 보존됩니다.
초록
전기 음향 자극(EAS)은 고주파 난청(HL) 환자의 청력 능력을 향상시키는 유망한 치료법입니다. EAS 수술에서는 잔류 청력 영역을 덮는 전극의 존재를 피하기 위해 더 짧은 전극이 선호되었습니다. 그러나 이전 연구에 따르면 더 긴 전극(28mm)을 가진 EAS는 청력을 보존할 수 있습니다. 또한 청력 보존(HP) 점수가 삽입된 전극의 길이와 무관하다고 보고했으며, 이는 체계적 문헌고찰과 일치합니다. 대부분의 EAS 환자는 HL의 자연스러운 경과로 인해 시간이 지남에 따라 점차 잔존 청력을 잃기 때문에 이러한 경우 더 긴 전극을 사용하여 더 넓은 달팽이관 범위를 제공하는 것이 더 나은 위치-피치 일치에 도움이 됩니다. 미래의 청력 저하에 대비하는 것 외에도 더 긴 전극을 가진 EAS는 다양한 유형의 MAP 전략을 제공할 수 있습니다. 여기에서는 EAS 수술의 사전, 중, 후 절차를 보여줍니다. 적절한 수술 전 평가, 덜 침습적인 수술, 유연한 측벽 전극 및 스테로이드 투여로 더 긴 전극을 가진 EAS에 따른 우수한 HP를 얻을 수 있었습니다.
서문
기존의 인공와우 이식(CI)은 고심도 난청(HL) 환자의 청력 능력을 개선하기 위한 표준 치료법입니다. 그 후, 전기 음향 자극(EAS)은 중증 고주파 난청 및 잔류 저주파 청력 환자를 치료하는 데 사용됩니다1. 이러한 환자에서는 소음 속에서 더 나은 어음 인식, 소리 위치 파악, 음악을 들을 때 향상된 음질을 얻기 위해 잔존 음향 청력을 보존하는 것이 중요하다2. 이를 해결하기 위해, 달팽이관의 음향 영역의 잔류 기능을 방해하지 않기 위해 EAS 환자에서 더 짧은 전극을 사용하는 것이 선호되었습니다. 그러나 우리의 이전 연구 3,4,5,6에서는 EAS 사례에서도 덜 침습적인 CI 수술과 얇고 직선적이며 유연한 "긴" 전극을 결합하여 잔류 청력을 보존할 수 있다고 문서화했습니다. 또한, 청력 보존은 삽입된 인공와우 전극7의 길이와 관련이 없다고 보고했으며, 이는 체계적 문헌고찰8과 일치한다.
기존 CI를 받은 환자에서 전극이 길면 음성 인식이 향상되었으며9,10,11 전극이 길면 달팽이관 적용 범위가 넓어지고 위치-피치 일치가 향상되었다. 유사하게, 더 깊은 삽입각(AID)과 더 나은 청력 사이의 상관관계가 보고되었습니다12,13. 대부분의 EAS 환자에서 잔존 청력은 시간이 지남에 따라 점차 악화된다14. HL의 원인이 되는 유전자를 확인하면 미래의 청력을 예측할 수 있습니다. 미래에 모든 주파수에서 청력이 손실될 것으로 예상되는 경우, 짧은 전극이 아닌 긴 전극을 가진 EAS가 더 높은 비율의 인공와우 커버리지를 제공하는 데 이상적이다15. 최적의 AID는 630°에서 720°16,17,18 사이로 생각되었으며, 이는 인간 달팽이관의 나선형 신경절 뉴런의 분포에 해당합니다. 그러나 각 달팽이관 길이(CDL)는 변동 범위가 넓기 때문에 EAS 환자에서도 적절한 AID를 달성하기 위해 각 사례에서 CDL을 측정해야 했습니다. 최근에는 상용화된 소프트웨어(재료 표 참조)를 통해 임상적으로 실현 가능한 컴퓨터 단층 촬영(CT) 데이터를 기반으로 각 CDL을 쉽게 측정할 수 있게 되었습니다.
이 프로토콜은 (1) HL의 원인을 확인하기 위한 유전자 분석과 최적의 전극 길이를 결정하기 위한 달팽이관 길이 측정을 포함한 수술 전 평가, (2) 외경 및 내시경을 통한 덜 침습적인 수술 절차, (3) 더 긴 전극으로 EAS를 받은 고주파 HL 환자의 수술 후 청력 결과 및 매핑 전략을 설명합니다.
프로토콜
기재된 절차는 신슈대학교 의과대학 기관심사위원회(승인 번호 4133)의 승인을 받았습니다. 환자는 연구에 참여하기 전에 서면 동의서를 제공했습니다. 이 연구에 사용된 시약, 장비 및 소프트웨어는 재료 표에 나열되어 있습니다.
1. 수술 전 평가
- 잔존 청력이 있는 환자의 일련의 순음 청력도를 검토하여 각 사례에서 HL의 진행 상황을 확인합니다.
- 환자와 가족으로부터 채취한 혈액 샘플에 대해 유전자 검사를 실시합니다.
- HL 6,7과 관련된 유전자 패널에서 차세대 염기서열 분석을 수행하는 것이 좋습니다.
- CT 및/또는 자기 공명 영상(MRI)과 같은 영상 검사를 수행합니다. CT 슬라이스 두께는 0.6mm 이하인 것이 권장되었습니다. MRI의 경우 1.5 Tesla의 강도가 충분한 것으로 간주되었습니다.
- 청력도 시리즈6 을 수집하고 이미징 및/또는 유전자 분석을 통해 병인을 식별한 후 가능한 한 최대한 미래의 잔존 음향 청력에 대한 예측을 수행합니다.
- 수술 전 CT 영상의 DICOM 데이터를 OTOPLAN 소프트웨어로 가져옵니다. 소프트웨어는 각 경우에 CDL을 자동으로 측정합니다.
- 향후 잔존 청력이 악화될 것으로 예상되는 영역을 커버하는 적절한 길이의 CI 어레이를 선택합니다. 얇고 직선이며 유연한 전극만 사용하십시오.
- 수술 2일 전부터 프레드니솔론을 0.5-1.0mg/kg/day의 용량으로 경구 투여합니다.
2. 수술 절차
- 환자를 앙와위 자세로 놓습니다.
- 펜타닐(1-2μg/kg), 프로포폴(1-2mg/kg), 로쿠로늄(0.6mg/kg) 정맥 주사로 마취를 유도합니다. 신경근 모니터링을 용이하게 하기 위해 베쿠로늄 없이 프로포폴(3-8mg/kg/h), 레미펜타닐(0.1-0.2μg/kg/min) 및 펜타닐(총: 300-500μg)로 마취를 유지합니다.
- 절개 30분 전에 덱사메타손 8mg을 정맥 주사합니다.
- 수술 중 환자의 머리를 45도로 회전합니다.
- 국소 마취(1:1,00,000 에피네프린이 함유된 피하 0.5% 리도카인)를 요로 후에 주사합니다.
- 5-6cm(게으른 S자형)의 귓바퀴 후 절개술과 6.0-4.0mm 절단 막대를 사용하여 유양돌기 절제술을 전방에 외측 반고리관과 인커스6의 짧은 돌기를 포함하는 지점에 도달할 때까지 수행합니다.
- 1.5-2.0mm 다이아몬드 바를 사용하여 예상되는 안면 신경과 척삭 고막 사이에 후방 고막 절개술을 수행합니다.
- 둥근 창 틈새를 시각화하고 1.0-1.5mm 다이아몬드 바가 있는 저속 드릴을 사용하여 둥근 창 멤브레인을 노출시켜 둥근 창의 뼈 돌출부를 제거합니다.
- 곡괭이를 사용하여 둥근 창막을 충분히 열고 전극을 3분 이상 천천히 조심스럽게 삽입합니다.
- 전극 삽입을 완료한 후 X-ray 및 청력도를 수행합니다.
3. 수술 후 평가
- 수술 후 3일 동안 덱사메타손을 8mg/일, 4mg/일, 4mg/일로 정맥 투여합니다.
- 최초 활성화 후 6개월 후에 비보조 청각 역치를 측정하고 Skarzynski et al.20에서 제공한 분류를 사용하여 HP 속도를 평가합니다.
- 수술 후 청력도의 결과와 환자 선호도를 기반으로 소프트웨어 도구를 사용하여 맵 설정을 최적화합니다.
대표적 결과
EAS는 EAS에 대한 청력학적 기준을 충족하는 10명의 환자(11명)를 대상으로 실시하였다(표 1 참조). 선정 기준은 다음과 같습니다: 양측 순음 청력 수준≤125Hz, 250Hz 및 500Hz의 경우 65dBHL; ≥2000Hz에서 80dBHL; 및 ≥85Hz 및 4000Hz에서 8000dBHL. 또한 기존 보청기의 최소한의 이점이 필요했으며, 이는 최적의 보조 조건에서도 60% 미만의 조용한 단음절 점수로 정의되었습니다. 모든 참가자는 더 긴 전극을 사용하여 EAS를 받았습니다( 재료 표 참조). 그림 1 은 EAS 수술 후 수술 전 및 수술 후 6개월 청력도를 보여주며, 이는 모든 경우에 잔류 저주파 청력이 잘 보존되었음을 시사합니다. Skarzynski et al.20이 보고한 청력 보존(HP) 분류 시스템에 따르면 36.4%(11건 중 4건)에서 완전 HP가 나타났고, 63.6%(11건 중 7건)에서 부분 HP가 나타났습니다. 현저한 청력 저하 사례는 없었습니다.
사례 발표(사례 #8)
5세 때 초등학교 정기 건강 검진에서 신생아 청력 검사를 받지 않은 14세 소녀가 난청(HL)이 의심된다는 진단을 받았습니다. 그 후 고주파 HL 진단을 받은 그녀는 보청기를 사용하기 시작했습니다. 그녀의 청력이 악화된 것으로 보아 그녀는 13세에 우리 부서에서 평가를 받았습니다.
CDH23 유전자의 병원성 변이체는 유전자 검사를 통해 확인되었다6. CDH23 관련 HL로 인해 잔존 청력이 저하될 가능성이 높기 때문에 음향 영역을 커버하기 위해 더 긴 전극을 선택했습니다. 그녀는 14세에 왼쪽 귀에 EAS 수술을 받았습니다. 수술 후 6개월 동안 잔여 청력이 완전히 보존되었습니다. 그녀는 당시 잔존 청력 영역을 가로지르는 활성화된 정점 전극을 사용하는 "전기 자극(ES) 전용 매핑"을 선호했습니다(그림 2). 환자는 저주파에서 ES를 사용하여 얻은 음향 증폭에 만족했습니다.
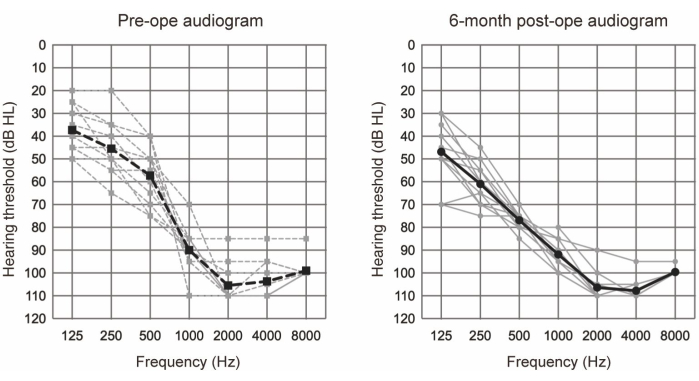
그림 1: 평균 공기 전도 청력 임계값. 점선과 실선은 각각 수술 전과 수술 후 6개월 측정값을 나타냅니다. 회색 선과 검은색 선은 각각 개별 데이터와 평균을 나타냅니다. 이 그림은 Yoshimura et al.6에서 발췌한 것입니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
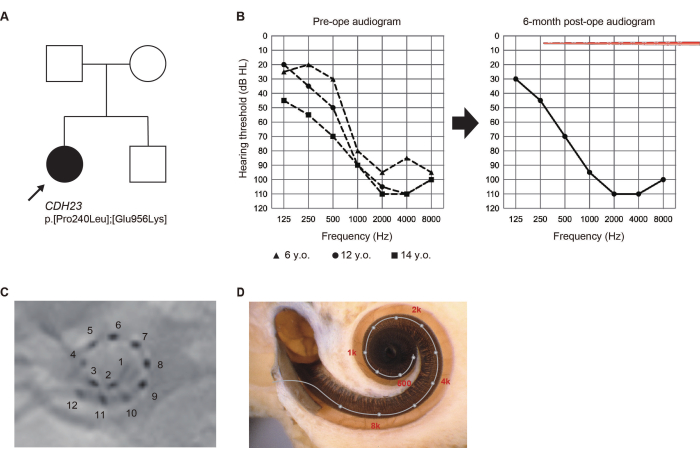
그림 2: 사례 #8의 임상 결과. (A) 환자의 가계도. (B) 수술 전 및 수술 후 6개월 청력도. 전극 어레이 그림은 삽입 깊이를 나타냅니다. (C) 수술 후 X선 소견, 개별 채널에 해당하는 번호. (D) 각 전극 위치 및 참조 tonotopic map에 대한 이미징. 이 그림은 Yoshimura et al.6에서 발췌한 것입니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
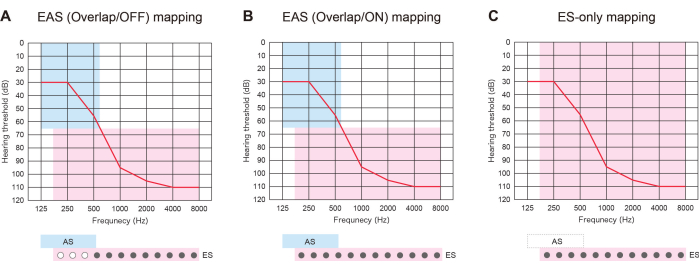
그림 3: 더 긴 전극을 사용하는 EAS 환자의 세 가지 유형의 매핑 전략. (A) EAS(Overlap/OFF) 맵. 일부 정점 접촉부는 비활성화되었지만 음향 자극(AS)은 활성화되었습니다. (B) EAS(Overlap/ON) 맵. 인공와우 이식(CI) 기본 설정에서 전기 자극(ES)과 AS가 모두 활용되었습니다. (C) ES 전용 맵. ES 설정에서 주파수 범위는 70-8,500Hz로 설정되었으며 AS는 비활성화되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
| 환자 | 이식 | 이식 | 책임 | 수술 전 | 6M 수술 후 | HP 숫자 | 마방 | |
| 아니요. | 성별 | 나이(년) | 쪽 | 유전자 | LFA (데시벨) | LFA (데시벨) | 척도(%) | 분류 |
| 1 | F | 12 | L | SLC26A4 | 63.3 | 70 | 70.8 | 부분적인 |
| 2 | F | 9 | L | SLC26A4 | 50 | 65 | 62.5 | 부분적인 |
| 3 | M | 50 | L | 기민기(CDH23) | 50 | 56.7 | 78.6 | 완성하다 |
| 4 | F | 31 | L | 알려지지 않은 | 45 | 61.7 | 67.7 | 부분적인 |
| 31 | R | 46.7 | 56.7 | 75.9 | 완성하다 | |||
| 5 | F | 57 | R | 알려지지 않은 | 38.3 | 65 | 59 | 부분적인 |
| 6 | F | 55 | R | 알려지지 않은 | 26.7 | 55 | 68.4 | 부분적인 |
| 7 | M | 21 | R | 록시디1 | 33.3 | 66.7 | 37.2 | 부분적인 |
| 8 | F | 14 | R | 기민기(CDH23) | 56.7 | 48.3 | 100 | 완성하다 |
| 9 | M | 20 | L | 알려지지 않은 | 51.7 | 73.3 | 48.1 | 부분적인 |
| 10 | M | 64 | R | 알려지지 않은 | 51.7 | 58.3 | 82.1 | 완성하다 |
표 1: 피험자 특성 및 청력 보존 결과 요약. 이 표는 Yoshimura et al.6에서 발췌한 것입니다.
토론
수술 전 평가에서 HL의 원인을 식별하는 것은 각 사례에서 미래의 청력도를 예측하는 데 중요합니다. 이전 연구에서는 고주파 HL7 환자에서 CDH23, ACTG1, Mit1555A>G, MYO7A, MYO15A, SLC26A4 및 TMPRSS3 유전자의 병원성 변이체가 자주 확인되었습니다. 대부분의 환자에서 잔존 청력은 점차 악화되었습니다(그림 2의 CDH23 관련 HL 사례 참조). 이러한 경우, 더 넓은 달팽이관 적용 범위를 위해 CI 전극을 선택할 때 HL의 자연스러운 경과를 고려했습니다.
CI 배열의 길이를 결정하기 위해서는 달팽이관 길이(CDL)를 측정해야 했습니다. 이 과정을 용이하게 하기 위해 OTOPLAN 소프트웨어는 임상적으로 실현 가능한 것으로 입증되었습니다21. OTOPLAN 3.0과 같은 이전 버전에서는 CDL을 수동으로 측정하여 각 달팽이관의 직경, 너비 및 높이를 표시했습니다. 그러나 OTOPLAN 4.0을 통해 CDL의 자동 측정이 가능해져 외과의의 편의성이 높아지고 측정 변동이 최소화되었습니다. 특히 슬라이스 두께가 0.6mm 이하인 CT 영상은 OTOPLAN에서 제공하는 자동 분석에 적합했습니다. 그 후, 각 경우에 최적의 삽입 깊이 각도(AID)를 달성하기 위해 CI 어레이의 길이를 선택해야 합니다.
덜 침습적인 EAS 수술을 수행하기 위해, 청력 역치를 높일 수 있는 급성 염증을 최소화하기 위해 스테로이드 투여 전, 투여 중, 및 스테로이드 투여 후가 필요했다22. 가까운 장래에 CI 및 EAS 수술 후 급성 반응뿐만 아니라 만성 반응을 최소화하기 위해 덱사메타손 용출 전극의 사용이 바람직할 것입니다. 스테로이드 투여 외에도 유연한 측벽 전극은 달팽이관에 대한 외상을 최소화하는 데 필수적이었습니다. 둥근 창 접근법을 사용하여 이러한 전극을 달팽이관에 조심스럽게 천천히 삽입하면 침습성을 최소화할 수 있습니다. 이를 돕기 위해 외시경과 내시경을 사용하여 수술을 수행하는 것이 더 선명한 시야를 생성하고 중이의 작은 구성 요소를 확인하는 데 유용했습니다. 달팽이관에서 광범위한 섬유-골 조직 형성을 유발하는 것을 방지하기 위해, 확장된 둥근 창 접근법과 달팽이루술은 피해야 한다23.
더 긴 전극을 가진 EAS는 HL의 향후 열화에 대비하는 것뿐만 아니라 세 가지 유형의 MAP 전략을 제공하는 데 유용했습니다. 삽입된 전극이 잔여 청력 영역과 겹치는 경우 EAS 환자는 "EAS(Overlap/ON) map" 또는 "ES-only map"과 같은 AS를 사용하거나 사용하지 않고 ES를 사용할 수 있습니다. 또는 일부 정점 접점을 끄고 AS: "EAS(Overlap/OFF) 맵"을 활성화할 수 있습니다. 청력이 저하되면 나중에 모든 접점을 켜서 더 나은 피치 정합을 제공할 수 있습니다(그림 3). 이러한 모든 결과는 더 긴 전극을 가진 EAS를 통해 사용자가 보다 자연스러운 청력을 위해 맵을 최적화할 수 있음을 보여줍니다.
여기에서, 수술 전 준비와 첨단 수술 기법이 외과적 외상을 최소화하는 데 필수적임을 보여준다. 위에서 언급한 일련의 수술 전 및 수술 중 절차를 수행함으로써 환자는 더 긴 전극을 가진 EAS의 이점을 누릴 수 있었습니다.
제한
앞서 언급한 덜 침습적인 수술 절차의 발전에도 불구하고 CI 후 특정 수의 환자에서 잔존 청력이 여전히 악화됩니다. 인공와우 마이크로포닉스(cochlear microphonics, CM)와 같은 수술 중 모니터링은 전극 삽입 동안의 달팽이관 손상을 측정하기 위해 임상적으로 실현 가능할 것이다(24). 그러나 더 긴 전극으로 EAS를 평가하는 방법과 진폭 감소와 같은 특정 CM 응답의 경우 어떻게 해야 하는지는 현재까지 불분명합니다. 이 분야에 대한 추가 연구가 필요합니다.
공개
저자는 이해 상충이 없음을 선언합니다.
감사의 말
이 연구는 일본 후생노동성의 희귀 및 난치성 질환 연구 및 장애인 건강 및 복지에 관한 종합 연구를 위한 건강 노동 과학 연구 보조금(S.U. 20FC1048, 23FC10149)과 일본 의료 연구 개발국(AMED)의 보조금(S.U. 19ek0109363h0002, 21ek0109542h003)의 지원을 받았습니다.
자료
| Name | Company | Catalog Number | Comments |
| DEXART 3.3 mg | Fuji Pharma | 22100AMX01404 | equal to dexamethasone sodium phosphate (4 mg) |
| DEXART 6.6 mg | Fuji Pharma | 22100AMX01402 | equal to dexamethasone sodium phosphate (8 mg) |
| Fentanyl injection 0.1 mg | TERUMO | 22100AMX00009 | |
| MAESTRO 7.0 | MED-EL | 4582290238456 | fitting software for map settings |
| Midas Rex MR8 | Medtronic | 301ADBZX00046000 | high speed drill |
| OTOPLAN software | Cascination / MED-EL | REF 20125 | for measuring cochlear duct length (CDL) |
| Predonine tablets | Shionogi | 16000AMZ01740000 | |
| Propofol 1% 50 mL | Maruishi Pharmaceutical Co.,Ltd | 30100AMX00158 | |
| Remifentanil 2 mg | Daiichi-Sankyo | 22800AMX00090 | |
| Rocuronium bromide 50 mg/50 mL | Maruishi Pharmaceutical Co.,Ltd | 22800AMX00534 | |
| SONNET2 EAS | MED-EL | 4582290241807 | processor |
| Synchrony2 FLEX28 | MED-EL | 4571573943026 | cochlear implant (electrode) |
| Xylocaine 0.5% with epinephrine | Sandoz Pharma | 4KUZ13127 |
참고문헌
- Von Ilberg, C., et al. Electric-acoustic stimulation of the auditory system. New technology for severe hearing loss. ORL J Otorhinolaryngol Relat Spec. 61 (6), 334-340 (1999).
- Gstoettner, W., et al. A new electrode for residual hearing preservation in cochlear implantation: First clinical results. Acta Otolaryngol. 129 (4), 372-379 (2009).
- Moteki, H., et al. Feasibility of hearing preservation for residual hearing with longer cochlear implant electrodes. Acta Otolaryngol. 138 (12), 1080-1085 (2018).
- Usami, S., et al. Achievement of hearing preservation in the presence of an electrode covering the residual hearing region. Acta Otolaryngol. 131 (4), 405-412 (2011).
- Usami, S., et al. Hearing preservation and clinical outcome of 32 consecutive electric acoustic stimulation (EAS) surgeries. Acta Otolaryngol. 134 (7), 717-727 (2014).
- Yoshimura, H., Moteki, H., Nishio, S. Y., Usami, S. I. Electric-acoustic stimulation with longer electrodes for potential deterioration in low-frequency hearing. Acta Otolaryngol. 140 (8), 632-638 (2020).
- Yoshimura, H., et al. Genetic testing has the potential to impact hearing preservation following cochlear implantation. Acta Otolaryngol. 140 (6), 438-444 (2020).
- Van de Heyning, P. H., et al. Systematic literature review of hearing preservation rates in cochlear implantation associated with medium- and longer-length flexible lateral wall electrode arrays. Front Surg. 9, 893839 (2022).
- Buchman, C. A., et al. Influence of cochlear implant insertion depth on performance: A prospective randomized trial. Otol Neurotol. 35 (10), 1773-1779 (2014).
- Buchner, A., Illg, A., Majdani, O., Lenarz, T. Investigation of the effect of cochlear implant electrode length on speech comprehension in quiet and noise compared with the results with users of electro-acoustic-stimulation, a retrospective analysis. PLoS One. 12 (5), e0174900 (2017).
- Canfarotta, M. W., et al. Long-term influence of electrode array length on speech recognition in cochlear implant users. Laryngoscope. 131 (4), 892-897 (2021).
- Nassiri, A. M., et al. Hearing preservation outcomes using a precurved electrode array inserted with an external sheath. Otol Neurotol. 41 (1), 33-38 (2020).
- O'Connell, B. P., et al. Electrode location and angular insertion depth are predictors of audiologic outcomes in cochlear implantation. Otol Neurotol. 37 (8), 1016-1023 (2016).
- Moteki, H., et al. Long-term results of hearing preservation cochlear implant surgery in patients with residual low frequency hearing. Acta Otolaryngol. 137 (5), 516-521 (2017).
- Von Ilberg, C. A., Baumann, U., Kiefer, J., Tillein, J., Adunka, O. F. Electric-acoustic stimulation of the auditory system: A review of the first decade. Audiol Neurootol. 16, 1-30 (2011).
- Ariyasu, L., Galey, F. R., Hilsinger, R., Byl, F. M. Computer-generated three-dimensional reconstruction of the cochlea. Otolaryngol Head Neck Surg. 100 (2), 87-91 (1989).
- Danielian, A., Ishiyama, G., Lopez, I. A., Ishiyama, A. Morphometric linear and angular measurements of the human cochlea in implant patients using 3-dimensional reconstruction. Hear Res. 386, 107874 (2020).
- Kawano, A., Seldon, H. L., Clark, G. M. Computer-aided three-dimensional reconstruction in human cochlear maps: Measurement of the lengths of organ of Corti, outer wall, inner wall, and Rosenthal's canal. Ann Otol Rhinol Laryngol. 105 (9), 701-709 (1996).
- Rask-Andersen, H., et al. Human cochlea: Anatomical characteristics and their relevance for cochlear implantation. Anat Rec (Hoboken). 295 (11), 1791-1811 (2012).
- Skarzynski, H., et al. Towards a consensus on a hearing preservation classification system. Acta Otolaryngol Suppl. 564, 3-13 (2013).
- Yoshimura, H., Watanabe, K., Nishio, S. Y., Takumi, Y., Usami, S. I. Determining optimal cochlear implant electrode array with OTOPLAN. Acta Otolaryngol. 143 (9), 748-752 (2023).
- Skarzynska, M. B., et al. Preservation of hearing following cochlear implantation using different steroid therapy regimens: a prospective clinical study. Med Sci Monit. 24, 2437-2445 (2018).
- Geerardyn, A., et al. Human histology after structure preservation cochlear implantation via round window insertion. Laryngoscope. 134 (2), 945-953 (2023).
- Campbell, L., et al. Intraoperative real-time cochlear response telemetry predicts hearing preservation in cochlear implantation. Otol Neurotol. 37 (4), 332-338 (2016).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유