JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
설치류 구강 질환 모델에서 치아 및 폐포골에 대한 미세 경도 측정
요약
미세경도는 기계적 특성이며 경질 조직 병태생리학을 평가하기 위한 정보 매개변수입니다. 여기에서는 설치류 구강 질환 모델에서 치아 및 치조골의 미세 경도 분석, 즉 치아 불소증 및 인자 유도 치주 골 흡수를 위한 표준화된 프로토콜(샘플 준비, 연마, 평평한 표면 및 압흔 부위)을 보여줍니다.
초록
기계적 특성인 미세 경도는 치아 불소증 및 치주염을 포함한 구강 질환 모델에서 치아 법랑질, 상아질 및 뼈에서 평가됩니다. Micro-CT(μCT)는 3D 이미징 정보(부피 및 미네랄 밀도)를 제공하고 주사전자현미경(SEM)은 미세구조 이미지(법랑질 프리즘 및 뼈 열공-수관)를 생성합니다. μCT 및 SEM에 의한 구조 분석을 보완하는 미세경도는 구조 변화가 기계적 특성을 어떻게 변화시키는지 평가하기 위한 정보 파라미터 중 하나입니다. 유용한 매개변수임에도 불구하고 구강 질환에서 치조골의 미세 경도에 대한 연구는 제한적입니다. 현재까지 다양한 미세경도 측정 방법이 보고되었습니다. 미세경도 값은 시료 전처리(연마 및 평평한 표면)와 압흔 부위에 따라 다르기 때문에 다양한 프로토콜로 인해 연구 간에 불일치가 발생할 수 있습니다. 미세경도 프로토콜의 표준화는 구강 질환 모델에서 일관되고 정확한 평가를 위해 필수적입니다. 본 연구에서는 치아 및 치조골의 미세경도 분석을 위한 표준화된 프로토콜을 보여줍니다. 사용된 표본은 다음과 같다: 치아 불소증 모델의 경우, 불소 함유 물을 6주 동안 처리하거나 사용하지 않은 마우스에서 앞니를 수집하였다; L-PBR(ligature-induced periodontal bone resorption) 모델의 경우, 치주골 흡수가 있는 치조골은 상악 2번째 어금니에 결찰된 마우스에서 수집되었습니다. 결찰 후 2주에 상악골을 채취했습니다. 비커스 경도는 표준화된 프로토콜에 따라 이 시편에서 분석되었습니다. 이 프로토콜은 수지 매립, 연속 연마 및 앞니와 치조골의 압흔 부위에 대한 자세한 재료와 방법을 제공합니다. 우리가 아는 한, 이것은 설치류 구강 질환 모델에서 치아와 치조골의 기계적 특성을 평가하기 위한 최초의 표준화된 미세경도 프로토콜입니다.
서문
경도는 기계적 특성(예: 탄성, 경도, 점탄성 및 파괴 거동) 중 하나이며 일반적으로 재료의 국소 영역의 압축 변형 및 파괴에 저항하는 능력을 특성화하는 데 사용됩니다. 정적 압입 경도 시험은 비커스 경도 및 누프 경도1을 포함하여 가장 많이 사용되는 방법입니다. 비커스 경도 시험은 고정 시험 하중 하에서 다이아몬드 압자를 표면으로 밀어 넣어서 구현됩니다. 압자는 피라미드 모양이며 바닥이 정사각형이고 반대쪽면 사이의 각도가 136°입니다. 시험 표면에 형성된 두 대각선의 길이를 측정하고 평균을 사용하여 경도를 계산하며, 이는 F/A 비율(여기서 F는 힘이고 A는 압흔의 표면적)에 의해 결정됩니다. 비커스 미세 경도 수 (HV = F / A)는 일반적으로 1 HV ≈ 0.1891 F / d2 (N / mm2)와 함께 mm2 압흔 당 킬로그램 힘 (kgf)으로 표시됩니다. Knoop 경도는 또한 두 개의 불균등한 대각으로 형성된 다이아몬드 정사각형 피라미드 압자로 구성됩니다. 누프 경도 번호(HK)는 투영된 접촉 면적에 적용된 하중의 비율과 같습니다. 경도 시험은 시험 재료에 가해지는 힘에 따라 마이크로 압입(microhardness) 시험과 거시 압입 시험으로 분류됩니다. 마이크로 압흔 시험은 일반적으로 0.01-2 N (약 1-203 gf) 범위의 하중을 사용합니다. 한편, 매크로 압흔 테스트는 10N(10119gf) 이상을 사용합니다1.
치아 및 치조골을 포함한 구강 질환에서 치아 경조직의 특징을 평가하기 위해 마이크로 CT(μCT) 및 주사 전자 현미경(SEM)을 사용하여 구조 분석을 수행합니다. μCT는 3D 이미징 정보(부피 및 미네랄 밀도)2를 제공하고 SEM은 미세 구조 이미지(법랑질 프리즘 및 뼈 열공-수관)3를 생성합니다. μCT 및 SEM에 의한 구조 분석을 보완하는 미세 경도는 구조적 변화가 구강 질환에서 치아 및 치조골의 기계적 특성(예: 법랑질 기형 및 치주골 흡수)을 어떻게 변화시키는지 평가하기 위한 정보 매개변수 중 하나입니다. 인간 법랑질(HV = 283-374)의 비커스 미세경도 값은 상아질(HV = 53-63)4,5보다 약 4-5배 높습니다. 설치류 치과불소증 모델에서, 대조군 법랑질(HV = 334)에 비해 불소로 처리된 마우스 앞니(HV = 136)에서 법랑질 미세경도가 현저히 감소합니다6,7. 이것은 불소화된 법랑질이 불소화되지 않은 법랑질에서 발견되는 것보다 더 부드럽고 약하며 미네랄 함량이 낮고 단백질 함량이 높다는 것을 시사합니다. 미세 경도는 뼈의 기계적 특성을 평가하는 데 사용됩니다. 이전의 여러 연구에서는 긴 뼈 미세 경도 8,9,10을 포함하여 다양한 해부학적 부위에서 인간 뼈의 기계적 거동을 조사했습니다. 인간 형광화 대퇴골의 평균 미세경도는 비불소화 대퇴골(HV = 294.4)에 비해 유의한 감소(HV = 222.4)를 보였습니다11. 유용한 매개 변수임에도 불구하고 구강 질환에서 폐포골의 미세 경도 (Vickers12 또는 Knoop 13,14)를 설명하는 문헌은 부족합니다.
현재까지 다양한 미세경도 측정 방법이 보고되었습니다. 미세경도 값은 시료 전처리(연마 및 평평한 표면)와 압흔 부위에 따라15 달라지기 때문에 다양한 프로토콜로 인해 연구 간에 불일치가 발생할 수 있습니다. 미세경도 검사 프로토콜의 표준화는 구강 질환 모델에서 일관되고 정확한 평가를 위해 필수적입니다. 본 연구에서는 마우스 치아 불소증 모델 및 치주골 흡수 모델에서 치아 및 치조골의 미세경도 분석을 위한 표준화된 프로토콜을 보여줍니다.
프로토콜
이 프로토콜에 설명된 모든 절차는 Augusta University의 IACUC(Institutional Animal Care Use Committee)와 AAALAC(Association for Assessment and Accreditation of Laboratory Animal Care International)의 인증을 받은 Nova Southeastern University에서 승인한 척추동물 사용에 대한 지침 및 규정에 따라 수행되었습니다. 스즈키 박사는 마우스 치아 불소증 실험이 완료된 Augusta University에 고용되어 있었습니다.
1. 마우스 치아 불소증 모델에서 하악 앞니 추출
- 불소 투여 1주일 전부터 불소 처리가 종료될 때까지 C57BL/6 마우스(5주령, 수컷)에게 불소가 없는 식단을 공급합니다.
- 증류수에 NaF를 첨가한 후 0.2μm 필터를 사용하여 진공 여과하여 불소수를 제조합니다. 동물에게 불소를 NaF(0ppm 및 125ppm)로 제공하십시오. N=5/그룹) 6주 동안 애드리비텀 . 2일마다 불소를 갓 준비한 물로 교체하십시오.
- 6주간의 불소 수처리 후CO2 로 동물을 안락사시킨 후 목을 베십시오.
- 각 마우스에서 앞니가 있는 하악반을 추출합니다. 앞니가 있는 하악골을 채취하려면 과도한 힘을 가하지 않고 하악 턱 주변의 근육을 자릅니다.
- 하악반을 PBS에 놓고 μ-CT 분석(선택 사항)까지 4°C에서 유지합니다. 메스(#15)와 가위를 사용하여 검체를 손상시키거나 파손시키지 않고 앞니와 하악을 분리합니다.
- 고립된 앞니를 PBS로 세척하고 알코올 농도(70% 및 100% 에탄올)에 2-3시간 동안 담가 탈수를 수행합니다.
참고: 조직(예: 펄프)이 충분히 탈수되지 않으면 수지 함침이 억제될 수 있으며 후속 평가가 부적절할 수 있습니다. - 에탄올로 탈수 한 후 앞니를 수지에 수평으로 매립합니다. 3단계를 계속합니다.
2. 마우스 합자 유도 치주골 흡수(L-PBR) 모델에서 상악 폐포골 추출
- 케타민(100mg/mL) 0.8mL + 자일라진(100mg/mL) 0.1mL + PBS 9.1mL를 마우스(C57BL/6, 8-12주, 수)에게 마취제로 복강내(i.p.)로 투여합니다. 투여량은 0.01mL/g(중량)입니다. 양쪽 눈에 안과 연고를 바르면 마취 후 건조함을 예방할 수 있습니다.
- 마취된 마우스를 가열 패드에 5-10분 동안 놓습니다. 꼬리/발가락 꼬집음에 대한 반응과 안구 반사의 온전성을 평가합니다. 마우스가 유해한 자극에 반응하지 않고 반사가 없는지 확인하십시오.
- 마우스를 치료 테이블에 놓고 치료 테이블의 자석 기둥에 연결된 합자 5-0 실크 봉합사를 사용하여 입을 벌리고 있습니다.
- 수술용 현미경으로 마이크로 바늘 홀더를 사용하여 상악 두 번째 어금니(단층)의 한쪽 주위에 합자(꼰 실크 봉합사 6-0)를 감습니다. 한쪽을 처리 측면으로, 다른 쪽을 대조군으로 사용하여 분석의 개인차를 최소화합니다.
- 합자를 묶고 입천장 쪽에 매듭을 만듭니다. 매듭을 만든 후 과도한 합자가 씹거나 먹는 데 방해가 되지 않도록 나머지 합자를 가능한 한 짧게 자릅니다. 이것은 후속 관찰 기간 동안 씹어서 합자가 느슨해지지 않도록 하는 데 중요합니다.
알림: 흉골 누운 자세를 유지하기에 충분한 의식을 회복할 때까지 동물을 방치하지 마십시오. 완전히 회복될 때까지 수술을 받은 동물을 다른 동물과 함께 돌려보내지 마십시오. 생존 기간 동안 멸균 상태를 유지하십시오. - 2 주 동안 생쥐에게 식단과 물을 먹이 십시오 . 결찰 2주 후CO2 로 마우스를 안락사시킨 후 목을 베십시오.
- 각 마우스에서 어금니로 양쪽 상악골(합자측과 대조측)을 발치합니다. 어금니가 있는 상악골을 채취하려면 과도한 힘을 가하지 않고 상악턱 주변의 근육과 뼈를 가위로 자릅니다. 각 상악골을 PBS에 놓고 μCT 분석(선택 사항)이 있을 때까지 4°C를 유지합니다.
- 메스(#15)와 가위를 사용하여 검체를 손상시키거나 파손하지 않고 어금니가 있는 치조골(1-3rd)을 상악골에서 분리합니다.
- PBS로 분리된 폐포골을 세척한 다음 알코올(70% 및 100% 에탄올)의 강도를 높이는 데 2-3시간 동안 담가 탈수 및 탈지합니다.
참고: 조직(예: 펄프 및 뼈)이 충분히 건조되지 않은 경우 수지 함침이 억제될 수 있으며 후속 평가가 부적절할 수 있습니다. - 에탄올로 탈수 한 후 치조골을 수지에 수평으로 매립합니다. 3단계를 계속합니다.
- 선택 사항: 미세경도 테스트 전에 μCT 평가를 수행합니다.
- 미세경도 시험 전에 보완 평가로 미세경도 시험에 동일한 샘플을 사용하여 비파괴 구조 분석(예: μCT)을 수행합니다(그림 1). μCT에 의한 구조 정보(3D 이미지, 광물 밀도, 부피)는 미세경도 결과에 영향을 줄 수 있는 시료의 기계적 특성 및 품질을 평가하는 데 도움이 될 수 있습니다.
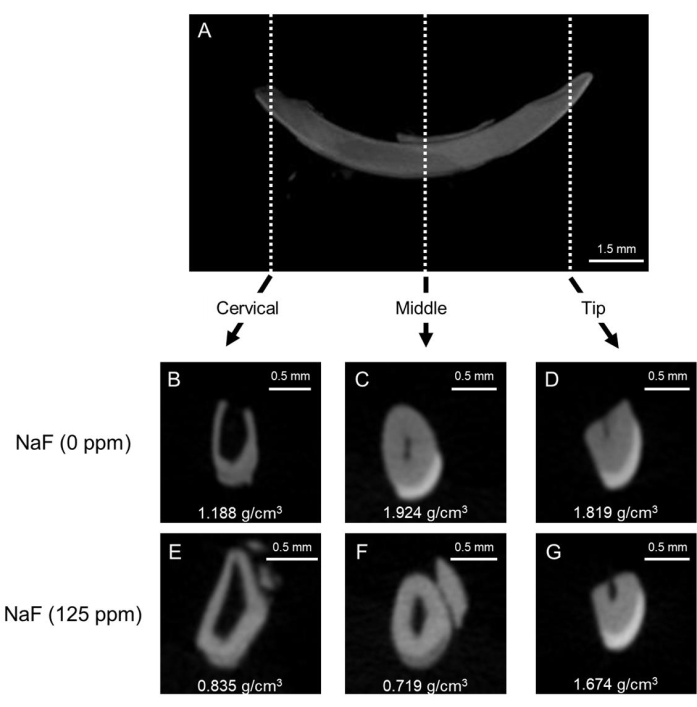
그림 1: 대조군 및 불소 처리된 마우스 앞니의 법랑질의 대표적인 μCT 이미지. (A) 하악 앞니의 대표적인 μCT 시상 이미지. (BD) 대조군 절치의 μCT 관상 이미지(NaF 0 ppm). (EG) NaF(125ppm)로 처리된 앞니의 μCT 관상 이미지. 대표적인 법랑질 미네랄 밀도(EMD)가 표시됩니다(g/cm3). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
3. 레진에 샘플 삽입
- 1.7단계(치과불소증 모델) 또는 2.10단계(L-PBR 모델)에서 계속합니다.
- 장착 컵(1인치)의 내부 표면을 얇은 바셀린층으로 코팅합니다. 지침에 따라 수지(냉간 설정 내장 수지)를 혼합합니다. 제공된 플라스틱 컵에 레진과 경화제를 15:2 부피 비율로 붓고 나무 주걱으로 최소 2분 동안 조심스럽게 섞습니다. 기포를 피하십시오.
- 탈수 및 탈지된 앞니(그림 2A) 또는 어금니가 있는 치조골(그림 2B)을 장착 컵 바닥과 수평 및 평행하게 배치합니다(컵당 표본 1개).
- 혼합 레진(충분한 레진, 약 1.5mL)을 장착 컵에 붓어 표본을 완전히 덮습니다. 과도한 수지는 연마 공정을 방해하므로 필요한 것보다 더 많은 수지를 추가하지 마십시오(그림 2C,D). 시편이 들어 있는 장착 컵을 50°C의 핫 플레이트에 놓고 최소 8시간 동안 수지 중합을 촉진합니다. 이 절차는 시편을 안정적인 위치에 고정하는 데 기여합니다.
참고: 샘플 크기에 따라 시편을 완전히 덮을 수 있도록 수지의 양을 조정하십시오. 너무 많은 수지를 채우지 마십시오, 그렇지 않으면 불필요한 수지를 제거하는 데 더 많은 시간이 필요합니다. - 경화 후 장착 컵에서 시편이 들어있는 수지를 제거합니다. 범람 시 거친 방수 연마지(Grit 60/P60 및 120/P120)가 있는 고급 그라인더 연마기를 사용하여 버를 제거하고 시편의 평면과 반대쪽 평면을 평행하고 평평하게 배열합니다. 앞니뼈와 치조골의 경우 표본의 높이를 약 3mm로 유지합니다(그림 2E,F).
참고: 미세경도 측정 후 SEM으로 시편을 분석할 때 시료의 두께는 후속 SEM 관찰에 영향을 미치지 않도록 약 3mm여야 합니다. 작은 샘플은 그라인더로 조작하기가 더 어렵습니다. 미세경도만을 목적으로 하는 시료의 경우 시편 높이가 약 10-20mm까지 증가할 수 있습니다. - 정밀 절단 톱을 사용하여 외부 모양을 다듬어 직사각형 단단한 수지 블록과 둥근 모서리(앞니의 경우 약 너비 30mm, 길이 10mm(그림 2G), 치조골의 경우 너비 10mm, 길이 5mm(그림 2H))를 만듭니다.
- 대략적인 형상 보정이 완료되면 초음파 세척기를 사용하여 수지 블록에서 이물질과 입자를 제거합니다(약 1분). 4단계로 진행합니다.

그림 2: 수지 매매 및 연마 절차의 흐름. (A) 탈수 및 탈지 앞니. (B) L-PBR의 탈수 및 탈지된 폐포골. (씨, D) 앞니와 치조골을 수지에 담근다. (E, F) 수지를 절단함으로써 대상 조직 표면을 연마하기 쉽습니다. (지, H) 연마 공정을 위해 둥글게 처리된 수지 모서리. 약어: L-PBR = ligature-induced periodontal bone resorption. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
4. 시편의 연마
참고: 시편의 연마는 물이 범람하는 상황에서 고급 그라인더 연마기에서 방수 연마지(거친 것부터 미세한 것까지)를 사용하여 수동으로 수행됩니다.
- 그라인더에 거친 방수 연마지(Grit 600/P1200)를 놓습니다. 다듬고 청소한 레진 블록(3.7단계에서)을 거친 방수 연마지 위에 놓습니다.
- 물을 붓는 동안 수지 블록을 잡고 그라인더 연마기(속도 1-10 x g)에서 시편의 평가 표면을 연마합니다. 이때, 평가면이 지면과 평행이 되도록 수지 블록을 잡도록 주의하십시오. 평가 표면을 손상되지 않게 유지하려면 육안이나 현미경으로 표면을 확인하십시오.
알림: 그라인더는 시계 방향으로 회전하며 균일한 압력으로 인해 표면이 평행하지 않을 수 있습니다. 평행면을 얻으려면 글라이더 회전 속도를 일정하게 유지하고 시편을 몇 초 동안 조심스럽게 누른 다음 시편을 180° 회전하여 같은 시간 동안 누릅니다. 거친 연마지는 수지뿐만 아니라 시편도 제거할 수 있습니다. - 연마지를 Grit 800/P2400으로 교체하고 그 위에 레진 블록을 놓습니다. 4.2단계를 반복합니다.
- 초음파 세척기를 사용하여 수지 블록에서 파편과 입자를 제거합니다(약 1분).
알림: 계속하기 전에 막힘을 방지하기 위해 초음파 세척기를 사용하여 표면 파편을 제거하는 것이 좋습니다. - 다음으로, 더 미세한 연마지를 사용하여 연속 연마를 수행합니다. 연마 순서는 12 μm, 9 μm, 3 μm, 1 μm 및 0.3 μm입니다.
- 그라인더 연마기 테이블에 랩핑 필름(12μm)을 회전하지 않고 놓고 랩핑 필름에 수지 블록을 놓습니다.
알림: 이 실험에서 그라인더 테이블은 물 범람 시 평평한 표면 조건을 얻는 데 적합합니다. 또는 평행도를 제공하는 대형 평면 미러(또는 유사한 미러)를 사용할 수도 있습니다. - 수냉식 상태에서 랩핑 필름에 시편의 평가 표면을 손으로 조심스럽게 연마합니다. 샘플을 수직, 수평 및 대각선으로 2-3cm(1인치)의 스트로크로 물 주입 상태에서 동일한 시간(초) 동안 이동합니다. 연마 절차가 제대로 이루어지면 수지 시편이 래핑 필름에 달라붙습니다.
- 4.4단계와 같이 파편과 입자를 제거합니다. 연마지를 연속 연마 순서에 따라 다음 크기(12μm에서 0.3μm)로 변경하고 그 위에 수지 블록을 놓습니다.
- 물을 붓는 동안 수지 블록을 잡고 손으로 랩핑 필름의 표본 표면을 조심스럽게 연마합니다. 4.4단계와 같이 파편과 입자를 제거합니다.
- 4.5 - 4.8 단계를 반복하여 최종 연마 (0.3 μm)를 완료합니다. 최종 연마(0.3μm)를 완료한 후 시편은 경면 마감 표면을 가져야 합니다(그림 3A).
- 시편 표면을 에탄올(100%)로 세척하여 탈지 및 탈수하고 미세경도 테스트 전까지 수지 블록을 실온에서 보관합니다. 보관 중에는 과도한 습기와 먼지를 피하십시오. 5단계로 진행합니다.
5. 비커스 미세경도 시험
참고: 경면 마감 표면 시편의 압흔은 미세경도 시험기를 사용하여 수행됩니다. 테스트는 비커스 팁을 사용하여 10초 동안 25g의 하중으로 수행됩니다.
- 앞니에 대한 비커스 미세경도 시험(치과용 불소증 모델)
참고: 법랑질은 외부(구강 쪽)에서 내부(치수측)까지 3개의 층으로 나눌 수 있습니다. 즉, 표층, 중간층 및 심층(상아질-법랑질 접합부, DEJ)(그림 3B)16. 이 프로토콜에서는 세 개의 에나멜 층을 테스트합니다.- 적재 하중을 25g으로, 적재 시간을 10초로 설정합니다. 레진 블록을 스테이지에 놓습니다.
- 각 법랑질층(표재층, 중간층 및 DEJ)에서 6점을 들여놓고 각 영역(경추, 중간 및 끝부분)의 상아질을 압입합니다. 그림 3B).
- 두 대각선(d1 및 d2; 그림 3B) 비커스 미세경도 값(HV; 그림 4).
- 치조골에 대한 비커스 미세경도 시험(L-PBR 모델)
- 적재 하중을 25g으로, 적재 시간을 10초로 설정합니다. 레진 블록을 스테이지에 놓습니다.
- 치조골에서 치조골의 각 근심 및 원위부에 3-6점을 들여냅니다. 1번째와 2번째 어금니(흰색 사각형) 사이의 치조골과 2번째와 3번째 어금니 사이를 들여냅니다.
참고: 이 프로토콜에서는 대조군(온전한) 본에 대해 각 내측 및 원위측의 6점(총 12점)을 평가하고, L-PBR에 대해 각 측의 3점(총 6점)을 평가했습니다. 함몰 지점의 수는 병변의 상태에 따라 다릅니다(예: 뼈 손실이 너무 많으면 함몰 영역이 제한됨).
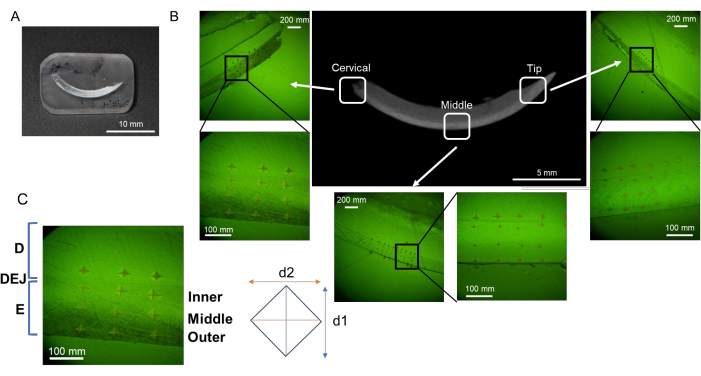
그림 3: 하악 절치의 미세경도 평가 영역. (A) 하악 절치를 포함하는 경면 마감 표면 샘플. (B) 각 영역의 들여쓰기; 자궁 경부, 중간 및 끝 부분 (NaF 0 ppm). (C) 3 개의 에나멜 층; DEJ, 내부, 중간 및 외부 에나멜에서. 약어: D = dentin, E = enamel, DEJ = dentin enamel junction 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
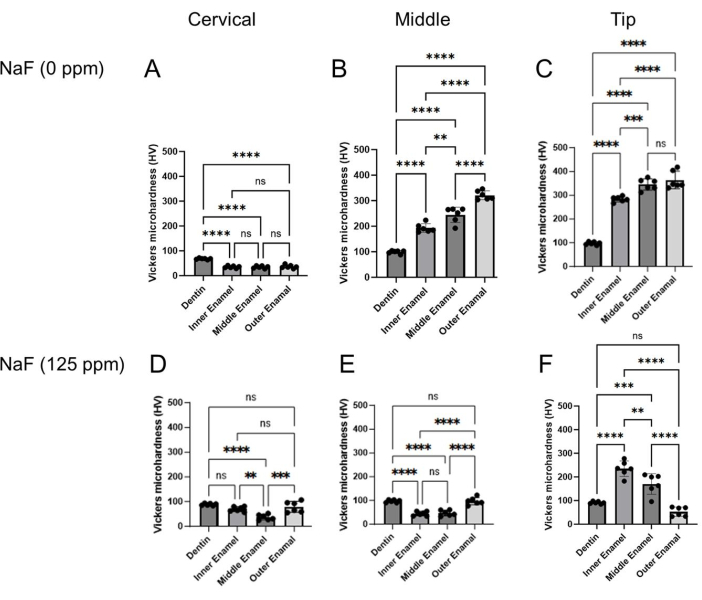
그림 4: NaF의 유무에 관계없이 처리된 에나멜의 비커스 미세 경도. 상아질과 3개의 법랑질층의 미세경도를 각 영역, 자궁경부, 중간, 끝 영역에서 평가했습니다. (A-C) 제어 및 (DF) NaF(125ppm) 처리. 데이터는 평균 ± SD로 표시되며, 유의한 차이는 Tukey의 사후 검정을 사용한 일원 분산 분석으로 평가되었습니다. p 값이 0.05< 통계적으로 유의한 것으로 간주되었습니다. **p < 0.005, ***p < 0.0005, ****p < 0.0001 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
결과
치아 불소증 모델: 그림 1은 대조군 및 불소 처리된 마우스의 앞니의 대표적인 μCT 이미지를 보여줍니다. 대조군(그림 1B-D)에서 자궁경부 부위는 중간(1.924g/cm3) 및 끝부분(1.819g/cm3)에 비해 1.188g/cm3(그림 1B)의 낮은 법랑질 미네랄 밀도(EMD)를 보였습니다. 그림 1C,D
토론
미세경도는 치아 및 뼈와 같은 경질 조직의 기계적 특성을 평가하기 위해 수행됩니다. 현재까지 다양한 미세경도 측정 방법이 보고되었습니다. 대부분의 측정 정보, 특히 시료 전처리 및 압흔 부위는 불충분할 수 있습니다. 이 연구는 치과 불소증 및 치주 질환 모델에서 법랑질 및 폐포 뼈에 대한 미세 경도 프로토콜에 중점을 두었습니다. 일관되고 정확한 결과를 얻기 위해 이 프로토콜의 중요한 ...
공개
저자는 이해 상충이 없음을 선언합니다.
감사의 말
이 간행물에 보고된 연구는 JSPS KAKENHI JP21K09915(MO) 및 National Institute of General Medical Sciences의 지원을 받았습니다. T34GM145509 (MM) 및 국립 치과 및 두개안면 연구소 (National Institute of Dental and Craniofacial Research); R01DE025255 및 R21DE032156(XH); R01DE029709, R21DE028715 및 R15DE027851(TK); R01DE027648 및 K02DE029531(MS).
자료
| Name | Company | Catalog Number | Comments |
| Braided Silk Suture 6-0 | Teleflex | ||
| Canica Small Animal Surgery System | Kent Scientific Corporation | SURGI 5001 | |
| CarbiMet PSA 120/P120 | Buehler | 30080120 | |
| CarbiMet PSA 60/P60 | Buehler | 36080060 | |
| CarbiMet PSA 600/P1200 | Buehler | 36080600 | |
| Castroviejo Micro Needle hilder | F.S.T | 12060-01 | |
| Epofix cold setting embeding Resin | Electron Microscopey Science | CAT-1237 | |
| Fisherbrand 112xx Series Advanced Ultrasonic Cleaner | Fisher Brand | FB11201 | |
| Fluoride-free Rodent diet | Bio Serv | F1515 | AIN-76A, 1/2" Pellets |
| in-vivo microCT Skyscan 1176 | Bruker | ||
| Isomet 1000 Precison saw | Buehler | MA112180 | |
| Lapping film 0.3µm | Maruto instrument co, LTD. Japan | 26-4203 | Alternative A3-0.3 SHT, 3M USA |
| Lapping film 1µm | Maruto instrument co, LTD. Japan | 26-4206 | Alternative A3-1 SHT, 3M USA |
| Lapping film 12µm | Maruto instrument co, LTD. Japan | 26-4211 | Alternative A3-12 SHT, 3M USA |
| Lapping film 3µm | Maruto instrument co, LTD. Japan | 26-4204 | Alternative A3-3 SHT, 3M USA |
| Lapping film 9µm | Maruto instrument co, LTD. Japan | 26-4201 | Alternative A3-9 SHT, 3M USA |
| Leica wild microscope | Leica | LEIC M690 | |
| Metaserv 2000 Variable speed Grinder polisher | Buehler | No: 557-MG1-1160 | |
| MicroCut PSA 1200/P2500 | Buehler | 36081200 | |
| MicroCut PSA P4000 | Buehler | 36084000 | |
| Microhardness tester, ALPHA-MHT-1000Z | PACE Technologies | ||
| SamplKups 1 inch | Buehler | No: 209178 | |
| Sodium Fluoride | Fisher Scientific | S299-100 | |
| West cott Stitch Scissor | JEDMED | Cat. #25-1180 | |
| ZooMed Repti Thern Undertank heater (U.T.H) | Zoo Med Laboratories, Inc. | RH-4 |
참고문헌
- Broitman, E. Indentation hardness measurements at macro-, micro-, and nanoscale: A critical overview. Tribol Lett. 65 (1), 23 (2017).
- Lee, M. J., et al. Sirt6 activation ameliorates inflammatory bone loss in ligature-induced periodontitis in mice. Int J Mol Sci. 24 (13), 10714 (2023).
- Min, J., et al. Investigation on the gradient nanomechanical behavior of dental fluorosis enamel. Nanoscale Res Lett. 13 (1), 347 (2018).
- Craig, R. G., Peyton, F. A. The micro-hardness of enamel and dentin. J Dent Res. 37 (4), 661-668 (1958).
- Chun, K., Choi, H., Lee, J. Comparison of mechanical property and role between enamel and dentin in the human teeth. J Dent Biomech. 5, (2014).
- Suzuki, M., Everett, E. T., Whitford, G. M., Bartlett, J. D. 4-phenylbutyrate mitigates fluoride-induced cytotoxicity in alc cells. Front Physiol. 8, 302 (2017).
- Sharma, R., et al. Assessment of dental fluorosis in mmp20 +/- mice. J Dent Res. 90 (6), 788-792 (2011).
- Wu, W. W., et al. Bone hardness of different anatomical regions of human radius and its impact on the pullout strength of screws. Orthop Surg. 11 (2), 270-276 (2019).
- Li, S., et al. Atlas of human skeleton hardness obtained using the micro-indentation technique. Orthop Surg. 13 (4), 1417-1422 (2021).
- Ibrahim, A., et al. Hardness an important indicator of bone quality, and the role of collagen in bone hardness. J Funct Biomater. 11 (4), 85 (2020).
- Vandana, K. L., Srishti Raj, B., Desai, R. Dental fluorosis and periodontium: An original research report of in vitro and in vivo institutional studies. Biol Trace Elem Res. 199 (10), 3579-3592 (2021).
- Xia, P. F., et al. Microcarriers containing "hypoxia-engine" for simultaneous enhanced osteogenesis and angiogenesis. Chemical Engineering Journal. 456, 141014 (2023).
- Chiu, R., et al. Effects of biglycan on physico-chemical properties of ligament-mineralized tissue attachment sites. Arch Oral Biol. 57 (2), 177-187 (2012).
- Leong, N. L., et al. Age-related adaptation of bone-pdl-tooth complex: Rattus-norvegicus as a model system. PLoS One. 7 (4), e35980 (2012).
- Johnson, W. M., Rapoff, A. J. Microindentation in bone: Hardness variation with five independent variables. J Mater Sci Mater Med. 18 (4), 591-597 (2007).
- Kweon, Y. S., et al. Effects of fam83h overexpression on enamel and dentine formation. Arch Oral Biol. 58 (9), 1148-1154 (2013).
- Boivin, G., et al. The role of mineralization and organic matrix in the microhardness of bone tissue from controls and osteoporotic patients. Bone. 43 (3), 532-538 (2008).
- Okamoto, M., et al. Microstructural evaluation of the mineralized apical barrier induced by a calcium hydroxide paste containing iodoform: A case report. J Endod. 2 (2), 243-251 (2024).
- Wang, Y., et al. B10 cells alleviate periodontal bone loss in experimental periodontitis. Infect Immun. 85 (9), e00335 (2017).
- Chen, Y., et al. Nlrp3 regulates alveolar bone loss in ligature-induced periodontitis by promoting osteoclastic differentiation. Cell Prolif. 54 (2), e12973 (2021).
- Robinson, J. W., et al. Male mice with elevated c-type natriuretic peptide-dependent guanylyl cyclase-b activity have increased osteoblasts, bone mass and bone strength. Bone. 135, 115320 (2020).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유