JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
저비용 Epimysial Electromysial Electromyography Electroode 개발: 제조 및 테스트를 위한 간소화된 워크플로우
요약
우리의 목적은 epimysial electromysial electromyography 전극의 제조 및 테스트에 대한 업데이트되고 따라하기 쉬운 가이드를 제공하는 것이었습니다. 이를 위해 재료 소싱에 대한 지침과 제조 및 테스트 프로세스에 대한 자세한 안내를 제공합니다.
초록
근전도(EMG)는 신경근 이상을 감지하는 데 유용한 진단 도구입니다. 이식 가능한 epimysial 전극은 일반적으로 전임상 모델에서 EMG 신호를 측정하는 데 사용됩니다. epimysial electrode fabrication의 원리를 설명하는 고전적 자료가 존재하지만, 전극 이론을 실제 사례로 번역하는 예시 정보는 드뭅니다. 이 문제를 해결하기 위해 저비용 epimysial 전극 제조 및 테스트에 대한 업데이트되고 따라하기 쉬운 가이드를 제공합니다.
전극은 두 개의 백금-이리듐 호일을 접고 미리 절단된 실리콘 베이스에 삽입하여 접촉면을 형성하여 만들었습니다. 다음으로, 코팅된 스테인리스강 와이어를 각 접촉면에 용접하여 전극 리드를 형성했습니다. 마지막으로 실리콘 혼합물을 사용하여 전극을 밀봉했습니다. 식 염수에서 맞춤형 제작 전극을 산업 표준 전극과 비교하기 위해 생체 외 테스트를 수행했으며, 모든 파형에서 높은 수준의 신호 일치(사인파[클래스 내 상관 - ICC= 0.993], 정사각형[ICC = 0.995], 삼각형[ICC = 0.958]) 및 시간 동시성(사인 [r = 0.987], 정사각형[r = 0.990], 삼각형 [r= 0.931])이 발견되었습니다. 낮은 수준의 전극 임피던스는 또한 전기화학적 임피던스 분광법을 통해 정량화되었습니다.
생체 내 성능 평가도 수행되어 쥐의 광대 외측 근육을 맞춤형 전극으로 외과적으로 계측하고 오르막 및 내리막 보행 중에 신호를 획득했습니다. 예상대로 최대 EMG 활성도는 오르막길(0.031 ± 0.180mV, p = 0.005)보다 내리막 걷기(0.008 ± 0.005mV)에서 현저히 낮았으며, 이는 장치의 유효성을 뒷받침합니다. 장치의 신뢰성과 생체 적합성은 이식 후 14일 및 56일째(각각 0.01 ± 0.007mV, 0.012 ± 0.007mV, p > 0.05)에 수평 보행 중 일관된 신호 전달과 조직학적 염증의 부재에 의해 뒷받침되었습니다. 총체적으로, 우리는 저비용 epimysial 전극의 제조 및 테스트를 위한 업데이트된 워크플로우를 제공합니다.
서문
근전도(EMG)는 근육의 전기적 활동을 연구하기 위한 강력한 도구입니다. EMG 기록은 신경근 기능 장애를 치료하기 위한 중재의 효과를 평가하기 위해 전임상 동물 모델에서 특히 유용할 수 있습니다. 이러한 모델에서는 이식 가능한 생체 적합성 전극을 사용하여 운동 뉴런과 근육 섬유 사이의 신경 생리학적 인터페이스를 평가합니다. 이러한 이식형 전극은 근육 흥분에 대한 국부적인 측정을 제공할 수 있으며 구성, 모양 및 재료 측면에서 다양할 수 있으며 궁극적으로 위치와 의도된 용도에 따라 최적의 설계가 결정됩니다.
전임상 모델에서 근육 흥분을 평가하기 위한 적합성에도 불구하고 상피 전극의 사용은 비용에 의해 제한될 수 있습니다. 그 결과, 많은 연구자들이 사내에서 생산된 맞춤형 상피 전극을 사용합니다. 전극 제조, 테스트 및 사용에 대한 기본 고려 사항을 자세히 설명하는 리소스가 존재하지만(1,2), 현대적인 방법을 사용하여 상부 전극의 소싱, 제조 및 검증을 자세히 설명하는 업데이트된 교육 가이드가 필요합니다. Loeb 및 Gans3 및 기타 전극 이론의 기초 연구에 영향을 받아 저비용 epimysial 전극의 소싱 및 제조에 대한 현대적인 지침을 제시하고 일련의 ex vivo 및 in vivo 실험에서 성능을 테스트합니다. 목표는 과학계의 다른 사람들이 동물용 저비용 상부 전극을 사내에서 소싱, 제조 및 테스트할 수 있도록 사용자 친화적인 가이드를 제공하여 전임상 모델에서 근육 흥분을 보다 광범위하게 정량화할 수 있도록 하는 것입니다.
이 프로토콜에서는 현대 전기 생리학 실험실에서 동물용 상피 전극의 소싱, 제조 및 테스트에 대한 교육 가이드를 제공합니다. 모양, 치수, 접촉 표면적, 전극 간 거리, 리드 길이 등과 같은 제조를 위해 선택된 전극 매개변수는 당사의 실험적 요구 사항에 맞게 선택되었으며 상업적으로 이용 가능한 산업 표준 상부 전극과 유사했습니다( 재료 표 참조). 우리는 다른 그룹이 사용 사례와 일치하는 신뢰할 수 있는 산업 표준 전극을 선택하는 것 외에도 필요에 맞게 이러한 매개변수를 수정하도록 권장합니다.
독자가 전극 성능을 비교적 빠르게 이해할 수 있도록 하기 위한 노력의 일환으로, 전극 임피던스 측정 옵션이 있는 생체 외 테스트 프로토콜의 예도 제공합니다. 또한 in vivo 전극 성능에 대한 평가 예를 제공합니다. ex vivo 실험에서는 안정적인 생리적 조건을 모방하기 위해 맞춤형 제작 전극을 식염수 수조의 산업 표준과 비교했습니다. 임피던스는 또한 전기화학적 임피던스 분광법(EIS)을 통해 생체 외 에서 평가되었습니다. 생체 내 실험은 16주 된 암컷 Long Evans 쥐(HsdBlu: LE, Envigo)의 광대(VL) 근육에 맞춤형 전극을 외과적으로 이식하여 높거나 낮은 신호(오르막, 내리막 걷기)를 유도하는 것으로 알려진 조건에서 EMG 신호를 측정하는 것으로 구성되었습니다. 맞춤형 전극의 신뢰성을 평가하기 위해 EMG 신호는 완전한 수술 회복 후 및 희생 전(각각 이식 후 14일 및 56일) 수평 보행 중에 획득되었습니다. Hematoxylin-eosin(H&E) 염색은 맞춤형 전극의 생체 적합성을 평가하기 위해 계장화된 근육에 대해 수행되었습니다.
Access restricted. Please log in or start a trial to view this content.
프로토콜
in vivo 절차는 University of Michigan의 Institutional Animal Care & Use Committee(IACUC 승인 #PRO00010765)의 승인 하에 수행되었으며 실험실 동물의 관리 및 사용에 대한 National Institutes of Health 지침에 따라 수행되었습니다.
1. 전극 소싱 및 제작
참고: 그림 1 은 추가 시각적 지침을 제공하는 QR 링크와 함께 모든 주요 제조 단계에 대한 개략적인 요약을 제공합니다.
- 제조를 위해 제조업체에서 직접 생체 적합성 전극 재료를 대량으로 공급합니다. 모든 전극 구성 요소와 소싱에 대한 세부 정보가 포함된 재료 표를 참조하십시오.
알림: 실리콘 베이스, 실리콘 실란트 및 백금-이리듐 접촉 호일이 생체 적합성이 있어 부작용 면역 반응을 피하고 만성 이식을 허용하는지 확인하십시오. 자체 제작의 경제적 이점을 지원하기 위해 산업 표준과 비교하여 맞춤형 가공 epimysial 전극에 대한 자세한 비용 분석을 제시합니다(재료 표). - 절단 및 접는 지그(보충 파일 1, 보충 파일 2)를 준비합니다. 선택한 3D 프린팅 소프트웨어를 사용하여 동일한 epimysial 전극의 배치 생산을 위한 절단 및 접는 지그를 설계하십시오.
- 모든 전극에서 동일한 접촉 표면적과 전극 간 거리를 위해 실리콘 베이스의 일관된 크기와 간격의 천공을 보장하도록 절단 지그를 설계합니다.
- 폴딩 지그를 만들어 백금-이리듐 접촉면을 접고 실리콘 베이스에 호일을 간단하게 배치합니다.
참고 : Gcode 파일이 제공됩니다. 실험적 요구 사항에 맞게 절단 및 접이식 지그의 치수와 사양을 수정합니다.
- 실리콘 베이스에 구멍을 뚫습니다. 커팅 지그에 실리콘 베이스를 놓고 테이프로 붙입니다. 접촉 포일을 배치하기 위해 X-acto 나이프를 사용하여 절단 지그의 가이드를 사용하여 실리콘을 천공합니다.
- 호일을 실리콘 베이스에 삽입하여 접촉면을 형성합니다. 생체 적합성이 있고 미리 절단된 백금-이리듐 접촉 포일(1.25mm x 5mm)을 접이식 지그를 사용하여 U자형으로 접습니다. 다음으로, 접힌 호일의 암을 실리콘 베이스의 천공된 슬롯으로 안내하여 전극의 접촉면을 구성합니다. 이런 식으로 12개의 호일을 모두 실리콘 베이스에 삽입합니다. 적절한 간격을 확보하기 위해 전극 사이에 단일 열을 열어 두십시오.
알림: 이 구성을 사용하면 6개의 양극성 epimysial 전극을 제작할 수 있습니다. 필요한 경우 커팅 지그를 편집하여 용량을 확장할 수 있습니다. - 커팅 지그에서 실리콘 베이스를 제거합니다. 호일을 제자리에 고정하기 위해 접촉면 위에 수술용 테이프를 붙입니다. 다음으로, 커팅 지그에서 실리콘 베이스를 제거하고 U자형 호일의 암이 노출되도록 뒤집은 다음 U자형 호일의 한쪽 암을 실리콘 베이스와 같은 높이로 접습니다.
- 전극 리드를 연결합니다. PFA(Perfluoroalkoxy) 코팅된 스테인리스 강선을 원하는 길이로 절단하여 준비합니다. 다음으로, 시중에서 판매되는 라이터를 사용하여 스테인리스 강선의 한쪽 끝을 ~ 1cm 정도 제거합니다. 스테인리스강 와이어의 돌출된 끝을 호일의 펼쳐진 암 안쪽에 놓습니다. Micro TIG 용접기를 사용하여 스테인리스 강선을 호일 암에 용접합니다(펄스 폭 = 0, 용접 에너지 = 25).
- 납-호일 인터페이스를 검사합니다. 스테인리스 스틸 와이어에 장력을 가하여 와이어-호일 연결을 테스트합니다. 연결이 유지되면 호일의 암을 실리콘 베이스와 같은 높이로 접고 실리콘 시트와 경계를 이루는 테이프를 제거합니다.
참고: 지정된 사용 사례에 적용된 장력을 나타내는 장력을 적용합니다. - 전극을 밀봉합니다. 더 묽은 농도를 얻으려면 생체적합성 액상 실리콘 1g과 톨루엔 0.75mL를 섞습니다. 18G 뭉툭한 끝 주사기를 사용하여 혼합물을 끌어올리고 각 전극의 용접된 면에 적용하여 전극 뒷면을 밀봉합니다.
주의: 톨루엔은 가연성이며 삼키거나 기도로 들어가 피부 자극을 일으키면 치명적일 수 있습니다. 흄 후드 아래에서 작업하고 화염으로부터 멀리 두십시오. - 배치를 개별 전극으로 분리합니다. 전극을 다루기 전에 실리콘-톨루엔을 72시간 동안 굳히십시오. 그런 다음 가위를 사용하여 실리콘 베이스를 10 x 5mm 크기의 개별 전극으로 자릅니다.
알림: 전극 크기는 절단 지그의 치수와 특정 사용 사례에 따라 다릅니다. 초음파 수조에서 오토클레이브 및/또는 깨끗한 전극.
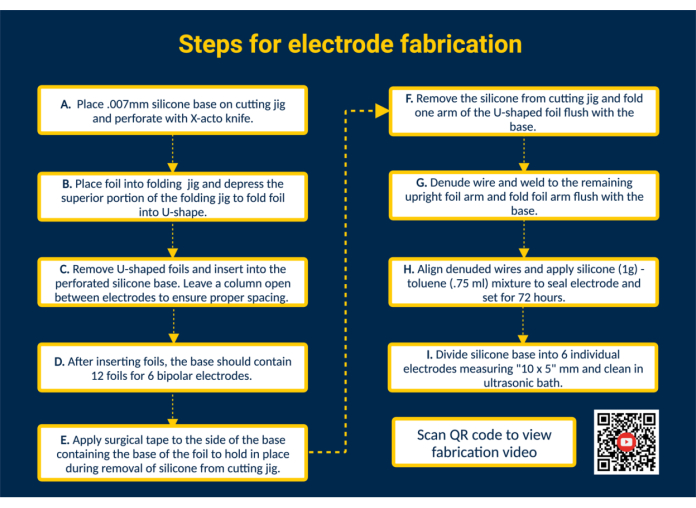
그림 1. 전극 제작 단계. (A) 실리콘 베이스에 구멍을 뚫습니다. (B) 폴딩 지그를 사용하여 U자형 포일을 형성합니다. (C) 구멍이 뚫린 실리콘 베이스에 U자형 호일을 삽입합니다. (D) 실리콘 베이스에는 6개의 양극 전극을 형성하는 12개의 호일이 포함되어 있습니다. (E) 커팅 지그에서 제거하는 동안 포일을 고정하기 위해 베이스에 수술용 테이프를 붙입니다. (F) 커팅 지그에서 실리콘 베이스를 제거합니다. (G) PFA 코팅된 스테인리스 강선을 제거하고 Micro TIG 용접기를 사용하여 직립 호일 암에 용접합니다. (H) 제거된 전선을 정렬하고 실리콘-톨루엔 실런트를 바르고 고정시킵니다. (I) 실리콘 베이스를 개별 전극으로 나누고 초음파 수조에서 세척합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
2. Ex vivo testing
- 녹음 장치에 전극을 연결합니다. 각 전극 리드선을 전극 인터페이스 보드(EIB)의 채널에 핀합니다. 비교를 위해 선택한 산업 표준 전극에 대해 이 단계를 반복합니다(동일한 EIB 사용). 마그네틱 테더 케이블 시스템을 통해 EIB를 데이터 수집 플랫폼에 연결합니다.
알림: 산업 표준 전극은 신뢰할 수 있고 실험적 요구에 적합한 것으로 간주되는 모든 전극이 될 수 있습니다. - EIB를 접지합니다. PFA 코팅된 스테인리스강의 한쪽 끝을 탈착하고 접지 소스(예: 스테인리스강 나사)에 스폿 용접합니다. 접지 리드선을 지정된 "접지" 위치에서 동일한 전극 인터페이스 보드에 핀합니다.
- 식염수를 설정합니다. 유리 비커(250mL)에 생리식염수 180mL(0.9% 멸균 식염수)를 채웁니다.4. 맞춤 제작 및 산업 표준 epimysial 전극을 식염수조에 담그고 안정적인 위치에 고정합니다. 다음으로, 접지 소스를 식염수에 담그고 그 위치를 고정합니다. 마지막으로 식염수에 두 개의 자극 바늘 전극을 담그고 부착하고 자극 전극을 신호 발생기에 연결합니다.
- 신호 발생기를 사용하여 신호 일치와 시간적 동기화를 평가할 수 있습니다. 신호 발생기를 사용하여 선택한 전압 및 주파수(0.1V 및 5Hz)에서 자극 전극을 통해 식염수로 반복된 파형을 전달합니다(그림 2). 다양한 파형(사인파, 사각파, 삼각파)을 전달하여 산업 표준을 기준으로 맞춤 제작된 상피 전극 간에 기록된 신호를 비교합니다.
- 비공식적이고 시각적으로 실시간으로 성능을 평가하여 전극 간의 신호가 변하는 정도를 평가합니다. ICC(intra-class correlations) 및 Pearson 상관관계를 수행하여 각각 신호 일치와 시간적 동기화를 평가합니다.
참고: 분석을 위해 4,000Hz에서 8,000개의 샘플을 획득하고 고역 및 저역 통과 버터워스 필터(고역 통과 = 75Hz, 저역 통과 = 2kHz)로 실시간으로 필터링했습니다. - 전극 임피던스를 측정합니다. 전극 임피던스를 측정하려면 Richie et al.이 아래에 설명한 절차를 사용하여 전위차 조절기를 사용하여 10Hz-31kHz5 주파수에서 맞춤형 전극(예: 10개의 전극)에서 EIS를 수집합니다.6. 바이폴라 전극의 전극 임피던스 측정에 대한 추가 정보는 Sarolic et al.을 참조하십시오7.
- Richie et al.의 절차에 따라 상피 전극 1mm를 1x 인산염 완충 식염수(PBS)에 담그십시오. 염화은(Ag|AgCl) 기준 전극과 스테인리스강 막대를 상대 전극으로 하여 회로를 완성합니다.
- Ag 중단|비커 클램프를 사용하여 1x PBS의 AgCl 기준 전극 및 스테인리스강 막대. 기준 전극을 사용 중인 임피던스 시스템의 기준에 연결하고 사용 중인 임피던스 시스템의 상대 전극 입력에 연결합니다.
- 전위차 조절기를 사용하여 1kHz 임피던스 스캔을 실행합니다. 단일 사인 파형에서 0.01 Vrms 에서 1 kHz 스캔 주파수로 설정합니다. 스캔의 처음 5초 동안 전위차 조절기를 0V로 설정하여 기록된 신호를 안정화합니다. potentiostat 관련 소프트웨어를 사용하여 측정값을 기록합니다.
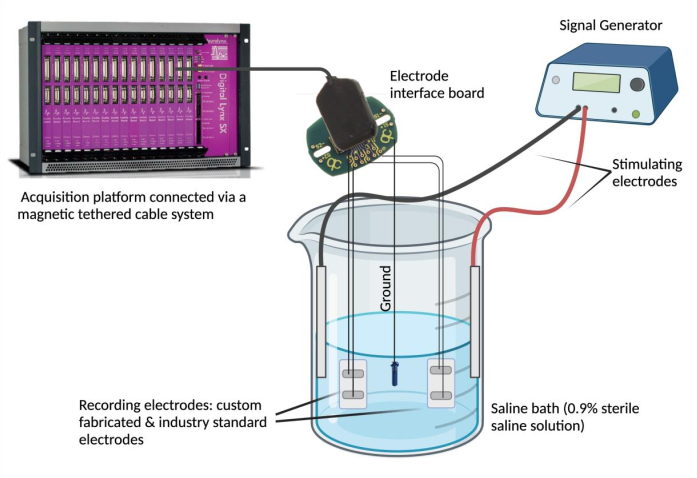
그림 2: Ex vivo testing: 맞춤형 제작 전극, 산업 표준 전극, 2개의 자극 전극 및 접지 소스를 포함하는 식염수조. 신호 일치와 시간적 동기화는 신호 발생기에서 사인파, 사각파 및 삼각파를 식염수로 전달하고 데이터 수집 플랫폼을 사용하여 각 전극에서 감지된 파형을 기록하여 평가되었습니다. 참고: 전기화학 임피던스 분광법은 그림에 나와 있지 않습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
3. 인체 적용 테스트
참고: in vivo testing 절차는 실험적 사용 사례를 설명합니다. 맞춤 제작된 epimysial 전극은 사용자가 의도한 실험 조건과 일치하는 방식으로 in vivo 에서 테스트하는 것이 좋습니다.
- 수술 정보를 검토하십시오. 만성 신경 기록 전극을 이식하는 과정을 배우는 외과 의사를 위한 정보를 다음 리소스를 사용하여 정보를 참조하십시오 8,9.
참고: 우리 원고의 초점이 전극 제조 및 테스트에 있다는 점을 감안할 때, 여기서는 생체 내 전극 테스트를 위해 실험실에서 사용되는 수술 기술에 대한 간략한 개요만 제공합니다. - 계측할 쥐를 선택합니다(예: 16주 된 암컷 Long Evans 쥐). 트레드밀 적응 전에 쥐가 1주일의 실험실 적응 기간을 거치도록 합니다. 실험실 적응 후 쥐를 최대 16m/min의 증가 속도로 설치류 러닝머신에 점차적으로 노출시킵니다.
- 먼저 각 전극 리드를 EIB의 채널에 고정하여 맞춤형 제작 상부 전극을 EIB에 부착하여 EIB를 준비합니다. EIB를 접지하려면 PFA 코팅된 스테인리스강 와이어의 한쪽 끝을 디노딩하고 선택한 접지(예: 스테인리스강 나사)에 스폿 용접합니다. 그런 다음 접지 리드선을 지정된 "접지" 위치의 동일한 EIB에 고정합니다.
알림: 계측 중에 전극을 보호하려면 보호 덮개(예: 파라필름)로 감싸십시오. - 시작하기 전에 모든 수술 도구와 수술 부위를 소독하십시오. 밀봉된 무균 수술 용품을 사용하고 멸균 포장되지 않은 모든 수술 기구를 고압멸균하십시오. 수술용 드레이프를 사용하여 멸균 수술 필드를 만듭니다.
- 3-5% 이소플루란과 1L/min 산소가 있는 유도 챔버를 사용하여 동물을 마취하고 쥐를 준비하는 동안 2% 이소플루란과 500mL 산소가 있는 노즈 콘을 통해 유지합니다. 마취 수술 평면에 도달한 후 발가락 꼬집을 통해 평가하고, 안연고를 바르고, 호흡수(70-110회 호흡/분)를 모니터링하고, 직장 프로브를 사용하여 심부 온도를 평가합니다.
- 다음으로 동물 가위로 수술 부위를 면도하고 수술 부위의 이물질을 제거합니다. 수술 부위를 면도한 후에는 클로르헥시딘, 이소프로필 알코올, 포비돈 요오드를 사용하여 수술 부위 중앙에서 바깥쪽으로 문질러 수술 부위를 소독합니다. 적절하고 승인된 진통제를 투여하고 심부 체온(37.5-38.5°C)을 유지하기 위해 열을 공급합니다. 준비 후, 쥐를 정위 프레임에 놓고 무균 필드를 설정합니다.
- 외과 의사의 적절한 수술 준비를 위해 비누 및/또는 소독제(클로르헥시딘)를 사용하여 손을 철저히 씻으십시오. 적절한 PPE 착용: 마스크, 멸균 장갑, 일회용 가운/스크럽 상의. 어떤 이유로든 무균 기술을 위반하는 경우 새 멸균 장갑을 착용하십시오.
- 오른쪽 VL을 기구로 만들려면 메스를 사용하여 오른쪽 뒷다리의 전방 부분을 3-5cm 절개하고 둔한 절개를 사용하여 VL 근육을 식별합니다.
- 관상 봉합사를 따라 1cm의 시상면을 절개하고 두개골을 노출시킵니다. 얇은 집게를 사용하여 오른쪽 뒷다리에서 두개골 기저부까지 피하 터널을 만듭니다. 집게를 사용하여 전극을 잡고 전극을 VL로 배선합니다.
- 뼈 드릴을 사용하여 calvaria에 구멍을 만듭니다(드릴 사양이 접지 나사의 사양과 일치하는지 확인). 접지 나사를 고정하고 치과용 시멘트를 사용하여 EIB를 두개골에 부착합니다.
알림: 소량의 과산화수소를 적용하여 두개골의 다공성을 증가시키고 치과용 시멘트의 접착력을 향상시킬 수 있습니다. - VL 근육을 확인한 후 4-0 비흡수성 모노필라멘트를 사용하여 근육 섬유에 따라 이식된 맞춤형 상부 전극을 이식합니다. 상처 클립을 사용하거나 봉합하여 절개 부위를 봉합합니다.
- 봉제 후에는 동물을 마취에서 제거하고 깨끗하고 건조한 동물 케이지에 개별적으로 보관하십시오. 쥐가 가열된 패드에서 회복하도록 하고 동물이 보행할 수 있을 때까지 15분마다 쥐의 체온과 호흡수를 모니터링합니다. 수술 후 통증을 치료하려면 기구 사용 후 며칠 동안 승인된 진통제를 투여합니다.
참고: 쥐는 완전히 회복될 때까지 개별적으로 수용해야 합니다. - 14일 후 생체 내 전극 검사를 수행하여 근육 활동의 생리적 변화를 포착하기 위해 맞춤 제작된 상부 전극의 유효성을 평가합니다. 계측된 쥐를 설치류 트레드밀에 놓고 VL EMG 신호의 증가 또는 감소를 유도하는 오르막 및 내리막 보행 조건에 무작위로 노출시킵니다(16° 경사, 16미터/분에서 16° 감소). 종적 데이터(예: 계측 후 14일 및 56일)를 수집하여 시간 경과에 따른 신뢰성을 보장합니다.
참고: 14일 및 56일 평가는 14일의 기간이 완전한 수술 회복을 허용하고 56일의 기간이 실험 일정을 초과하기 때문에 선택되었습니다. 우리는 다른 사람들이 사용하기 전에 실험 타임라인을 복제하는 기간을 사용하여 전극 성능과 신뢰성을 테스트하도록 권장합니다. 속도(16m/min) 및 보행 조건(16° 경사, 16° 감소)은 이 모델10에서 VL 여자의 증가 및 감소의 확립된 조건과 일치하도록 선택되었습니다. - 실험 요구 사항에 맞게 획득 파라미터를 수정합니다. 데이터 수집 플랫폼을 사용하여 2,000Hz의 속도로 보행 중 EMG 신호를 캡처하고 모션 캡처 시스템과 동기화합니다.
참고: 다른 획득 장치를 사용하는 경우 제조업체의 지침에 따라 실험 요구 사항을 충족하기 위해 EMG 및 모션 캡처를 수집하십시오. - 각 보행 조건에서 25초의 보행 데이터를 추출하고 추가 신호 처리 및 분석을 위해 사용자 지정 Python 스크립트로 내보냅니다. 기준선 조정(0), 수정 및 평활화는 50ms bin 너비의 평균 제곱근 알고리즘을 사용합니다. 피크 검출 알고리즘을 적용하여 후속 데이터 분석에 활용할 RMS-EMG 피크를 선택합니다.
참고: 이 단계는 프로그래밍 언어와 EMG 수집 소프트웨어 및 하드웨어로 인해 크게 다르기 때문에 EMG 데이터를 사전 처리하고 분석하는 방법을 간략하게 설명했습니다. 저자는 추가 정보를 위해 다음 리소스를 참조할 것을 권장합니다 3,11,12,13.
4. 생체 적합성 테스트
- 종적 EMG 수집이 끝난 후(또는 선택한 시점에) 적절하고 승인된 방법(예: CO2 를 사용한 질식 후 양측 개흉술)을 사용하여 쥐를 안락사시킵니다.
- 안락사 후 전외측 우측 및 좌측 뒷다리를 절개하여 양측 VL 근육을 추출합니다. 액체 질소에 급속 냉동하고 -80°C에서 보관합니다.
알림: 추출하는 동안 전극이 기구화된 근육(예: 오른쪽 VL)의 제자리에 있도록 주의하십시오. 또는 하위 전극 영역을 표시하거나 하위 전극 영역에서 근육만 추출합니다. 이것은 반대측/조절 근육에는 적용되지 않습니다. - 저온 유지 장치를 사용하여 전극-근막 계면 바로 아래 영역에서 연속 근육 단면(7μm)을 절단합니다. 반대측 VL의 근육 배에서 부분을 잘라 대조군 역할을 합니다. 동결 절제술에 대한 자세한 내용은 Kumar et al.을 참조하십시오14.
- Hematoxylin & Eosin (H&E)를 가진 염색; 골격근 단면의 H&E 염색에 대한 자세한 내용은 Wang et al.을 참조하십시오15.
- 20x 배율의 광학 현미경을 사용하여 염색된 부분(계장 및 대조군)을 검사합니다. 샘플의 출처에 대한 맹목적으로 조직학적 변화를 분석합니다. 다음과 같은 병리학적 특징을 사용하여 평가된 조직 건강을 평가합니다: 면역 세포 침윤, 내부 근핵 축적, 섬유 형성 및 유육종 단편화.
5. 제안된 통계 분석
- 산업 표준과 비교하여 맞춤 제작된 상피 전극의 성능을 평가하려면 생체 외 데이터를 선택한 통계 패키지로 가져오십시오. 맞춤형 제작 및 산업 표준 전극에서 수집된 생체 외 데이터(예: 사인파, 삼각파 및 사각 파형의 대표 샘플 8,000개)에 다음 통계 테스트를 적용합니다. p ≤ 0.05에서 알파 수준을 선험적으로 설정합니다.
- 전극 간의 신호 합치 수준을 테스트하려면 ICC(Intraclass Correlations)와 Bland-Altman 플롯을 사용하십시오. ICC 추정치와 95% 신뢰 구간을 단일 등급(k = 2), 절대 합치, 2-way 랜덤 효과 모델을 기반으로 계산합니다.
- 시간 동기화라고도 하는 시간 경과에 따른 파형 기록이 공변하는 정도를 테스트하려면 맞춤형 전극 및 산업 표준 전극으로 수집된 값에 대해 Pearson 상관 관계를 수행합니다.
- 선택한 맞춤형 제작 전극(예: 10개 전극)의 두 접촉면(1kHz에서 측정)에 대한 평균 전극 임피던스를 산업 표준 전극의 임피던스와 비교합니다.
알림: 전극 임피던스 값은 전극 제조 중에 사용되는 사용 사례와 재료에 따라 다릅니다.
- 생체 내 기록의 품질을 평가하려면 트레드밀 보행 중에 수집된 데이터를 선택한 통계 패키지로 가져옵니다.
- in vivo 테스트(근육 활동의 생리적 변화를 유도하기 위해 오르막 및 내리막 보행을 통해 쥐의 걸음걸이를 교란한 경우) 동안 맞춤형 전극의 유효성을 평가하기 위해 Welch의 t-test를 수행하여 오르막 및 내리막 보행 조건의 평균 피크 값을 비교합니다.
참고: 독자는 간결성16을 위해 여기에 제시되지 않은 추가 테스트 및 분석(예: 신호 대 잡음비(SNR) 평가, EMG 신호 수집의 Delysys 기본 개념 참조)을 수행하는 것이 좋습니다. - 시간 경과에 따른 전극 신호의 신뢰성을 평가하려면 쌍체 t-테스트를 통해 일관된 조건(이식 후 14일 및 56일 간격으로 16m/min으로 수평 보행) 동안 수집된 종단 데이터를 평가합니다.
- in vivo 테스트(근육 활동의 생리적 변화를 유도하기 위해 오르막 및 내리막 보행을 통해 쥐의 걸음걸이를 교란한 경우) 동안 맞춤형 전극의 유효성을 평가하기 위해 Welch의 t-test를 수행하여 오르막 및 내리막 보행 조건의 평균 피크 값을 비교합니다.
Access restricted. Please log in or start a trial to view this content.
결과
Ex vivo 성능
ICC는 모든 파형(사인 [ICC = 0.993], 정사각형 [ICC = 0.995], 삼각형 [ICC = 0.958], p < .001)에서 맞춤 제작 전극과 산업 표준 전극 간에 높은 수준의 일치를 보여주었습니다. Bland-Altman 플롯은 또한 전극 간의 높은 수준의 신호 일치를 보여주었습니다. Bland Altman 플롯과 Pearson 상관 관계는 맞춤 제작 전극과 산업 표준 전극 간의 강한 양의 상관 관계로
Access restricted. Please log in or start a trial to view this content.
토론
우리의 목표는 EMG 제조 프로세스를 간소화하여 상피 전극 설계의 광범위한 채택 및 구현을 가능하게 하여 접근성을 높이고 신경근 연구를 발전시키는 것이었습니다. 이를 위해 저비용 epimysial electrodes를 사내에서 소싱, 제조 및 테스트할 수 있는 사용자 친화적인 가이드를 제시합니다. 다른 연구 그룹을 지원하기 위해 당사는 연구 노력을 위한 사내 epimysial 전극 생산을 용...
Access restricted. Please log in or start a trial to view this content.
공개
저자들은 이 논문에 보고된 연구에 영향을 미칠 수 있는 경쟁적인 재정적 이해관계나 개인적 관계를 알지 못한다고 선언한다.
감사의 말
이 연구는 미국 국립 관절염 및 근골격계 및 피부 질환 연구소(National Institute of Arthritis and Musculoskeletal and Skin Diseases)의 그랜트 R01AR081235(L. K. Lepley)의 지원을 받았습니다. 저자들은 생체 적합성 전극의 제조 및 테스트에 기여한 Joel Pingel, Grant Gueller, Akhil Ramesh, Joe Letner, Jacky Tian 및 Ross Brancati에게 감사를 표합니다.
Access restricted. Please log in or start a trial to view this content.
자료
| Name | Company | Catalog Number | Comments |
| Electrode Materials | |||
| Quantity & price per electrode | |||
| Contact surface | Prince and Izant PT90/IR10 1.25 mm x 5 mm foil | Catalog #1040055 | 2 per electrode $7.50 per foil $15.00 per electrode |
| PFA coated stainless-steel electrode lead wire | A-M Systems Multi-Stranded PFA-Coated Stainless Steel Wire 50.8 µm strand diameter | Catalog #793500 | Dependent on desired lead length (e.g., 9 inch lead wires x2) $128 per 25 ft spool $5.12 per foot $0.42 per inch (x18) $7.68 per electrode |
| Folding jig | 3D printed (see .gcode file) | NA | NA |
| Sealant for electrode body | Nusil Med-1137 liquid silicone | Catalog #MED-1137 | 1 gram $344.66 per 2 oz. (59.15 mL) $5.83 per electrode |
| Silicone base | Implantech Alliedsil Silicone Sheeting-Reinforced, Long Term Implantable (8” x 6”) .007 thick | Catalog #701-07 | 10mm x 5mm sheet $225.00 per 8 x 6 inch $0.36 per electrode (10 mm x 5 mm) |
| Thinner for sealant mixture | Toluene 99.5% ACS Reagent 500mL or Xylene ACS 99.5% | Catalog #179418-500 ML | 0.75 mL $25.53 per 500 mL $0.38 per electrode |
| Template for perforating silicone base | Cutting jig – 3D printed (see CAD file) | NA | NA |
| Custom-fabricated electrode: $29.25 | |||
| Industry standard electrode (EP105 EMG Patch Electrode, 2 contacts, single-sided, 7mm x 4mm, MicroProbe for Life Science): $305.00 | |||
| Additional Fabrication Materials | |||
| Quantity & price per electrode | |||
| 3D printing software | Solidworks (Solidworks, 2022) | ||
| Micro-Tig welder | Micro-Tig Welder (CD1000SPM, Single Pulse Research and Light Production Resistance Spot Welder, Sunstone) | SKU 301010 | $3,500 |
| Ultrasonic bath | Ultrasonic bath (CPX Series Ultrasonic Bath, Fisherbrand). | 15-337-403 | NA |
| Ex Vivo Testing Materials | |||
| Quantity & price per electrode | |||
| Data acquisition platform and software | DigitalLynx 4sX Base Cheetah version 6.0 (Neuralynx Inc.) | NA | EMG acquisition hardware and software |
| Electrode interface board (EIB) | EIB, EIB16-QC, Neuralynx Inc. | 31-0603-0007 | NA |
| Signal generator | 5 MHz Function Generator, B&K Precision | 4005DDS220V | $387.46 |
| Potentiostat | PGSTAT1 potentiostat (EcoChemie, Utrecht, Netherlands) | NA | NA |
| Stainless steel screw | Fine Science Tools | 19010-00 | $98 |
| Ex Vivo Testing Materials | |||
| Quantity & price per electrode | |||
| Rodent treadmill | Exer 3/6 Open Treadmill, Columbus Instruments | NA | NA |
| Dental cement | Excel Formula® Pourable Dental Material, St. George Technology Inc. | #24211 | $125.60 |
| Light microscope | Keyence BZ-X800, Keyence Corporation, Osaka, Japan | NA | NA |
| Motion capture system | Optitrack Color Camera, Optitrack, NaturalPoint Inc. | NA | NA |
| Peak detection algorithm | “SciPy.signal.find_peaks - SciPy v1.8.1 Manual”, 2022 | NA | NA |
| Python software | Python Software Foundation. Python Language Reference, version 3.9. Available at http://www.python.org | NA | NA |
| Rat | HsdBlu: LE, Envigo | 140 | NA |
| Statistical sotware | GraphPad Prism version 10.0.0 (GraphPad Software, Boston, Massachusetts USA) | NA | NA |
참고문헌
- Grandjean, P. A., Mortimer, J. T. Recruitment properties of monopolar and bipolar epimysial electrodes. Ann. Biomed. Eng. 14 (1), 53-66 (1986).
- Memberg, W. D., Stage, T. G., Kirsch, R. F. A fully implanted intramuscular bipolar myoelectric signal recording electrode. Neuromodulation J. Int. Neuromodulation Soc. 17 (8), discussion 799 794-799 (2014).
- Loeb, G. E., Gans, C. Electromyography for Experimentalists. , University of Chicago Press. Chicago, IL. (1986).
- Boehler, C., Carli, S., Fadiga, L., Stieglitz, T., Asplund, M. Tutorial: guidelines for standardized performance tests for electrodes intended for neural interfaces and bioelectronics. Nat. Protoc. 15 (11), 3557-3578 (2020).
- Patel, P. R., et al. Insertion of linear 8.4 µm diameter 16 channel carbon fiber electrode arrays for single unit recordings. J. Neural Eng. 12 (4), 046009(2015).
- Richie, J. M., et al. Open-source toolkit: benchtop carbon fiber microelectrode array for nerve recording. J. Vis. Exp. (176), e63099(2021).
- Impedance measurement of bipolar stimulation electrodes immersed in medium. Sarolic, A., Skalic, I., Deftu, A., Sapunar, D. 2018 EMF-Med 1st World Conf. Biomed. Appl. Electromagn. Fields EMF-Med, , 1-2 (2018).
- Pritchett-Corning, K. R., Mulder, G. B., Luo, Y., White, W. J. Principles of rodent surgery for the New Surgeon. J. Vis. Exp.: JoVE. (47), e2586(2011).
- Zealear, D., Li, Y., Huang, S. An implantable system for chronic in vivo electromyography. J. Vis. Exp. JoVE. (158), e60345(2020).
- Butterfield, T. A., Leonard, T. R., Herzog, W. Differential serial sarcomere number adaptations in knee extensor muscles of rats is contraction type dependent. J. Appl. Physiol. Bethesda Md 1985. 99 (4), 1352-1358 (2005).
- Farago, E., MacIsaac, D., Suk, M., Chan, A. D. C. A review of techniques for surface electromyography signal quality analysis. IEEE Rev. Biomed. Eng. 16, 472-486 (2023).
- Raez, M. B. I., Hussain, M. S., Mohd-Yasin, F. Techniques of EMG signal analysis: detection, processing, classification and applications. Biol. Proced. Online. 8, 11-35 (2006).
- Tankisi, H., et al. Standards of instrumentation of EMG. Clin. Neurophysiol. 131 (1), 243-258 (2020).
- Kumar, A., Accorsi, A., Younghwa, R., Mahasweta, G. Do's and don'ts in the preparation of muscle cryosections for histological analysis. J. Vis. Exp. JoVE. (99), e52793(2015).
- Wang, C., Yue, F., Kuang, S. Muscle histology characterization using H&E staining and muscle fiber type classification using immunofluorescence staining. Bio-Protoc. 7 (10), e2279(2017).
- Kreifeldt, J. G. Signal versus noise characteristics of filtered EMG used as a control source. IEEE Trans. Biomed. Eng. BME-18 (1), 16-22 (1971).
- Farina, D., Yoshida, K., Stieglitz, T., Koch, K. P. Multichannel thin-film electrode for intramuscular electromyographic recordings. J. Appl. Physiol. 104 (3), 821-827 (2008).
- Muceli, S., et al. Decoding motor neuron activity from epimysial thin-film electrode recordings following targeted muscle reinnervation. J. Neural Eng. 16 (1), 016010(2018).
- Guo, L., Guvanasen, G., Tuthill, C., Nichols, T., Deweerth, S. Characterization of a Stretchable Multielectrode Array for Epimysial Recording. , 694(2011).
- Zwarts, M. J., Stegeman, D. F. Multichannel surface EMG: basic aspects and clinical utility. Muscle Nerve. 28 (1), 1-17 (2003).
- Fabrication and test of robust spherical epimysial electrodes for lower limb stimulation. Aalb. Den. Koch, K. P., Leinenbach, C., Stieglitz, T. IFESS 5th Conf, , (2000).
- Uhlir, J. P., Triolo, R. J., Davis, J. A., Bieri, C. Performance of epimysial stimulating electrodes in the lower extremities of individuals with spinal cord injury. IEEE Trans. Neural Syst. Rehabil. Eng. 12 (2), 279-287 (2004).
- Deer, T. R., et al. The appropriate use of neurostimulation: new and evolving neurostimulation therapies and applicable treatment for chronic pain and selected disease states. Neuromodulation Technol. Neural Interface. 17 (6), 599-615 (2014).
- Ortiz-Catalan, M., Brånemark, R., Håkansson, B., Delbeke, J. On the viability of implantable electrodes for the natural control of artificial limbs: Review and discussion. Biomed. Eng. OnLine. 11, 33(2012).
- Sando, I. C., et al. Regenerative peripheral nerve interface for prostheses control: electrode comparison. J. Reconstr. Microsurg. 32 (3), 194-199 (2016).
Access restricted. Please log in or start a trial to view this content.
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유