JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
Atomic Force Microscopy: Intact and Regenerating Axolotl Limbs의 연골 측정
* 이 저자들은 동등하게 기여했습니다
요약
이 프로토콜에서는 원자력 현미경(AFM)을 위해 아홀로틀 조직을 준비하고 온전하고 재생되는 사지 연골에서 압흔 측정을 수행하는 방법을 보여줍니다.
초록
기계적 힘은 발달 중인 조직에서 정상적인 세포 기능과 패턴 형성에 중요한 신호를 제공하며, 그 역할은 배발생 및 발병 과정에서 널리 연구되었습니다. 이에 비해, 동물의 재생 과정에서 이러한 신호에 대해서는 알려진 바가 거의 없다.
아홀로틀은 부상 후 손실된 연골과 뼈를 포함하여 많은 장기와 조직을 완전히 복원할 수 있는 능력을 감안할 때 재생 연구를 위한 중요한 모델 유기체입니다. 척추동물의 신체에서 주요 지지 조직으로서의 중요한 역할로 인해 재생 중 골격 기능을 회복하려면 누락된 구조의 복원과 기계적 특성이 모두 필요합니다. 이 프로토콜은 높은 공간 분해능에서 세포 및 조직의 기계적 특성을 조사하기 위한 황금 표준인 원자력 현미경(AFM)을 위해 아홀로틀 사지 샘플을 처리하는 방법을 설명합니다.
이 연구는 아홀로틀의 재생 능력을 활용하여 항상성과 사지 재생의 두 단계인 조직 조직 분해 및 연골 응축 중 사지 연골의 강성을 측정했습니다. 우리는 AFM이 동적 조직 재구성 및 재생 중에 발생하는 기계적 변화에 대한 통찰력을 얻는 데 유용한 도구임을 보여줍니다.
서문
골격, 특히 연골과 뼈는 척추 동물에서 신체의 연조직에 대한 주요 기계적 지지를 제공합니다. 따라서 골격계의 손상은 기능과 생존에 큰 영향을 미칠 수 있습니다. 인간에서 골절은 가장 흔한 외상성 부상중 하나이며1, 대부분은 몇 주 안에 회복되지만, 이 중 5%-10%는 치유가 지연되거나 완전히 회복되지 않습니다 2,3. 더욱이, 인간은 광범위한 뼈나 연골 손실로부터 회복할 수 없다 4,5. 그러나 일부 도롱뇽은 전체 팔다리6를 포함한 다양한 신체 구조를 재생할 수 있어 골격 재생 연구에 이상적인 모델이다.
아홀로틀(Ambystoma mexicanum)은 사지 재생이 광범위하게 연구된 도롱뇽의 일종입니다. 이 과정은 1) 상처 치유, 2) 염증/조직 용해, 3) 모세포종 형성, 4) 배반종 증식/분화의 네 가지 주요 순차적이지만 중복되는 단계로 발생합니다(7,8에서 검토). 절단 후에는 부상 부위와 접해 있는 각질형성세포가 빠르게 이동하여 상처를 봉합하고 상처 상피(WE)를 형성합니다. 이어지는 염증 및 조직용해 과정에서 병원체가 제거되고, 파편과 손상된 세포가 제거되며, 절단 표면 아래의 세포외 기질(ECM)이 리모델링된다9. 조직 조직용해는 사지 재생이 이루어지기 위해 필수적이며10, 단백질 분해 효소의 분비는 전체 ECM 리모델링뿐만 아니라 모세포를 발생시키는 세포를 방출하고 ECM 자체에 격리된 생체 활성 분자를 방출하는 데 중요하다8. 실제로, 많은 재생 상황 및 모델 유기체에 대한 연구는 조직 용해 중 ECM의 고유한 재료 특성이 역분화 과정을 유도하거나 세포의 이동을 손상 부위로 유도할 수 있음을 보여주었습니다(11에서 검토). 더욱이, 조직용해의 말기 단계에서 석회화된 조직의 재흡수는 새로 형성된 사지 골격 요소의 적절한 통합에 핵심적인 것으로 나타났다12. 조직용해 단계 후, 모세포종은 역분화된 성숙 조직 세포 또는 거주 줄기 세포에서 유래한 미분화, 다중 계통 전구 세포의 축적으로 상처 상피(WE) 아래에 형성됩니다. Blastema 세포는 증식하고 모든 결손 세포 유형으로 분화합니다. 마지막으로, 사지 형태 형성이 일어나며, 여기서 골격 조직은 골격 주위 세포와 transdifferentiated dermal fibroblasts 13,14,15에서 유래 된 연골 형성 세포의 응축을 통해 재생됩니다.
세포 정체성 및 ECM 구성의 변화를 조절하는 많은 생화학적 단서가 확인되었지만10,13,14,16,17,18, 사지 재생의 여러 단계 동안 조직의 기계적 특성과 재생에 미치는 영향은 대부분 탐구되지 않은 상태로 남아 있습니다. 많은 연구에 따르면 세포는 여러 상황에서 자신의 운명과 행동을 조절하는 기계적 신호를 감지하고 통합합니다(19,20에서 검토). 따라서 사지 재생에 대한 세포 및 분자 지식을 조직 역학적 측정으로 보완하면 이러한 과정에 대한 이해가 크게 향상될 것입니다.
생물학적 샘플의 기계적 특성화 및 힘 조작을 허용하는 다양한 기술이 개발되었습니다21. 이러한 기술 중 원자력 현미경(AFM)은 초고감도 힘 센서인 AFM 캔틸레버22로 압입하여 생물학적 샘플의 점탄성 특성을 높은 공간 해상도로 조사하는 기계생물학의 황금 표준이 되었습니다. 이 기법은 샘플과 직접 접촉해야 하기 때문에 일반적으로 조직 절편이 생성되며, 이는 경우에 따라 어려울 수 있습니다. 따라서, 가능한 한 생리학적 조건에 가깝게 유지될 수 있고 최소한의 아티팩트가 생성될 수 있도록 각 특정 샘플에 대해 준비 조건을 조정하고 최적화해야 합니다23. 이 프로토콜은 AFM을 사용하여 아홀로틀 사지의 조직 강성을 측정하는 방법을 설명하며, 조직용해를 받는 동안 및 연골 응축 단계에서 온전한 상태의 연골 조직에 초점을 맞춥니다(그림 1 및 그림 2). 이 방법은 다른 조직 유형의 측정을 위해 확장될 수도 있습니다.
프로토콜
아홀로틀(Ambystoma mexicanum)은 드레스덴 공과대학(TUD)의 드레스덴 재생 치료 센터(CRTD)의 아홀로틀 시설에서 재배되었습니다. 사육 조건에 대한 자세한 설명은24에서 찾을 수 있습니다. 간단히 말해서, 객실은 20-22 ° C로 12/12 시간 낮 / 밤주기로 유지되었습니다. 모든 취급 및 수술 절차는 현지 윤리 위원회 지침에 따라 수행되었으며 독일 Landesdirektion Sachsen의 승인을 받았습니다.
이 연구는 모든 실험에 백색(d/d) 아홀로틀을 사용했으며, 이는 신체 색소 침착이 결핍된(멜라노포어 및 크산토포어가 거의 없거나 전혀 없는) 자연적으로 발생하는 돌연변이 균주로, 눈의 홍채에만 홍채에만 홍채가 있습니다. 이 연구는 성별에 따른 편견 없이 주둥이에서 꼬리(생후 5-7개월)까지 8-15cm 크기의 아홀로틀을 사용했습니다.
1. 준비
- axolotls의 마취 및 안락사에 사용할 10%(w/v) 벤조카인 원액을 준비합니다(아래 참조). 이를 위해 50mL 한계에 도달 할 때까지 100 % 에탄올과 함께 50g의 벤조 카인을 부피 병에 섞습니다.
- 0.03%(w/v) 벤조카인 원액을 준비합니다.
- 1L의 경우 50mL의 10x 트리스 완충 식염수(TBS) 30mL의 10%(w/v) 벤조카인 및 5mL의 4000%(w/v) Holtfreter 용액을 증류수 915mL와 혼합하고 자석 교반 막대로 밤새 혼합합니다.
- 1L의 10x TBS 용액의 경우 Trizma 염기 24.2g과 NaCl 90g을 탈이온수 990mL와 혼합합니다. 자석 교반 막대와 잘 섞으십시오. 그런 다음 약 10mL의 농축 HCl(12M 또는 37%)을 넣고 pH 8로 조정합니다.
- 1L의 4000%(w/v) Holtfreter 용액에 대해 158.4g의 NaCl, 11.13g의 MgSO4·7H2O, 5.36g의 CaCl2·2H2O및 2.88g의 KCl을 탈이온수와 1L까지 혼합합니다.
- 0.03%(w/v) 원액을 1:3으로 희석하여 마취를 위해 탱크 물을 보관하는 데 0.01%(w/v) 작동 벤조카인 희석을 준비합니다.
- 용액 1L의 경우 벤조카인 원액 333mL와 저장 탱크 물 666mL를 사용합니다.
- 진통을 위해 5mg/mL 부토르판올 주석산염 원액을 준비합니다. 이를 위해 부토르파놀(+)-주석산염 100mg과 초순수 20mL를 섞습니다. 부분 표본은 4 °C에서 보관하십시오.
- 절단 당일, 0.5 mg/L 부토르판올 주석산염 작업 용액을 신선하게 준비하여 스톡 용액을 저장 탱크 물에 1:10.000으로 희석하여 수술 후 동물의 통증을 줄입니다.
- 길이가 8cm 미만인 동물의 경우 20μL의 원액을 200mL 저장 탱크 물에 혼합합니다.
- 더 큰 동물의 경우 60μL의 원액을 600mL 저장 탱크 물에 혼합합니다.
- 80%(v/v) PBS 용액인 멸균 양서류 인산염 완충 식염수(APBS)를 준비하고 DPBS 800mL와 탈이온수 200mL를 혼합하여 실온(RT)에서 유지합니다.
- 1mg/mL 인슐린 원액을 준비합니다. 이를 위해 인슐린 분말 250mg과 HCl 0.1M 25mL를 혼합하고 용해될 때까지 천천히 교반합니다. 교반하는 동안 용액이 맑아질 때까지 225mL의 APBS를 추가합니다. 제균 필터를 사용하고 -20°C에서 4mL 부분 표본을 보관합니다.
- 멸균 배양 배지(모든 %(v/v): 62.5% L15 배지, 10% 가열 불활성화 FBS, 1% 페니실린/스트렙토마이신, 1% 인슐린, 1% L-글루타민)을 준비하고 사용 당일까지 4°C에서 보관합니다. 실험 당일에는 사용 전에 RT와 평형을 이루십시오.
- 배양 배지 400mL의 경우 L15 배지 250mL, 가열 비활성화 FBS 40mL, 페니실린/스트렙토마이신 4mL, 인슐린 용액 4mL(1.7단계), L-글루타민 4mL 및 탈이온수 멸균수 98mL를 사용합니다. 멸균 조건에서 준비하고 모든 구성 요소를 혼합한 후 멸균 필터를 사용하십시오. 15mL 부분 표본을 준비합니다.
- APBS 용액에 2.5% 및 3%(w/v) 저융점(lmp)-아가로스를 준비하고 70°C에서 가열하여 아가로스를 완전히 용해시킵니다. 1.5mL 튜브에 부분 표본을 준비하고 사용 당일까지 4°C에서 보관합니다.
- 2.5%(w/v) lmp-agarose 20mL의 경우 50mL 튜브에 lmp-agarose 0.5g과 APBS 20mL를 섞고 아가로스가 완전히 녹을 때까지 70°C의 수조에서 가열합니다. 해결책은 명확하고 투명해야 합니다. 아직 따뜻할 때 부분 표본을 준비하십시오.
- 3%(w/v) lmp-agarose 20mL의 경우 lmp-agarose 0.6g과 APBS 20mL를 혼합하고 위와 같이 진행합니다.
- (선택 사항): 1%(w/v) lmp-agarose 20mL의 경우 lmp-agarose 0.2g과 APBS 20mL를 혼합하고 위와 같이 진행합니다.
참고: 용융 시간은 lmp-agarose의 농도에 따라 다르며 대략 15-40분 사이일 수 있습니다.
- 절단 및 조직 장착의 경우 명시야 스테레오스코프를 사용하십시오.
- 절단 및 조직 채취를 위해 직경 100mm의 플라스틱 페트리 접시, 집게, 메스, 수술용 가위를 조립합니다.
- 압흔 측정을 위해 35mm 직경의 플라스틱 페트리 접시를 준비합니다.
- 직경이 ~1cm인 ~1cm 길이의 실린더를 준비합니다. 이를 위해 분젠 버너 화염 아래에서 판지 절단기를 가열하고 가열 된 칼날로 15mL 튜브를 자릅니다.
- 1cm의 작은 2 사각형의 파라 필름을 잘라 보관하십시오.
- -20 °C에서 금속 또는 차가운 블록을 냉동실에 최소 1시간 동안 두어 준비합니다.
- 플라스틱 파스퇴르 피펫을 준비합니다.
- (선택 사항): 정착성 MEMFa 용액(3-(N-모르폴리노)프로판술폰산[걸레] 0.1M pH 7.4, 에틸렌 글리콜-비스(2-아미노에틸에테르)-N,N,N′,N′-테트라아세트산[EGTA] 2mM, MgSO4·7H2O 1mM, 3.7% 포름알데히드)를 준비합니다. 이를 위해 걸레 10.465g, MgSO4·7H2O0.123g, 0.5M EDTA pH 8.0 2mL를 넣고 45mL까지 물을 추가합니다. 5mL의 총 부피에 5mL 포름알데히드 37%(w/v)를 추가합니다.
2. 시약
- 이 작업에 사용되는 시약에 대해서는 재료 표를 참조하지만 다른 상업적 공급자도 사용할 수 있습니다.
3. 아홀로틀 절단 및 사지 재생
- 모든 실험 절차에 앞서, 20 분 동안 탱크 물 (단계 1.3)에 희석 된 0.01 % (w / v) 벤조카인에 동물을 마취시켜, 동물이 깊이 마취되고 촉각 자극에 반응하지 않도록하십시오.
- 마취제에서 아홀로틀을 제거하고 마취제가 함유된 물로 적신 종이 조직이 들어 있는 100mm 페트리 접시 위에 놓습니다. 팔다리를 신체 축에 수직으로 향하게 하고 더 나은 시각화를 위해 플레이트를 스테레오스코프 아래에 놓습니다.
참고: 소형 거위 목 램프가 있는 스테레오스코프가 여기에 사용되었습니다. - 제우고포디움 영역(요골/척골)의 석회화된 부위 바로 원위부에 있는 날카로운 멸균 메스로 사지를 절단합니다(그림 1A).
알림: 3R 동물 복지 원칙을 준수하여 절단 시 처음에 제거된 팔다리를 온전한 대조군으로 사용하는 것이 좋습니다. - 동물을 접시에 놓고 벤조카인 함유 물에 적신 가습 티슈로 15분 동안 덮어 혈액 응고와 상처 봉합이 일어날 수 있도록 합니다.
- 진통제(부토르파놀 타르타르산염, 0.5mg/L, 1.5단계부터)가 들어 있는 탱크로 동물을 되돌려 보냅니다.
- 수술 후 진통제 치료 후 24시간 후에 신선한 물이 들어 있는 원래 탱크로 동물을 옮깁니다.
- 원하는 관심 단계까지 동물이 재생되도록 합니다.
참고: 분석된 팔다리는 5개월 된 동물의 온전한 단계의 경우 절단 당일에, 조직 용해 단계의 경우 절단 후 5일(dpa)에 수집되었습니다. 연골 응축 단계는 7개월 된 동물에서 21dpa로 측정되었습니다.
4. 측정을 위한 조직 장착 및 처리
- 아가로스가 완전히 녹을 때까지 70°C의 써모블록에서 2.5% 또는 3%(w/v) lmp-agarose(단계 1.9에서)를 포함하는 1.5mL 튜브를 가열합니다. 튜브를 37°C에서 다른 써모블록으로 교체하고 사용하기 전에 온도가 평형을 이루도록 합니다.
참고: 여기에서 2.5%의 lmp-agarose는 재생 조직을 측정하는 데 사용되었고 3%는 온전한 조직을 측정하는 데 사용되었습니다. - 1cm 길이의 실린더(1.13단계)의 한쪽 면을 파라필름 조각 중 하나(1.14단계)로 덮어 바닥이 완전히 밀봉되도록 합니다.
- 배양 배지 15mL 분취액을 RT와 평형화합니다(1.8단계에서).
- 동물을 마취제 함유 물(저장 탱크 물에 희석된 0.01%(w/v) 벤조카인)에 최소 20분 동안 담가 마취시킵니다.
- 정량적 측정이 가능한 소프트웨어를 사용하여 입체경으로 팔다리를 이미지화합니다. 관심 구조의 길이를 측정하고 관심 부분에 도달할 때까지 사지의 말단 끝에서 얼마나 많은 조직을 제거해야 하는지 계산합니다.
- 팔다리를 재생하려면 메스 및/또는 수술용 가위로 팔꿈치 높이에서 절단하고 팔다리에서 과도한 조직을 절개하여 수집합니다. 다음 단계를 준비하는 동안 조직을 APBS 용액에 그대로 두십시오. 절단이 균일한 표면을 만들기 위해 아래쪽 암 축으로 횡단(90°)되는지 확인합니다. 손상되지 않은 팔다리를 위해 손목 부위를 절단하여 손을 제거합니다.
- 동물을 최소 20분 동안 치사량의 마취제(0.1% 벤조카인)에 노출시켜 안락사시킵니다. 이를 위해 10%(w/v) 벤조카인 용액의 필요한 부피를 추가하여 0.1%(w/v) 농도에 도달합니다.
- 동물을 0.01%(w/v) 벤조카인 용액 100mL에 마취한 경우 10%(w/v) 벤조카인 용액 900mL를 추가합니다.
- 팔다리를 APBS 용액에 담가 헹굽니다.
- 파스퇴르 피펫과 써모블록(아가로스 부분 표본으로 37°C에서 안정화)이 작업 스테이션에 가까이 있는지 확인하십시오. -20 °C 냉동고에서 콜드 블록을 꺼내고 파라필름으로 덮인 끝이 아래를 향하도록 실린더를 놓습니다.
- 절개된 팔다리를 잡고 티슈 페이퍼로 여분의 액체를 부드럽게 제거합니다. 팔다리를 깨끗한 접시에 놓고 그 위에 녹인 lmp-agarose를 넣은 다음 agarose에서 팔다리를 잠시 움직여 피부 표면에 남아 있는 APBS를 제거합니다.
- 빠르게 작업하여 팔다리를 실린더 내부에 놓고 관심 영역이 위쪽을 향하도록 수직 방향이 되도록 합니다.
- 집게로 팔다리를 부드럽게 잡으면서 조직이 완전히 덮일 때까지 실린더 내부에 lmp-agarose를 추가합니다. 아가로스가 응고되기 전에 겸자를 부드럽게 제거합니다.
- 콜드 블록에서 실린더를 제거하고 아가로스가 약 30초 동안 실온에서 완전히 응고되도록 합니다.
- 조직 함유 아가로스 블록을 멸균 배양 배지 부분 표본 및 APBS와 함께 RT에서 즉시 진동실로 가져갑니다.
- 실린더 바닥에서 파라필름을 제거하고 시아노아크릴레이트 접착제로 조직을 포함하는 아가로스를 비브라톰 스테이지에 부착합니다. 아가로스와 샘플이 모두 스테이지에 붙어 있는지 확인합니다.
- 단면화를 위해 APBS에 스테이지를 담그십시오.
참고: 온전한 조직에는 더 단단한 뼈/연골이 포함되는 반면 재생 조직은 더 부드럽습니다. 따라서 비브라톰 매개변수는 그에 따라 조정되어야 합니다. 이 연구는 온전한 조직(진폭 1.2mm 및 속도 0.1mm/s) 및 재생 조직(진폭 0.9mm 및 속도 0.4mm/s) 매개변수를 사용했습니다. - 조직 팁에 도달할 때까지 짧은 단계(예: 100μm 단계)로 아가로스 절단을 시작합니다. 그런 다음 조직의 원위 부분(4.5단계에서 계산)이 제거될 때까지 조직 블록을 절단합니다. 이렇게 하면 관심 영역의 횡단 단면에 쉽게 접근할 수 있습니다.
참고: 제거된 조직 섹션에는 AFM으로 프로브된 것과 바로 인접한 표면이 포함되며 조직 구조에 대한 참조 역할을 할 수 있습니다. 따라서 직접 보완 분석에 사용하거나 후속 염색을 위해 고정할 수 있습니다(섹션 6 참조). - 면도날로 vibratome stage에서 조직 함유 블록을 조심스럽게 제거하고 접착제의 흔적을 모두 제거합니다. 즉시 수술용 조직 접착 접착제로 35mm 플라스틱 페트리 접시에 블록을 붙이고 RT에서 약 2mL의 배양 배지를 추가하여 조직이 완전히 덮이도록 합니다.
참고: 아가로스 블록에서 노출된 조직 표면은 프로브할 표면입니다.
5. AFM을 사용한 측정
- 측정 최소 1일 전에 측정을 위해 캔틸레버를 준비하십시오.
참고: 이 작업을 위해 팁이 없는 실리콘 캔틸레버를 폴리스티렌 비드(직경 20μm)로 기능화하고 비드-캔틸레버 결합을 압흔 측정에 사용하기 전에 최소 1일 동안 강화하도록 두었습니다.- 처리 시간이 5분인 에폭시 접착제를 사용하여 캔틸레버에 비드를 부착합니다.
- 캔틸레버를 접착제로 코팅된 유리 슬라이드에 최소한의 접촉으로 빠르게 내려 끝에 작은 접착제 방울이 형성되도록 하고 그 직후에 적절한 비드와 접촉하도록 합니다.
- 캔틸레버 비드 접점을 ~10분 동안 유지한 후 비드가 바인딩된 캔틸레버를 표면에서 들어 올립니다.
- 측정하기 전에 캔틸레버를 보정하십시오.
알림: 수정된 캔틸레버는 AFM 소프트웨어의 내장 절차를 사용하여 열 소음 방법으로 각 실험 세트 전에 보정되었습니다. - 조직 블록(단계 4.18) 및 배양 배지가 있는 페트리 접시를 AFM의 페트리 접시 홀더에 삽입하고 명시야 현미경으로 개요 이미지를 얻습니다(그림 1B).
참고: 압흔 테스트의 경우 정립 광학 현미경 위에 모터스테이지가 장착된 설정이 사용됩니다. AFM 헤드를 장착하고 캔틸레버를 조직 위에 놓고 캔틸레버를 표면 가까이로 가져옵니다. - 특정 관심 영역을 선택하고 힘-거리 곡선 배열을 기록합니다(그림 2A).
참고: 접근 및 수축 속도 7.5μm/s, z 길이 50μm, 그리드 크기 70μm x 70μm(3 x 3점 포함)로 강성이 다른 조직에 대해 ~1-4μm의 유사한 압흔 깊이에 도달하기 위해 2-25nN의 상대 하중 설정값이 사용되었습니다. - 모든 프로브 영역에 대해 brightfield microscopy 이미지를 획득하여 얻은 값을 사지 절편의 각 특정 영역에 연결합니다.
- 모든 샘플에 대해 조직 유형당 최소 3개의 다른 영역을 조사합니다.
참고: 모든 경우에 이 연구는 연골 중앙의 4개 영역과 연골 영역 주변의 3개 영역을 측정하고 최대 1시간 동안 조직을 현미경으로 관찰했습니다. - 압흔 측정이 완료되면 추가 분석을 위해 조직을 버리거나 고정합니다.
참고: 샘플은 MEMFa 용액이 들어있는 2mL 튜브에 넣어 측정을 완료한 후 고정하고 4°C에서 밤새 고정했습니다. MEMFa(단계 1.17)를 사용했지만 PBS의 포름알데히드 4%(w/v) 용액도 사용할 수 있습니다.
6. (선택 사항) 인접 조직 절편의 처리
- 인접한 조직 절편을 후속 염색에 사용하는 경우, 절편 직후 고정액이 들어 있는 작은 2mL 튜브에 넣고 4°C에서 밤새 고정합니다.
- 액틴 세포골격 및 핵의 라벨링을 통해 조직 구조를 밝히려면 PBS로 각각 5분씩 3회 세척하여 고정액을 제거하고 PBS의 Alexa Fluor 488 conjugated Phalloidin(1:250) 및 Hoechst 33258(1:10000)을 함유한 용액으로 로킹 플랫폼에서 RT로 1시간 동안 염색합니다.
- 다음으로, 37°C에서 안정화된 APBS에서 1%(w/v) lmp-agarose를 사용하여 유리 바닥 접시 위에 염색된 샘플을 고정시킵니다(단계 1.9에서). 관심 표면이 유리를 향하고 있는지 확인하십시오. 아가로스가 응고되면 탈수를 방지하기 위해 샘플을 PBS로 덮습니다.
참고: 원형(intact) 및 조직분해(histolysis) 샘플은 도립 컨포칼 현미경(10x 배율 및 8μm 광학 절편)으로 이미징됩니다. 그림 1C 의 이미지는 8개의 광학 섹션의 최대 투영입니다.
- 새로운 조직이 필요한 즉각적인 다운스트림 분석(예: RNA 추출, 생염료를 사용한 배양 등)에 인접한 조직 절편을 사용하는 경우 신속하게 작업하고 세포 배양 배지(1.8단계부터)를 사용하여 가능한 최고의 조직 무결성을 보장해야 합니다.
7. 데이터 분석 및 표시
- 겉보기 영률(Young's modulus)을 계산하려면 푸아송 비율이 0.5라고 가정하고 JPK/Bruker 데이터 처리 소프트웨어를 사용하여 구형 압자에 대한 Hertz/Sneddon 모델(식 1)을 사용하여 힘-거리 곡선을 분석합니다.
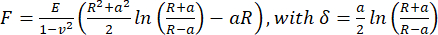 (식 1)
(식 1)
여기서 R : 압자 반경, E : 탄성 계수, ν : 푸아송 비, a : 압자와 시료 사이의 원형 접촉 면적의 반경, δ : 압흔 깊이. - 점탄성 분석을 위해 "Kelvin-Voigt-Maxwell (KVM)을 사용하여 점탄성을 보정한 Hertz 모델"(Paul Müller, https://github.com/AFM-analysis/PyJibe)25 확장자를 사용하여 PyJibe 0.15.0에서 힘-압입 곡선의 접근 부분을 분석합니다. fit 함수는 Abuhattum et al.26이 설명한 모델을 기반으로 하며, Kelvin-Voigt-Maxwell 모델 요소를 적분합니다.
- 하중 압입 곡선을 사전 처리하여 외곽진입 부품에 대한 선(기준선)과 다항식 맞춤 함수를 사용하여 접촉점을 추정합니다.
- 힘-압입 곡선을 "KVM(Kelvin-Voigt-Maxwell) 모델을 사용하여 점탄성을 보정한 Hertz 모델"에 맞춥니다. 피팅에서 이완되지 않은 영률(Young's modulus), 겉보기 영률(apparent Young's modulus) 및 겉보기 점도(apparent viscosity)를 구합니다. 이 모델은 또한 Maxwell 이완 및 압입 시간을 제공합니다.
참고: 분석된 여러 힘 압흔 곡선(특히 온전한 조직)에서 Maxwell 이완 시간은 압흔 시간보다 훨씬 크거나 작았으며, 이는 각각 다소 탄성 거동 또는 Kelvin-Voigt 기계적 거동을 나타냅니다.
- 모든 측정값을 스프레드시트로 내보내고 조직 유형 및 샘플당 겉보기 영률 중앙값을 계산합니다.
- 적절한 소프트웨어를 사용하여 데이터를 플로팅하고 통계적으로 분석합니다.
참고: 여기에는 GraphPad Prism이 사용되며, 결과를 설명할 때 이 연구는 샘플당 겉보기 Young's moduli의 평균 ± SD를 참조합니다(그림 2D-F에 표시). - 공초점 이미지의 광학 슬라이스를 Fiji maximum projection 기능으로 투사하여 표시합니다. 형광 염색을 최적으로 시각화하기 위해 각 개별 채널의 밝기와 대비를 조정합니다.
- 적절한 소프트웨어를 사용하여 Figure 패널을 생성합니다.
참고: Affinity Designer는 패널을 생성하는 데 사용되며 그림 1A 의 모델은 Affinity Designer를 사용하여 그려집니다.
결과
위에서 설명한 프로토콜을 사용하여 항상성("온전한") 상태, 초기 연골 조직용해 및 후기 연골 응축 단계 동안 연골 아홀로틀 사지 조직의 겉보기 영률(Young's modulus)을 측정했습니다(그림 1A). 우리는 또한 캔틸레버 위치를 묘사한 이미지에서 볼 수 있듯이 중심과 주변을 포함한 다양한 영역에서 골격 요소의 기계적 특성을 조사했습니다(
토론
여기에서는 AFM을 사용하여 아홀로틀 사지의 연골 강성을 측정하는 기술을 보여줍니다. 그러나 이 방법은 다른 조직 유형도 조사하기 위해 확장될 수 있습니다. 성공적인 AFM 측정을 위한 핵심 단계는 시료 전처리이며, 이는 아홀로틀 시료에서 특히 어려운 것으로 입증되었습니다. 우리는 아가로스 블록에 여전히 박혀 있는 조직 표면을 조사하는 것이 조직 무결성을 보존?...
공개
저자는 이해 상충이 없음을 선언합니다
감사의 말
이 작업을 개발하는 동안 지속적인 지원과 동료애를 보여준 Sandoval-Guzmán 연구소의 모든 구성원에게 감사드립니다. 또한 아홀로틀 치료에 대한 Anja Wagner, Beate Gruhl 및 Judith Konantz의 헌신에도 감사드립니다. 또한 AFM 데이터 분석을 위한 코드를 제공해 준 Paul Müller에게도 감사의 뜻을 전합니다. 이 연구는 TU 드레스덴에 있는 CMCB 기술 플랫폼의 광학 현미경 시설의 지원을 받았습니다. AT는 독일 암 지원단(Deutsche Krebshilfe)의 지원을 받는 Mildred Scheel Early Career Center Dresden P2의 펠로우입니다. RA는 Deutsche Forschungsgemeinschaft(DFG, 독일 연구 재단)의 임시 PI 직위(Eigene Stelle)에서 자금을 지원합니다(AI 214/1-1).
자료
| Name | Company | Catalog Number | Comments |
| Affinity Designer | Affinity | version 1.10.4 | For figure assembling |
| Agarose Low Melt | Roth | 6351.1 | For sample preparation |
| Alexa Fluor 488 Phalloidin | Invitrogen | A12379 | To stain tissue |
| Axiozoom | Zeiss | To image samplea under the AFM | |
| Benzocaine | Sigma-Aldrich | E1501 | To anesthetize the animals |
| Butorphanol (+)-tartrate salt | Sigma-Aldrich | B9156 | As analgesic |
| Cantilever | NanoWorld | Arrow TL1 | For AFM indentation measurements |
| Cellhesion 200 setup equipped with a motorstage | JPK/Bruker | For AFM indentation measurements | |
| CellSense Entry | For imaging in Stereoscope Olympus UC90 | ||
| Dulbecco’s Phosphate Buffered Saline (DPBS, 1x) | Gibco | 14190-144 | To clean samples and section under vibratome |
| FIJI (ImageJ2) | https://imagej.net/software/fiji | version 2.9.0/1.53t | For image processing |
| GraphPad Prism | GraphPad Software | (version 8.4.3) | To graph and statistically analyze the data |
| Heat-inactivated FBS | Gibco | 10270-106 | For cell culture medium |
| Histoacryl glue (2-Butyl-Cyanoacrylate) | Braun | To glue sample to petri dishes | |
| Hoechst 33258 | Abcam | ab228550 | To stain tissue |
| Insulin | Sigma-Aldrich | I5500 | For cell culture medium |
| Inverted confocal microscope | Zeiss | 780 LSM | To image tissue sections |
| Inverted confocal microscope | Zeiss | 980 LSM | To image tissue sections |
| JPK/Bruker data processing software | JPK/Bruker | SPM 6.4 | To analyze force-distance curves |
| L15 medium (Leibovitz) | Sigma | L1518 | For cell culture medium |
| L-Glutamine | Gibco | 25030-024 | For cell culture medium |
| Penicillin/Streptomycin | Gibco | 15140-122 | For cell culture medium |
| polystyrene beads ( 20 µm diameter); ) | microParticles | For AFM indentation measurements | |
| Pyjibe | written by Paul Müller https://github.com/AFM-analysis/PyJibe | 0.15.0 | For viscoelastic analysis |
| Stereoscope Olympus SX10 | Olympus | SX10 | For limb amputations and tissue mounting |
| Stereoscope Olympus UC90 | Olympus | UC90 | For imaging |
| Vibratome Leica | Leica | VT 1200S | For tissue sectioning |
참고문헌
- Mills, L. A., Aitken, S. A., Simpson, A. H. R. W. The risk of non-union per fracture: current myths and revised figures from a population of over 4 million adults. Acta Orthop. 88 (4), 434-439 (2017).
- Calori, G. M., et al. Non-unions. Clin Cases Miner Bone Metab. 14 (2), 186-188 (2017).
- Nandra, R., Grover, L., Porter, K. Fracture non-union epidemiology and treatment. Trauma. 18 (1), 3-11 (2016).
- Nauth, A., Schemitsch, E., Norris, B., Nollin, Z., Watson, J. T. Critical-size bone defects: Is there a consensus for diagnosis and treatment. J Orthop Trauma. 32 (3 Suppl), S7-S11 (2018).
- Schemitsch, E. H. Size matters: Defining critical in bone defect size. J Orthop Trauma. 31 (10), S20-S22 (2017).
- Joven, A., Elewa, A., Simon, A. Model systems for regeneration: Salamanders. Development (Cambridge). 146 (14), 0 (2019).
- Aires, R., Keeley, S. D., Sandoval-Guzmán, T. Basics of Self-Regeneration. Cell Engineering and Regeneration. , (2020).
- Stocum, D. L. Mechanisms of urodele limb regeneration. Regeneration. 4 (4), 159-200 (2017).
- Bassat, E., Tanaka, E. M. The cellular and signaling dynamics of salamander limb regeneration. Curr Opin Cell Biol. 73, 117-123 (2021).
- Vinarsky, V., Atkinson, D. L., Stevenson, T. J., Keating, M. T., Odelberg, S. J. Normal newt limb regeneration requires matrix metalloproteinase function. Dev Biol. 279 (1), 86-98 (2005).
- Godwin, J., Kuraitis, D., Rosenthal, N. Extracellular matrix considerations for scar-free repair and regeneration: Insights from regenerative diversity among vertebrates. International J Biochem Cell Biol. 56, 47-55 (2014).
- Riquelme-Guzmán, C., et al. Osteoclast-mediated resorption primes the skeleton for successful integration during axolotl limb regeneration. ELife. 11, e79966 (2022).
- Gerber, T., et al. Single-cell analysis uncovers convergence of cell identities during axolotl limb regeneration. Science. 362 (6413), aaq0681 (2018).
- Kragl, M., et al. Cells keep a memory of their tissue origin during axolotl limb regeneration. Nature. 460 (7251), 60-65 (2009).
- Currie, J. D., et al. Live Imaging of Axolotl Digit Regeneration Reveals Spatiotemporal Choreography of Diverse Connective Tissue Progenitor Pools. Dev Cell. 39 (4), 411-423 (2016).
- Qin, T., et al. Single-cell RNA-seq reveals novel mitochondria-related musculoskeletal cell populations during adult axolotl limb regeneration process. Cell Death Differ. 28 (3), 1110-1125 (2021).
- Sandoval-Guzman, T., et al. Fundamental differences in dedifferentiation and stem cell recruitment during skeletal muscle regeneration in two salamander species. Cell Stem Cell. 14, 174-187 (2014).
- Currie, J. D., et al. The Prrx1limb enhancer marks an adult subpopulation of injury-responsive dermal fibroblasts. Biol Open. 8, bio043711 (2019).
- Wagh, K., Ishikawa, M., Garcia, D. A., Stavreva, D. A., Upadhyaya, A., Hager, G. L. Mechanical regulation of transcription: Recent advances. Trends Cell Biol. 31 (6), 457-472 (2021).
- d'Angelo, M., et al. The role of stiffness in cell reprogramming: A potential role for biomaterials in inducing tissue regeneration. Cells. 8 (9), 1036 (2019).
- Akhtar, R., Sherratt, M. J., Cruickshank, J. K., Derby, B. Characterizing the elastic properties of tissues. Mater Today (Kidlington). 14 (3), 96-105 (2011).
- Krieg, M., et al. Atomic force microscopy-based mechanobiology. Nat Rev Phys. 1 (1), 41-57 (2019).
- El Kirat, K., Burton, I., Dupres, V., Dufrene, Y. F. Sample preparation procedures for biological atomic force microscopy. J Microsc. 218 (3), 199-207 (2005).
- Riquelme-Guzmán, C., et al. Postembryonic development and aging of the appendicular skeleton in Ambystoma mexicanum. Dev Dyn. 251 (6), 1015-1034 (2021).
- López-Alonso, J., Eroles, M., Janel, S., et al. PyFMLab: Open-source software for atomic force microscopy microrheology data analysis [version 2; peer review: 2 approved]. Open Res Europe 2024. 3 (187), (2024).
- Abuhattum, S., Mokbel, D., Müller, P., Soteriou, D., Guck, J., Aland, S. An explicit model to extract viscoelastic properties of cells from AFM force-indentation curves. iScience. 25 (4), 104016 (2022).
- Glorieux, L., et al. In-depth analysis of the pancreatic extracellular matrix during development for next-generation tissue engineering. Int J Mol Sci. 24 (12), 10268 (2023).
- Hiratsuka, S., et al. Power-law stress and creep relaxations of single cells measured by colloidal probe atomic force microscopy. Jpn J Appl Phys. 48 (8 PART 3), 08JB17 (2009).
- Johnson, K. L., Kendall, K., Roberts, A. D. Surface energy and the contact of elastic solids. Proc R Soc Lond A. 324, 301-313 (1971).
- Kondiboyina, V., Duerr, T. J., Monaghan, J. R., Shefelbine, S. J. Material properties in regenerating axolotl limbs using inverse finite element analysis. J Mech Behav Biomed Mater. 150, 106341 (2024).
- Calve, S., Simon, H. Biochemical and mechanical environment cooperatively regulate skeletal muscle regeneration. FASEB J. 26 (6), 2538-2545 (2012).
- Calve, S., Simon, H. G. Extracellular control of limb regeneration. IUTAM Symposium on Cellular, Molecular and Tissue Mechanics. IUTAM Bookseries. 16, 257-266 (2010).
- Kaufmann, R. A., Kozin, S. H., Barnes, A., Kalluri, P. Changes in strain distribution along the radius and ulna with loading and interosseous membrane section. J Hand Surg Am. 27 (1), 93-97 (2002).
- Martin, A. R., et al. Measurement of distal forearm bone mineral density: Can different forearm segments be used interchangeably. J Clin Densitom. 2 (4), 381-387 (1999).
- Riquelme-Guzmán, C., et al. In vivo assessment of mechanical properties during axolotl development and regeneration using confocal Brillouin microscopy. Open Biol. 12 (6), 220078 (2022).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유