Method Article
SE-FRET(Sensitized-Emission Förster Resonance Energy Transfer)를 사용하여 8채널(LRRC8/VRAC) 활성을 포함하는 류신이 풍부한 반복 모니터링
요약
전기생리학은 이온 채널 활성을 조사하기 위한 황금 표준입니다. 그러나 광학적 방법을 포함하여 많은 대체 접근 방식이 있습니다. 여기에서는 FRET(inter-subunit Förster 공명 에너지 전달) 기반 방법을 사용하여 8채널(LRRC8) 형성된 음이온 채널을 포함하는 류신이 풍부한 반복의 활성을 모니터링하는 방법을 설명합니다.
초록
LRRC8 단백질 계열의 구성원은 수많은 생리학적 과정에서 역할을 하는 이질체 이온 및 삼투압 채널을 형성합니다. 부피 조절 음이온 채널(VRAC)/부피에 민감한 외부 정류 채널(VSOR)은 삼투압 세포 팽창 시 활성화되고 염화물 및 유기 삼투압의 압출을 매개하여 물의 유출을 유발하여 세포 수축을 유발합니다. VRAC는 삼투압 부피 조절에서의 역할 외에도 분화, 이동 및 세포사멸과 같은 세포 과정에 관여해 왔습니다. 막전위에 미치는 영향과 다양한 신호 분자의 이동을 통해 8개의 (LRRC8) 채널을 포함하는 류신이 풍부한 반복은 뉴런-아교세포 통신, 인슐린 분비 및 면역 반응에 중요한 역할을 합니다. 활성화 메커니즘은 여전히 파악하기 어렵습니다. LRRC8 채널은 다른 이온 채널과 마찬가지로 일반적으로 전기생리학적 방법을 사용하여 연구됩니다. 여기에서는 LRRC8 소단위체의 C-말단 류신이 풍부한 반복 도메인에 융합된 형광 단백질 간의 SE-FRET(intra-complex sensitized-emission Förster 공명 에너지 전달)를 측정하여 LRRC8 채널 활성화를 감지하는 방법을 설명합니다. 이 방법은 세포질 환경의 교환 없이 그리고 세포 분화 및 세포사멸과 같은 과정 중에 in situ 채널 활성화를 연구할 수 있는 가능성을 제공합니다.
서문
8 (LRRC8) 계열 단백질을 포함하는 류신이 풍부한 반복의 이질체로 구성된 이온 채널은 척추 동물 세포 전체에서 발견되며 광범위한 생리적 기능에 참여합니다 1,2. 이러한 LRRC8 채널은 처음에 부피 조절 음이온 채널(VRAC) 또는 부피에 민감한 외부 정류 채널(VSOR)로 확인되었으며 세포 조절 부피 감소에 중요한 역할을 합니다 3,4. 그들은 염화물 이온과 유기 삼투압의 배출을 촉진하며, 이는 삼투압 팽창에 대한 반응으로 물 유출을 뒤따릅니다. 삼투압 스트레스 반응에서의 역할 외에도 세포 부피 조절에 대한 역할은 세포 증식 및 이동, 세포사멸, 정자 형성 및 상피 무결성과 관련이 있습니다 5,6,7. LRRC8/VRAC 활성화 시 막 전위의 변화는 췌장 β세포에 의한 근관 분화8 및 인슐린 분비에 기여하는 것으로 나타났습니다 9,10,11. 더욱이, LRRC8 채널은 퓨린성 신호 분자 ATP 및 cGAMP 또는 흥분성 아미노산 글루타메이트와 같은 다양한 유기 삼투압을 전도하여 면역 체계 또는 신경교-뉴런 상호 작용12,13,14,15,16,17,18,19,20,21,22. 염료 플루오레세인(dye fluorescein), 항생제 블라스티시딘 S 또는 항암제 시스플라틴(cisplatin)과 같은 생체이물조차도 LRRC8 채널23,24,25에 의해 수행됩니다.
LRRC8/VRAC 활성화로 이어지는 신호 전달에 대한 수많은 보고가 있습니다 26,27,28. 그러나 그 메커니즘은 불분명하며, 문헌은 특정 생리학적 과정에 의존할 수 있는 광범위한 잠재적 메커니즘을 제시합니다. 여기에는 세포질 이온 강도의 변화, 세포골격과의 상호 작용, 막 구성, G 단백질, 산화 환원 상태 및 인산화 폭포 2,27,29,30,31의 변화가 포함됩니다.
LRRC8/VRAC 채널은 생리학적으로 기능적인 채널 4,14,32를 형성하기 위해 패러로그 LRRC8B-E 중 적어도 하나와 이질중합되어야 하는 필수 서브유닛 3,4로 LRRC8A를 포함합니다. 소단위 조성은 정류 및 탈분극 의존적 불활성화 4,29,32,33,34, 기질 특이성 15,17,20,21,24,35 및 일부 활성화 경로36,37과 같은 채널의 생물물리학적 특성을 결정합니다. 초저온 전자 현미경 (Cryo-EM) 구조는 LRRC8A 동질체와 이질체가 헥사머 38,39,40으로 조립되는 반면, 기능 채널을 형성하는 LRRC8A / LRRC8C 키메라는 헵타머41로 조립됨을 보여줍니다. 모든 LRRC8 단백질의 N-말단 부분은 4개의 막관통 나선으로 구성되며, C-말단 부분은 류신이 풍부한 반복(LRRD)이 있는 도메인을 포함합니다. 이용 가능한 LRRC8 복합 구조는 세포질 3,4,23으로 뻗어 있는 LRRD가 채널 게이팅 34,42,43 동안 구조적 재배열을 겪을 수 있다는 증거를 제공합니다. 이 개념은 형광 단백질의 C-말단 융합이 기저 채널 활성(14)을 유발하고 나노바디를 도메인에 결합하면 채널 활성(44)을 조절할 수 있다는 발견에 의해 뒷받침됩니다. 더욱이, C-termini의 구조적 변화는 intra-complex Förster 공명 에너지 전달(FRET)45에 의해 나타났습니다.
이온 채널 활성을 연구하는 가장 일반적인 방법은 전기생리학적 측정(electrophysiological measurement)46이며, 이는 분자 식별(molecular identification)47 전에 VRAC의 조사에 광범위하게 적용되었습니다. 그러나 VRAC 활동을 간접적으로 모니터링할 수 있는 다양한 추가 방법이 있으며, 여기에는 전도성 기질(할로겐화물 이온 또는 유기 삼투압)의 측정 또는 세포 부피48에 미치는 영향을 포함합니다. 실제로, LRRC8 단백질을 VRAC로 식별하는 것은 활성화된 VRAC 3,4를 통해 세포에 들어가는 요오드화물에 의한 할로겐화물에 민감한 형광 단백질49의 담금질에 기초한 분석에 의존했습니다. LRRC8/VRAC 채널 활성을 모니터링하는 또 다른 방법은 FRET45의 변화에 의해 다른 이온 채널 50,51,52,53에서와 같이 관찰할 수 있는 세포질 도메인의 움직임을 사용합니다. 이를 위해 청록색-형광 단백질(CFP)/mCerulean3을 공여체로, 황색-형광 단백질(YFP)/mVenus를 수용체로 사용하여 FRET 쌍 역할을 하는 형광 단백질을 LRRC8 단백질의 C-말단에 융합했습니다(그림 1). LRRC8 소단위 사이의 복합 내 FRET는 수용체 광표백 실험45에 의해 나타났습니다. 파괴적인 광표백 방법을 피하기 위해, 시간 경과에 따른 FRET 변화는 sensitized-emission FRET(SE-FRET)에 의해 모니터링되었으며, 여기서 기본적으로 공여자의 방출 스펙트럼과 수용체의 여기 스펙트럼의 겹침으로 인한 공여자의 여기 시 수용체의 감작 방출이 측정됩니다. LRRC8/VRAC 활성화를 위한 자극인 세포외 긴장저하증을 적용하면 SE-FRET 강도가 가역적으로 감소했다45. 중요한 것은, 저장성 치료 중 전세포 패치-클램프 측정과 FRET 모니터링을 동시에 실시한 결과, FRET의 감소가 실제로 LRRC8/VRAC 활성화와 유사하다는 것을 보여주었다45. 피펫 용액에 의한 원형질막의 파괴 또는 세포 내 환경의 변경을 방지하는 이 방법은 LRRC8/VRAC 활성을 모니터링하기 위한 대안을 제공합니다. 네이티브 세포질을 유지하는 것이 중요하거나, 세포 내 해상도가 필요하거나, 채널 활성을 장기간 관찰해야 하는 생리학적 환경에서 특히 유용합니다.
여기에서는 이러한 FRET 기반 판독으로 LRRC8/VRAC를 연구하기 위한 프로토콜을 제시합니다. 이 프로토콜은 세포를 처리 및 transfection하고, 샘플을 획득하여 이미지를 제어하고, 데이터를 분석하고, SE-FRET(sensitized emission FRET) 값을 계산하는 방법을 보여줍니다.
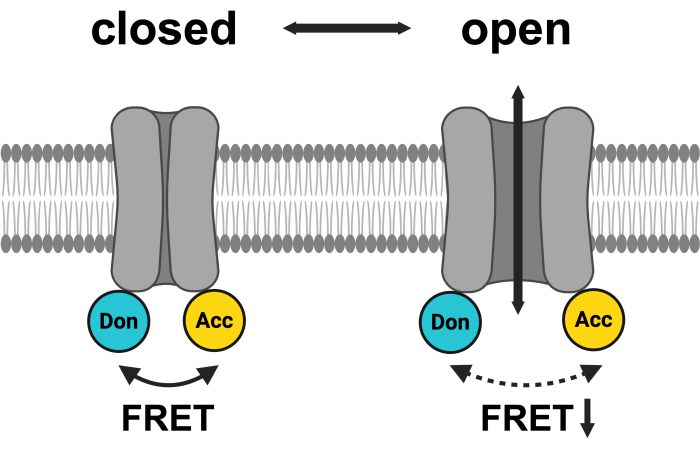
그림 1: LRRC8 FRET 쌍 시스템의 개략도. mCerulean3는 청록색으로, mVenus는 노란색으로 표시됩니다. VRAC 개방 후 형광단 사이의 거리(및/또는 공간 방향)가 변경되어 공여체(Don)와 수용체(Acc) 사이의 에너지 전달이 감소하고 관찰된 FRET가 낮아집니다. BioRender.com 로 만들어졌습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
프로토콜
1. 완충액 및 시약의 제조
- 중간 및 등장성 완충액, 저장성 완충액 및 고긴장성 완충액을 준비하고 삼투압계로 완충액의 삼투압을 측정하여 삼투압도(Osm)가 허용 가능한 편차만 있는 예상 범위에 있는지 확인합니다.
- 세포 배양 배지: 10% 소 태아 혈청(FBS) 및 1% 페니실린/스트렙토마이신이 보충된 Dulbecco's Modified Eagle Medium(DMEM)을 준비합니다.
- 등장성 이미징 버퍼(~340mOsm): 150mM NaCl, 6mM KCl, 1mM MgCl2, 1.5mM CaCl2, 10mM D(+)-글루코스 및 10mM 4-(2-하이드록시 에틸)-1-피페라진 에탄 설폰산(HEPES)을 혼합하여 등장성 이미징 버퍼를 준비합니다.
- 저음석 이미징 버퍼(~250mOsm): 105mM NaCl, 6mM KCl, 1mM MgCl2, 1.5mM CaCl2, 10mM D(+)-포도당 및 10mM Hepes를 혼합하여 저장성 이미징 버퍼를 준비합니다.
- 고긴장 이미징 버퍼(~500mOsm): 160mM D(-)-만니톨, 150mM NaCl, 6mM KCl, 1mM MgCl2, 1.5mM CaCl2, 10mM D(+)-포도당 및 10mM Hepes를 혼합하여 고긴장 이미징 버퍼를 준비합니다.
참고: 완충액은 조사 대상에 따라 특정 약물로 보충될 수 있습니다.
2. 유리 바닥 접시에 부착 세포의 성장
- 공여자 또는 수용체 형광단에 융합된 관심 단백질(POI)로만 형질주입을 위한 접시를 하나 이상 준비하고, 공여자와 수용체 쌍을 가진 형질주입을 위해 하나 이상의 접시를 준비합니다(표 1 및 그림 2). 유리 바닥 접시를 사용하여 형광 현미경 검사를 허용합니다. 세포 유형에 따라 특수 세척 또는 폴리리신으로 코팅하여 표면을 전처리합니다.
참고: 여기서 FRET 공여체 mCerulean3 (mCer)54 및 FRET 수용체 mVenus (mVen)55 는 FRET 쌍으로 사용되지만 형광단의 다른 조합도 적용할 수 있습니다. 공여체 또는 수용체 단독으로 융합된 POI를 발현하는 샘플을 사용하여 수용체 채널에서 공여체 블리드를 교정하고 공여체 여기 파장에 의한 수용체의 교차 여기(cross excitation)를 보정하는 데 필요한 보정 인자 β 및 γ(표 1)을 결정하는 데 사용됩니다(그림 2Ac, Bf). - transfection 전날, 형광 현미경 검사에 적합한 유리 바닥이 있는 35mm 접시에 2mL의 세포 배양 배지 중 1 x 105 HeLa 세포를 시딩합니다. 세포 배양 인큐베이터에서 37°C 및 5% CO2 분위기에서 하룻밤 동안 세포를 배양합니다.
참고: 시약의 부피는 다른 크기의 다른 세포 배양 접시/플라스크의 표면적에 맞게 조정할 수 있습니다. 세포 수는 다양한 세포주와 실험적 접근 방식에 적합한 밀도에 맞게 조정할 수 있습니다.- 진공 펌프를 사용하여 T75 세포 배양 플라스크에서 배양된 부착 세포의 단층에서 세포 배양 상등액을 흡입합니다.
- 세포 배양 플라스크에 Dulbecco의 DPBS(Phosphate Buffered Saline) 10mL를 첨가하고 나중에 진공 펌프로 용액을 흡인하여 세포를 세척합니다.
- 1mL의 0,05% 트립신-EDTA로 세포를 완전히 덮고 세포 배양 인큐베이터에서 37°C 및 5% CO2 분위기에서 2분 동안 세포를 배양합니다.
- 9mL의 세포 배양 배지를 추가하고 피펫팅으로 세포를 현탁시킵니다.
- 세포 현탁액을 15mL 튜브로 옮기고 실온(RT)에서 3분 동안 700 x g 으로 원심분리합니다.
- 진공 펌프로 상층액을 흡입하고 세포 배양 배지 10mL에 세포 펠렛을 재현탁합니다.
- 튜브에 동일한 부피의 세포 현탁액과 0.4% 트리판 블루를 혼합하고 카운팅 슬라이드에 10μL를 추가합니다. 슬라이드를 자동 세포 카운터에 놓고 세포 계수에 적합한 프로그램을 사용하여 계수를 시작합니다.
- 각 접시에 필요한 세포 현탁액의 부피를 계산하려면 접시당 필요한 세포 수(1 x 105)를 세포 계수기에서 얻은 밀리리터당 세포 수로 나눕니다.
- 접시당 필요한 부피(2mL)의 접시당 필요한 세포 수와 추가 접시 1개에 대한 양을 포함하는 적절한 튜브에 세포 현탁액을 준비합니다.
- 각 접시에 세포 현탁액 2mL를 튜브와 피펫으로 뒤집어 세포 현탁액을 최소 20회 혼합합니다.
- 세포가 보다 균일하게 분포되도록 하려면 세포 배양 인큐베이터에 넣기 전에 접시를 RT에서 30분 동안 그대로 두십시오.
3. 세포 transfection
참고: 여기서, FuGENE은 형질주입 시약으로 사용되었습니다. 다른 transfection 시약 및 방법도 적용할 수 있습니다. transfection 시약에 대한 plasmid DNA(pDNA)의 최적 비율과 각 POI 및 세포 모델에 대한 최적 발현 시간을 경험적으로 평가해야 합니다. 여기서, 35 mm 접시당 2 μg의 총 pDNA를 사용하였다. FRET donor 및 acceptor 구조체는 1:1 비율로 사용되었으며, pDNA와 transfection 시약의 비율은 1:4였습니다(표 1).
- transfection하기 전에 세포 배양 상등액을 예열된 새 배지 2mL로 교체합니다.
- pDNA를 Opti-Minimal Essential Medium(MEM)에서 최종 부피 100μL(=pDNA 용액)로 희석합니다.
- Opti-MEM에서 transfection 시약을 최종 부피 100μL(=시약 용액)로 희석합니다.
참고: 보다 균일한 transfection을 위해 pDNA 및 시약 용액에 대한 마스터 믹스를 준비하십시오. - pDNA와 시약 용액을 잘 혼합합니다.
- pDNA 용액을 시약 용액(=transfection solution)에 추가합니다.
- transfection 용액을 잘 혼합합니다.
- RT에서 15분 동안 transfection 용액을 배양합니다.
- transfection solution을 나선형으로 접시에 적가합니다.
- 접시를 벤치 표면에서 수평, 수직으로 5회 움직여 섞습니다.
- 세포 배양 인큐베이터에서 37°C 및 5% CO2 분위기에서 하룻밤 동안 세포를 배양합니다.
| 조건 | 구문 (들) | 견본 | 에 사용됩니다 |
| 1 | LRRC8A-m세룰리안 | 기부자 구문만 | 보정 계수 β 결정 |
| 2 | LRRC8E-m비너스 | Acceptor 구문만 | 보정 계수 결정 γ |
| 3 | LRRC8A-mCerulean 및 LRRC8E-mVenus | 프렛 페어 | SE-FRET 정량화 |
표 1: 공여체(mCerulean3)에 융합된 LRRC8A 소단위체와 수용체(mVenus) 형광단에 융합된 LRRC8E 소단위로 구성된 채널의 LRRC8/VRAC 활성을 측정하기 위한 일반적인 SE-FRET 실험에 필요한 조건의 예.
4. 보정 계수 결정을 위한 이미지 획득
참고: FRET 동안 감지된 수용체의 방출로 공여체 방출의 블리드스루가 있습니다. 또한, 공여체 여기 파장에 의한 수용체 형광단의 교차 여기(cross-excitation)가 있습니다. 이러한 프로세스는 SE-FRET을 계산하는 동안 보상되어야 합니다. 이를 위해, transfection 24시간 후에 FRET donor 또는 acceptor만 발현하는 세포에서 correction factor를 측정합니다. 여기에서 이미징은 Leica LED8 램프, 필터 큐브 CYR71010, HC PL APO 63x/1.40 OIL 대물렌즈, 460/80 및 553/70용 롱 패스 필터 및 Leica DFC9000GTC 카메라가 장착된 Leica THUNDER Imager에서 수행되었습니다. 실험은 환경 제어 없이 수행되었지만 pH를 안정화하기 위해 이미징 버퍼에 HEPES가 있는 상태에서 수행되었습니다. 장기 관찰/측정을 위해서는 환경 제어 시스템을 사용하는 것이 좋습니다. 분석을 위해 SE-FRET는 캡처된 원시 이미지에서 계산됩니다. 이 작업은 획득 중 또는 이후에 동시에 수행할 수 있습니다. 여기에서 SE-FRET 플러그인이 포함된 Leica LAS X 소프트웨어를 사용하여 보정 계수 계산과 관련된 실험 절차를 단순화하고 이미지 획득 중 SE-FRET 값 변화를 실시간으로 시각화했습니다. 수집 후의 경우, 아래 제공된 프로토콜에 따라 원시 데이터 수집 후 다른 소프트웨어 패키지(예: FIJI)로 보정 계수 및 SE-FRET를 결정할 수 있습니다.
- 보정 인자를 계산하기 위해 transfection된 단일 세포의 이미지를 획득하기 전에 FRET 쌍을 발현하는 하나의 샘플을 사용하여 모든 채널(donor excitation/donor emission DD, donor/acceptor DA 및 acceptor/acceptor AA, 표 1 및 그림 2C 및 그림 3A 참조)에 대한 현미경 설정을 지정합니다.
참고: 위에서 설명한 대로 transfection된 mCerulean3 및 mVenus 태그가 지정된 VRAC 서브유닛을 사용한 SE-FRET 측정의 경우 8x8 픽셀 비닝, 100ms 노출 시간 및 10% LED 램프 강도 매개변수가 사용되었습니다. - donor 구조체를 발현하는 샘플만 취하고(그림 2A), 세포 배양 배지를 흡인하고 2mL의 등장계 완충액으로 세포를 3회 세척합니다.
- 3mL의 등장성 완충액을 추가하고 샘플을 현미경 스테이지에 놓습니다.
- donor construct를 발현하는 cell이 하나 이상 있는 field of view(FOV)를 찾습니다.
- 모든 채널을 이미지화합니다(DD, DA 및 AA는 표 2 및 그림 2A 참조).
- 세포/셀 주위에 관심 영역(ROI)을 그리고 DA의 평균 강도를 측정합니다(= IDA; 그림 2Ac) 및 DD (= IDD; 그림 2Aa).
- 배경 빼기의 경우 배경 신호만 발견되는 DA 및 DD 채널에서 ROI를 그리고 평균 강도(IBDA 및 IBDD)를 측정합니다.
- 해당 채널의 셀 ROI에서 측정된 평균 강도에서 배경 ROI의 평균 강도를 뺍니다(
 및
및 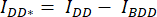 ).
). - 수용체 구문만 발현하는 샘플에 대해 4.2-4.5단계를 반복합니다(그림 2B).
- 셀 주위에 ROI를 그리고 DA의 평균 강도를 측정합니다(= IDA; 그림 2Bf) 및 AA (= IAA; 그림 2Be).
- 배경 빼기의 경우 배경 신호만 발견되는 DA 및 AA 채널에서 ROI를 그리고 평균 강도(IBDA 및 IBAA)를 측정합니다.
- 해당 채널의 셀 ROI에서 측정된 평균 강도에서 배경 ROI의 평균 강도를 뺍니다(
 및
및 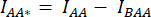 ).
). - IDA*, IDD* 및 IAA* 에 대해 결정된 값을 사용하여 보정 계수
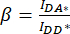 및
및 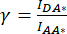 를 계산합니다.
를 계산합니다.
이에 의해, 보정 계수(β)는 DA 채널로의 공여체 방출의 블리드-스루(bleed-through)를 보상하기 위해 사용된다. 보정 계수 γ는 DA 채널에서 donor excitation 파장에 의한 acceptor fluorophore의 cross-excitation을 보상하는 데 사용됩니다.
| 여기의 | 방출 | 채널 이름 | LED 라인 | 필터 큐브 | 장역 통과 필터 |
| 기증자 | 기증자 | 디디 | 440 nm의 | CYR71010 | 80 nm 분량의 460 |
| 기증자 | 어음 인수인 | 다 | 440 nm의 | CYR71010 | 535/70 nm 수준 |
| 어음 인수인 | 어음 인수인 | 금주 | 510 nm 수준 | CYR71010 | 535/70 nm 수준 |
표 2: SE-FRET 실험에 필요한 채널 요약.
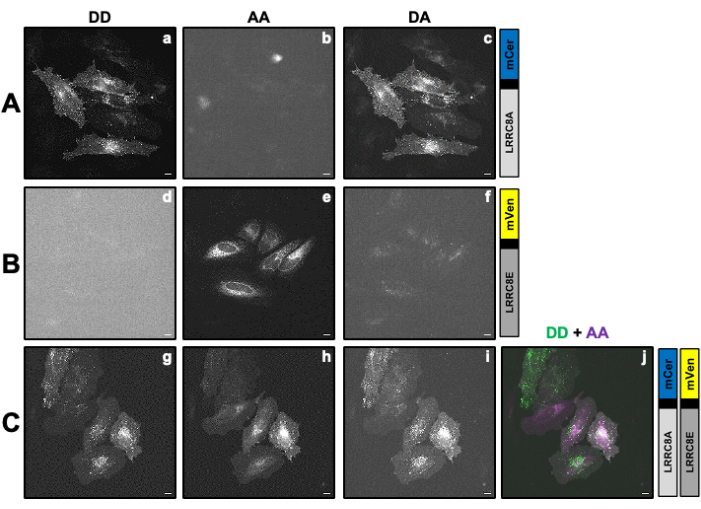
그림 2: SE-FRET 측정에 의해 공여체 mCerulean3(mCer)에 융합된 LRRC8A 소단위와 수용체 mVenus(mVen) 형광단에 융합된 LRRC8E 소단위로 구성된 채널의 VRAC 활성을 결정하는 데 필요한 보정 계수 β 및 γ 계산하는 데 사용되는 샘플의 대표적인 형광 이미지. (A,B) HeLa 세포에서 공여자/공여자: AA, 공여자/수용자 AA 및 공여자/수용자 DA 채널의 검출은 공여자(A) LRRC8A-mCer 또는 수용자(B) LRRC8E-mVen만 발현합니다. (C) 공여자 및 수용체 쌍 LRRC8A-mCer 및 LRRC8E-mVen과 함께 형질 주입된 HeLa 세포에서 DD, AA 및 DA 채널 검출. 패널 a-i는 기증자 검출 채널에서 촬영된 이미지(공여자의 여기 및 공여자의 신호 감지; DD입니다. A, D 및 G), 수용체 검출 채널(수용체의 여기 및 수용체 신호의 검출; AA입니다. b, e, 및 h) 및 FRET 신호 검출 채널(공여체의 여기 및 수용체 신호의 검출; 다; C, F 및 I)를 사용합니다. 패널 j는 패널 g와 h의 오버레이입니다. DD 채널은 녹색으로, AA 채널은 자홍색으로 표시됩니다. 스케일 바 = 10μm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
5. SE-FRET 정량화를 위한 타임랩스 이미징
- donor 및 acceptor 구조체(표 1, 그림 2C 및 그림 3A)를 발현하는 샘플을 취하여 세포 배양 배지를 흡인하고 transfection 24시간 후 2mL의 등장성 완충액으로 세포를 3회 세척합니다.
- 3mL의 등장계 완충액을 추가하고 샘플을 현미경 스테이지에 놓습니다.
- 나중에 등장성 완충액을 흡인하려면 캐뉼라 팁이 접시 바닥에 닿도록 호스 캐뉼라를 고정하고 조정하십시오.
- 완충액을 추가하려면 중력 흐름에 의해 구동되는 완충액이 접시로 떨어질 수 있도록 튜브를 고정하고 조정하십시오.
참고: 여기서는 버퍼 흐름을 제어하기 위해 4개의 마그네틱 밸브가 있는 밸브 제어 중력 관류 시스템이 사용되었지만 다른 방법도 적용할 수 있습니다. - donor와 acceptor construct를 동시에 발현하는 cell이 하나 이상 있는 FOV를 찾습니다.
- 자극 시퀀스의 모든 조건(예: 기준선의 12주기와 조건당 15주기)을 다루기 위해 10초 간격과 기간으로 채널 DD, DA 및 AA에 대한 타임랩스 실험을 설정합니다(그림 3).
참고: 주기의 간격과 수는 실험 요구에 따라 채택할 수 있지만 더 나은 시각화 및 데이터 비교를 위해 정규화를 위한 기준선 측정을 항상 포함해야 합니다. - 기준선 측정 후 첫 번째 조건에 대해 버퍼에서 샘플을 세척합니다.
- 호스 캐뉼라를 통해 등장성 완충액을 흡입하고 주사기로 진공을 적용합니다.
- 중력 흐름에 의해 다음 조건의 완충액 3mL를 추가합니다.
- 완충액을 흡입하고 동일한 완충액 3mL를 다시 추가합니다.
- 5.7.3단계를 한 번 더 반복합니다.
- 첫 번째 조건을 측정한 후 s를 세척합니다.amp다음 조건을 위해 버퍼에서 le를 사용합니다(단계 5.7.1-5.7.4).
- 모든 조건이 캡처될 때까지 5.5-5.8단계를 반복합니다.
- SE-FRET 정량화의 경우 셀 주위에 ROI를 그리고 시계열의 모든 이미지(시점)에 대한 DD = (IDD), DA(IDA) 및 AA(IAA) 채널의 평균 강도를 측정합니다(그림 3A, B).
- FRET 신호에 대한 배경 빼기의 경우, 배경 신호만 발견되는 DA 채널에서 ROI를 그리고 평균 강도(IBDA)를 측정합니다.
- DA 채널의 셀 ROI에서 측정된 평균 강도에서 배경 ROI의 평균 강도를 뺍니다().

- 결정된 값을 사용하여 각 ROI 및 모든 시점
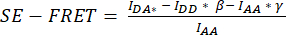 에 대한 평균 SE-FRET 값을 계산합니다.
에 대한 평균 SE-FRET 값을 계산합니다. - 서로 다른 조건을 더 잘 비교하고 SE-FRET 값을 시각화하려면 각 ROI의 기준선 값의 평균을 사용하여 해당 ROI의 모든 시점을 정규화합니다.
- 시간 경과에 따른 정규화된 SE-FRET 값을 플로팅합니다(그림 3B).
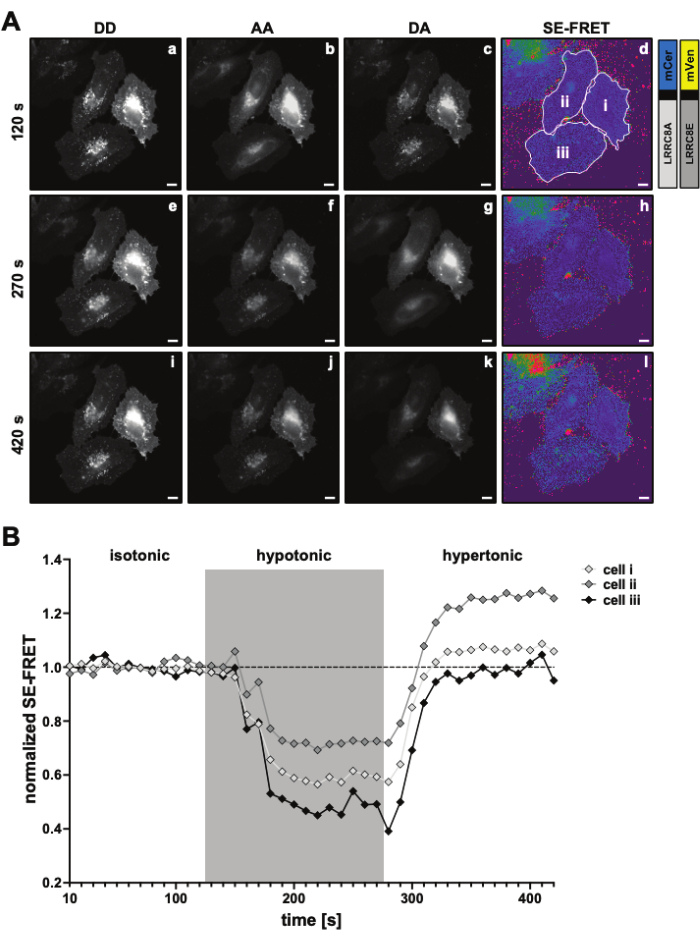
그림 3: 대표적인 형광 이미지 및 SE-FRET 정량화.(A) 대표적인 형광 이미지와 첫 번째 시점의 겉보기 SE-FRET은 긴장도에 따라 LRRC8A 및 LRRC8E 서브유닛으로 구성된 채널의 SE-FRET에 의한 VRAC 활성을 측정하는 실험입니다. 눈금 막대 = 10μm. 동일한 셀이 그림 2C에 나와 있습니다. 패널 a-i는 DD, AA 및 DA 채널의 검출과 계산된 겉보기 SE-FRET를 보여줍니다. 흰색 윤곽선은 DD, AA 및 DA의 평균 신호 강도를 측정하는 데 사용되는 ROI(패널 d의 셀 i-iii)와 명백한 SE-FRET 이미지를 나타냅니다. (B) 시간 경과에 따른 SE-FRET 값의 정량화. 조건의 순서는 12 사이클의 등장성 이미징 버퍼(기준선)와 15 사이클의 하이토닉 이미징 버퍼였습니다. 각 ROI(셀 i-iii) 및 시점의 원시 평균 SE-FRET 값은 해당 ROI에 대한 기준선(isotonic) 값의 평균으로 정규화되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
결과
이 FRET 기반 방법을 사용하면 삼투압 자극 중에 LRRC8/VRAC 활성을 모니터링할 수 있으며 SE-FRET의 감소는 세포 외 긴장저하도의 정도와 상관관계가 있습니다45. 긴장저하로 인한 채널 활성화에 대한 대표적인 결과도 여기에 나와 있습니다(그림 3 및 그림 4). 또한, 디아실글리세롤 신호전달45 의 조작 또는 근세포 활성화56 동안과 같은 다양한 동방성 자극에 의한 LRRC8/VRAC 활성화를 관찰할 수 있습니다.
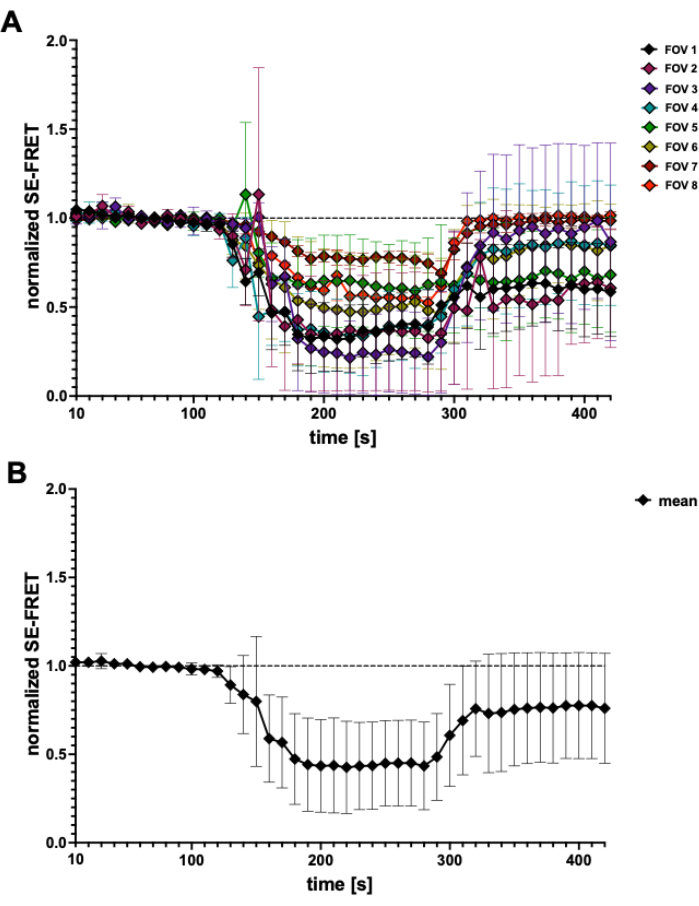
그림 4: SE-FRET 추적. (A) 5개의 독립적인 실험에서 나타난 명백한 SE-FRET 추적. 데이터는 시야(FOV)당 ± 셀의 N = 2에서 N = 7개의 SD를 나타냅니다. (B) 모든 셀의 평균 ± SD(N = 31 셀). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
LRRC8/VRAC 채널은 또한 세포사멸 부피 감소24,57에 관여하기 때문에, 세포사멸 유도 시 채널 활동을 관찰하는 것은 여기에 설명된 방법에 대한 또 다른 응용이 될 것입니다. 이에 따라 LRRC8A-mCerulean3 및 LRRC8E-mVenus를 발현하는 HeLa 세포에서 SE-FRET을 모니터링하기 위한 프로토콜은 사멸 수용체 매개 세포사멸 유도 약물을 적용하면서 수행되었습니다. 종양괴사인자(TNF)-α와 시클로헥시미드(CHX)는 이전에 몇 분 이내에 VRAC 전류를 유발하는 것으로 나타났다58. 등장성 완충액에 2ng/mL TNF-α 및 1μg/mL CHX를 첨가한 후 SE-FRET가 크게 감소했습니다(그림 5). 완충액을 긴장성 매질로 대체하면 TNF-α와 CHX가 포함되어 있음에도 불구하고 SE-FRET 값이 기준선에 가깝게 회복되었으며(그림 5A), 이는 세포사멸 유도 Fas 리간드로 치료하는 동안 긴장성 수용액에서 VRAC 전류가 감소하는 것과 일치합니다58. TNF-α 및 CHX의 용매인 DMSO로 세포를 처리한 결과 SE-FRET가 감소하지 않았습니다. TNF-α + CHX는 FRET 제어59로 EYFP 및 ECFP 탠덤 구성물인 CFP-18aa-YFP의 SE-FRET에 영향을 미치지 않았으며, 이는 LRRC8/VRAC에 대한 특이성을 입증했습니다(그림 5B).
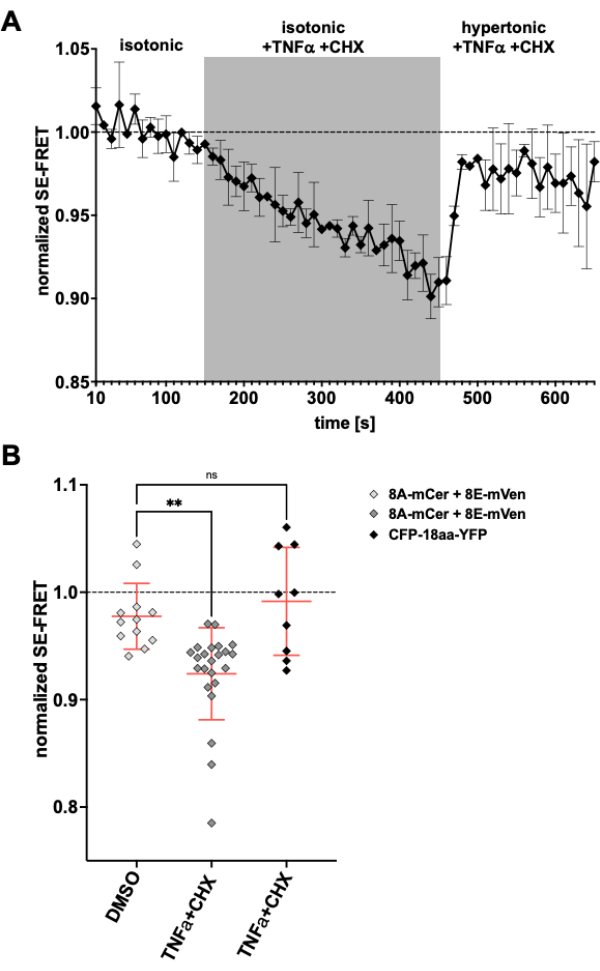
그림 5: 사멸 수용체 매개 세포사멸에 의한 등방성 VRAC 활성화. (A) 시간 경과에 따른 HeLa 세포(n = 8개 접시, 23개 세포)를 발현하는 LRRC8A-mCer/LRRC8E-mVen의 정규화된 SE-FRET 값. 등장성 이미징 버퍼(기준선)에서 15회 후, 수조 용액을 30회 주기 동안 2ng/mL TNF-α 및 1μg/mL 시클로헥시미드(CHX)가 보충된 등장성 완충액으로 교체한 후 TNF-α 및 CHX가 포함된 20회 주기의 긴장성 이미징 완충액으로 교체했습니다. 각 ROI 및 시점의 원시 평균 SE-FRET 값은 각 ROI에 대한 기준선(isotonic) 값의 평균으로 정규화되었습니다. (B) CHX(n = 5개 접시, 12개 세포)에 대한 비히클 제어로 DMSO를 포함하는 등장성 용액 또는 A(n = 8개 접시, 23개 세포)와 같이 세포사멸 유도제를 포함하는 등장성 완충액 또는 세포사멸 유도자(n = 3개 접시, 9개 세포)로 CFP-18aa-YFP를 발현하는 HeLa 세포의 A에서와 같이 LRRC8A/E를 발현하는 HeLa 세포의 정규화된 SE-FRET 값의 정량화. 데이터는 개별 셀(기호)의 각 버퍼에 있는 마지막 10개 시점의 평균과 SD에 ± 모든 셀의 평균을 나타냅니다. ** p < 0.01 일반 일원 분산 분석과 Tukey의 다중 비교 사후 검정. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
FRET 현미경 검사는 단백질 간의 상호 작용을 연구하기 위해 널리 사용되는 잘 정립된 기술입니다. 따라서 FRET 기반 분석법은 다양한 전문 지식을 갖춘 많은 실험실에 적용할 수 있습니다. 게이팅 중 구조적 재배열은 FRET 기반 분석을 사용하여 광범위한 이온 채널에 대해 모니터링되었습니다(예: 참고 문헌 34,50,51,52,53,60,61,62,63,64,65,66,67 참조)), 어떤 경우에는 패치 클램프 형광 측정법의 전기 생리학과 결합 68,69,70,71. FRET는 이러한 이온 채널의 구조-기능 관계를 연구하거나 이온 수송과 무관하게 그 활성을 모니터링하는 데 사용할 수 있습니다. 여기에 제시된 방법은 현장에서 LRRC8/VRAC 채널의 활동을 모니터링할 수 있기 때문에 전기생리학에 비해 분명한 이점이 있을 수 있습니다.
프로토콜의 중요한 단계에는 transfection 및 imaging을 위한 최적의 confluency에 도달하기 위해 세포를 도금하는 것이 포함되며, 이는 향후 분석을 위해 세포를 쉽게 구별할 수 있도록 이상적으로 촉진합니다. 서로 다른 subunit의 효과적인 co-transfection은 올바른 subcellular localization을 위해 매우 중요합니다. 예를 들어, non-LRRC8A 서브유닛이 과도하게 생성되면 소포체(ER) 국소화가 향상됩니다4. 따라서 플라스미드 비율을 조정해야 할 수 있습니다. 시스템에 따라 새로 생성된 FRET 쌍은 예를 들어 수용체 표백을 통해 검증해야 합니다. 비닝(Binning)과 노출 시간(exposure time)은 연구 질문에 대한 최적의 시간적, 공간적 해상도를 가능하게 하기 위해 서로 균형을 이루어야 합니다. Binning을 사용하면 노출 시간을 단축할 수 있으므로 FRET 센서의 잠재적인 표백을 줄이면서 공간 해상도를 줄일 수 있습니다. 따라서 실험 설정에서 예를 들어 LRRC8/VRAC 활성의 세포 내 구별이 필요한 경우 비닝을 피해야 합니다. 연구 질문은 타임랩스 시리즈에서 주기의 수와 간격을 동등하게 결정합니다. 간격은 FRET 변화의 역학(따라서 LRRC8/VRAC 활성화/불활성화)이 필요한 경우에만 관련이 있습니다. 그렇지 않으면 간단한 "전후" 녹음도 수행할 수 있습니다. 실험의 길이는 생리학적 과정에 따라 다릅니다. 이상적으로는 SE-FRET가 안정화될 때까지 자극에 대한 LRRC8/VRAC 활동을 모니터링해야 합니다. 이러한 요인은 파일럿 실험에서 결정할 수 있습니다. 실제 SE-FRET 신호를 계산하기 위한 보정 계수는 모든 조건에 대해 결정되어야 합니다. 잘못 결정된 보정 계수는 SE-FRET 강도를 과대 또는 과소 평가로 이어질 수 있습니다. 마지막으로, 안정적인 기준선을 설정한 후에는 관심 있는 생리학적 과정을 포착할 수 있을 만큼 이미지 간의 시간 간격이 짧아야 합니다.
이 방법에는 몇 가지 제한 사항이 있습니다. 그 중 하나는 LRRD의 움직임을 반영하는 동안 inter-LRRC8 FRET 강도의 변화가 반드시 공극을 통한 이온 또는 삼투압 수송과 일치하는 것은 아니라는 것입니다. 이것은 최소 전류 4,32,72에도 불구하고 LRRC8A 호질머45에서 관찰 된 FRET 변화에서 분명합니다. LRRC8/VRAC 채널의 기공 차단제는 FRET 신호에 영향을 미치지 않을 수 있으므로 이 방법은 특정 채널 변조기 검색에 적합하지 않습니다. 더욱이, 과발현된 LRRC8 단백질의 발현 수준은 특히 C-말단으로 표지된 LRRC8 단백질이 기저 활성을 나타내기 때문에 관찰되는 생리학적 과정에 영향을 미칠 수 있습니다14.
특정 연구 질문에 따라 제한 또는 장점으로 간주될 수 있는 측면은 이 방법에서는 이소적으로 발현된 LRRC8 subunit만 선택적으로 측정된다는 것입니다. 따라서 내인성 단백질의 배경 수준은 측정을 거의 방해하지 않습니다. 반면에, 과발현된 단백질은 잠재적으로 다른 소단위 구성 및 화학량론을 가진 내인성 LRRC8 채널처럼 행동하지 않을 수 있습니다. 예를 들어, 산화와 같은 다양한 자극은 상이하게 구성된 LRRC8 채널(36)에 반대되는 변조 효과를 가질 수 있다. 함께 발현된 소단위체 간의 비율을 변경함으로써 화학량론 및 전체 이온 전도도를 조정할 수 있지만(14,73), 하나의 복합체21 내에 종종 두 개 이상의 파라로그(paralog)를 가질 가능성이 있는 기본 구성은 명확하지 않으며 세포 유형에 따라 다를 수 있습니다 74,75,76. 또한, LRRC8 단백질의 세포질 C-말단에 대한 형광 단백질의 융합은 제노푸스 난모세포14에서 기초 LRRC8/VRAC 채널 활성을 증가시키는 것으로 나타났는데, 이는 큰 태그가 채널 개방을 지배할 수 있는 LRRD의 형태를 조절하기 때문일 수 있습니다 14,44,45. 따라서 형광 단백질의 크기, 링커 및 배향은 FRET 효율뿐만 아니라 채널 활성에도 영향을 미칠 수 있습니다. 그러나, 중요한 것은, 형광 단백질과 융합된 LRRC8 단백질의 VRAC 채널은 저긴장 자극14에 반응하는 상태를 유지하여, FRET 센서45로 사용할 수 있었다는 것이다.
다른 방법과 비교하여 광학 현미경으로 LRRC8/VRAC 채널 활성을 모니터링하는 이 비침습적 방법의 장점은 다음과 같습니다: (i) 전기생리학을 위해 일반적으로 접근할 수 없는 세포 또는 구획 내에서 LRRC8/VRAC를 관찰할 수 있습니다. 여기에는 LRRC8 복합체가 발견되거나 45,77,78을 표적으로 할 수 있는 세포 내 소기관이 포함됩니다. (ii) 세포질 조성은 방법에 의해 변경되지 않은 상태로 유지되는 반면, 전체 세포 패치-클램프 측정 중에 세포질은 대부분 피펫 용액으로 대체되며, 이는 phorbol-12-myristate-13-acetate (PMA) 유도 LRRC8/VRAC 활성화에서 관찰된 신호 경로에 영향을 미칠 수 있습니다45. (iii) 세포 이동 중 선행 및 후행 가장자리에서 활동을 구별하는 것과 같은 세포 내 해상도로 LRRC8/VRAC 활성화를 관찰할 수 있는 가능성을 제공하며, 여기서 -제한된 공간으로 제한됨-VRAC가 연루되어 있습니다 79,80. (iv) 근세포 분화와 같은 확장된 생리학적 과정 동안 LRRC8/VRAC 활성을 지속적으로 모니터링할 수 있습니다56.
이 방법에는 한계와 과제가 있지만 동물 모델의 잠재적 응용 프로그램을 포함하여 추가 탐구에 대한 약속이 있습니다. 이 이온 및 삼투압 채널 제품군을 연구하기 위한 다른 방법과 함께 이 FRET 기반 분석은 활성화 메커니즘을 밝히고 고유 환경에서 LRRC8 채널의 다양한 생리학적 기능을 탐색하는 데 크게 기여할 수 있습니다.
공개
저자는 공개할 이해 상충이 없습니다.
감사의 말
CFP-18aa-YFP 구조체를 인코딩하는 플라스미드를 선물해 주신 C.F. Kaminski, 기술 지원을 주신 A. Klemmer, 그리고 이 방법의 개발에 기여한 Stauber 실험실의 모든 전현직 구성원에게 감사드립니다.
자료
| Name | Company | Catalog Number | Comments |
| 0.05% Trypsin-EDTA | gibco | 25300-054 | |
| Camera DFC9000GTC | Leica | 11547007 | |
| CFP-18aa-YFP | N/A | N/A | Elder et al. 2009 PMCID: PMC2706461; Gift from C.F. Kaminski (University of Cambridge, UK) |
| Cycloheximide (CHX) | Sigma-Aldrich | 66-81-9 | |
| D(-)-Mannitol | Carl Roth | 4175.1 | |
| D(+)-Glucose | Carl Roth | HN06.1 | |
| DMEM (Dulbeccos Modified Eagle Medium) | PAN-Biotech | P04-03590 | |
| DPBS (Dulbecco's Phosphate Buffer Saline) | PAN-Biotech | P04-36500 | |
| Emission filter wheel (460/80, 535/70, 590/50, 642/80, 100%) | Leica | 11525480 | |
| FBS (Fetal Bovine Serum) | PAN-Biotech | P30-3302 | |
| Filter cube CYR71010 | Leica | 11525416 | |
| FuGENE | Promega | E2691 | |
| Glas Bottom Culture Dishes 35 mm | MatTek | P35G-0-10-C | |
| HeLa cells | Leibniz Forschungsinstitut DSMZ | ACC 57 | Mammalian cervix carcinoma/ Obtained from Leibniz Forschungsinstitut DSMZ |
| HEPES | Carl Roth | 9105.4 | |
| ibidi µ-Disch 35 mm | ibidi | 81156 | |
| KCl (Potassium chloride) | Carl Roth | 6781.1 | |
| LAS X FRET Wizard | Leica | 11640862 | |
| Light source LED8 | Leica | 11504256 | |
| LRRC8A-mCerulean3 | N/A | N/A | König et al. 2019 |
| LRRC8E-mVenus | N/A | N/A | König et al. 2019 |
| Luna-II Automated Cell Counter | logos biosystems | L40002 | |
| Luna-II Cell Counter Slides | logos biosystems | L12001 | |
| MgCl2 (Magnesium chloride) | Carl Roth | KK36.1 | |
| Microscope THUNDER Imager live cell | Leica | 11525681 | |
| NaCl (Sodium chloride) | Carl Roth | 9263 | |
| Objective HC PL APO 63x/1.40 OIL | Leica | 11506349 | |
| Opti-Minimal Essential Medium (MEM) | gibco | 11058 | |
| Osmometer OM807 | Vogel | V04807 | |
| Penicillin Streptomycin (Pen Step) | gibco | 15070-063 | |
| Trypan blue solution (0,4%) | Sigma | T8154 | |
| Tumor necrosis factor (TNF)-a | Sigma-Aldrich | 94948-59-1 | |
| Valve Controlled Gravity Perfusion System | ALA Scientific Instruments | VC3-4xG |
참고문헌
- Jentsch, T. J. VRACs and other ion channels and transporters in the regulation of cell volume and beyond. Nat Rev Mol Cell Biol. 17 (5), 293-307 (2016).
- Chen, L., et al. More than just a pressure relief valve: physiological roles of volume-regulated LRRC8 anion channels. Biol Chem. 400 (11), 1481-1496 (2019).
- Qiu, Z., et al. SWELL1, a plasma membrane protein, is an essential component of volume-regulated anion channel. Cell. 157 (2), 447-458 (2014).
- Voss, F. K., et al. Identification of LRRC8 heteromers as an essential component of the volume-regulated anion channel VRAC. Science. 344 (6184), 634-638 (2014).
- Hoffmann, E. K., Schettino, T., Marshall, W. S. The role of volume-sensitive ion transport systems in regulation of epithelial transport. Comp Biochem Physiol A Mol Integr Physiol. 148 (1), 29-43 (2007).
- López-Cayuqueo, K. I., et al. Renal deletion of LRRC8/VRAC channels induces proximal tubulopathy. J Am Soc Nephrol. 33 (8), 1528-1545 (2022).
- Lück, J. C., Puchkov, D., Ullrich, F., Jentsch, T. J. LRRC8/VRAC anion channels are required for late stages of spermatid development in mice. J Biol Chem. 293 (30), 11796-11808 (2018).
- Chen, L., Becker, T. M., Koch, U., Stauber, T. The LRRC8/VRAC anion channel facilitates myogenic differentiation of murine myoblasts by promoting membrane hyperpolarization. J Biol Chem. 294 (39), 14279-14288 (2019).
- Best, L., Brown, P. D., Sener, A., Malaisse, W. J. Electrical activity in pancreatic islet cells: The VRAC hypothesis. Islets. 2 (2), 59-64 (2010).
- Kang, C., et al. SWELL1 is a glucose sensor regulating beta-cell excitability and systemic glycaemia. Nat Commun. 9 (1), 367 (2018).
- Stuhlmann, T., Planells-Cases, R., Jentsch, T. J. LRRC8/VRAC anion channels enhance beta-cell glucose sensing and insulin secretion. Nat Commun. 9 (1), 1974 (2018).
- Hisadome, K., et al. Volume-regulated anion channels serve as an auto/paracrine nucleotide release pathway in aortic endothelial cells. J Gen Physiol. 119 (6), 511-520 (2002).
- Burow, P., Klapperstück, M., Markwardt, F. Activation of ATP secretion via volume-regulated anion channels by sphingosine-1-phosphate in RAW macrophages. Pflügers Arch. 467 (6), 1215-1226 (2015).
- Gaitán-Peñas, H., et al. Investigation of LRRC8-mediated volume-regulated anion currents in Xenopus oocytes. Biophys J. 111 (7), 1429-1443 (2016).
- Lahey, L. J., et al. LRRC8A:C/E heteromeric channels are ubiquitous transporters of cGAMP. Mol Cell. 80 (4), 578-591 (2020).
- Chen, X., et al. Regulation of anion channel LRRC8 volume-regulated anion channels in transport of 2'3'-cyclic GMP-AMP and cisplatin under steady state and inflammation. J Immunol. 206 (9), 2061-2074 (2021).
- Zhou, C., et al. Transfer of cGAMP into bystander cells via LRRC8 volume-regulated anion channels augments STING-mediated interferon responses and anti-viral immunity. Immunity. 52 (5), 767-781 (2020).
- Feustel, P. J., Jin, Y., Kimelberg, H. K. Volume-regulated anion channels are the predominant contributors to release of excitatory amino acids in the ischemic cortical penumbra. Stroke. 35 (5), 1164-1168 (2004).
- Mongin, A. A. Volume-regulated anion channel--a frenemy within the brain. Pflügers Arch. 468 (3), 421-441 (2016).
- Schober, A. L., Wilson, C. S., Mongin, A. A. Molecular composition and heterogeneity of the LRRC8-containing swelling-activated osmolyte channels in primary rat astrocytes. J Physiol. 595 (22), 6939-6951 (2017).
- Lutter, D., Ullrich, F., Lueck, J. C., Kempa, S., Jentsch, T. J. Selective transport of neurotransmitters and modulators by distinct volume-regulated LRRC8 anion channels. J Cell Sci. 130 (6), 1122-1133 (2017).
- Yang, J., et al. Glutamate-releasing SWELL1 channel in astrocytes modulates synaptic transmission and promotes brain damage in stroke. Neuron. 102 (4), 813-827 (2019).
- Lee, C. C., Freinkman, E., Sabatini, D. M., Ploegh, H. L. The protein synthesis inhibitor blasticidin s enters mammalian cells via leucine-rich repeat-containing protein 8D. J Biol Chem. 289 (24), 17124-17131 (2014).
- Planells-Cases, R., et al. Subunit composition of VRAC channels determines substrate specificity and cellular resistance to Pt-based anticancer drugs. EMBO J. 34 (24), 2993-3008 (2015).
- Model, M. A., Nia, F. H., Zook, E., Hollembeak, J. E., Stauber, T. Uptake of fluorescein upon osmotic cell swelling is dependent on the volume-regulated anion channel VRAC/LRRC8. Paracelsus Proc Exp Med. 1 (1), 3-14 (2022).
- Stauber, T. The volume-regulated anion channel is formed by LRRC8 heteromers - molecular identification and roles in membrane transport and physiology. Biol Chem. 396 (9-10), 975-990 (2015).
- Bertelli, S., et al. Mechanisms of activation of LRRC8 volume regulated anion channels. Cell Physiol Biochem. 55 (S1), 41-56 (2021).
- Liu, T., Li, Y., Wang, D., Stauber, T., Zhao, J. Trends in volume-regulated anion channel (VRAC) research: visualization and bibliometric analysis from 2014 to 2022. Front Pharmacol. 14, 1234885 (2023).
- Strange, K., Yamada, T., Denton, J. S. A 30-year journey from volume-regulated anion currents to molecular structure of the LRRC8 channel. J Gen Physiol. 151 (2), 100-117 (2019).
- Osei-Owusu, J., Yang, J., Vitery, M. D. C., Qiu, Z. Molecular biology and physiology of volume-regulated anion channel (VRAC). Curr Top Membr. 81, 177-203 (2018).
- Friard, J., Laurain, A., Rubera, I., Duranton, C. LRRC8/VRAC channels and the redox balance: A complex Relationship. Cell Physiol Biochem. 55 (S1), 106-118 (2021).
- Syeda, R., et al. LRRC8 proteins form volume-regulated anion channels that sense ionic strength. Cell. 164 (3), 499-511 (2016).
- Ullrich, F., Reincke, S. M., Voss, F. K., Stauber, T., Jentsch, T. J. Inactivation and anion selectivity of volume-regulated anion channels (VRACs) depend on C-terminal residues of the first extracellular loop. J Biol Chem. 291 (33), 17040-17048 (2016).
- König, B., Stauber, T. Biophysics and structure-function relationships of LRRC8-formed volume-regulated anion channels. Biophys J. 116 (7), 1185-1193 (2019).
- Concepcion, A. R., et al. The volume-regulated anion channel LRRC8C suppresses T cell function by regulating cyclic dinucleotide transport and STING-p53 signaling. Nat Immunol. 23 (2), 287-302 (2022).
- Gradogna, A., Gavazzo, P., Boccaccio, A., Pusch, M. Subunit-dependent oxidative stress sensitivity of LRRC8 volume-regulated anion channels. J Physiol. 595 (21), 6719-6733 (2017).
- Bertelli, S., Zuccolini, P., Gavazzo, P., Pusch, M. Molecular determinants underlying volume-regulated anion channel subunit-dependent oxidation sensitivity. J Physiol. 600 (17), 3965-3982 (2022).
- Deneka, D., Sawicka, M., Lam, A. K. M., Paulino, C., Dutzler, R. Structure of a volume-regulated anion channel of the LRRC8 family. Nature. 558 (7709), 254-259 (2018).
- Kasuya, G., et al. Cryo-EM structures of the human volume-regulated anion channel LRRC8. Nat Struct Mol Biol. 25 (9), 797-804 (2018).
- Kefauver, J. M., et al. Structure of the human volume regulated anion channel. Elife. 7, e38461 (2018).
- Takahashi, H., Yamada, T., Denton, J. S., Strange, K., Karakas, E. Cryo-EM structures of an LRRC8 chimera with native functional properties reveal heptameric assembly. Elife. 12, e82431 (2023).
- Sawicka, M., Dutzler, R. Regulators of cell volume: The structural and functional properties of anion channels of the LRRC8 family. Curr Opin Struct Biol. 74, 102382 (2022).
- Kasuya, G., Nureki, O. Recent advances in the structural biology of the volume-regulated anion channel LRRC8. Front Pharmacol. 13, 896532 (2022).
- Deneka, D., et al. Allosteric modulation of LRRC8 channels by targeting their cytoplasmic domains. Nat Commun. 12 (1), 5435 (2021).
- König, B., Hao, Y., Schwartz, S., Plested, A. J., Stauber, T. A FRET sensor of C-terminal movement reveals VRAC activation by plasma membrane DAG signaling rather than ionic strength. Elife. 8, e45421 (2019).
- Hille, B. . Ion Channels of Excitable Membranes. 3rd edn. , (2001).
- Pedersen, S. F., Okada, Y., Nilius, B. Biophysics and physiology of the volume-regulated anion channel (VRAC)/volume-sensitive outwardly rectifying anion channel (VSOR). Pflügers Arch. 468 (3), 371-383 (2016).
- Kolobkova, Y., Pervaiz, S., Stauber, T. The expanding toolbox to study the LRRC8-formed volume-regulated anion channel VRAC. Curr Top Membr. 88, 119-163 (2021).
- Galietta, L. J., Haggie, P. M., Verkman, A. S. Green fluorescent protein-based halide indicators with improved chloride and iodide affinities. FEBS Lett. 499 (3), 220-224 (2001).
- Bykova, E. A., Zhang, X. D., Chen, T. Y., Zheng, J. Large movement in the C terminus of CLC-0 chloride channel during slow gating. Nat Struct Mol Biol. 13 (12), 1115-1119 (2006).
- Zheng, J., Zagotta, W. N. Gating rearrangements in cyclic nucleotide-gated channels revealed by patch-clamp fluorometry. Neuron. 28 (2), 369-374 (2000).
- Miranda, P., et al. State-dependent FRET reports calcium- and voltage-dependent gating-ring motions in BK channels. Proc Natl Acad Sci U S A. 110 (13), 5217-5222 (2013).
- Zachariassen, L. G., et al. Structural rearrangement of the intracellular domains during AMPA receptor activation. Proc Natl Acad Sci U S A. 113 (27), E3950-E3959 (2016).
- Markwardt, M. L., et al. An improved cerulean fluorescent protein with enhanced brightness and reduced reversible photoswitching. PLoS One. 6 (3), e17896 (2011).
- Nagai, T., et al. A variant of yellow fluorescent protein with fast and efficient maturation for cell-biological applications. Nat Biotechnol. 20 (1), 87-90 (2002).
- Chen, L., König, B., Stauber, T. LRRC8 channel activation and reduction in cytosolic chloride concentration during early differentiation of C2C12 myoblasts. Biochem Biophys Res Commun. 532, 482-488 (2020).
- Maeno, E., Ishizaki, Y., Kanaseki, T., Hazama, A., Okada, Y. Normotonic cell shrinkage because of disordered volume regulation is an early prerequisite to apoptosis. Proc Natl Acad Sci U S A. 97 (17), 9487-9492 (2000).
- Shimizu, T., Numata, T., Okada, Y. A role of reactive oxygen species in apoptotic activation of volume-sensitive Cl- channel. Proc Natl Acad Sci U S A. 101 (17), 6770-6773 (2004).
- Elder, A. D., et al. A quantitative protocol for dynamic measurements of protein interactions by Förster resonance energy transfer-sensitized fluorescence emission. Journal of the Royal Society Interface. 6, S59-S81 (2009).
- Glauner, K. S., Mannuzzu, L. M., Gandhi, C. S., Isacoff, E. Y. Spectroscopic mapping of voltage sensor movement in the Shaker potassium channel. Nature. 402 (6763), 813-817 (1999).
- Dai, G., Aman, T. K., DiMaio, F., Zagotta, W. N. The HCN channel voltage sensor undergoes a large downward motion during hyperpolarization. Nat Struct Mol Biol. 26 (8), 686-694 (2019).
- Renart, M. L., et al. Conformational plasticity in the KcsA potassium channel pore helix revealed by homo-FRET studies. Sci Rep. 9 (1), 6215 (2019).
- Wang, S., et al. Potassium channel selectivity filter dynamics revealed by single-molecule FRET. Nat Chem Biol. 15 (4), 377-383 (2019).
- Harley, C. A., et al. Conformation-sensitive antibody reveals an altered cytosolic PAS/CNBh assembly during hERG channel gating. Proc Natl Acad Sci U S A. 118 (44), e2108796118 (2021).
- Han, S., et al. Structural dynamics determine voltage and pH gating in human voltage-gated proton channel. Elife. 11, e73093 (2022).
- Cullinan, M. M., Klipp, R. C., Camenisch, A., Bankston, J. R. Dynamic landscape of the intracellular termini of acid-sensing ion channel 1a. Elife. 12, e90755 (2023).
- Kim, J., Won, J., Chung, D. K., Lee, H. H. FRET analysis of the temperature-induced structural changes in human TRPV3. Sci Rep. 13 (1), 10108 (2023).
- Zheng, J., Zagotta, W. N. Patch-clamp fluorometry recording of conformational rearrangements of ion channels. Sci STKE. (176), PL7 (2003).
- Kusch, J., Zifarelli, G. Patch-clamp fluorometry: electrophysiology meets fluorescence. Biophys J. 106 (6), 1250-1257 (2014).
- Cowgill, J., Chanda, B. The contribution of voltage clamp fluorometry to the understanding of channel and transporter mechanisms. J Gen Physiol. 151 (10), 1163-1172 (2019).
- Bhat, S., Blunck, R. Characterising ion channel structure and dynamics using fluorescence spectroscopy techniques. Biochem Soc Trans. 50 (5), 1427-1445 (2022).
- Yamada, T., Figueroa, E. E., Denton, J. S., Strange, K. LRRC8A homohexameric channels poorly recapitulate VRAC regulation and pharmacology. Am J Physiol Cell Physiol. 320 (3), C293-C303 (2021).
- Yamada, T., Wondergem, R., Morrison, R., Yin, V. P., Strange, K. Leucine-rich repeat containing protein LRRC8A is essential for swelling-activated Cl- currents and embryonic development in zebrafish. Physiol Rep. 4 (19), e12940 (2016).
- Pervaiz, S., Kopp, A., von Kleist, L., Stauber, T. Absolute protein amounts and relative abundance of volume-regulated anion channel (VRAC) LRRC8 subunits in cells and tissues revealed by quantitative immunoblotting. Int J Mol Sci. 20 (23), 5879 (2019).
- Kern, D. M., et al. Structural basis for assembly and lipid-mediated gating of LRRC8A:C volume-regulated anion channels. Nat Struct Mol Biol. 30 (6), 841-852 (2023).
- Rutz, S., Deneka, D., Dittmann, A., Sawicka, M., Dutzler, R. Structure of a volume-regulated heteromeric LRRC8A/C channel. Nat Struct Mol Biol. 30 (1), 52-61 (2023).
- Li, P., et al. LRRC8 family proteins within lysosomes regulate cellular osmoregulation and enhance cell survival to multiple physiological stresses. Proc Natl Acad Sci U S A. 117 (46), 29155-29165 (2020).
- Kashyap, P., et al. An optogenetic method for the controlled release of single molecules. Nat Methods. 21 (4), 666-672 (2024).
- Liu, T., Stauber, T. The volume-regulated anion channel LRRC8/VRAC is dispensable for cell proliferation and migration. Int J Mol Sci. 20 (11), e2663 (2019).
- Zhang, Y., et al. Polarized NHE1 and SWELL1 regulate migration direction, efficiency and metastasis. Nat Commun. 13 (1), 6128 (2022).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유