Method Article
A Mouse Model for Vascular Cognitive Impairment and Dementia Based on Needle-guided Asymmetric Bilateral Common Carotid Artery Stenosis(바늘 유도 비대칭 양측 공통 경동맥 협착증에 기반한 혈관 인지 장애 및 치매에 대한 마우스 모델)
요약
혈관 인지 장애 및 치매에 대한 마우스 모델을 만들기 위해 비대칭 양측 총경동맥 협착증의 바늘 방법이 제안됩니다. 이는 이전에 확립된 모델에 비해 장기적인 결과를 가져오며 실시간 MRI와 호환됩니다. 절차를 보여주는 시각적 표현은 수술을 마스터하기 위한 지침을 제공합니다.
초록
혈관성 인지 장애 및 치매(VCID)는 혈관 뇌 손상으로 인해 발생합니다. 인구가 고령화됨에 따라 계속 증가할 것으로 예상되는 VCID의 높은 발병률을 감안할 때 이 질병에 대한 강력한 동물 모델을 확립하는 것이 중요합니다. 본 논문은 경동맥 죽상동맥경화증으로 인한 인간의 만성 대뇌저관류를 모방한 비대칭 양측 총경동맥 협착증을 기반으로 하는 VCID의 마우스 모델을 만드는 새로운 방법을 제시합니다.
간단히 말해서, 총경동맥(CCA)을 7-0 실크 봉합사를 사용하여 다른 게이지 바늘(오른쪽 CCA의 경우 32G, 왼쪽 CCA의 경우 34G)에 결찰한 후 즉시 바늘을 제거합니다. 나머지 봉합사는 백질 손상, 미세경색 및 반응성 신경교증과 관련된 지속적인 혈류 감소 및 장기적인 인지 장애를 유발하여 VCID의 발병 기전을 밀접하게 모방합니다. 중요한 것은 이 바늘 모델에서 임상적 표현이 시간이 지나도 되돌아가지 않아 신뢰할 수 있는 장기적인 인지 장애를 제공한다는 것입니다. 또한 수술 후 24주 생존율은 81.6%로 비슷한 수준의 혈류 감소를 보이는 다른 VCID 모델에 비해 높았습니다.
추가 이점으로는 재료비가 저렴하고 금속이 이식되지 않기 때문에 살아있는 동물의 뇌 손상을 모니터링하기 위한 MRI와의 호환성이 있습니다. VCID의 바늘 모델을 사용할 때 가장 큰 과제는 마우스 CCA의 직경이 0.6mm 미만이고 매우 취약하기 때문에 고급 수술 기술을 개발해야 한다는 것입니다. 따라서 수술의 고품질 시각적 표현은 연구자가 이 기술을 마스터하고 VCID에 대한 이해를 높이는 데 도움이 될 것이며, 잠재적으로 VCID와 관련된 파괴적인 인지 기능 저하를 줄이기 위한 새로운 치료 양식의 개발로 이어질 것입니다.
서문
혈관성 인지 장애 및 치매(VCID)는 인지 기능 저하의 두 번째 주요 원인입니다. VCID 발병 기전과 그 위험 요인을 이해하는 데 있어 부인할 수 없는 진전이 있었음에도 불구하고 신경 혈관 기능 장애가 인지 능력의 저하에 어떻게 기여하는지에 대한 메커니즘은 여전히 모호합니다. 인간 VCID1의 임상 표현을 모방하기 위해 뇌허혈을 유도하기 위해 다양한 복잡성의 많은 설치류 모델이 확립되었습니다. 이러한 모델 중 일부는 일시적인 대뇌 저관류를 생성하는 것을 기반으로 합니다. 그러나 대부분은 인간 환자에서 VCID를 유발하는 주요 기전인 만성 뇌 저관류를 유도하여 생성됩니다2.
만성 대뇌 저관류는 심각하지만 종종 치명적인 결과를 유발하는 양측 경동맥 폐색(BCAO) 또는 양측 경동맥 협착증(BCAS)을 사용하여 도입할 수 있습니다. BCAS는 일반적으로 두 가지 방법 중 하나를 사용하여 수행됩니다 : 두 CCA 주위에 동일한 마이크로 코일을 배치하여 대칭 협착3을 초래합니다. 또는 좌측 및 우측 CCA 주위에 각각 아메로이드 수축 장치와 마이크로코일을 이식하여 좌측 및 우측 CCA에 점진적인 폐색과 ~50%의 혈류 감소를 유발하며, 이에 따라4. 두 방법 모두의 단점은 협착이 너무 심하거나 CCA가 막히고 신체에 금속이 존재하여 살아있는 동물 MRI 스캔과 호환되지 않는 경우 사망률이 높다는 것입니다. 몇 가지 유전 마우스 모델도 확립되었습니다 1,5,6,7,8. 추가 옵션으로는 피질하 경색을 동반한 대뇌 상염색체 우성 동맥병증과 백질뇌병증 마우스 모델 9,10이 있습니다. 그럼에도 불구하고 제안된 모델 중 어느 것도 인간 환자에서 나타나는 허혈성 손상의 전체 범위를 모방하지 않으므로 업데이트된 VCID 모델에 대한 검색이 계속되고 있습니다.
본 논문은 생쥐에서 비대칭 양측 총경동맥 협착증(ABCS)을 유도하는 새로운 수술 방법을 제시하며, 실크 봉합사를 사용하여 CCA 협착을 시행하고 CCA를 다양한 직경의 바늘에 접합한 후 즉시 바늘을 제거하는 방식으로 제어합니다11. 그 결과, 정확한 직경의 봉합사가 CCA에 영구적으로 남아 만성 협착증을 보장합니다. 대칭 방법보다 ABCS를 사용하는 이점은 오른쪽의 중간 정도의 저관류가 더 나은 생존을 보장하는 반면 왼쪽의 더 뚜렷한 저관류는 장기적인 신경학적 및 병리학적 표현을 보장한다는 것입니다. 이 바늘 모델은 전통적인 BCAS 모델11 에 비해 지속적인 결과, 낮은 폐사율, 초저비용, 유연성 및 특수 분석 접근법의 사용 가능성과 같은 몇 가지 장점이 있습니다.
이러한 장점을 자세히 설명하자면, 3개의 결찰은 초점 협착증이 아닌 CCA 협착증의 일부를 유발하여 생쥐의 ~90%에서 지속적인 저관류, 백질 손상 및 인지 기능 저하를 유발합니다. 바늘 마우스의 폐사율은 ~17%로, 우리의 경험에 비추어 볼 때 16주 동안 ~30%의 폐사율을 가진 핫토리의 아메로이드 제한기/마이크로코일 모델4의 폐사율보다 낮았습니다. 각 BCAS 모델은 고가의 마이크로코일 또는 아메로이드 제한기로 인해 일반적으로 약 100달러의 비용이 드는 반면 바늘 모델은 마우스당 약 1달러에 불과합니다. 또한, 바늘의 게이지는 양쪽의 혈류 제한에 대한 연구별 요구 사항에 따라 수정될 수 있습니다. 본 논문에 제시된 변형에서, 바늘 모델은 폐색이 없는 편측성 영구 협착증으로 인한 중증 경동맥 협착증의 병태생리학을 모방하며, 이는 클리닉11에서 가장 흔한 질병의 표현입니다. 또한, 전통적인 BCAS 모델에 사용되는 아메로이드 제한기 및 마이크로코일은 금속으로 만들어졌기 때문에 금속이 뇌가 아니라 가슴에 이식되었음에도 불구하고 생체 내 MRI를 수행할 경우 상당한 인공물을 유발할 수 있습니다. 금속의 존재가 이미징에 정확히 어떤 영향을 미칠지 예측하기 어려울 수 있습니다.
일반적으로 마이크로코일 주입 후 수행되는 생체 내 MRI는 일반적으로 단순한 해부학적 영상으로 다중 모욕의 정량 분석에 적합하지 않아 VCID 연구에 매우 바람직합니다. 대조적으로, 여기에 제시된 바늘 모델은 실크 봉합사만 사용하며 모든 종류의 생체 내 MRI와 완벽하게 호환됩니다. 이는 두 가지 이유에서 중요합니다: (1) MRI는 작은 뇌 병변, 미세 출혈 또는 표재성 측선증12에 매우 민감하므로 CT 스캔과 같은 다른 분석 방법보다 선호됩니다 (2) VCID 연구는 병변 진행/치유의 역학을 추적함으로써 의심할 여지 없이 이점을 얻을 수 있기 때문에 생체 외 MRI보다 생체 내 MRI가 선호되어야 합니다. 특히 제안된 새로운 치료법에 대한 반응으로. 또한 바늘 모델에서 기능적(fMRI)을 수행하여 대뇌 저관류에 대한 반응으로 신경혈관 결합의 무결성에 대한 중요한 통찰력을 제공할 수 있습니다. 따라서 생체 내 MRI를 사용할 수 있는 가능성은 특히 약력학 연구에서 신경 혈관 결합뿐만 아니라 병변의 크기와 위치 및 인지 기능 사이의 복잡한 상관 관계에 대한 심층적인 분석의 길을 열어줍니다.
프로토콜
모든 동물 프로토콜은 피츠버그 대학의 기관 동물 관리 및 사용 위원회(Institutional Animal Care and Use Committee)의 승인을 받았으며 미국 국립보건원(National Institutes of Health)의 실험실 동물 관리 및 사용을 위한 가이드(National Institutes of Health Guide for the Care and Use of Laboratory Animals)에 따라 수행되었습니다. 모든 생존 수술에서 멸균 기술을 유지해야 합니다. 체중이 25-30g인 12주 된 수컷 C57BL/6J 마우스를 제시된 실험에 사용했습니다.
1. 자재 및 작업 공간 준비
- 바늘 조각을 준비합니다(~4mm 길이, 오른쪽 CCA의 경우 32G, 왼쪽 CCA의 경우 34G). 날카로운 끝을 단단한 표면에 조심스럽게 두드려 바늘의 날카로운 끝을 약간 무디게 하고 바늘 홀더를 사용하여 플라스틱 조각에서 바늘을 조심스럽게 분리합니다. 7-0 실크 봉합사를 1-2cm 길이의 조각으로 미리 자릅니다.
- 수술 기구, 바늘 조각 및 봉합사를 고압증기멸균 또는 기타 적절한 방법으로 살균합니다.
2. 수술 수행
- 마우스의 무게를 측정하고 25% O2 및 72% N2O의 혼합물에 3% 이소플루란으로 환기되는 챔버에 마우스를 2-3분 동안 두어 마취를 유도합니다.
- 일정한 체온(37°C)을 유지하기 위해 멸균 수술 시트로 덮인 가열 패드에 마우스(복부 쪽이 위로)를 놓고 1% O25 와 74% N2O의 혼합물에 2% 이소플루란으로 환기용 안면 마스크를 고정합니다. 접착 테이프로 마우스의 팔다리를 고정합니다.
- 전기 면도기로 목의 털을 면도하십시오. 접착 테이프나 키보드 진공 청소기로 가는 머리카락을 청소하십시오.
- Betadine Solution(요오드 10%)으로 수술 부위를 소독합니다. 70% 에탄올로 피부를 탈요오드화합니다. 딘스감염을 3회 반복합니다. 단단한 발가락 꼬집음(페달 반사)에 대한 반응이 부족하여 마취 수준이 적절한지 확인하십시오.
- 수술 부위를 드레이프합니다. 그런 다음 기관을 따라 수직 정중선을 절개하고 마이크로 겸자로 양측 갑상선을 분리합니다. 멸균된 소형 피부 견인기로 피부와 조직을 당겨 빼냅니다.
- 현미경 아래에서 각진 핀셋을 사용하여 미주신경과 초에서 CCA 중 하나를 조심스럽게 노출시키고 둔화하여 해부합니다. CCA가 겸자에 달라붙는 경향이 있는 경우 멸균수 또는 인산염 완충 식염수(PBS)를 사용하여 절개 부위를 적십니다. 필요한 경우 자세를 지지하기 위해 목 아래에 작은 플라스틱 주사기를 놓습니다.
참고: CCA가 파열되지 않도록 각별히 주의하십시오. - 각진 핀셋을 사용하여 CCA(1mm 간격) 아래에 미리 절단된 실크 봉합사 조각 3개(크기 7-0)를 끼웁니다.
- 봉합사 조각 중 하나의 CCA 주위에 매우 느슨한 이중 매듭을 드래프트합니다.
참고: 수술 부위와 봉합사를 멸균수나 PBS로 적시면 매듭을 만드는 데 도움이 될 수 있습니다. - 느슨한 매듭 내부에 CCA와 평행하게 바늘 조각(오른쪽 CCA의 경우 32G, 왼쪽 CCA의 경우 34G)을 놓습니다(그림 1A). 혈류가 관찰되지 않을 때까지 바늘과 CCA 주위의 기본 매듭을 조심스럽게 조이고 보조 매듭으로 고정합니다. 즉시 바늘을 당겨 부분적인 혈류를 회복하고 봉합사 끝을 다듬습니다.
참고: 외과의는 매듭이 완료된 후 봉합사 끝을 다듬는 데 매우 주의해야 합니다. 매듭에 너무 가깝게 자르면 매듭이 느슨해질 수 있습니다. 또한 바늘을 제거한 후 CCA를 관찰하여 혈류가 매듭의 하류에서 여전히 활성화되어 있는지 확인하는 것이 중요합니다. 바늘 제거 후 CCA가 매우 창백해 보이면 CCA가 과도하게 압축되었음을 의미합니다. - 동일한 CCA의 2.8번째 및 2.9번째 봉합사 나사산에 대해 약 2.9mm 간격으로 1-1단계를 반복합니다(그림 1B).
- 32G 바늘 조각을 사용하여 반대쪽 CCA로 2.6-2.10단계를 반복합니다.
- 두 CCA가 모두 효율적으로 결찰되어 있는지 주의 깊게 검사합니다: 세 개의 봉합사 밴드가 모두 제자리에 단단히 매듭이 지어졌지만 혈류를 완전히 차단할 정도로 빡빡하지 않은지 확인합니다(CCA가 매듭의 하류에서 창백하지 않은지 확인). 각 CCA에 있는 세 개의 봉합 밴드가 서로 약 1mm 떨어져 있는지 확인합니다.
- 멸균 모노필라멘트 봉합사를 사용하여 피부를 봉합합니다.
- 수술 직후 100-150μL의 케토프로펜(1mg/mL 스톡, 체중 5mg/kg)을 복강내 주사하여 수술 후 통증을 완화합니다. 수술 후 24시간 및 48시간 후에 이 주사를 반복하십시오.
- 동물을 동물 시설로 돌려보내기 전에 2시간 동안 지속적인 모니터링을 위해 37°C의 동종 담요 위에 마우스를 놓습니다.
참고: 가짜 절차의 경우 2.7-2.12단계를 생략해야 합니다.
3. 모델의 검증
참고: 뇌 손상은 생체 내 MRI로 분석되었으며 Luxol fast blue(LFB) 염색 및 행동 테스트로 추가로 검증되었습니다.
- 뇌혈 관류의 영상.
- 1-1.5% 이소플루란을 사용하여 마우스를 마취합니다. 베타딘 용액(요오드 10%)으로 수술 부위를 소독합니다. 그런 다음 70% 에탄올로 피부를 탈요오드화합니다.
- 동물의 두개골을 정위 프레임에 고정하십시오. 두두에서 후두골까지 두피의 정중선 처짐 절개를 하여 두개골을 드러내고 두개골 표면을 멸균 식염수로 청소합니다.
- 2차원 레이저 스페클 시스템을 사용하여 전하 결합 장치 카메라를 두개골 위 10cm 높이에 배치합니다. 두개골 절제술 부위에 프로브 홀더를 놓고 단단히 고정합니다.
- 수술 5분 전과 바늘을 놓은 직후 또는 수술 후 7, 14, 21, 28, 35, 42일 후에 혈액 관류 이미지를 촬영합니다.
- 멸균 모노필라멘트 봉합사를 사용하여 피부를 봉합합니다. 수술 후 통증을 완화하기 위해 100-150μL의 케토프로펜(1mg/mL 스톡, 체중 5mg/kg)을 복강내로 주사합니다. 이 주입을 24 시간 및 48 시간 동안 반복하십시오.
- 생체 내 MRI 촬영
- 1-1.5% 이소플루란을 사용하여 마우스를 마취하고, 호흡을 지속적으로 모니터링하고, 이미지 획득 중 따뜻한 공기로 온도를 37°C로 유지합니다.
- 관련 소프트웨어를 실행하여 9.4T 스캐너, 86mm Tx 코일 및 4채널 마우스 뇌 수신기 어레이를 사용하여 생체 내 MRI를 수행합니다. 포지셔닝 및 파일럿 스캔 후 다음 매개변수를 사용하여 RARE(Rapid Acquisition with Relaxation Enhancement) 시퀀스를 사용하여 T2WI(T2 가중치 이미지)를 획득합니다: 에코 시간/반복 시간(TE/TR) = 40/4,000ms, 평균 = 8,256 × 256 매트릭스, 0.5mm 슬라이스 두께의 16개 슬라이스, 희귀 계수 = 4, 20 x 20mm의 시야(FOV).
- TR/TE = 2,300/22ms, 획득 매트릭스 = 128 x 128, 2개의 세그먼트, 5개의 A0 이미지 및 30개의 비동일선형 확산 이미지, Δ/δ = 10/3ms, b-value = 1,000s/mm2를 제외하고 T2WI와 동일한 기하학적 및 매개변수를 사용하여 EPI(Echo Planar Imaging)-DTI 이미징 시퀀스를 사용하여 DTI(Diffusion Tensor Imaging) 데이터를 수집합니다.
- DSI Studio 소프트웨어(http://dsistudio.labsolver.org/)를 사용하여 DTI 데이터를 분석하여 확산 스칼라 파라미터(FA(Fractional Anisotropy), MD(Mean Diffusivity), AD(Axial Diffusivity) 및 RD(Radial Diffusivity))의 차이를 찾습니다. 양쪽 반구에서 말뭉치(CC), 외부 캡슐(EC), 내부 캡슐(IC), 핌브리아, 전방(AC), 신굴럼(Cing), 해마(hippo), 피질(C) 및 선조체(Str)에 대한 관심 영역(ROI)을 그립니다.
- Luxol 패스트 블루(LFB) 염색
- 뇌 절편 준비: 4% PFA로 뇌를 24시간 동안 고정한 다음 뇌가 가라앉을 때까지 30% 자당에 뇌를 담그십시오. 드라이아이스에 OCT 화합물로 뇌를 삽입하십시오. 슬라이딩 마이크로톰에서 20μm 두께의 관상 뇌 절편을 자릅니다. 뇌 조각을 저장 용액(PBS에 30% 글리세롤/30% 에틸렌 글리콜)에 보관하십시오.
- 뇌 절편을 LFB(0.1% 알코올 용액)에 담그고 56°C에서 하룻밤 동안 유지한 후 증류수로 씻습니다.
- 0.05% 탄산리튬으로 뇌 절편을 배양하고 등급이 매겨진 알코올을 통해 탈수합니다.
- 0.5% 크레실 바이올렛으로 단면을 5분 동안 염색하고 70% 에탄올로 구별합니다.
- 장착 매체로 염색된 뇌 부분을 장착합니다.
- 수정된 Morris 물 미로 테스트를 통한 인지 기능 평가
- 원형 탱크에 물(25 °C, 깊이 33cm)을 채우고 수영장의 북쪽, 동쪽, 남쪽 또는 서쪽 가장자리에서 31cm, 수위 아래 1.2cm에 정사각형 ~10 x 10cm2 개의 플렉시 유리 플랫폼을 담그십시오.
참고: 이 플랫폼은 전체 테스트 기간 동안 동일한 위치에 유지되어야 합니다. - 천장에 장착된 비디오 카메라를 켭니다. 마우스를 탱크에 넣고 (수위에서 떨어 뜨리지 마십시오) 벽을 향하고 북동쪽, 남동쪽, 남서쪽 또는 북서쪽에서 시작합니다. 마우스가 물에 잠긴 플랫폼을 찾기 위해 최대 90초 동안 수영할 수 있도록 합니다.
- 플랫폼이 발견되면 마우스가 30초 동안 물에 잠긴 플랫폼에 머물도록 합니다. 플랫폼을 찾을 수 없으면 마우스를 30초 동안 거기에 놓습니다.
- 마우스를 5분 동안 쉬게 한 후 수영 시도(단계 3.4.2 - 3.4.3)를 2회 반복합니다.
- 천 조각으로 마우스를 말리고 전구 아래의 케이지로 다시 넣으십시오.
- 5일 동안 매일 3번의 수영 시도를 반복합니다.
- 비디오 영상을 사용하여 탈출 대기 시간(각 평가판에서 플랫폼을 찾는 데 걸리는 시간)을 계산합니다.
- 테스트 마지막 날에 플랫폼을 제거하고 플랫폼이 이전에 있던 사분면에서 마우스가 소비하는 시간을 기록합니다.
- 원형 탱크에 물(25 °C, 깊이 33cm)을 채우고 수영장의 북쪽, 동쪽, 남쪽 또는 서쪽 가장자리에서 31cm, 수위 아래 1.2cm에 정사각형 ~10 x 10cm2 개의 플렉시 유리 플랫폼을 담그십시오.
결과
Long-term asymmetrical cerebral hypoperfusion(장기 비대칭 대뇌 저관류)
CCA 혈류는 앞서 설명한 바와 같이 마지막(세 번째) 결찰에서 바늘을 놓기 전과 직후에 측정하였다11. 혈류는 좌측 CCA에서 ~70%, 우측 CCA에서 ~50% 감소했습니다. 뇌혈 관류는 2차원 레이저 스페클을 사용하여 동적으로 모니터링되었습니다. 이 수술로 인해 양쪽 반구에서 뇌 관류 저하가 발생했으며, 좌반구가 더 심하게 영향을 받았습니다(그림 2). 수술 후 최소 24주 동안 대뇌 저관류가 유지된다11.
낮은 사망률
수컷 마우스의 6주 이상 생존율은 81.6%였습니다(그림 3). 생쥐는 수술 후 첫 주에 더 쉽게 죽었다.
뇌 손상에 대한 In vivo MRI 감지
T2 가중치 이미지는 ABCS 수술을 받은 마우스에서 해마(Hippo), 외부 캡슐(EC), 내부 캡슐(IC), 말뭉치(CC) 및 선조체(Str)의 저강도 또는 초강도 영역을 보여주었으며, 이는 뇌 손상을 나타냅니다(그림 4A). 구조적 손상은 가짜와 비교할 때 ABCS 마우스의 DTI의 DEC(Directionally Encoded Color) 맵에서 관찰되었습니다(그림 4B).
정량적 분석에 따르면 ABCS 마우스는 가짜(P < 0.05 대 가짜)와 비교할 때 좌측 하마, IC, 전방 커미셔어(AC), 싱굴럼(Cg) 및 핌브리아(Fi)에서 현저히 낮은 분획 이방성(FA)을 보였으며, 이는 좌반구의 백질 미세 구조가 손상되었음을 나타냅니다(왼쪽 상단 패널, 그림 4C). ABCS 마우스의 오른쪽 Cg와 Fi의 FA도 감소했습니다(P < 0.05 대 가짜). 좌측 IC의 FA와 ABCS 마우스의 Fi는 우측의 FA보다 현저히 낮았다(P < 0.05, 좌측 vs 우측).
유사하게, ABCS 마우스의 왼쪽 EC, IC, Str 및 Fi에서 가짜와 비교하여 상당히 낮은 축 방향 확산성(AD)이 나타났으며, 이는 축삭 손상을 시사합니다(오른쪽 상단 패널, 그림 4C (P < 0.05 대 가짜)). 왼쪽 Str만이 가짜와 비교하여 ABCS 마우스에서 평균 확산도(MD) 감소를 보였습니다(왼쪽 하단 패널, 그림 4C). 방사상 확산성(RD) 차이는 ABCS 마우스의 왼쪽 CC, Str 및 Fi에서 관찰되었으며(오른쪽 하단 패널, 그림 4C), 이는 이러한 영역에서 염증 및 세포성 증가를 시사합니다13.
두 반구의 비대칭적 뇌 손상과 좌반구의 백질 영역의 손상
뇌 손상은 앞서 설명한 절차를 사용하여 LFB 염색으로 추가로 분석했습니다14 (그림 5). 저배율 이미지는 EC 및 Str에서 더 밝은 파란색 염색을 보여주었으며, 이는 이 부위의 탈수초화를 시사합니다. 고화질 이미지는 가짜 마우스가 EC에서 직계 지향 희소돌기아교세포를 가진 잘 조직되고 수초화된 축삭돌기를 나타내는 것을 보여주었습니다. 그러나 축삭돌기는 사라지고 ABCS 마우스의 EC에서 널리 퍼진 파란색 염색 세포가 관찰되었습니다. 가짜 마우스는 Str에서 짙은 푸른 색으로 얼룩지고 잘 조직된 섬유 다발 구조를 보여주었습니다. 그러나 섬유 다발은 더 가볍고 작게 염색되었으며 무결성이 손상되었습니다. 일부 섬유 다발은 ABCS 마우스에서 진공 처리되었습니다. 섬유 다발은 왜곡되었고, 번들 간 매트릭스는 ABCS 마우스의 AC에서 상당히 두꺼워졌습니다. 요약하면, ABCS 수술은 축삭 탈수 및 손상을 유발합니다. 백질 손상은 주로 좌반구에서 발생합니다.
학습과 기억 기능 장애
바늘 ABCS 수술은 Morris 물 미로 테스트 중에 물에 잠긴 플랫폼을 찾는 시간(탈출 대기 시간)이 증가한 것에서 알 수 있듯이 심각한 학습 장애를 초래했습니다(그림 6). 이 장애는 수술 후 최소 24주 동안 지속되었습니다. 메모리도 상당한 영향을 받았는데, 플랫폼이 제거된 후 목표 사분면에서 보낸 시간이 감소한 것에서 알 수 있습니다.
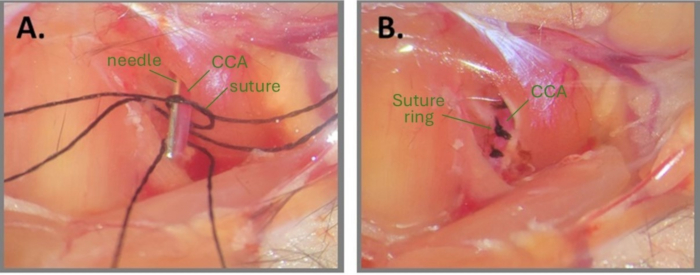
그림 1: ABCS를 만들기 위한 바늘 수술 단계. (A) 왼쪽 CCA가 노출되어 있고 CCA 아래에 3개의 실크 봉합사가 나사산이 있습니다. 봉합사 조각 중 하나에 느슨한 매듭을 드래프팅하고 바늘을 CCA와 평행하게 배치합니다. (B) 3개의 봉합 링이 약 1mm 간격으로 배치됩니다. 약어: ABCS = 비대칭 양측 공통 경동맥 협착증; CCA = 총경동맥. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 2: 바늘 ABCS 모델에서 지속적인 비대칭 대뇌 저관류 . 수술 후 뇌 혈류의 동적 모니터링. 지속적인 대뇌 저관류는 양쪽 반구에서 관찰될 수 있으며, 왼쪽에서 더 심하게 관찰됩니다. 검은색 별표는 저관류 영역을 나타냅니다. 약기 : ABCS = 비대칭 양측 공통 경동맥 협착. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 3: 바늘 ABCS 수술 후 생존율. 이 수술은 6주 동안 81.6%의 생존율을 기록했습니다. 사망은 주로 수술 후 첫 주에 발생했다. 약기 : ABCS = 비대칭 양측 공통 경동맥 협착. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
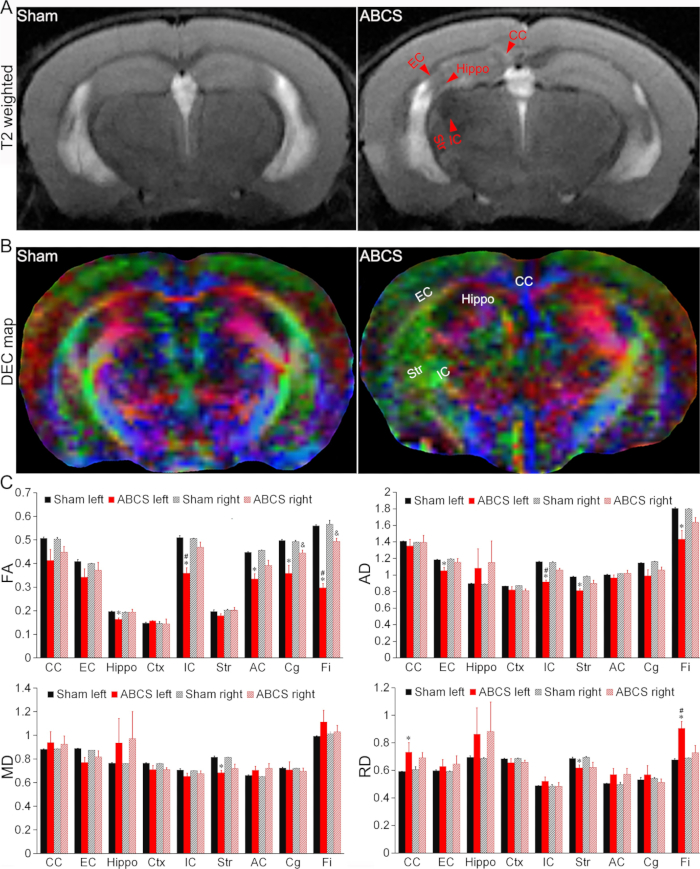
그림 4: 바늘 ABCS 모델에서 뇌 손상에 대한 생체 내 MRI 감지.(A) 가짜 및 ABCS 마우스의 대표적인 T2 가중치 이미지. 빨간색 화살촉은 저강도 또는 초고강도 영역을 나타냅니다. (B) 바늘 ABCS 수술 2주 후 in vivo DTI의 대표 DEC 지도. 색상은 확산의 주축의 방향성을 나타냅니다(빨간색 = 왼쪽/오른쪽, 녹색 = 등쪽/복부, 파란색 = 배쪽/꼬리). (C) 가짜 및 ABCS 마우스의 정량 분석(일원 ANOVA). *는 p< 0.05 ABCS 대 가짜(좌반구)를 나타냅니다. #은 왼쪽과 오른쪽< 0.05 p를 나타냅니다. &는 p< 0.05 ABCS 대 가짜(우반구)를 나타냅니다. 데이터는 평균 ± SEM으로 표시됩니다. n = 4 가짜, n = 4 ABCS 마우스. 약어: ABCS = 비대칭 양측 공통 경동맥 협착증; Hippo = 해마; EC = 외부 캡슐; IC = 내부 캡슐; CC = 말뭉치; Str = 선조체; DEC = 방향성으로 인코딩된 색상; DTI = 확산 텐서 이미징; FA = 분수 이방성; MD = 평균 확산도; AD = 축 방향 확산도; RD = 방사형 확산도. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
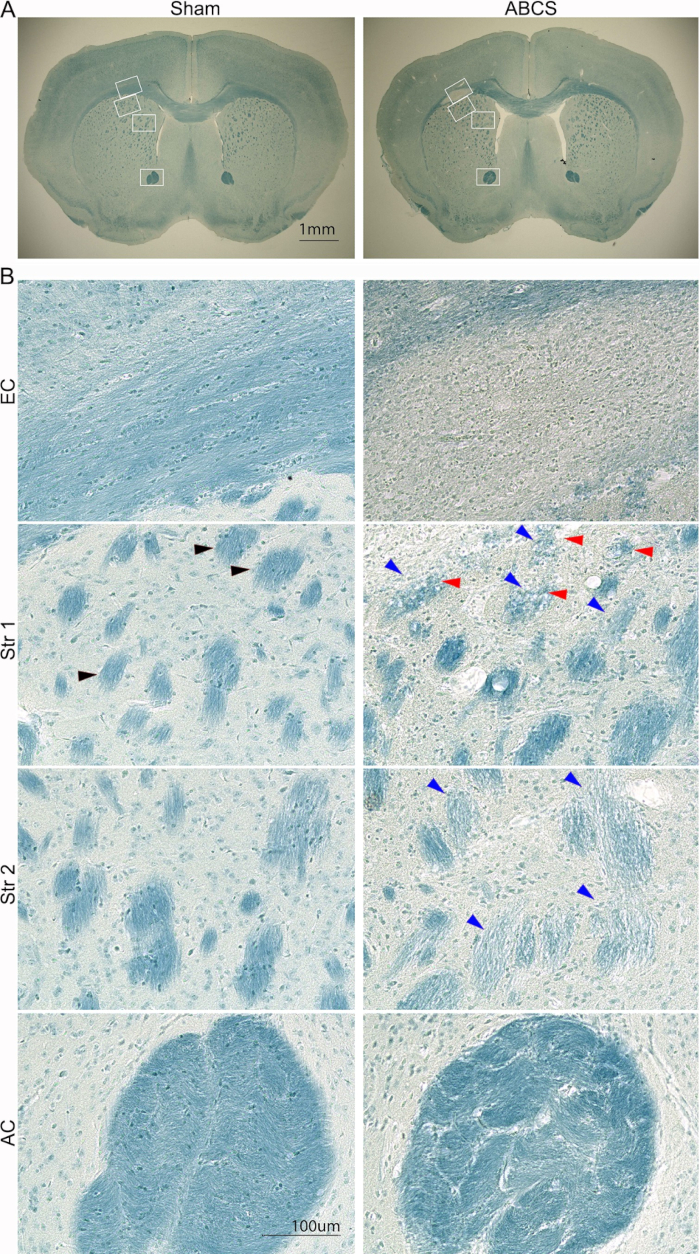
그림 5: 바늘 ABCS 수술 후 6주 후 뇌 절편의 대표적인 LFB 염색. (A) 가짜 및 ABCS 마우스의 LFB 염색에 대한 저배율 이미지. 흰색 상자는 B의 고화질 이미지에 해당하는 위치를 나타냅니다. (B) EC(상단 패널) 및 Str 위치 1 및 2(중간 패널) 및 AC(하단 패널)의 고화질 이미지(200x). 검은색 화살촉은 정상적인 섬유 다발을 나타냅니다. 파란색 화살촉은 손상된 섬유 다발을 가리킵니다. 빨간색 화살촉은 진공 섬유를 나타냅니다. 스케일 바 = 1mm(A), 100μm(B). 약어: ABCS = 비대칭 양측 공통 경동맥 협착증; LFB = Luxol 패스트 블루; EC = 외부 캡슐; Str = 선조체; AC = 전방 커미셔르. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
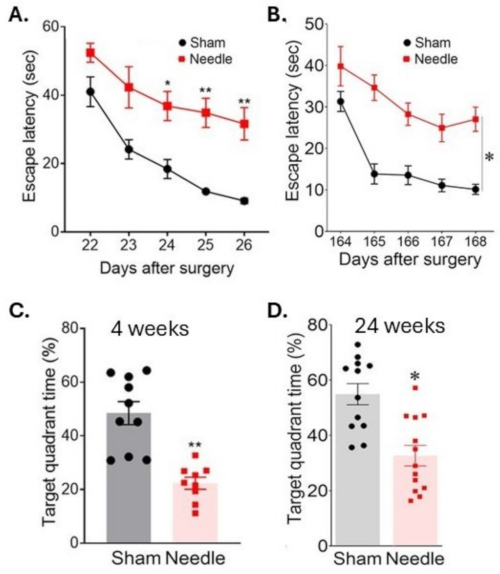
그림 6: 물 미로 테스트에서 공간 학습 및 기억 평가. 공간 학습은 수술 후 (A) 3주와 (B) 24주를 연속으로 플랫폼을 찾는 시간을 측정하여 평가했습니다. 기억력은 플랫폼을 제거한 후 목표 사분면에서 보낸 시간을 측정하여 수술 후 (C) 4주 및 (D) 24주를 평가했습니다. 이 수술은 장기적으로 인지 기능의 붕괴를 초래했습니다. 데이터는 평균 ± SEM, *p < 0.05 바늘 대 가짜로 표현되었습니다. **p < 0.01 대 가짜; 양방향 ANOVA 및 Neuman-Keuls 사후 분석. n = 10(가짜), n = 10(바늘 그룹). 이 그림은 Weng et al.11에서 수정되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
비대칭 CCA 협착증을 이용한 VCID 유도의 여러 가지 방법이 설명되었으며, 이들 모두는 CCA를 미주신경에서 단계적으로 분리하는 중요하고 중요한 외과적 단계적 격리와 CCA의 외피 및 노출을 공유하여 협착증에 접근할 수 있도록 합니다. 우리는 결찰 전 CCA의 외과적 노출에 대한 양질의 시각적 지침을 제공하는 한편, 연구자들이 다른 마우스 및 랫트 수술과 관련하여 온라인에서 이용할 수 있는 CCA 분리에 대한 추가 비디오를 시청하도록 지시하고 싶습니다 15,16,17,18. CCA는 뇌에 산소가 공급된 혈액을 공급하는 주요 동맥이므로 CCA를 압박하거나 파열하지 않도록 각별히 주의해야 합니다.
숙달해야 하는 수술의 또 다른 중요한 단계는 느슨한 매듭을 작성하고 바늘로 CCA 주위를 더 조인 다음 바늘을 제거하는 것입니다. 마취된 마우스에서 이 단계를 수행하기 전에 바늘만으로 이 단계를 연습하는 것이 좋습니다. 이를 통해 섬세한 집게 움직임을 마스터하고 마우스를 다치게 할 위험 없이 봉합사로 완벽하게 조작할 수 있습니다. 매듭은 바늘을 제거하는 동안 끊어지지 않고 잘 고정되어야 하며, 바늘을 잡을 수 있을 만큼 단단해야 하지만 집게를 사용하여 매듭이 있는 봉합사에서 바늘을 밀어낼 수 있을 만큼 느슨해야 합니다.
중요한 것은 각 CCA의 단일 결찰만으로는 혈류를 안정적으로 감소시키고 장기적으로 대뇌 저관류를 유지하기에 충분하지 않다는 것을 발견했다는 것입니다11. 한 가지 가능한 설명은 단일 결찰이 점 협착증을 유발하며, 이는 국부적인 압력 증가를 유발할 가능성이 높으며, 이는 혈류 감소를 보상하기 위해 혈류 속도를 증가시킬 수 있다는 것입니다. 협착증의 단편을 만들기 위해 서로 ~1mm 떨어진 3개의 결찰을 수행하는 것이 좋습니다. 3개의 결찰을 사용하는 또 다른 이점은 매듭이 추가 바늘 제거 중에 매듭 중 하나가 느슨해지는 경우 교정 메커니즘 역할을 한다는 것입니다. 실제로, 동일한 CCA의 3개의 개별 결찰에 의해 유발된 협착 조각은 모델 일관성을 증가시켜 약 90%의 마우스에서 지속적인 뇌 저관류를 유발합니다. 더욱이, 단편 협착은 인간 환자의 죽상동맥경화증으로 인한 CCA 협착증을 초점 협착증에 비해 더 정확하게 모방하여 바늘 모델의 임상적 관련성을 높입니다.
CCA 혈류가 부분적으로 회복되었는지 확인하기 위해 첫 번째 결찰을 마친 후 즉시 바늘을 제거한 다음 두 번째 및 세 번째 결찰로 순차적으로 진행할 것을 강력히 권장합니다. 세 개의 매듭 안에 있는 바늘로 세 가지 결찰을 모두 완료하는 것은 혈류가 완전히 막히는 시간을 크게 늘리므로 권장하지 않습니다. 일반적으로 바늘을 제거하기 전에 1분 이상 완전한 CCA 폐색을 권장하지 않습니다. 이 권고안은 마우스가 두 CCA를 60초 교합하는 3회 세션 후 기능 장애의 징후를 보이지 않았다는 보고에 근거합니다19. 이 모델에서 외과의는 한 번에 하나의 CCA를 수술하는데, 이는 두 CCA를 동시에 폐색하는 것보다 더 관대하지만, 양쪽의 만성 저관류보다는 장기간의 폐색으로 인한 아티팩트를 제외하기 위해 이 타임라인을 따르는 것이 좋습니다.
이 바늘 모델은 다양한 직경의 바늘을 사용하여 매듭이 있는 봉합사의 직경을 조정할 수 있지만(체중 또는 혈류 제한의 특정 요구 사항에 따라), 우리의 경험에 따르면 우반구의 저관류가 심한 것보다 중간 정도일 때 쥐의 생존율이 더 높았습니다. 반면에, 좌반구에서 지속적이고 심각한 저관류는 장기적인 병리학적, 신경학적 결과를 초래했다. 따라서 우측 CCA를 결찰하기 위해 더 두꺼운 바늘을 사용하여 비대칭 결찰술을 수행하고(우반구에서 중등도의 저관류를 유발함) 더 얇은 바늘을 사용하여 좌측 CCA를 결찰(좌반구에서 심각한 저관류를 유발함)을 수행하는 것이 좋습니다.
마지막으로, 연구자들은 주로 대뇌 혈관 해부학의 차이로 인해 다른 마우스 균주가 허혈성 또는 외상성 모욕과 다른 결과를 생성할 수 있음을 알고 있어야 합니다20,21. 요즘 많은 연구에서 새로운 형질전환 마우스의 생성을 필요로 하기 때문에 실험 설계의 어느 단계에서든 BCAO 수술이 필요한 경우 배경 변형을 신중하게 고려해야 합니다. 예를 들어, C57BL/6 및 SV129 균주는 모두 뇌졸중 연구를 위한 형질전환 동물을 생성하기 위한 일반적인 배경 선택입니다21. 그러나, C57BL/6 마우스는 SV129 마우스를 포함하여 시험된 다른 균주에 비해 허혈에 훨씬 더 민감하다는 것이 잘 문서화되어 있습니다20,21. 사실, 쥐 균주의 효과가 VCID21을 유도하는 데 사용되는 기술의 효과보다 훨씬 더 중요할 수 있다는 증거가 있습니다. 따라서 설치류에서 허혈성 뇌 손상을 유발하는 것과 관련된 모든 실험에서 마우스 배경을 일관되게 유지하는 것이 매우 중요합니다. 중요한 것은 연구자들이 0.5점을 포함 기준으로 신경학적 점수 매기기시스템 22을 사용하여 살아있는 동물의 수술 결과의 효율성을 평가할 수 있다는 것입니다. 뇌 손상은 경미한 국소 박리 후에도 뇌 손상에 매우 민감한 Iba1 면역염색을 사용하여 추가로 확인할 수 있습니다.
요약하면, VCI는 많은 임상 표현과 원인을 동일한 우산 아래 통합하는 복잡한 용어라는 것을 기억하는 것이 중요합니다. 따라서 연구자는 연구하고자 하는 VCI 측면에 따라 어떤 모델을 선택해야 하는지 항상 염두에 두어야 합니다. 모든 VCI 표현에 대해 단일 범용 모델은 결코 있을 수 없습니다. CCA 협착 모델은 주요 동맥의 혈류를 심각하게 제한하여 동맥경화성 협착증 환자를 모방합니다. C57BL/6J 마우스에서 비대칭 BCAS를 생성하는 새로운 바늘 방법은 이전에 보고된 방법에 비해 몇 가지 이점(특히 높은 유연성, 낮은 폐사율, 장기 결과, 최소 비용 및 실시간 MRI 모니터링)을 제공하는 VCID를 모방하는 신뢰할 수 있는 방법입니다. 다른 모델에 비해 장점이 있기 때문에 VCID 진행에 대한 지식을 더욱 발전시킬 수 있을 뿐만 아니라 VCID의 진행을 치료하거나 늦추기 위한 잠재적인 치료제를 스크리닝하기 위한 기초로 사용할 수 있습니다. 보고된 다른 BCAS 방법과 마찬가지로, 바늘 모델은 이 시각적 시연을 가이드로 사용하여 시간이 지남에 따라 숙달할 수 있는 고급 수술 기술을 필요로 합니다.
공개
저자는 공개할 이해 상충이 없습니다.
감사의 말
이 프로젝트는 미국 국립보건원(National Institutes of Health)/NINDS 보조금 RF1NS117509(G. Cao) 및 VA Merit Review 보조금 BX003923 및 BX006454(G. Cao)의 지원을 받았습니다.
자료
| Name | Company | Catalog Number | Comments |
| 1 mL syringe | BD | 309659 | IP injection of ketoprofen |
| 2.5 mm blunt retractor tips | Kent Scientific Corporation | SURGI-5016-2 | 2 needed |
| Andis Ion T-Blade Pet Trimmer | Andis | BTF3 | To shave fur |
| Betadine Solution | Avrio Health L.P. | NDC 67618-150-17 | |
| Braided silk suture, 5-0 | Teleflex Medical | 106-S | For suturing skin |
| Braided silk suture, 7-0 | Teleflex Medical | 103-S | For ligating CCAs |
| Camera | Med Associates, Inc | VID-CAM-MONO-7 | For model validation |
| cover glass | Fisherbrand | 12-541-012 | For model validation |
| cresyl violet | Thermo Scientific | C581-25 | For model validation |
| Dispensing Tip, Needle, Flex, 34 Gauge, 1/4" OAL | Jensen Global | JG34-0.25HPX | For the left CCA |
| DSIStudio | https://dsi-studio.labsolver.org; for DTI data analysis | ||
| Dumont Tweezers; Pattern #1 | Roboz Surgical Instrument Co | RS-4960 | 2 needed |
| Dumont Tweezers; Pattern #5, 45 Degree Angle | Roboz Surgical Instrument Co | RS-5058 | 2 needed |
| Ethanol | Fisher Scientific | 64-17-5 | Dilute to 70% |
| ethylene glycol | Thermo Scientific | E178-4 | For model validation |
| Eye Needle, Size #4; 3/8 Circle, Cutting Edge, 11 mm Chord Length | Roboz Surgical Instrument Co | RS-7981-4 | For suturing skin |
| E-Z Anesthesia Classic System | E-Z systems | EZ-7000 | |
| glycerol | Thermo Scientific | AAA16205AP | For model validation |
| Homeothermic Monitoring System | Harvard Bioscience | K 022258 | |
| Imaging system EVOS FL Auto | Life Technologies | AMAFD2000 | For model validation |
| Isoflurane | Covetrus | 11695-6777-2 | |
| Ketoprofen | Zoetis | 5487 | |
| Leica M320 F12 clinic and surgery microscope | Leica | M320 F12 | |
| Lidocaine and Prilocaine Cream, USP 2.5%/2.5% | Padagis | NDC 0574-2042-30 | Generic to EMLA cream |
| lithium carbonate | Thermo Scientific | L119-500 | For model validation |
| Luxol fast blue | Thermo Scientific | AC212170250 | For model validation |
| microscope slides | Fisherbrand | 12-550-403 | For model validation |
| Microtome | Leica | SM2010R | For model validation |
| Morris Water Maze with the hidden platform | Maze Engineers | https://maze.conductscience.com/portfolio/morris-water-maze/ | |
| M-Prove Portable Balance | Sartorius | AY711 | Scales for weiging the mouse |
| MRI with ParaVision 6.0.1 | Bruker | AV3HD 9.4T | For model validation |
| Multi gas flow meter | Aalborg Instruments | GMR2-010334 | for low flow rate gas blending (N2O and O2) |
| Nano Ultra Fine Pen Needles - 32G 4mm | BD | 58320883 | For the right CCA |
| O.C.T. | Thermo Scientific | 23-730-571 | For model validation |
| Paraformaldehyde, 4% | Thermo Scientific | J61899.AK | For model validation |
| PBS | Thermo Scientific | BP399500 | For model validation |
| PeriCam PSI System with Aperiflux probe holder | Perimed Inc | PeriCam PSI HR | For model validation |
| permount | Thermo Scientific | SP15-100 | For model validation |
| Round Handle Forceps; Micro Suturing With Tying Platform; Curved | Roboz Surgical Instrument Co | RS-5264 | To help with cutting and suturing the skin |
| Small Animal Heat Lamp, 75 Watt | Morganville Scientific | HL0100 | For model validation |
| Small cotton-tipped applicators | Fisher Scientific | 23-400-118 | |
| Spring Scissors - 8mm Cutting Edge | Fine Science tools | 15024-10 | |
| Student Halsey Needle Holder | Fine Science tools | 91201-13 | 3 needed: 2 for holding skin retractors and 1 for suturing the skin |
| Sucrose | Thermo Scientific | A15583.36 | For model validation |
| Universal Camera Ceiling Mount | Med Associates, Inc | ENV-598 | For model validation |
| water bath | VWR | 89032-226 | For model validation |
참고문헌
- Tuo, Q. Z., Zou, J. J., Lei, P. Rodent models of vascular cognitive impairment. J Mol Neurosci. 71 (5), 1-12 (2021).
- Zhou, Z., et al. Deeper cerebral hypoperfusion leads to spatial cognitive impairment in mice. Stroke Vasc Neurol. 7 (6), 527-533 (2022).
- Shibata, M., Ohtani, R., Ihara, M., Tomimoto, H. White matter lesions and glial activation in a novel mouse model of chronic cerebral hypoperfusion. Stroke. 35 (11), 2598-2603 (2004).
- Hattori, Y., et al. A novel mouse model of subcortical infarcts with dementia. J Neurosci. 35 (9), 3915-3928 (2015).
- Janson, J., et al. Increased risk of type 2 diabetes in Alzheimer disease. Diabetes. 53 (2), 474-481 (2004).
- Herzig, M. C., et al. Abeta is targeted to the vasculature in a mouse model of hereditary cerebral hemorrhage with amyloidosis. Nat Neurosci. 7 (9), 954-960 (2004).
- Miao, J., et al. Cerebral microvascular amyloid beta protein deposition induces vascular degeneration and neuroinflammation in transgenic mice expressing human vasculotropic mutant amyloid beta precursor protein. Am J Pathol. 167 (2), 505-515 (2005).
- Moechars, D., et al. Early phenotypic changes in transgenic mice that overexpress different mutants of amyloid precursor protein in brain. J Biol Chem. 274 (10), 6483-6492 (1999).
- Wallays, G., et al. Notch3 Arg170Cys knock-in mice display pathologic and clinical features of the neurovascular disorder cerebral autosomal dominant arteriopathy with subcortical infarcts and leukoencephalopathy. Arterioscler Thromb Vasc Biol. 31 (12), 2881-2888 (2011).
- Cognat, E., Cleophax, S., Domenga-Denier, V., Joutel, A. Early white matter changes in CADASIL: evidence of segmental intramyelinic oedema in a pre-clinical mouse model. Acta Neuropathol Commun. 2, 49 (2014).
- Weng, Z., et al. A novel needle mouse model of vascular cognitive impairment and dementia. J Neurosci. 43 (44), 7351-7360 (2023).
- Biesbroek, J. M., Biessels, G. J. Diagnosing vascular cognitive impairment: Current challenges and future perspectives. Int J Stroke. 18 (1), 36-43 (2023).
- Winklewski, P. J., et al. Understanding the physiopathology behind axial and radial diffusivity changes-what do we know. Front Neurol. 9, 92 (2018).
- Jing, Z., et al. Neuronal NAMPT is released after cerebral ischemia and protects against white matter injury. J Cereb Blood Flow Metab. 34 (10), 1613-1621 (2014).
- Yang, S. T., et al. Adult mouse venous hypertension model: common carotid artery to external jugular vein anastomosis. J Vis Exp. (95), e50472 (2015).
- Speetzen, L. J., Endres, M., Kunz, A. Bilateral common carotid artery occlusion as an adequate preconditioning stimulus to induce early ischemic tolerance to focal cerebral ischemia. J Vis Exp. (75), e4387 (2013).
- Lee, D., et al. A murine model of ischemic retinal injury induced by transient bilateral common carotid artery occlusion. J Vis Exp. (165), (2020).
- Schleimer, K., et al. Training a sophisticated microsurgical technique: interposition of external jugular vein graft in the common carotid artery in rats. J Vis Exp. (69), e4124 (2012).
- Speetzen, L. J., Endres, M., Kunz, A. Bilateral common carotid artery occlusion as an adequate preconditioning stimulus to induce early ischemic tolerance to focal cerebral ischemia. J Vis Exp. (75), e4387 (2013).
- Barone, F. C., Knudsen, D. J., Nelson, A. H., Feuerstein, G. Z., Willette, R. N. Mouse strain differences in susceptibility to cerebral ischemia are related to cerebral vascular anatomy. J Cereb Blood Flow Metab. 13 (4), 683-692 (1993).
- Wellons, J. C., et al. A comparison of strain-related susceptibility in two murine recovery models of global cerebral ischemia. Brain Res. 868 (1), 14-21 (2000).
- Cao, G., et al. In Vivo delivery of a Bcl-xL fusion protein containing the TAT protein transduction domain protects against ischemic brain injury and neuronal apoptosis. J Neurosci. 22 (13), 5423-5431 (2002).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유