Method Article
Microglia-Manipulated Transgenic Mice에서 EcoHIV 감염 세포 식별
요약
이 프로토콜은 EcoHIV 감염과 Tmem119-EGFP 마우스의 조합이 HIV 관련 신경인지 장애의 설치류 모델에서 미세아교세포 변형 및 바이러스 저장소를 조사하기 위한 귀중한 생물학적 시스템을 제공하는 방법을 설명합니다.
초록
항레트로바이러스 병용 요법(cART)은 HIV 감염자(PLWH)의 삶의 질을 획기적으로 향상시켰습니다. 그러나 400만 명 이상의 PLWH가 50세 이상이며 HIV 관련 신경인지 장애(HAND)를 동반한 경험이 있습니다. HIV가 중추 신경계에 어떤 영향을 미치는지 이해하려면 신뢰할 수 있고 실현 가능한 HIV 모델이 필요합니다. 이전에는 신경인지 장애와 시냅스 기능 장애를 조사하기 위해 쥐 모델에서 키메라 HIV(EcoHIV) 접종을 사용하는 새로운 생물학적 시스템이 개발되었습니다. 그럼에도 불구하고 EcoHIV의 신경해부학적 분포, 특히 뇌의 다양한 세포 유형에서 차등 발현을 규명하는 데 있어 중요한 과제가 남아 있습니다. 현재 연구에서 mScarlet 형광 표지가 있는 EcoHIV를 변형하고 Tmem119-EGFP 넉인 마우스(주로 미세아교세포에서 강화된 녹색 형광 단백질을 발현)에 역궤도 주입하여 미세아교세포가 뇌에서 HIV의 바이러스 발현 및 저장소를 담당하는 주요 세포 유형인지 확인했습니다. 현재 데이터는 다음과 같이 보여줍니다 : (1) 시험관 내에서, EcoHIV-mScarlet 형광 신호는 주로 1 차 설치류 뇌 세포 중 미세 아교 세포와 같은 세포에서 국한되었습니다. (2) 생체 내에서 Tmem119-EGFP 마우스에 EcoHIV-mScarlet을 주입하면 마우스 뇌에서 유의한 HIV 발현이 유도되었습니다. mScarlet과 EGFP 신호의 공동 국소화는 미세아교세포가 뇌에 HIV를 품고 있는 주요 세포 유형임을 시사합니다. 전반적으로 설치류의 EcoHIV는 미세아교세포의 변화, 뇌의 바이러스 저장고 및 HIV 관련 신경인지 장애의 신경학적 메커니즘을 연구하는 데 유용한 생물학적 시스템을 제공합니다.
서문
항레트로바이러스 요법에서 파생된 엄청난 이점에도 불구하고 HIV(PLWH)에 감염된 사람들은 여전히 신경인지 장애를 겪고 있습니다. HIV 관련 신경인지 장애(HAND)의 신경 메커니즘을 더 잘 이해하기 위해서는 HIV 모델이 NeuroHIV에 대한 특정 세포 유형 관여를 추가로 설명하기 위해 매우 중요합니다.
HIV-1 바이러스 단백질에 구조적으로 노출되는 HIV-1 형질전환 쥐는 HAND와 관련된 신경인지 장애 1,2,3,4 및 신경 해부학적 변화 5,6,7를 조사하는 데 사용되는 인기 있는 설치류 모델입니다. gag 및 pol 도메인의 기능적 결실은 바이러스 복제를 방지하여 HIV-1 형질전환 쥐를 비감염성으로 만듭니다 8,9. 최근에는 Potash et al.10에 의해 마우스의 키메라 HIV(EcoHIV) 감염 모델이 처음 보고되었고 나중에 쥐로 확장되었으며, 이는 손 및 약물 사용 장애에 대한 추가 연구에 유리할 수 있습니다11. 이 새로운 생물학적 시스템에서 전신 HIV-1 감염이 관찰되었으며 림프구 및 대식세포 관여, 항바이러스 면역 반응, 신경 침습성 및 뇌 염증을 포함한 인간 HIV-1의 많은 임상적 특징이 관찰되었습니다.
미세아교세포는 뇌 기능과 항상성을 유지하는 데 특화된 뇌 상주 대식세포로서 중요한 역할을 합니다. 밀접하게 관련된 세포 유형(예: 혈액 단핵구, 혈관 주위 대식세포, 수막 대식세포)과 미세아교세포를 구별하기 위해 현재 연구에서는 Tmem119-EGFP 넉인 마우스 라인을 사용했습니다. 이전 연구에서는 막관통 단백질 119(Tmem119)가 설치류와 인간의 뇌 조직 12,13,14,15에서 독점적으로 미세아교세포 특이적 발현 패턴을 나타낸다고 보고했습니다. Tmem119-EGFP 넉인 마우스의 EGFP 신호는 뇌 전체에서 관찰되었으며 미세아교세포에 특이적으로 국한되었습니다.
본 연구에서는 Tmem119-EGFP 넉인 마우스에 EcoHIV-mScarlet 바이러스를 접종하고 중추신경계에서 EcoHIV에 양성인 세포를 확인하였다. 여기에서는 Tmem119-EGFP knock-in 마우스에서 EcoHIV-mScarlet 접종을 위한 프로토콜을 제시하여 HIV의 미세아교세포 변형을 치료적으로 표적으로 하기 위한 신뢰할 수 있는 모델을 제공합니다.
프로토콜
사우스캐롤라이나 대학의 동물 보호 및 사용 위원회는 모든 동물 프로토콜(연방 보증 번호: D16-00028)을 승인했습니다. 모든 실험은 미국 국립보건원(National Institutes of Health)이 실험실 동물의 관리 및 사용 가이드(Guide for the Care and Use of Laboratory Animals)에서 제정한 지침을 엄격히 따랐습니다. Tmem119-EGFP 넉인 마우스(생후 30일, 수컷, 체중 23-26g)를 상업적 출처에서 얻어 AAALAC 인증 시설에 그룹 수용했습니다. 모든 동물은 12/12시간 명암 주기로 수용되었으며 음식과 물을 자유롭게 이용할 수 있었습니다. 이 연구에 사용된 동물, 시약 및 장비에 대한 자세한 내용은 재료 표에 나열되어 있습니다.
1. 293FT 세포의 EcoHIV-mScarlet 포장
- 젤라틴이 사전 코팅된 75cm2 플라스크에서 293FT 세포를 배양합니다. transfection에서 세포가 30% confluent까지 계속 성장합니다.
- 제조업체의 지침에 따라 Lipofectamine 3000(22.5μL)을 사용하여 EcoHIV-mScarlet(보충 파일 1)의 플라스미드 DNA(15μg)에 대한 transfection을 수행합니다( 재료표 참조).
- DMEM 배지에서 10% FBS 혈청으로 37°C에서 3일 동안 세포를 배양합니다.
- 바이러스 현탁액이 있는 조건부 배지를 수집합니다. 500 × g 에서 4 °C에서 10분 동안 원심분리기. 10mL 피펫을 사용하여 상층액을 멸균된 50mL 튜브로 옮깁니다.
- 바이러스 혼합물에 일정량의 Lenti-x 농축기(1:3 비율)를 추가합니다(예: 농축기 8mL와 바이러스 혼합물 24mL). 튜브를 부드럽게 다섯 번 뒤집습니다.
- 바이러스-렌티 농축기 혼합물을 4°C에서 2일 동안 유지합니다. 1,500 × g, 45 분, 4 ° C에서 원심 분리기. 피펫을 사용하여 상층액을 최대한 조심스럽게 제거합니다.
- 예냉각된 200μL의 100mM PBS로 펠릿을 다시 현탁합니다. 바이러스는 -80 °C에서 보관하십시오.
참고: 293FT 세포의 EcoHIV-mScarlet 패키징에 대한 자세한 내용은 이전 연구16에서 설명되었습니다. 바이러스 용액에 와류를 일으키거나 기포를 도입하지 마십시오.
2. 원발성 쥐 뇌 세포의 EcoHIV-mScarlet 감염
- 이전에 발표된 보고서16에 따라 쥐 태아로부터 1차 뇌세포 분리(18일)를 수행합니다.
- 해리된 세포를 1mL의 DMEM/F12 배지와 10% FBS가 함유된 유리 인서트를 사용하여 사전 코팅된 poly-L-Lysine 12-well plate로 이동합니다. 다음날 Neurobasal 배지의 배지를 B27 보충제로 교체하십시오.
- 1차 태아 뇌세포를 5% CO2 인큐베이터에서 3주 동안 배양합니다.
- EcoHIV-mScarlet(60 μL, 1.26 × 106 TU/mL)을 배양 배지에 추가합니다. 배양된 뇌세포를 EcoHIV-mScarlet으로 6일간 배양합니다.
- 4% PFA로 세포를 고정하고 특정 1차 항체(CD11b/c, Iba1)를 사용하여 감염된 뇌세포에 면역염색을 수행합니다.
- 컨포칼 현미경 시스템에서 40× 대물렌즈를 사용하여 이미지를 획득합니다.
3. 성체 마우스의 1차 신경교세포에서 EcoHIV-mScarlet 바이러스 감염
- 성체 마우스를 5% 세보플루란으로 5분 동안 마취합니다(기관에서 승인한 프로토콜에 따름). 70% EtOH로 머리 피부를 살균합니다.
- 마우스가 더 이상 유해한 자극에 반응하지 않는 것을 확인한 후 멸균된 날카로운 가위를 사용하여 참수를 수행합니다. HBSS 5mL로 채워진 새 페트리 접시에 헤드를 옮깁니다.
- 두피를 열고 뇌 조직을 멸균된 HBSS 5mL가 들어 있는 다른 페트리 접시에 옮깁니다. 수막을 떼어내고 전두엽 피질을 HBSS 2mL로 옮깁니다.
- 혼합물에 0.25% 트립신-EDTA 20μL를 첨가합니다. 실온에서 15분 동안 배양합니다. 몇 분마다 튜브를 부드럽게 휘젓습니다.
- 해리된 세포를 10mL의 DMEM/F12 배지 및 10% FBS가 포함된 사전 코팅된 75cm2 플라스크로 이동합니다.
- 37 ° C, 5 % CO2 인큐베이터에서 90 % 포화도까지 세포를 배양합니다. 0.25% 트립신-EDTA 2mL로 뇌세포를 소화합니다.
- 뇌세포를 80% 포화도까지 5mL의 DMEM/F12 성장 배지를 포함하는 35mm 유리 바닥 접시에 계대배양합니다.
- EcoHIV-mScarlet(8 μL, 1.26 × 106 TU/mL)을 배양 배지에 추가합니다. 마우스 신경교세포를 2일 동안 배양합니다.
- 형광 현미경으로 빨간색(mScarlet) 형광 신호를 매일 확인하십시오.
4. Tmem119-EGFP 마우스에 EcoHIV-mScarlet 바이러스 역안와 주입
- 3% 세보플루란을 사용하여 Tmem119-EGFP 마우스(생후 30일령의 수컷 및 암컷 마우스 모두)가 유해 자극에 더 이상 반응하지 않을 때까지 마취합니다.
- 주사 안이 위를 향하도록 하고 마취 시스템에 연결된 콧방울을 통해 호흡을 하도록 마우스 옆으로 고정합니다. 적절한 노즈콘 크기를 사용하여 지속적인 마취를 제공합니다.
- EcoHIV-mScarlet을 얼음 위에서 해동합니다. 33G의 뭉툭한 바늘로 바이러스 용액을 인공 주사기에 채웁니다.
- 마우스를 오른쪽 측면 누운 자세에 놓고 머리를 왼쪽을 향하게 합니다. 내측 안각의 위치를 주사 부위로 식별합니다.
- 안구를 안고 닦은 후 눈의 내측안각에 바늘(45도 각도)을 천천히 부드럽게 삽입합니다. 안구 뒤의 혈관(후안와동)에 바늘을 조심스럽게 앞으로 삽입합니다.
- 6.5μL의 EcoHIV-mScarlet(1.26 × 106 TU/mL, 양측 눈 접종)을 후안와동에 부드럽게 주입합니다. 후안와동에서 바늘을 조심스럽게 제거하고 눈꺼풀에 부드럽게 압력을 가하여 지혈을 제공합니다.
- 각막이 건조하거나 다치는 것을 방지하기 위해 눈에 윤활제를 바르십시오.
- 생쥐가 깨어날 때까지 가열 패드가 있는 회수 챔버에서 회복하도록 합니다.
알림: 동맥이 파열되거나 뼈가 골절되지 않도록 바늘 경사를 너무 깊게 배치해서는 안 됩니다. 바이러스 주입 시간은 여러 요인(예: 주입량, 역가, 동물 크기)에 따라 달라집니다. EcoHIV 바이러스 주입의 경우, 역안와 주사 1주일 후 유의미한 발현이 관찰되었다 11,16,17.
5. 뇌 조직 절편의 시각화
- 5% 세보플루란을 사용하여 생쥐를 심도 마취합니다. 마우스가 유해한 자극에 반응을 보이지 않고 반사 신경이 없는 경우 5.2단계로 이동합니다.
- 생쥐를 화학 흄 후드 안에 누운 자세로 유지하십시오.
- 흉부 정중선을 따라 피부를 엽니다. 횡격막을 분리하고 가위로 가슴을 엽니다.
- 22 G1 1/2 바늘을 좌심실에 삽입합니다. 가위로 오른쪽 아트리움을 엽니다.
- 50mL의 사전 냉각된 100mM PBS를 관류합니다. 사전 냉각된 100% 파라포름알데히드 완충액 4mL16을 관류합니다.
- 쥐의 뇌 전체를 제거한다16.
- 4% 파라포름알데히드로 하룻밤 동안 고정하십시오.
- Vibratome의 금속 플랫폼에 조직 접착제를 사용하여 뇌 조직을 고정합니다. 탄소강 블레이드로 50μm 두께의 코로나 단면을 절단합니다.
- 브러시를 사용하여 뇌 조각을 유리 슬라이드에 놓습니다. 즉시 0.1mL의 페이드 방지 장착 매체를 각 섹션에 추가합니다.
- 뇌 부분에 22mm x 50mm 커버슬립을 놓습니다. 슈퍼 프로스트 슬라이드를 1 일 동안 어둠 속에서 말리십시오.
- 컨포칼 현미경 시스템을 60×(A/1.4, 오일)의 배율로 구성하고 핀홀 크기가 30μm이고 후방 투영 핀홀 반경이 167nm인 0.15μm의 Z-평면 간격을 설정합니다.
- 488nm 및 594nm 파장을 사용하여 관심 뇌 영역의 다중 채널 이미지를 획득할 수 있습니다.
결과
3' 말단에 "Cla1", 5' 말단에 "Not1"의 효소 부위를 포함하는 mScarlet(1858 bp) 단편을 pNL4-3-EcoHIV 렌티바이러스 벡터에 삽입했습니다(그림 1). EcoHIV-mScarlet의 발현을 검증하기 위해 쥐 E18 배아의 피질에서 분리된 일차 뇌세포를 in vitro 6일 동안 EcoHIV-mScarlet(60 μL, 1.26 ×10 6 TU/mL)으로 처리했습니다. 그림 2의 데이터는 mScarlet의 적색 형광 신호가 주로 다양한 세포 형태에 따라 신경교 세포에서 국한되어 있음을 보여주었습니다. 또한, CD11b/c 및 Iba1(미세아교세포에 대한 세포 마커) 표지는 mScarlet 신호가 CD11b/c + 및/또는 Iba1 + 세포와 공동 국소화됨을 보여주었습니다. 이 데이터는 미세아교세포가 시험관 내 EcoHIV-mScarlet 분포의 주요 세포 유형임을 나타냅니다. 배양된 세포에서는 유의미한 신경 감염이 없었습니다(보충 그림 1).
다음으로, EcoHIV-mScarlet의 감염은 성체 마우스의 1차 혼합 신경교세포에서 테스트되었습니다. 이를 위해 먼저 성체 마우스(2개월)에서 혼합된 신경교세포를 분리 및 정제하고 2일 동안 EcoHIV-mScarlet(8 μL, 1.26 × 106 TU/mL)에 감염시켰습니다. 그림 3 의 이미지는 EcoHIV-mScarlet이 성체 마우스 신경교세포를 성공적으로 감염시켰음을 보여줍니다.
생쥐 뇌에서 EcoHIV-mScarlet의 분포 패턴을 더 자세히 다루기 위해, 특히 감염된 세포 유형을 확인하기 위해 EcoHIV-mScarlet을 Tmem119-EGFP 넉인 마우스 라인에 역궤도 주입했으며, 여기서 미세아교세포는 다른 대식세포 유형의 충돌 없이 EGFP 신호로 특이적으로 표지되었습니다5. 그림 4 ( 보충 그림 2에도 있음)의 결과는 EGFP 양성 세포에서 mScarlet red 형광 신호가 관찰되었음을 보여주며, 이는 미세아교세포가 마우스 뇌에서 EcoHIV 발현의 주요 세포 유형임을 시사합니다.
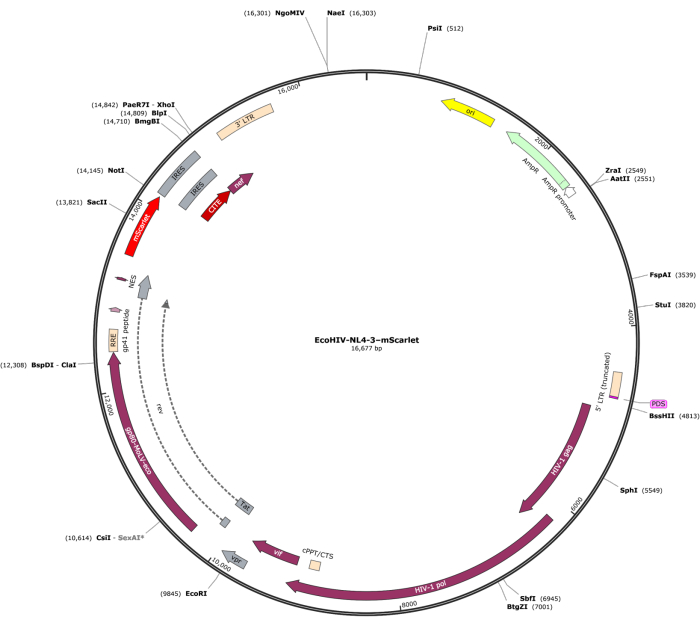
그림 1: EcoHIV-NL-4-3-mScarlet의 벡터 맵. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
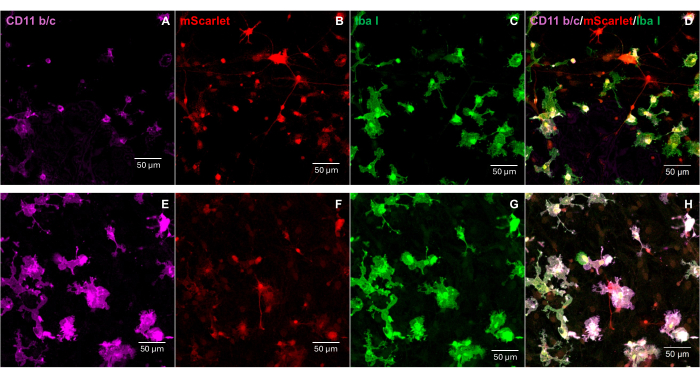
그림 2: 원발성 쥐 뇌세포에서 EcoHIV-mScarlet 감염. (A,E) 원발성 뇌세포에서 CD11b/c 염색의 대표적인 이미지. 뇌세포를 E18 쥐 배아에서 분리하여 6일 동안 EcoHIV-mScarlet 바이러스에 감염시켰습니다. (나,여) 체외 뇌 세포의 mScarlet 형광 신호의 대표 이미지. (씨,지) 일차 뇌 세포에서 Iba1 염색의 대표적인 이미지. (D,H) CD11b/c, mScarlet 및 Iba1의 삼중 표지 이미지를 병합했습니다. 스케일 바: 50μm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
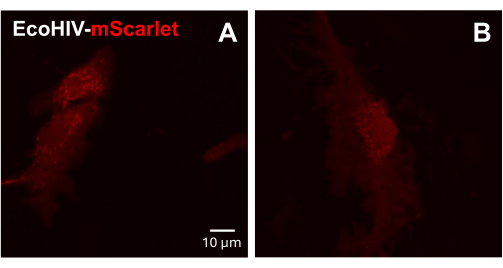
그림 3: 1차 마우스 혼합 신경교세포에서 EcoHIV-mScarlet 감염. (A,B) in vitro mScarlet 분포의 대표적인 컨포칼 이미지. 1차 혼합 신경교세포는 성체 C57BL6 마우스(2개월령)에서 분리하고 바이러스 감염 전 2주 동안 배양했습니다. EcoHIV-mScarlet을 이틀 동안 배양 배지에 첨가하고 컨포칼 현미경의 60× 대물렌즈 아래에서 이미지를 캡처했습니다. 눈금 막대 : 10 μm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
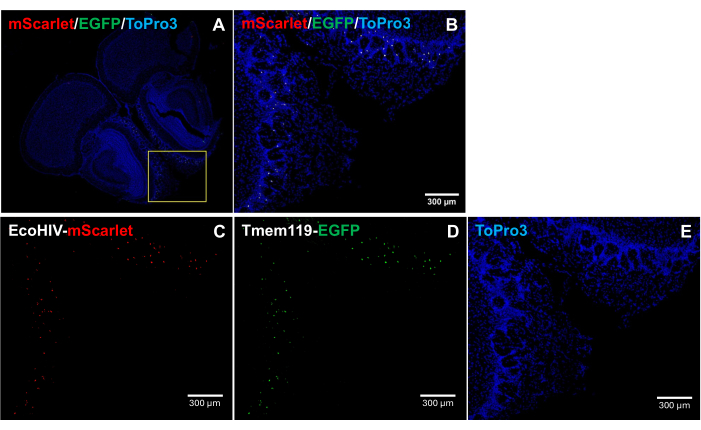
그림 4: Tmem119-EGFP knock-in 마우스 라인의 EcoHIV-mScarlet 분포. (A,B) 뇌 절편에서 mScarlet/EGFP/ToPro3 신호의 병합 이미지. 노란색 프레임은 (B)의 대상 영역을 나타냅니다. 눈금자: 300 μm. (C) Tmem119-EGFP 넉인 마우스 라인의 후각 영역의 외부 망상층에서 mScarlet 분포의 대표 이미지. (D) EGFP 분포의 대표 이미지. 형광 신호는 Tmem119-EGFP 넉인 마우스 라인의 미세아교세포에 국한되었습니다. (E) TO-PRO-3 핵 염색의 대표 이미지. 스케일 바: 300μm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
보충 그림 1: EcoHIV-mScarlet 바이러스에 감염된 원발성 쥐 뇌 세포의 MAP2 및 MOG 염색. 스케일 바: 50 μm. 이 파일을 다운로드하려면 여기를 클릭하십시오.
보충 그림 2: Tmem119-EGFP 넉인 마우스 라인에서 EcoHIV-mScarlet 감염의 컨포칼 이미지. 스케일 바: 75μm. 이 파일을 다운로드하려면 여기를 클릭하십시오.
보충 파일 1: EcoHIV-mScarlet plasmid DNA sequence. 이 파일을 다운로드하려면 여기를 클릭하십시오.
토론
본 연구에서는 (1) 새로운 EcoHIV-mScarlet이 시험관 내에서 1차 쥐의 뇌 세포를 성공적으로 감염시켰다는 사실이 밝혀졌습니다. (2) mScarlet, CD11b/c 및 Iba1의 삼중 표지는 시험관 내 쥐 뇌 세포에서 이 EcoHIV 발현의 우세한 세포 유형으로 미세아교세포를 확인했다. (3) 체외에서 성인의 1차 마우스 뇌세포는 EcoHIV-mScarlet 감염을 추가로 증거합니다. (4) Tmem119-EGFP knock-in 마우스 라인에서 EcoHIV-mScarlet 분포는 EcoHIV 감염의 미세아교세포 특이적 분포 패턴을 보여주었습니다.
새로운 연구에서는 중추 신경계(뉴런, 성상교세포, 미세아교세포, 희소돌기아교세포 등) 내에서 확인된 다양한 유형의 뇌세포가 HIV 및 HIV 관련 신경인지 장애 동안 기능적 및 전사체 변화를 나타낸다고 제안했습니다18,19. 예를 들어, 성상세포는 뇌의 30%-70%를 기여하며 뇌의 항상성을 유지하기 위해 감시를 수행합니다20. 성상세포는 또한 면역 기능을 조절하고 특히 HIV의 뇌 염증 및 신경 퇴행 상황에서 다중 사이토카인 및 케모카인의 분비를 조절합니다21,22. 미세아교세포의 HIV 감염은 바이러스 단백질과 전염증성 사이토카인 및 케모카인의 지속적인 방출을 초래할 뿐만 아니라 HIV 바이러스 저장소의 주된 공급원을 제공합니다 23,24,25,26. 또한, 활성화된 미세아교세포는 중추신경계에서 중요한 면역학적 기능에 기여합니다. 그러나 장기간의 활성화는 HIV 진행의 신경 퇴행을 악화시킬 수도 있습니다10,27. 희소돌기아교세포는 또한 여러 신경 영양 세포(예: 신경 성장 인자, 뇌 유래 신경 영양 인자 등)를 방출하는 것을 포함하여 중요한 기능을 합니다.28. 이전 연구에서는 AIDS 환자의 뇌에서 희소돌기아교세포의 수가 현저히 감소하는 것으로 밝혀졌는데, 이는 HIV 바이러스 단백질로 인한 희소돌기아교세포의 직접적인 손상을 나타낼 수 있다29. 그러므로, HIV의 특정 유형의 세포 조작 감염 모델은 감염 후 다양한 뇌 세포의 차등 기능을 식별하는 근본적인 수단을 제공해야 합니다. 이번 연구에서는 키메라 HIV(EcoHIV) 접종을 통해 HIV-1의 특징을 모방하는 생물학적 시스템을 개발했다. 이 HIV 접종은 또한 Tmem119-EGFP 넉인 마우스 라인과 결합되어 HIV의 미세아교세포 조작 설치류 모델을 생성하고 검증했습니다.
그러나 본 연구의 한계는 인정되어야 한다. in vitro에서 mScarlet 형광 신호를 나타내는 몇 가지 Iba1/CD11b/c 음성 세포가 있었습니다. 뇌 대식세포 또는 주피세포와 같은 다른 유형의 뇌세포가 EcoHIV 감염에 관여할 수 있으며, 또는 세포 배양 환경이 생체 내 접종에 비해 비정상적인 감염 패턴을 촉진할 수 있습니다. 앞으로는 전체 동물 연구를 통해 EcoHIV 감염 과정에서 mScarlet+ 미세아교세포의 기능을 더욱 규명하고, 뇌에서 mScarlet+EcoHIV 미세아교세포의 국소 분포를 더욱 규명해야 합니다. 또한, 미세아교세포 감염의 결과로 발생하는 신경인지적 변화도 이 설치류 모델에서 다루어질 수 있습니다. 총체적으로, Tmem119-EGFP 넉인 마우스의 EcoHIV-mScarlet 접종은 HIV 관련 신경인지 장애의 미세아교세포 주도 메커니즘을 조사하기 위한 새로운 모델 및 연구 전략을 제공합니다.
공개
저자 중 누구도 선언할 이해 상충이 없습니다.
감사의 말
이 작업은 NIH 보조금 DA059310, DA058586, AG082539 및 GM109091로 자금을 지원받았습니다. 마운트 시나이(Mount Sinai)에 있는 아이칸 의과대학(Icahn School of Medicine)의 포타시(Potash) 박사가 준 EcoHIV-NL4-3-EGFP의 관대한 선물에 감사드립니다.
자료
| Name | Company | Catalog Number | Comments |
| 293FT cells | ThermoFisher Scientific | R70007 | |
| 33 G, Small Hub RN Needle, (Point Style: 3, Needle Length: 19.25 mm) | Hamilton | 7803-05 | |
| Antibiotic-Antimycotic solution | Cellgro | 30004CI | 100x |
| C57BL/6-Tmem119em2Gfng/J | The Jackson Laboratory | Strain #:031823 | |
| Corning BioCoat Gelatin 75cm² Rectangular Canted Neck Cell Culture Flask with Vented Cap | Life Technologies | 354488 | |
| Corning DMEM with L-Glutamine, 4.5 g/L Glucose and Sodium Pyruvate | Life Technologies | 10013CV | |
| Cover glass | VWR | 637-137 | |
| Dumont #5 Forceps | World Precision Instruments | 14095 | |
| Dumont #7 Forceps | World Precision Instruments | 14097 | |
| EndoFree Plasmid Maxi Kit (10) | Qiagen | 12362 | |
| Eppendorf Snap-Cap Microcentrifuge Biopur Safe-Lock Tubes | Life Technologies | 22600028 | |
| Feather Double Edge Carbon Steel Blades | Ted Pella, inc. | 121-9 | |
| Fisher BioReagents Microbiology Media: LB Broth, Miller | Fisher Scientific | BP1426-500 | |
| Human recombinant anti-CD11b antibody | Miltenyi Biotec | 130-120-214 | 1:50 dilution |
| Intraocular Injector Syringe (6.5 µL), Removable Needle | Hamilton | 6609071-01 | |
| Invitrogen Lipofectamine 3000 Transfection Reagent | Life Technologies | L3000015 | |
| Invitrogen One Shot TOP10 Electrocomp E. coli | Fisher Scientific | C404052 | |
| Iris Forceps | World Precision Instruments | 15914 | |
| Iris Scissors | World Precision Instruments | 500216 | |
| Lentivirus-Associated p24 ELISA Kit | Cell Biolabs, inc. | VPK-107-5 | |
| Lenti-X Concentrator | Takara | PT4421-2 | |
| Opti-MEM I Reduced Serum Medium | Life Technologies | 11058021 | |
| Paraformaldehyde | Sigma-Aldrich | 158127-500G | |
| Paraformaldehyde | Sigma | P6148 | |
| PELCO easiSlicer Vibratory Tissue Slicer | Ted Pella, inc. | 11000 | |
| PELCO Pro CA44 Tissue Adhesive | Ted Pella, inc. | 10033 | |
| PELCO Pro Specimen Retrievers | Ted Pella, inc. | 101-33 | |
| ProLong Gold | Fisher Scientific | P36930 | |
| Rabbit monoclonal anti-Iba1 antibody | Abcam | ab178847 | 1:500 dilution |
| RN Compression Fitting 1 mm | Hamilton | 55750-01 | |
| Sevoflurane | Merritt Veterinary Supply | 347075 | |
| Sprague Dawley pregnant rat | Inotiv | ||
| SuperFrost Plus Slides | Fisher Scientific | 12-550-154% | |
| To-Pro-3 | ThermoFisher Scientific | T3605 | Nucleus staining kit |
| Trypsin-EDTA (0.25%), phenol red | ThermoFisher Scientific | 25200-056 | |
| Vannas Scissors | World Precision Instruments | 500086 |
참고문헌
- Vigorito, M., Lashomb, A. L., Chang, S. L. Spatial learning and memory in HIV-1 transgenic rats. J Neuroimmune Pharmacol. 2, 319-328 (2007).
- Moran, L. M., Booze, R. M., Mactutus, C. F. Time and time again: Temporal processing demands implicate perceptual and gating deficits in the HIV-1 transgenic rat. J. Neuroimmune Pharmacol. 8 (4), 988-997 (2013).
- Repunte-Canonigo,, et al. Gene expression changes consistent with neuroAIDS and impaired working memory in HIV-1 transgenic rats. Mol Neurodegener. 9, 26(2014).
- Reid, W., et al. An HIV-1 transgenic rat that develops HIV-related pathology and immunologic dysfunction. Proc Natl Acad Sci USA. 98 (16), 9271-9276 (2001).
- McLaurin, K. A., Li, H., Booze, R. M., Mactutus, C. F. Disruption of timing: NeuroHIV progression in the post-cART era. Sci Rep. 9, 827(2019).
- Roscoe, R. F., Mactutus, C. F., Booze, R. M. HIV-1 transgenic female rat: Synaptodendritic alterations of medium spiny neurons in the nucleus accumbens. J Neuroimmune Pharmacol. 9 (5), 642-653 (2014).
- Denton, A. R., et al. Selective monoaminergic and histaminergic circuit dysregulation following long-term HIV-1 protein exposure. J NeuroVirol. 25 (4), 540-550 (2019).
- Peng, J., et al. The HIV-1 transgenic rat as a model for HIV-1 infected individuals on HAART. J Neuroimmunol. 218 (1-2), 94-101 (2010).
- Abbondanzo, S. J., Chang, S. L. HIV-1 transgenic rats display alterations in immunophenotype and cellular responses associated with aging. PLoS ONE. 9, e105256(2014).
- Potash, M. J., et al. A mouse model for study of systemic HIV-1 infection, antiviral immune responses, and neuroinvasiveness. Proc Natl Acad Sci USA. 102 (10), 3760-3765 (2005).
- Li, H., McLaurin, K. A., Illenberger, J. M., Mactutus, C. F., Booze, R. M. Microglial HIV-1 expression: Role in HIV-1 associated neurocognitive disorders. Viruses. 13 (5), 924(2021).
- Kaiser, T., Feng, G. Tmem119-EGFP and Tmem119-CreERT2 transgenic mice for labeling and manipulating microglia. eNeuro. 6 (4), (2019).
- Bennett, M. L., et al. New tools for studying microglia in the mouse and human CNS. Proc Natl Acad Sci. USA. 113 (12), E1738-E1746 (2016).
- Satoh, J., et al. TMEM119 marks a subset of microglia in the human brain. Neuropathology. 36 (1), 39-49 (2016).
- Li, H., Aksenova, M., Bertrand, S. J., Mactutus, C. F., Booze, R. M. Quantification of filamentous actin (F-actin) puncta in rat cortical neurons. J Vis Exp. (108), e53697(2016).
- Li, H., McLaurin, K. A., Mactutus, C. F., Booze, R. M. A rat model of EcoHIV brain infection. J Vis Exp. (167), e62137(2021).
- Alfar, H. R., et al. Protocol for optimizing production and quality control of infective EcoHIV virions. STAR Protoc. 4 (3), 102368(2023).
- Malatesta, P., Hartfuss, E., Götz, M. Isolation of radial glial cells by fluorescent-activated cell sorting reveals a neuronal lineage. Development. 127 (24), 5253-5263 (2000).
- Parpura, V., et al. Glutamate-mediated astrocyte-neuron signaling. Nature. 369 (6483), 744-747 (1994).
- Wahl, A., Al-Harthi, L. HIV infection of non-classical cells in the brain. Retrovirology. 20 (1), 1(2023).
- Pandey, H. S., Seth, P. Friends turn foe-astrocytes contribute to neuronal damage in NeuroAIDS. J. Mol. Neurosci. 69 (2), 286-297 (2019).
- Minagar, A., et al. The role of macrophage/microglia and astrocytes in the pathogenesis of three neurologic disorders: HIV-associated dementia, Alzheimer's disease, and multiple sclerosis. J Neurol Sci. 202 (1-2), 13-23 (2002).
- Borrajo, A., Spuch, C., Penedo, M. A., Olivares, J. M., Agís-Balboa, R. C. Important role of microglia in HIV-1 associated neurocognitive disorders and the molecular pathways implicated in its pathogenesis. Ann Med. 53 (1), 43-69 (2021).
- González-Scarano, F., Martín-García, J. The neuropathogenesis of AIDS. Nat Rev Immunol. 5 (1), 69-81 (2005).
- Li, H., McLaurin, K. A., Mactutus, C. F., Booze, R. M. Microglia proliferation underlies synaptic dysfunction in the prefrontal cortex: Implications for the pathogenesis of HIV-1-associated neurocognitive and affective alterations. J. Neurovirol. 29 (4), 460-471 (2023).
- Kim, B. H., et al. EcoHIV infection of primary murine brain cell cultures to model HIV replication and neuropathogenesis. Viruses. 16 (5), 693(2024).
- Réu, P., et al. The lifespan and turnover of microglia in the human brain. Cell Rep. 20 (4), 779-784 (2017).
- Jones, J. D. Potential of glial cell modulators in the management of substance use disorders. CNS Drugs. 34 (7), 697-722 (2020).
- Kaalund, S. S., Johansen, A., Fabricius, K., Pakkenberg, B. Untreated patients dying with aids have loss of neocortical neurons and glial cells. Front Neurosci. 13, 1398(2020).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유