Method Article
Characterizing Mediated Extracellular Electron Transfer in Lactic Acid Bacteria with a Three-Electrode, Two-Chamber Bioelectrochemical System
요약
여기에서는 3전극, 2챔버 생전기화학 시스템을 사용하여 젖산 박테리아의 매개 세포외 전자 전달(EET)을 특성화하기 위한 프로토콜을 제시합니다. Lactiplantibacillus plantarum 과 산화환원 매개체 1,4-dihydroxy-2-naphthoic acid를 사용하여 이 방법을 설명하고 매개 EET를 평가하는 데 사용되는 전기화학적 기술에 대한 자세한 설명을 제공합니다.
초록
많은 박테리아가 세포외 전자 전달(EET)을 수행하여 전자가 세포에서 세포 외 말단 전자 수용체로 전달됩니다. 이 전자 수용체는 전극일 수 있으며 전자는 산화환원 활성 매개체 분자를 통해 간접적으로 전달될 수 있습니다. 본 연구에서는 식품업계에서 널리 사용되는 프로바이오틱 유산균인 락티플란티 바실러스 플란타럼(Lactiplantibacillus plantarum)의 매개된 EET를 생전기화학 시스템을 이용하여 연구하기 위한 프로토콜을 제시합니다. 3전극, 2챔버 생전기화학 시스템을 조립하는 방법을 자세히 설명하고 크로노암페로메트리 및 순환 전압전류법 기술을 사용하여 용해성 매개체가 있는 상태에서 EET를 특성화하는 방법에 대한 지침을 제공합니다. 데이터 분석 및 해석을 입증하기 위해 L. plantarum 을 사용한 1,4-dihydroxy-2-naphthoic acid(DHNA) 매개 EET 실험의 대표 데이터를 사용합니다. 이 프로토콜에 설명된 기술은 전기 발효 및 생체 전기 촉매에 대한 새로운 기회를 열 수 있습니다. L. plantarum 에 이 전기화학 기술을 최근 적용한 결과, 식품 발효에서 중요한 풍미 성분인 발효 최종 제품을 생산하기 위한 대사 흐름이 가속화되는 것으로 나타났습니다. 따라서 이 시스템은 식품 생산의 풍미를 변경하거나 귀중한 화학 물질을 생산하기 위해 더욱 개발될 가능성이 있습니다.
서문
생전기화학 시스템은 미생물과 전극을 인터페이스하여 세포외 전자 전달(EET) 메커니즘을 조사하고 생체 전기 촉매에 대한 재생 가능한 접근 방식을 제공합니다 1,2,3. 자연적으로 EET를 수행하는 미생물은 외전기원(exoelectrogen)으로 알려져 있으며, 이는 신진대사에서 파생된 전자를 세포 외 말단 전자 수용체(예: 철(수)산화물 및 전극)로 전달합니다1. Geobacter 및 Shewanella 종 4,5에서 처음 특성화된 EET 경로는 이후 많은 박테리아에서 확인되었습니다. 이러한 외전기원은 폐기물 흐름에서 전기 에너지를 생성하고, CO2를 고정하고, 전기 합성을 통해 귀중한 화학 물질을 생산하는 것과 같은 여러 미생물 전기화학 기술에서 중심적인 역할을 합니다 1,6,7,8,9,10,11,12.
이러한 외전기원 중 하나는 그람 양성 젖산 박테리아인 락티플란티바실러스 플란타룸(Lactiplantibacillus plantarum)입니다13. L. plantarum은 육류, 시리얼, 야채, 발효 식품 및 음료와 같은 다양한 유형의 식품뿐만 아니라 인간 및 기타 척추 동물의 내장을 포함한 광범위한 환경에 서식하는 유목민 프로바이오틱 박테리아입니다 14,15,16,17. 게놈은 유연한 이종발효 대사를 암호화하여 이러한 다양한 환경에서 성공적인 적응을 가능하게 합니다. 그것은 잘 연구되고 식품 및 건강 산업에서 널리 사용되며 일반적으로 식품 의약국 (Food and Drug Administration)에 의해 안전한 것으로 인정됩니다18,19. 따라서 L. plantarum은 EET 기반 기술을 위한 유용한 플랫폼 역할을 할 수 있는 잠재력을 가지고 있습니다.
L. plantarum에 대한 최근 연구에서는 원래 Listeria monocytogenes13,20에서 특징지어지는 복잡한 EET 경로를 암호화하는 다중 유전자 오페론을 확인했습니다. L. plantarum에서 이 오페론에서 합성된 단백질은 전자 매개체로 퀴논 1,4-디하이드록시-2-나프토산(DHNA)을 제공할 때 생전기화학 시스템(BES)에서 EET를 촉진합니다13. 이 경로의 첫 번째 필수 단백질은 NADH를 산화시키고 DHNA를 환원시키는 막결합 NADH-퀴논 산화환원효소(Ndh2)입니다. DHNA는 전극에 직접 전자를 전달하거나 보조 단백질 PplA를 통해 간접적으로 전자를 전달합니다 (그림 1) 13 , 21 , 22 . 최근 연구에 따르면 L. plantarum은 DHNA와 구조적으로 유사한 다른 퀴논을 전자 매개체로 사용할 수도 있습니다. 그러나 L. plantarum은 DHNA 또는 이러한 대체 퀴논을 생산할 수 없으므로 EET가 발생하기 위해서는 매개체가 환경에 외인성으로 존재해야 합니다 13,22,23.
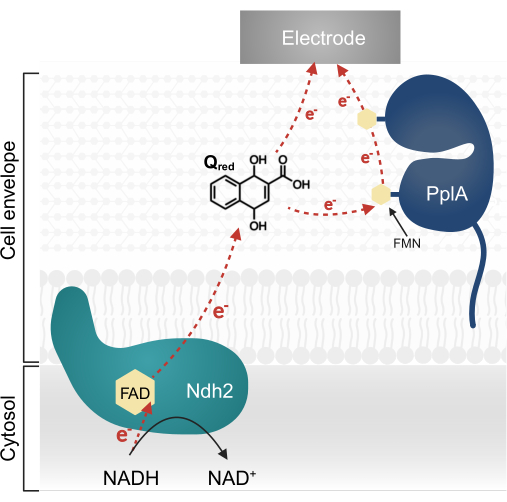
그림 1: Lactiplantibacillus plantarum EET의 전자 흐름. Ndh2는 NADH에서 퀴논 DHNA로 전자를 전달합니다. 전자는 전극으로 셔틀되어 환원된 퀴논에 의해 직접 또는 부속 단백질 PplA를 통해 간접적으로 전류를 생성합니다. 약어: FAD = Flavin adenine dinucleotide; FMN = 플라빈 모노뉴클레오티드; EET = 세포외 전자 전달; NADH = 환원된 니코틴아미드 아데닌 디뉴클레오티드; Ndh2 = NADH-퀴논 산화환원효소; DHNA = 1,4- 디 히드 록시 -2- 나프 토산; PplA = 포스포리파제 A. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
이 기사에서는 BES 기반 방법을 사용하여 L. plantarum에서 DHNA 매개 EET를 특성화하기 위한 포괄적인 프로토콜을 제공합니다. 3전극, 2챔버 시스템은 박테리아를 작동 전극에 가두어 박테리아에 가해지는 전위를 정밀하게 제어하는 동시에 작동 전극과 상대 전극 사이의 누화를 방지합니다. 당사는 사전 실험 준비, BES 조립, 크로노암페어 측정법(CA) 및 순환 전압전류법(CV)을 활용한 EET 분석, 실험 후 시료 분석을 포함하는 5일에 걸친 포괄적인 프로토콜을 제시합니다. 이 프로토콜은 EET 경로의 메커니즘을 밝히고 전기 발효 및 전기 촉매를 위한 시스템을 구축하는 데 적용할 수 있습니다.
프로토콜
참고: 2개의 챔버가 있는 BES 어셈블리는 다음 프로토콜에서 "반응기"라고 합니다.
1. 배지 준비
- L. plantarum 배양 배지를 준비합니다.
- 지시에 따라 상업용 MRS(de Man Rogosa Sharpe) 매체 및 표 1에 설명된 대로 mMRS 매체24를 준비합니다. mMRS의 pH를 6.5로 조정합니다. 두 매체를 0.22μm 필터에 통과시켜 필터 멸균하고 둘 다 사용할 때까지 4°C에서 보관합니다.
- 표 2에 설명된 대로 만니톨(mCDM)13,25로 화학적으로 정의된 배지를 준비하고 pH를 6.5로 조정합니다. 각 반응기의 양극 챔버를 110mL의 배지로 채울 수 있도록 충분한 배지를 준비합니다. 0.22μm 필터를 통해 mCDM을 필터 멸균합니다.
참고: mCDM은 사용 당일에 신선하게 준비해야 합니다. 구성요소 용액은 사전에 준비될 수 있습니다. 0.22μm 필터를 통해 모든 구성 용액을 필터 멸균하고 4°C에서 보관합니다. Wolfe's 비타민을 준비할 때 살균하기 전에 pH를 11로 조정하고 어두운 곳에 보관하거나 호일에 싸서 보관하십시오. Wolfe's Minerals를 준비할 때 니트릴로트리아세트산(NTA)을 첨가한 후 pH를 8로 조정하십시오. 그런 다음 나머지 성분을 넣고 살균한 후 어두운 곳에 보관하거나 호일로 싸서 보관하십시오.
- 살균을 위해 1x PBS와 오토클레이브를 준비합니다. 이 프로토콜에 사용하기 위해 4°C에서 보관하십시오.
- 지시에 따라 상업용 M9 매체를 준비하고(표 3) 오토클레이브를 사용하여 멸균합니다. 각 반응기의 음극 챔버를 110mL로 채울 수 있도록 충분한 매체를 준비합니다. 실온에서 보관하십시오.
2. 1일차: BES 반응기 조립 및 초기 L. 플란타럼 배양
참고: BES 반응기의 개략도와 프로토콜에 표시된 조립 부품을 자세히 설명하는 다이어그램에 대해서는 그림 2 를 참조하십시오.
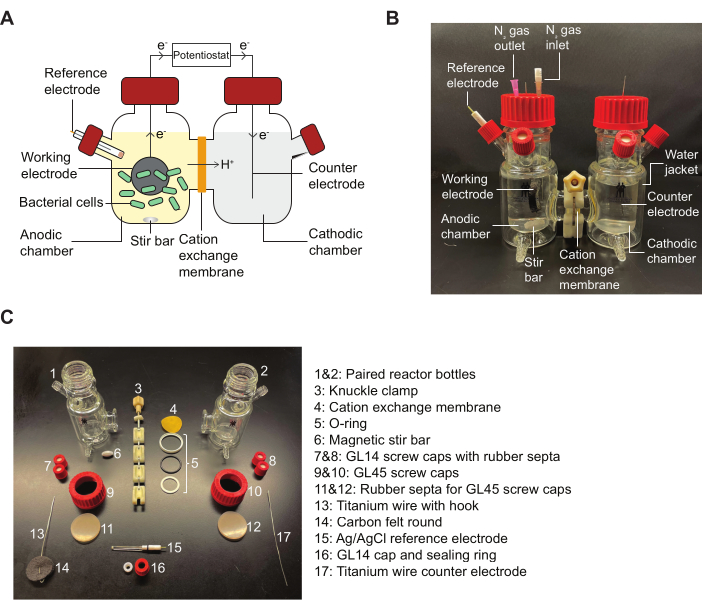
그림 2: BES 구성 요소 및 조립 다이어그램. (A) 2챔버 BES 반응기의 개략도. 양극 챔버의 박테리아(녹색)는 퀴논 매개체가 있는 상태에서 전자를 작동 전극(검은색 원)으로 전달합니다. 전자는 회로를 통해 음극 챔버로 흐르므로 전위차 조절기에 의해 양극과 음극 사이의 전류를 측정할 수 있습니다. (B) 양극 챔버 내의 N2 입구 및 출구 바늘을 포함하여 완전히 조립된 BES 반응기를 묘사한 이미지. (C) 분해된 반응기의 모든 부분을 묘사한 이미지. 약어 : BES = bioelectrochemical system. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
- 반응기를 조립하고 살균합니다.
- 작동 전극과 카운터 전극을 준비합니다. 작업을 위해 1.0mm 직경의 티타늄 와이어를 모래로 미리 절단하고 균일하게 광택이 날 때까지 산화알루미늄 사포로 전극을 반대합니다. 펜치를 사용하여 각 작업 전극 와이어의 한쪽 끝을 작은 고리로 구부립니다. 16cm2 탄소 펠트를 각 작동 전극 와이어에 원형으로 밀어 넣고 탄소 펠트 안팎으로 와이어를 한 번 엮고 후크에 고정될 때까지 라운드를 와이어 아래로 당깁니다. 고무 격막을 와이어로 뚫고 몇 센티미터 당겨 작업 전극과 카운터 전극을 GL45 캡에 고정합니다.
- 쌍을 이루는 반응기를 조립하려면 먼저 O-링을 조립하고 물에 미리 적신 미리 절단된 양이온 교환 멤브레인을 조립된 O-링에 배치합니다. 두 쌍의 반응기 병의 큰 바닥 구멍 사이에 멤브레인이 있는 O-링을 놓습니다. 반응기 쌍 병과 O-링을 너클 클램프로 멤브레인으로 고정하여 손가락으로 단단히 조입니다. 마그네틱 교반 막대를 각 양극 챔버에 떨어뜨린 다음 고무 격막이 장착된 GL14 캡으로 각 병 상단의 모든 작은 구멍을 닫습니다.
알림: 너클 cl을 과도하게 조이지 마십시오.amps 또는 캡은 병에 균열이나 파손을 유발할 수 있습니다. - 각 반응기 병에 110mL의 탈이온수(DI)를 채운 다음 전극이 장착된 적절한 GL45 캡으로 각 병을 닫습니다. 원형이 후크에 남아 있도록 펠트 원형의 상단을 부드럽게 눌러 탄소 펠트 원형 작동 전극이 장착된 캡을 삽입합니다.
알림: 신선한 탄소 펠트는 소수성이며 초기 조립에서 반응기의 물을 튕겨냅니다. 오토클레이브는 탄소 펠트가 실험을 위해 적절하게 친수성을 갖도록 합니다. - 실리콘 밀봉 링이 장착된 GL14 전극 캡을 수집합니다.
- 고압증기멸균 전에 모든 GL45 캡을 부드럽게 풉니다. 물로 채워진 반응기와 전극 캡을 멸균하기 위해 오토클레이브합니다. 오토클레이빙 후 반응기를 실온으로 냉각시킵니다.
- 문화 L. plantarum NCIMB8826. 멸균 상태에서 글리세롤 스톡의 상단에서 일부 박테리아를 긁어내고 3mL의 상용 MRS 배지에 접종합니다. 흔들리지 않고 37 ° C에서 밤새 배양을 성장시킵니다.
참고 : L. plantarum 은 산소를 말단 전자 수용체로 사용하지 않습니다. 그러므로,26을 흔들어 매체에 산소를 공급할 필요는 없다. 그러나 다른 미생물을 사용하는 경우 배양 조건이 달라집니다.
3. 2일차: 기준전극 준비, 실험 시작을 위한 반응기 준비, L. plantarum sub-culturing
- Ag/AgCl 기준 전극을 준비합니다.
참고: 이 단계는 재료 표에 표시된 Ag/AgCl 기준 전극의 준비를 설명합니다. 사용자는 다른 기준 전극을 사용하는 경우 제조업체의 지침을 따라야 합니다.- Ag/AgCl 기준 전극을 분해하고 와이어를 샌딩합니다. 유리 하우징에서 전극을 부드럽게 당겨 유리 하우징을 두드려 기존 KCl 용액을 비웁니다. 산화된 물질을 제거하기 위해 고르게 광택이 날 때까지 산화알루미늄 사포로 전극 와이어를 부드럽게 샌딩합니다.
- 샌딩된 모든 참조 전극 와이어를 작은 교반 막대가 있는 작은 비커에 모으고 와이어가 완전히 잠길 때까지 비커에 100% 표백제를 채웁니다. 전극이 더 어두운 회색으로 변할 때까지 30분 동안 교반 플랫폼에서 와이어를 표백시켜 와이어를 염화시킵니다. 표백 후 전극선을 DI 물로 철저히 헹굽니다.
- 기준 전극을 다시 조립하려면 주사기를 사용하여 염화은으로 포화된 3M KCl 용액으로 유리 하우징을 완전히 채우고 측면을 가볍게 두드려 기포를 제거합니다. 동일한 주사기를 사용하여 전극 와이어 캡에 KCl 용액을 채운 다음 와이어를 하우징에 삽입합니다. 유리 하우징의 바닥을 벤치 상단의 종이 타월에 대고 전극을 유리 하우징에 삽입한 다음 캡을 단단히 눌러 전극을 닫습니다. 필요할 때까지 KCl 용액으로 얕게 채워진 비커에 기준 전극을 보관하고 나머지 모든 기준 전극으로 반복합니다.
- 디지털 멀티미터를 사용하여 집에서 만든 Ag/AgCl 기준 전극의 전압을 측정합니다.
- Ag/AgCl 기준 전극(표준 수소 전극, SHE에 비해 197mV로 추정됨)의 끝을 3M KCl로 채워진 비커에 얕게 담그십시오. 멀티미터를 상업적으로 구입한 포화 칼로멜 전극(SCE, 241mV 대 SHE)에 단단히 연결합니다.
- 각 기준 전극과 SCE 사이의 전위차를 측정합니다. 기준 전극이 SCE와 44 ± 10 mV 차이가 있는지 확인합니다. 이 범위를 벗어나는 모든 기준 전극을 분해하고 재조립하십시오.
- 캡이 유리 하우징과 만나는 이음새를 파라필름으로 밀봉합니다.
- 실험을 위해 반응기를 준비합니다.
- 멸균 생물 안전 캐비닛에서 반응기의 오토클레이브 물을 적절한 매체로 교환합니다. 오토클레이브 물을 붓습니다. 음극 챔버를 110mL의 오토클레이브 M9 배지로 채웁니다. 아노딕 챔버를 갓 준비한 mCDM 110mL로 채웁니다.
- 기준 전극을 설치합니다. 각 양극 챔버에서 하나의 GL14 캡을 제거하고 오토클레이브 전극 캡(실리콘 밀봉 링이 있는 GL14 캡)으로 교체합니다. 기준 전극에 70% 에탄올을 분사하여 멸균한 다음 전극 캡을 통해 하나의 기준 전극을 각 양극 챔버에 배치합니다.
알림: 기준 전극이 탄소 펠트 라운드와 직접 접촉하지 않는지 확인하십시오. - 생물 안전 캐비닛에서 반응기를 제거하기 전에 누출을 방지하기 위해 모든 캡과 클램프를 손가락으로 조이십시오.
- 반응기를 워터 펌프 시스템에 연결합니다. 각 반응기를 적절한 교반 막대 플랫폼에 놓습니다. 각 반응기의 워터 재킷 꼭지를 고무 튜브로 다음 반응기에 연결하고 말단 반응기를 워터 펌프의 유입 및 유출 튜브에 연결합니다.
알림: 필요한 경우 지퍼 타이를 사용하여 튜브를 고정하여 모든 연결부가 누출 없이 단단히 조여져 있는지 확인하십시오. - 펌프에 물을 채우고 물 조절기 4-6방울을 넣으십시오. 펌프 시스템을 켜고 온도를 30°C로 설정합니다. 펌프를 시작하고 모든 반응기 워터 재킷을 통한 물의 흐름을 관찰하여 연결부에서 누출이 없는지 확인합니다.
- 교반 플랫폼을 켜고 220RPM으로 연속 교반하도록 설정합니다.
- 반응기를 질소 분사 가스 라인에 부착합니다. 에어 필터를 4인치, 22G 바늘에 부착하고 반응기 양극 챔버의 상단 격막을 통해 바늘을 매체에 삽입하여 질소 주입구 역할을 합니다. 질소 배출구 역할을 하는 양극 챔버의 상단 격막에 또 다른 1인치, 18G 바늘을 삽입합니다. 질소 공급원의 가스 라인을 에어 필터에 연결하고 밸브를 열어 가스가 반응기를 통해 부드럽게 거품이 일도록 합니다. 혐기성 상태를 유지하기 위해 실험 내내 모든 양극 챔버를 통해 질소 거품이 지속적으로 발생하도록 합니다.
알림: 입구 바늘이 탄소 펠트 원형에서 멀리 떨어져 있는지 확인하십시오. 기포 흐름은 탄소 펠트 또는 기준 전극과 접촉해서는 안 됩니다. - 생물반응기를 전위차 리드에 부착합니다. potentiostat의 working, counter 및 reference electrode alligator clip lead를 해당 전극에 연결합니다.
알림: 멀티미터를 사용하여 전선/집전체와 전극 사이의 저항을 확인하여 적절한 전기 연결을 확인하고 잠재적인 측정 오류를 최소화합니다.
- prerun을 위한 potentiostat 매개변수를 입력합니다.
참고: 중요한 기술 설정은 다음과 같습니다. 각 기술에 대한 소프트웨어 설정의 확장 목록은 표 4 를 참조하십시오.- 포텐시오스탯을 켜고 컴퓨터에서 EC-lab 소프트웨어를 초기화합니다. 장치 아래의 왼쪽 상단 패널에 있는 전위차점 기호 버튼을 클릭하여 전위차점을 컴퓨터에 연결합니다. 연결되면 장치 이름이 아래 텍스트 상자에 녹색 원과 함께 나타납니다.
- Bioreactors에 연결된 모든 채널을 Edit 탭을 클릭한 다음 synchronize를 선택하여 하나의 그룹으로 동기화합니다. 해당 채널 번호 상자를 클릭합니다. | 확인.
- 왼쪽의 매개변수 설정 패널에서 + 버튼을 클릭하여 전위차에 개방 회로 전압(OCV) 기술을 추가합니다. 파란색 설정 상자에서; 기준 전극(RE)에 대해 작동 전극 전위(EWE)를 측정하도록 설정하고 총 3시간 동안 36초마다 dt 간격으로 시간을 기록합니다.
- 다음으로, 전위차 조절기에 순환 전압주사법(CV) 기술을 추가합니다. EWE의 초기 전위를 2mV/s의 스캔 속도로 RE에 비해 0V의 Ei로 설정합니다. 0.4 V의 버텍스 전위(E1)로 스윕 대 RE는 -0.7 V의 버텍스 퍼텐셜(E2)로 반전합니다. 총 두 번의 스윕에 대해 스캔을 반복합니다.
참고: 미생물 전기화학 시스템에서 미생물 접종 및 생물막 형성은 금속 물질 또는 무기 분자에 비해 높은 용량을 유도합니다. 순환 전압주사법 스캐닝 중에는 전위가 변하고 충전 전류가 배경 역할을 합니다. 높은 신호 대 잡음 비율을 달성하려면 더 낮은 스캔 속도가 필요하지만 이렇게 하면 스캔 시간이 늘어납니다. 1.1V의 넓은 전기화학적 창을 포함하는 두 사이클을 스캔하기 때문에 2mV/s의 스캔 속도로 최대 9.1분이 소요되는 반사이클이 발생합니다. 결과적으로 두 사이클에 총 36.4분이 걸립니다. 스캔 속도를 더 줄이면 시간이 과도하게 많이 걸립니다. - 크로노암페로메트리(CA) 기술을 추가합니다. t = 200 h의 시간 동안 RE 대 0.2 V의 일정한 전위 EWE를 적용하고 25-40 초마다 dt 간격으로 시간을 기록합니다. 원하는 수준의 세부 정보를 얻기 위해 전위차도 소프트웨어를 기반으로 시간 간격을 조정합니다.
참고: DHNA의 중간점 전위는 Ag/AgCl에 비해 약 -0.093V입니다. 따라서 작동 전극에 RE 대비 0.2V의 전위가 가해지면 DHNA에서 전극으로 전자가 전달될 수 있습니다. - 모든 매개변수를 입력한 후 녹색 시작 삼각형을 눌러 실행을 시작합니다. 소프트웨어의 지시에 따라 파일을 원하는 대로 저장한 다음 Save(저장)를 클릭합니다. 소프트웨어는 기술 1, "OCV"를 시작합니다. 몇 분 동안 OCV 트레이스를 관찰하여 모든 반응기가 긍정적으로 읽고 안정적인 신호로 서로 닫히는지 확인합니다. OCV 및 초기 CV(미디어 제어 CV는 보충 그림 S1 참조)를 완료하고 CA가 안정화될 때까지 실행되도록 실험을 밤새 실행합니다.
- 무균 조건에서 L. plantarum 1:200의 MRS 배양을 50mL의 mMRS에서 계대배양합니다. 흔들지 않고 37°C에서 밤새 세포를 성장시킵니다.
참고: 50mL 야간 배양은 일반적으로 반응기에서 최종 OD600 이 0.2라고 가정할 때 6개의 반응기에 충분한 세포를 생성합니다. 더 크거나 작은 실험에 맞게 배양 부피를 조정합니다.
4. 3일차: 세포 및 DHNA/DMSO 주입
- 세포를 씻고 반응기에 주입하십시오.
- 아침에 인큐베이터에서 mMRS L. plantarum 배양액을 제거합니다. 멸균 상태에서 배양물을 50mL 원뿔형 튜브로 옮기고 얼음 위에 놓습니다.
- 멸균되고 차가운 1x PBS에서 세포를 2x 세척합니다. 이를 위해 4 °C 원심분리기에서 4,000 × g의 배양물을 5분 동안 원심분리하여 세포를 펠릿화합니다. 무균 상태에서 PBS 50mL에 세포를 부드럽지만 완전히 재현탁시킨 다음 이전과 같이 다시 원심분리합니다. 두 번째 세탁을 위해 반복합니다. 최종 원심분리 후 차가운 PBS에서 세포를 OD600 = 11로 재현탁합니다.
- 멸균 조건에서 각 반응기에 바늘이 장착된 3mL 주사기에 2mL의 재현탁 세포를 로드합니다.
- 반응기 스테이션에서 세포 주사기의 뚜껑을 제거하고 바늘을 반응기 양극 챔버 상단에 삽입합니다. 이때 주사기 플런저를 누르지 마십시오. 모든 반응기에 대해 반복합니다. 모든 주사기가 제자리에 놓이면 플런저를 눌러 세포를 반응기에 주입하고 CA 트레이스에서 주입 시간을 기록합니다. 이 부피의 셀은 반응기에서 0.2의 최종 OD600 을 생성합니다. 모든 주사기는 생물학적 위험 상자에 넣고 바늘은 지정된 날카로운 물건 생물학적 위험 용기에 폐기하십시오. 전류가 2-4시간 동안 CA 트레이스에서 평평하게 안정화되도록 합니다.
참고: 주입 시 CA 추적에서 전류 변동을 관찰할 수 있습니다. 2-4시간 후에 이러한 변동은 평평한 전류(한 시간 동안 <2μA 전류 변화)로 안정화되며, 이 시점에서 DHNA를 주입할 수 있습니다.
- 초기 pH를 측정하고 DHNA를 주입합니다.
- DHNA 용액을 준비합니다. 1.5mL 튜브에 분말 DHNA를 100% DMSO에 용해시켜 20mg/mL DHNA 용액 500μL를 준비합니다. 인슐린 주사기 3개에 DHNA 용액 110μL를, 인슐린 주사기 3개에 110μL의 DMSO만 채웁니다.
참고: DHNA는 물에 약간 용해되지만 DMSO는 이 농도의 DHNA 스톡에 더 나은 용매입니다. 매개체 용매는 다른 매개체를 사용하는 경우 달라질 수 있습니다. - BES 반응기 스테이션에서 실험용 반응기를 + DHNA 로, 용매 제어 반응기를 - DHNA로 표시합니다. DHNA 주사기의 뚜껑을 제거하고 + DHNA로 지정된 각 양극 챔버의 상단에 주사기를 삽입합니다. DMSO 전용 주사기를 - DHNA로 지정된 각 양극 챔버에 삽입합니다. 이때 주사기 플런저를 누르지 마십시오.
- 샘플 분석을 위해 0h 시점 샘플을 채취합니다. 2인치, 21G 바늘이 장착된 3mL 주사기를 사용하여 사용하지 않은 스몰캡 격막을 통해 각 양극 챔버에서 2mL 배지 샘플을 채취하고 샘플을 24 딥 웰 플레이트로 옮겨 0시간 시점(DHNA 주입점) 동안 pH를 측정합니다. 원하는 경우 각 양극 챔버에서 사용한 배지 1mL를 취하고 0.2μm 필터를 통해 깨끗한 라벨링된 튜브로 필터링하여 HPLC 또는 기타 분석을 사용하여 대사 산물을 정량화합니다. 사용한 배지 샘플은 -80°C에서 보관하십시오.
- 모든 DHNA 및 DMSO 주사기의 플런저를 눌러 반응기에 주입합니다. CA 추적에서 주입 시간을 기록합니다. 모든 주사기와 바늘은 적절하게 폐기하십시오.
- 각 반응기에 대해 0h pH 샘플을 측정하고 기록합니다.
- DHNA 용액을 준비합니다. 1.5mL 튜브에 분말 DHNA를 100% DMSO에 용해시켜 20mg/mL DHNA 용액 500μL를 준비합니다. 인슐린 주사기 3개에 DHNA 용액 110μL를, 인슐린 주사기 3개에 110μL의 DMSO만 채웁니다.
5. 4일차: 실험 완료 및 시료 채취
- DHNA 주입 후 24시간 후에 전기화학 분석을 수행하고 최종 샘플을 채취합니다.
- DHNA 주입 후 24시간 이내에 CA 실행을 종료합니다.
- 4.2.3단계에 따라 샘플 분석을 위해 24시간 시점 샘플을 채취합니다.
- 3.3.4단계에서 설명한 매개 변수에 따라 24시간 시점에 대해 CV를 다시 실행합니다.
- 각 반응기에서 24시간 샘플의 pH를 측정하고 기록합니다.
- 반응기를 분해하고 청소하십시오.
- 전위차 조절기를 끕니다. 그런 다음 각 반응기에서 작동, 카운터 및 참조 리드를 분리합니다. 전위차도 리드 앨리게이터 클립에서 수분을 닦아냅니다.
- 질소 가스 흐름을 끕니다. 가스 리드를 분리한 다음 유입 및 유출 바늘을 제거합니다. 모든 바늘은 날카로운 물건 용기에 적절하게 폐기하십시오.
- 워터 펌프를 끕니다. 펌프에서 유입 및 유출 튜브를 분리하고 물이 양동이로 배수되도록 합니다. 분리할 때 튜브의 끝을 펌프의 급수관 위로 올려 물이 바닥으로 빨려 들어가는 것을 방지하십시오. 워터 재킷 튜브에서 각 반응기를 하나씩 분리하여 최종 유출 반응기에서 초기 유입 반응기까지 작업합니다.
- 반응기의 모든 매체를 큰 생물학적 위험 용기에 비우십시오. 폐기 시 일반 배양 표백 방법을 따르십시오.
- 비우면 모든 반응기 조각을 분해하고 청소하십시오. 양이온 교환 멤브레인과 탄소 펠트 라운드를 적절한 생물학적 위험 폐기물로 폐기하십시오. 70% 에탄올로 기준 전극과 티타늄 와이어를 청소하고 청소한 기준 전극을 물이 얕게 채워진 비커에 보관하십시오. 반응기 병, 캡, O-링 및 CL을 부드럽게 청소하십시오.amp실험실 세제를 푼 따뜻한 물에 넣고 DI 물로 철저히 헹구고 보관하기 전에 모든 부품을 자연 건조하십시오.
6. 5일차: 전기화학 분석
참고: 다음은 이 프로토콜에 대한 데이터 플로팅에 대한 일반적인 설명입니다. 분석 및 데이터 해석에 대한 자세한 설명은 대표 결과 섹션에서 제공됩니다.
- CA 분석의 경우: DHNA 주입 시간을 0h 시점으로 설정합니다. 0시간 시점의 모든 반복에 대해 36초마다 측정된 전류 밀도(μA /cm2의 j)의 평균 및 표준 편차를 시간(h)의 함수로 표시합니다. 전류 밀도를 작업 전극 영역(16cm2)의 함수로 계산합니다.
- CV 분석의 경우: 전류 밀도(j in μA/cm2)를 작동 전극 전위(EWE in V)의 함수로 나타내는 각 실험 조건(매체만 해당, DMSO 또는 DHNA)에 대한 대표 CV 트레이스를 플롯합니다. 선택한 CV 실행의 플롯 주기 2.
결과
크로노암페로메트리 분석
L. plantarum의 EET는 그림 3에 표시된 크로노암페로메트리(CA) 데이터를 통해 관찰할 수 있으며, 여기서 전류 밀도 추적은 L. plantarum에서 작동 전극으로의 전자 전달을 시각화합니다. 우리는 24시간 동안 Ag/AgCl에 대해 +200mV의 일정한 전위를 유지하면서 시간 대비 전류 밀도(j)를 모니터링했습니다. 교반 전해질 용액에 20μg/mL DHNA를 주입한 후 비생물적 DHNA 산화 스파이크가 관찰된 후 약 8시간 시점에서 132.0 ± 2.47μA/cm2에서 최고조에 달하는 생체 전류 밀도의 급격한 증가가 관찰되었습니다. 반대로, DMSO의 주입은 무시할 수 있는 전류 밀도를 초래했습니다. 이러한 결과는 L. plantarum과 전극 사이의 전자 전달을 촉진하는 데 필요하고 효율적인 매개체로서 DHNA의 중요성을 강조합니다. 사용자는 BES에서 DHNA의 농도를 조정하여 전류 출력을 조정할 수 있습니다. 이전 연구는 또한 L. plantarum이 광범위한 DHNA 농도에 걸쳐 용량 의존적 방식으로 DHNA에 반응하여 0.01 μg / mL13,22의 낮은 DHNA 농도가있는 상태에서 상당한 전류를 생성한다는 것을 나타냅니다.
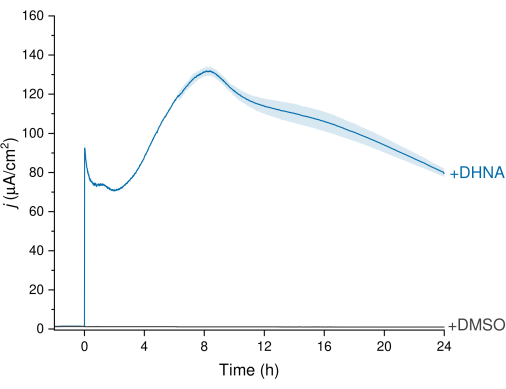
그림 3: DHNA에 의해 매개된 락티플란티바실러스 플란타럼 EET의 크로노암페로메트리 분석. DHNA(20μg/mL) 또는 DMSO를 mCDM 전해질(pH~ 6.5)에 주입하고 주입 시간을 t = 0으로 식별했습니다. j 는 전류 밀도를 작동 전극 영역의 함수로 나타냅니다. 실험은 탄소 펠트 전극 (16cm2)을 사용하여 200mV 대 Ag / AgCl에서 수행하고 교반했다. 값은 삼중 BES 반응기에서 얻은 평균 ± sd로 표시됩니다. 약어: EET = extracellular electron transfer; DHNA = 1,4- 디 히드 록시 -2- 나프 토산; DMSO = 디메틸 설 폭사이드; mCDM = 만니톨이 포함된 화학적으로 정의된 배지. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
순환 전압주사법 해석
L. plantarum에서 DHNA 매개 EET를 추가로 평가하기 위해 DHNA 주입 후 24시간 후에 순환 전압주사법을 실시했습니다. 여기에서는 20μg/mL DHNA가 있는 L. 플란타럼, DMSO가 있는 L. 플란타럼, 20μg/mL DHNA가 있는 배지의 세 가지 조건에 대한 CV 추적을 보여줍니다. 그림 4A에서 볼 수 있듯이, L. 플란타럼을 함유한 반응기에 20μg/mL DHNA가 존재하면 50mV에서 산화 전류가 뚜렷하게 증가했는데, 이는 DMSO만 있을 때는 발생하지 않았습니다. 이러한 데이터는 L. plantarum과 양극 사이의 전자 전달을 촉진하기 위해 산화 환원 매개체 DHNA를 추가하는 것이 필요하다는 것을 확인합니다. L. plantarum + DMSO trace에서 다양한 작은 redox peaks가 관찰되었지만, 이러한 peaks는 media control trace와 유사했으며 mCDM의 redox-active 성분에 기인할 가능성이 높습니다(보충 그림 S1). 그림 4B에서는 생물 조건(L. plantarum + DHNA)과 비생물적 조건(Media + DHNA)에서 DHNA의 미량을 비교했습니다. 두 미량 모두 50mV 부근에서 뚜렷한 DHNA 산화 피크를 나타냈지만, 생물 조건에서만 50mV를 초과하는 전류의 지속적인 증가를 관찰했습니다. 촉매 피크는 300mV에서 129μA/cm2의 전류 밀도에 도달했으며, 이는 비생물적 미량에 비해 256% 증가를 나타냅니다. 이 turnover CV 프로파일은 미생물 EET27의 특징으로, 양극에서 DHNA가 산화된 후 전자원(만니톨)이 있는 상태에서 L. plantarum 세포에 의한 DHNA의 재환원을 나타냅니다. 또한, 비생물적 미량은 -240 mV 및 -180 mV 부근의 새로운 산화 피크를 나타냈습니다. 이전 연구에 따르면 이러한 피크의 출현은 DHNA가 ACNQ (2- 아미노 -3- 카르복시 -1,4- 나프토 퀴논) 21 , 28로 분해되기 때문일 수 있습니다. 당사는 생물 미량에서 이러한 피크를 관찰하지 못했으며, 이는 L. 플란타럼 세포와 DHNA의 상호 작용이 DHNA를 안정화하고 분해를 방지할 수 있음을 나타냅니다. 주목해야 할 점은 20μg/mL DHNA가 있는 배지에 대한 24시간 추적이 세포를 추가하지 않고 이 프로토콜에 따라 별도로 수행되었다는 것입니다.
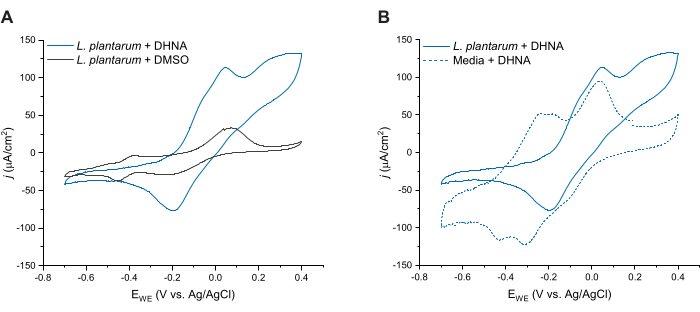
그림 4: 대표적인 순환 전압전류법 트레이스. 모든 CV 실험은 용액을 교반하는 동안 2mV/s의 스캔 속도로 탄소 펠트(16cm2)를 작업 전극으로 사용하여 mCDM에서 수행되었습니다. (A) t = 24h에서 DHNA(20μg/mL) 또는 DMSO를 사용한 Lactiplantibacillus plantarum 에 대한 CV 추적.(B) t = 24h에서 L. plantarum (생물 조건) 또는 mCDM(비생물적 조건)에서 20μg/mL DHNA의 CV 추적. 약어: CV = 순환 전압주사법; mCDM = 만니톨이 포함된 화학적으로 정의된 배지; DHNA = 1,4- 디 히드 록시 -2- 나프 토산; DMSO = 디메틸 설폭사이드. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
pH 분석
L. plantarum의 EET 활성은 24시간 동안 pH를 현저하게 떨어뜨렸습니다. 그림 5에서 볼 수 있듯이 DHNA에 노출된 L. plantarum의 평균 샘플 pH는 3.33 ± 0.01(p = 6.85 × 10-6, n = 3)로 떨어졌고, DMSO에 노출된 L. plantarum의 평균 샘플 pH는 6.50 ± 0.06(p = 0.0409, n = 3)으로 떨어졌습니다. 이전 연구에서 나타난 바와 같이, 이러한 감소는 L. plantarum이 EET13을 수행할 때 발생하는 발효 대사의 증가에 기인합니다. L. plantarum은 일반적으로 해당과정(glycolysis) 및 발효 경로를 통해 만니톨을 대사하며, 이는 아세테이트(acetate), 젖산염(lactate) 및 에탄올(ethanol)을 최종 발효 산물로 생산하고 기질 수준의 인산화(phosphorylation)를 통해 ATP를 생성합니다29. EET 조건에서 발효를 통한 대사 흐름이 증가하여 BES 매체에서 최종 발효 생성물의 생산이 증가합니다13. 이러한 대사 변화로 인해 DMSO 대조 반응기에 비해 DHNA가 있는 반응기에서 매체 pH가 더 빠르게 떨어집니다.
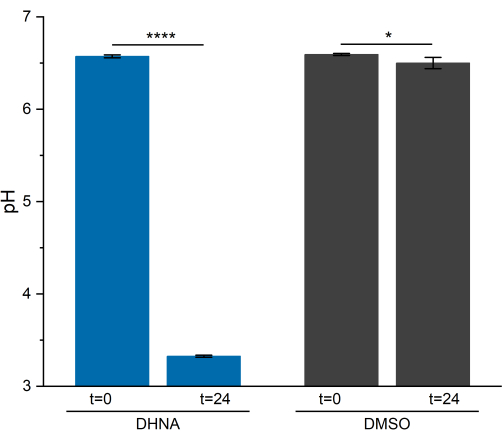
그림 5: 락티플란티바실러스 플란타럼 생전기화학 시스템의 pH 분석. 샘플은 크로노암페어 측정 동안 t = 0 및 t = 24시간에 수집되었습니다. 값은 삼중 BES 반응기에서 얻은 평균 ± sd로 표시됩니다. 유의성은 단측 t-검정에 의해 결정되었습니다. DHNA: P-값 = 6.85 × 10-6. DMSO: p-값 = 0.0409. 약어 : DHNA = 1,4- 디 히드 록시 -2- 나프 토산; DMSO = 디메틸 설폭사이드. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
표 1: mMRS 배지 제조를 위한 성분24. 이 표를 다운로드하려면 여기를 클릭하십시오.
표 2: mCDM 매체 준비를 위한 성분. 이 표는 Tejedor-Sanz et al.13 및 Aumiller et al.25에서 발췌한 것입니다. 이 표를 다운로드하려면 여기를 클릭하십시오.
표 3: M9 매체 준비를 위한 성분. 이 표를 다운로드하려면 여기를 클릭하십시오.
표 4: OCV, CA 및 CV 기술에 대한 EC-Lab 매개변수 설정. 약어: OCV = 개방 회로 전압; CA = 크로노암페로메트리; CV = 순환 전압전류법. 이 표를 다운로드하려면 여기를 클릭하십시오.
보충 그림 S1: DMSO 및 mCDM만 사용한 Lactiplantibacillus plantarum 의 대표적인 순환 전압주사법 흔적. t = 24 h에서 DMSO를 사용하고 t = 0 h에서 mCDM을 단독으로 사용하는 L. plantarum 에 대한 CV 추적. 모든 CV 실험은 용액을 교반하는 동안 2mV / s의 스캔 속도로 탄소 펠트 (16cm2)를 작동 전극으로 사용하여 수행되었습니다. 약어: CV = 순환 전압주사법; mCDM = 만니톨이 포함된 화학적으로 정의된 배지; DHNA = 1,4- 디 히드 록시 -2- 나프 토산; DMSO = 디메틸 설폭사이드. 이 파일을 다운로드하려면 여기를 클릭하십시오.
토론
여기에 설명된 3전극, 2챔버 생전기화학 시스템을 사용하여 L. plantarum에서 DHNA 매개 EET의 현재 생성을 측정하는 방법을 보여주었습니다. 이러한 BES 실험은 고품질 데이터를 생성합니다. 그러나 BES는 민감합니다. 따라서 프로토콜의 성공 여부는 특히 반응기 및 기준 전극 어셈블리, 양극 챔버 내 바늘 및 전극의 위치 지정, 양이온 교환 멤브레인 교체에서 사용자의 정밀도에 달려 있습니다. 반응기를 조심스럽게 조립하여 고압증기멸균 또는 실험 중에 물/매체 누출이 없도록 하는 것이 중요합니다. 누수는 양이온 교환 멤브레인이 O-링에 정확하게 맞도록 절단되었는지 확인하고 너클 클램프를 손가락으로 단단히 조이면 해결할 수 있습니다. 또한 실험을 위해 친수성이 될 수 있도록 고압멸균 중에 펠트 탄소를 물에 완전히 담그는 것도 중요합니다. 새로운 사용자는 고압증기멸균 전에 물로 채워진 새로 조립된 반응기를 2시간 동안 방치하여 주 병 접합부 아래에서 느린 누출 징후를 확인하는 것이 좋습니다. 또한 적절한 기준 전극 어셈블리를 보장하면 반응기 전반에 걸쳐 일관된 데이터 복제가 보장됩니다. 유리 하우징 내부의 테프론 프릿이 변색되거나 금이 가거나 건조되면 기준 전극의 높은 저항이 발생할 수 있습니다. 사용자는 유리 하우징을 교체하여 기준 전극 성능을 복원할 수 있습니다.
실험 중 양극 챔버 내의 모든 바늘과 전극의 올바른 방향은 실험 성공에 매우 중요합니다. 기준 전극은 탄소 펠트 작동 전극의 어떤 부분도 직접 접촉해서는 안 됩니다. 사용자는 반응기 위에서 작동 전극 티타늄 와이어를 부드럽게 회전시켜 탄소 펠트 위치를 조정할 수 있습니다. 또한 질소 살포를 위한 바늘 배치는 챔버 내의 전극 또는 챔버 위의 전극/전위차 연결부와 직접 접촉해서는 안 됩니다. 질소 흐름은 어느 전극으로도 흐르지 않도록 조정해야 합니다. 마지막으로, 사용자는 작업 전극을 교반 막대에서 1-2cm 위에 위치시켜 교반 막대가 작동 전극과 접촉하지 않도록 해야 합니다. OCV에서 불규칙한 신호가 관찰되는 경우, 일반적으로 반응기 내에 전극과 질소 흐름을 적절하게 배치하고 전위차 기둥 리드와 반응기 전극 사이의 연결이 정확하고 안전한지 확인하여 해결할 수 있습니다. 마지막으로, 우리의 경험에 따르면 DHNA와 같은 전자 매개체는 양이온 교환막 내에 유지될 수 있으며 너무 많이 재사용하면 높은 백그라운드 전류를 유발할 수 있습니다. 신뢰할 수 있는 실험 결과를 보장하기 위해 특히 매개된 EET를 조사할 때 2-3회 사용 후 양이온 교환막을 교체하는 것이 좋습니다.
전극에 대한 직접적인 미생물 부착이 전자 전달을 촉진하는 직접 EET와 달리, 매개 EET는 세포막과 전극을 가로지르는 전자 셔틀의 일관된 확산을 필요로 하므로 여기에 설명된 고유한 BES 설정이 가능합니다. 먼저, 프로토콜에서 단일 챔버 BES보다 이중 챔버 BES를 선택하여 양이온 교환 멤브레인으로 양극 및 음극 반응을 분리했습니다. 이러한 분리는 자유롭게 확산되는 전자 매개체(DHNA)와 미생물이 음극과 교차 상호 작용하는 것을 방지하여 미생물 EET가 전자 매개체와 양극을 감소시키는 주요 전자 공급원이 되도록 합니다. 또한 분리를 통해 매개체 농도/분포 및 양극에 배치된 전위와 같은 매개변수를 정밀하게 제어할 수 있습니다. 또한 흑연 막대, 금속 전극, 유리 탄소 또는 인듐 주석 산화물(ITO)과 같은 다른 옵션 중에서 탄소 펠트를 양극 재료로 선택했습니다. 이는 탄소 펠트의 3D 다공성 구조가 전극(30)보다 훨씬 더 큰 표면적을 제공하여 고농도에서도 매개체를 효율적으로 활용할 수 있기 때문입니다. 당사의 3전극, 2챔버 BES 설정은 장기 모니터링에서도 매개된 EET에 대한 신뢰할 수 있고 재현성 있는 판독값을 제공합니다. 그러나 이 프로세스는 상대적으로 처리량이 적습니다. 이 프로토콜은 EET 메커니즘에 대한 벤치 스케일 이해 또는 프로토타입 EET 응용 프로그램을 테스트하는 데 적합합니다. 휴대용 또는 인쇄된 BES(31,32), 상보성 금속 산화물 반도체(CMOS) 어레이(33), 또는 업스케일링된 BES(34)와 같은 대안적인 BES 아키텍처는 상이한 기본 또는 응용 목적을 위해 연구자에 의해 고려될 수 있다.
이 프로토콜에서는 가장 일반적으로 사용되는 전기화학 기술인 크로노암페어메트리(CA) 및 순환 전압주사법(CV)에 대한 자세한 지침을 제공합니다. EIS(Electrochemical Impedance Spectroscopy) 및 DPV(Differential Pulse Voltammetry)와 같은 다른 전기화학 기술은 전하 전달 저항과 이중층 커패시턴스 35,36,37을 분석하여 BES에 대한 더 깊은 통찰력을 제공할 수 있다는 점은 주목할 가치가 있습니다. 이 BES 프로토콜은 EET 측정을 가능하게 하지만, 포괄적인 분석을 위해서는 대사 활성 및 세포 바이오매스 측정으로 전기화학적 데이터를 보완하는 것도 필수적일 수 있습니다. L. plantarum과 같은 미생물은 젖산 및 에탄올과 같은 다른 발효 부산물과 함께 전자 싱크 중 하나로 EET에 참여합니다. 더욱이, 세포 바이오매쓰 성장은 또한 전자 싱크(13)로서 작용한다는 것은 주목할 만하다. 따라서 소비된 전자 공여체(예: 만니톨)를 정량화하고, 세포 바이오매스 성장을 평가하고, 발효 부산물을 모니터링하면 EET의 효율성과 생리학적 파급 효과에 대한 심층적인 통찰력을 얻을 수 있습니다. 세포 대사 산물은 일반적으로 크로마토그래피와 효소 분석을 사용하여 정량화되며, 세포 생존율과 성장은 집락 형성 단위를 계산하고 600nm에서 사용된 배지의 광학 밀도를 각각 측정하여 평가합니다13. 또한 EET 측정은 실험 조건의 작은 섭동에 민감하다는 점에 유의하는 것이 중요합니다. 이는 pH, 온도, 교반 속도 및 질소 가스 살포 속도(38)를 포함하지만 이에 제한되지 않습니다. 따라서 바이오분석 측정으로 측정된 EET 수준을 정규화하는 것은 내부 대조군으로 작용하여 다른 날에 수행된 실험 전반에 걸쳐 일관된 평가를 용이하게 합니다.
매개된 EET는 전기화학적 기법과 다른 생물분석 측정을 결합하여 전기발효 및 생물전기촉매를 위한 새로운 기회를 창출합니다. 유기, 무기 또는 효소 전기 촉매의 기존 사용은 높은 비용으로 인해 문제가 발생하고 분해되기 쉽습니다. 또는 미생물을 살아있는 전기 촉매로 사용하는 것은 미생물의 자가 복구 및 자가 복제 능력으로 인해 더 저렴하고 확장 가능한 솔루션을 제공합니다39. 일반적으로 안전한 유산균으로 인식되는 L. plantarum은 특히 흥미로운 섀시입니다. 이 프로토콜에 설명된 것과 동일한 전기화학적 설정을 사용하여 이전에 L. plantarum이 EET 조건에서 케일 주스를 발효시키고 젖산염, 아세테이트 및 숙시네이트와 같은 더 많은 발효 최종 생성물을 생산하기 위한 대사 플럭스를 가속화할 수 있음을 보여주었습니다13; 이러한 유기산은 식품 발효에 필수적인 풍미 화합물입니다. 이는 전기화학적 기술을 사용하여 L. 플란타럼의 매개된 EET가 잠재적으로 하이재킹되어 대사 흐름을 조작하거나 식품 맛을 변경하거나 귀중한 화학 물질을 생산할 수 있음을 의미합니다. 이 프로토콜에 제시된 전기화학적 기술은 L. plantarum에 적용될 수 있을 뿐만 아니라 매개 EET를 수행하는 다른 토착 미생물 또는 엔지니어링 미생물에도 일반적으로 적용될 수 있다는 점에 주목할 가치가 있습니다40,41. 플라빈(flavin), 페로센(ferrocene), 중성 적색(neutral red), 페리시아나이드(ferricyanide), 로손(lawsone) 및 메나디온(menadione)과 같은 상이한 전자 매개체는 사용되는 특정 미생물의 전자 전달 메커니즘에 기초하여 선택될 수 있다22,42. 더욱이, 이 연구에서 확립된 BES 프로토콜은 이전에 Shewanella 및 Geobacter 종43,44에서 입증된 바와 같이 매개자가 없는 EET를 수행하는 외전기원으로 확장될 수 있습니다. 최적화된 성장 배지를 사용하여 특정 미생물의 세포 활동을 지원하여 EET 성능을 촉진해야 합니다. 이 프로토콜은 L. plantarum에서 DHNA 매개 EET에 대한 매개변수를 미세 조정하지만 다른 미생물 및 전자 매개체가 적용될 때 수정이 예상됩니다.
공개
저자는 선언할 경쟁 이해관계가 없습니다.
감사의 말
BES 조립, 유지 관리, 중요 단계 및 문제 해결에 대한 통찰력 있는 토론을 해주신 Ajo-Franklin 연구소 구성원들에게 감사드립니다. 이 연구는 육군 연구실의 후원을 받았으며 보조금 번호 W911NF-22-1-0239 (C. M. A-F, R. A. 지원) 및 텍사스 암 예방 및 연구소 (Cancer Prevention and Research Institute of Texas)의 보조금 # RR190063 (C. M. A-F, R. C., S. L. 및 B. B. K. 지원)에 따라 수행되었습니다. 그림 1 은 BioRender.com 를 사용하여 만든 것입니다.
자료
| Name | Company | Catalog Number | Comments |
| 1,4-Dihydroxy-2-naphthoic acid (DHNA) | Sigma-Aldrich | 281255-25G | |
| 1.0 mm diameter titanium wire | Thermo Fisher Scientific | 045485.BY | Cut to size for working and counter electrodes |
| 120-C Aluminum Oxide Sheets 9" x 11" | Johnson Abrasives | 10108-15 | |
| 3 mL plastic syringes | Thermo Fisher Scientific | 14955457 | |
| 3M KCl solution saturated with silver chloride | Millipore Sigma | 60137-250ML | |
| 6.35-mm-thick carbon felt | Thermo Fisher Scientific | 043200.RF | Cut into 16 cm2 rounds |
| Ag/AgCl reference electrode | CH Instruments | CH111 | |
| Air-Tite Premium Hypodermic Needles | Thermo Fisher Scientific | 14-817-102 | |
| AlK(SO)4 * 12H2O | Sigma-Aldrich | 237086-100G | |
| Ammonium citrate tribasic | Millipore Sigma | A1332 | |
| Avanti J-15R Centrifuge | Beckman Coulter | B99517 | |
| BD Precision Glide Needle, 18 G x 1 inch | Thermo Fisher Scientific | 14-826-5G | |
| BD Precision Glide Needle, 21 G x 2 inch | Thermo Fisher Scientific | 14-821-13N | |
| Bel-Art SP Scienceware Cleanware Aqua-Clear Water Condtioner | Thermo Fisher Scientific | 23-278339 | |
| Biotin | Millipore Sigma | B4639 | |
| CaCl2 | Millipore Sigma | C4901 | |
| Calcium D-(+)-pantothenate | Millipore Sigma | 1087009 | |
| Casamino acids | Millipore Sigma | 2240-OP | |
| cation exchange membrane | Membranes International | CMI-7000 | Cut into rounds fit to the BES O-ring |
| CoCl2 * 6H2O | Millipore Sigma | C8661 | |
| CuSO4 * 5H2O | Millipore Sigma | C8027 | |
| Cysteine-HCl * H2O | Millipore Sigma | 30129 | |
| DMSO | Millipore Sigma | 5439001000 | |
| DS-11+ Spectrophotometer | Denovix | N/A | |
| EC-Lab Software | BioLogic | N/A | |
| ECO E 4 S heating circulator | Lauda-Brinkmann | Cat. No. 115 V; 60 Hz : L001191 | |
| FeSO4 * 7H2O | Millipore Sigma | 215422 | |
| Folic acid | Millipore Sigma | F8758 | |
| H3BO3 | Millipore Sigma | B6768 | |
| Insulin syringes with BD Micro-Fine IV Needle | Thermo Fisher Scientific | 14-829-1A | |
| Lactiplantibacillus plantarum NCIMB8826 | N/A | N/A | Reference: Tejedor-Sanz et al., 2022 |
| Lactobacillus MRS Broth | HiMedia | M369 | |
| M9 Broth | Milliport Sigma | 63011 | |
| Magnesium sulfate anhydrous | Millipore Sigma | 208094 | |
| Manganese sulfate monohydrate | Millipore Sigma | 221287 | |
| mannitol | Millipore Sigma | M1902-1KG | |
| Mettler Toledo FiveEasy Benchtop pH Meter | Hogentogler | F20-KIT | |
| MgCl2 * 6H2O | Millipore Sigma | M9272 | |
| MgSO4 * 7H2O | Millipore Sigma | M2773 | |
| Millex - GV 0.22 µm PVDF Membrane Filter Unit | Millipore Sigma | SLGV004SL | |
| MnCl2 * 4H2O | Millipore Sigma | 203734 | |
| MnSO4 * H2O | Millipore Sigma | 221287 | |
| MOPS | Millipore Sigma | M1442 | |
| N2 gas | Airgas | NI UHP300 | Filter before use |
| Na2MoO4 * 2H2O | Millipore Sigma | 331058 | |
| Na2SO4 | Millipore Sigma | 238597 | |
| NaCl | Millipore Sigma | S9888 | |
| NH4Cl | Millipore Sigma | A9434 | |
| Nicotinic acid | Millipore Sigma | N-0761 | |
| Nitrilotriacetic acid (NTA) | Millipore Sigma | 72560 | |
| p-Aminobenzoic acid | Millipore Sigma | P9879 | |
| Phosphate buffered saline, 10x solution | Thermo Fisher Scientific | BP399-1 | |
| Potassium phosphate dibasic | Millipore Sigma | P8281 | |
| potentiostat | BioLogic | VMP-300 | |
| Protease peptone #3 | Bacto | 211693 | |
| Pyridoxine HCl | Millipore Sigma | P6280 | |
| Riboflavin | Millipore Sigma | 555682 | |
| RO10 magnetic stir bar platform | IKA | 3691000 | |
| Sodium acetate trihydrate | Millipore Sigma | 935700 | |
| Stir bar, egg-shaped | Thermo Fisher Scientific | 14-512-121 | Place in anodic chamber of BES |
| Thiamine HCl | Millipore Sigma | V-014 | |
| Thioctic acid (α-Lipoic acid) | Millipore Sigma | T-1395 | |
| Tryptophan | Millipore Sigma | 9136 | |
| Tween80 | Millipore Sigma | P4780 | |
| Vitamin B12 | Millipore Sigma | V6629 | |
| Jacketed MCF set, 100 ml, NW25, 2 x GL14 port | Adams & Chittenden Scientific Glass | NA | Customized |
| Yeast extract | Millipore Sigma | Y1625 | |
| ZnSO4 * 7H2O | Millipore Sigma | Z0251 |
참고문헌
- TerAvest, M. A., Ajo-Franklin, C. M. Transforming exoelectrogens for biotechnology using synthetic biology. Biotechnol Bioeng. 113 (4), 687-697 (2016).
- Chen, H., Dong, F., Minteer, S. D. The progress and outlook of bioelectrocatalysis for the production of chemicals, fuels and materials. Nat Catal. 3 (3), 225-244 (2020).
- Chen, H., et al. Fundamentals, applications, and future directions of bioelectrocatalysis. Chem Rev. 120 (23), 12903-12993 (2020).
- Lovley, D. R., Phillips, E. J. P. Novel mode of microbial energy metabolism: organic carbon oxidation coupled to dissimilatory reduction of iron or manganese. Appl Environ Microbiol. 54 (6), 1472-1480 (1988).
- Myers, C. R., Nealson, K. H. Bacterial manganese reduction and growth with manganese oxide as the sole electron acceptor. Science. 240 (4857), 1319-1321 (1988).
- Koch, C., Harnisch, F. Is there a specific ecological niche for electroactive Microorganisms. ChemElectroChem. 3 (9), 1282-1295 (2016).
- Zhao, J., et al. Microbial extracellular electron transfer and strategies for engineering electroactive microorganisms. Biotechnol Adv. 53, 107682 (2021).
- Zhang, J., Li, F., Liu, D., Liu, Q., Song, H. Engineering extracellular electron transfer pathways of electroactive microorganisms by synthetic biology for energy and chemicals production. Chem Soc Rev. 53 (3), 1375-1446 (2024).
- Logan, B. E. Exoelectrogenic bacteria that power microbial fuel cells. Nat Rev Microbiol. 7 (5), 375-381 (2009).
- Logan, B. E., Rabaey, K. Conversion of wastes into bioelectricity and chemicals by using microbial electrochemical technologies. Science. 337 (6095), 686-690 (2012).
- Gu, L., Xiao, X., Yup Lee, S., Lai, B., Solem, C. Superior anodic electro-fermentation by enhancing capacity for extracellular electron transfer. Bioresour Technol. 389, 129813 (2023).
- Boucher, D. G., et al. Bioelectrocatalytic synthesis: concepts and applications. Angew Chem Int Ed. 62 (46), e202307780 (2023).
- Tejedor-Sanz, S., et al. Extracellular electron transfer increases fermentation in lactic acid bacteria via a hybrid metabolism. eLife. 11, e70684 (2022).
- Martino, M. E., et al. Nomadic lifestyle of Lactobacillus plantarum revealed by comparative genomics of 54 strains isolated from different habitats. Environ Microbiol. 18 (12), 4974-4989 (2016).
- Fidanza, M., Panigrahi, P., Kollmann, T. R. Lactiplantibacillus plantarum-nomad and ideal probiotic. Front Microbiol. 12, 712236 (2021).
- Duar, R. M., et al. Lifestyles in transition: evolution and natural history of the genus Lactobacillus. FEMS Microbiol Rev. 41 (Suppl_1), S27-S48 (2017).
- Kaushik, J. K., et al. Functional and probiotic attributes of an indigenous isolate of Lactobacillus plantarum. PLOS ONE. 4 (12), e8099 (2009).
- Seddik, H. A., et al. Lactobacillus plantarum and its probiotic and food potentialities. Probiotics Antimicrob Proteins. 9 (2), 111-122 (2017).
- Siezen, R. J., et al. Phenotypic and genomic diversity of Lactobacillus plantarum strains isolated from various environmental niches. Environ Microbiol. 12 (3), 758-773 (2010).
- Light, S. H., et al. A flavin-based extracellular electron transfer mechanism in diverse Gram-positive bacteria. Nature. 562 (7725), 140-144 (2018).
- Tolar, J. G., Li, S., Ajo-Franklin, C. M. The differing roles of flavins and quinones in extracellular electron transfer in Lactiplantibacillus plantarum. Appl Environ Microbiol. 89 (1), e0131322 (2023).
- Li, S., De Groote Tavares, C., Tolar, J. G., Ajo-Franklin, C. M. Selective bioelectronic sensing of pharmacologically relevant quinones using extracellular electron transfer in Lactiplantibacillus plantarum. Biosens Bioelectron. 243, 115762 (2024).
- Blackburn, B., Alba, R., Hatch, A., Ajo-Franklin, C. M., Mevers, E. Understanding the Chemical Properties that Drive Extracellular Electron Shuttles. ChemRxiv. , (2024).
- De Man, J. C., Rogosa, M., Sharpe, M. E. A medium for the cultivation of Lactobacilli. J Appl Bacteriol. 23 (1), 130-135 (1960).
- Aumiller, K., et al. A chemically-defined growth medium to support Lactobacillus-Acetobacter sp. community analysis. PLOS ONE. 18 (10), e0292585 (2023).
- Brooijmans, R. J. W., de Vos, W. M., Hugenholtz, J. Lactobacillus plantarum WCFS1 electron transport chains. Appl Environ Microbiol. 75 (11), 3580-3585 (2009).
- LaBelle, E., Bond, D. R. Cyclic voltammetry for the study of microbial electron transfer at electrodes. Bio-electrochemical systems: from extracellular electron transfer to biotechnological application. , (2009).
- Mevers, E., et al. An elusive electron shuttle from a facultative anaerobe. eLife. 8, e48054 (2019).
- Dirar, H., Collins, E. B. End-products, Fermentation balances and molar growth yields of homofermentative Lactobacilli. Microbiology. 73 (2), 233-238 (1972).
- Huong Le, T. X., Bechelany, M., Cretin, M. Carbon felt based-electrodes for energy and environmental applications: A review. Carbon. 122, 564-591 (2017).
- Zhou, A. Y., Baruch, M., Ajo-Franklin, C. M., Maharbiz, M. M. A portable bioelectronic sensing system (BESSY) for environmental deployment incorporating differential microbial sensing in miniaturized reactors. PLOS ONE. 12 (9), e0184994 (2017).
- Benjamin, S. R., de Lima, F., Nascimento, V. A. d. o., de Andrade, G. M., Oriá, R. B. Advancement in paper-based electrochemical biosensing and emerging diagnostic methods. Biosensors. 13 (7), 689 (2023).
- Kumashi, S. R., et al. A CMOS multi-modal electrochemical and impedance cellular sensing array for massively paralleled exoelectrogen screening. IEEE Trans Biomed Circuits Syst. 15 (2), 221-234 (2021).
- Jadhav, D. A., et al. Scale-up of the bioelectrochemical system: Strategic perspectives and normalization of performance indices. Bioresour Technol. 363, 127935 (2022).
- Kim, J., Cestellos-Blanco, S., Shen, Y., Cai, R., Yang, P. Enhancing biohybrid CO2 to multicarbon reduction via adapted whole-cell catalysts. Nano Lett. 22 (13), 5503-5509 (2022).
- He, Z., Mansfeld, F. Exploring the use of electrochemical impedance spectroscopy (EIS) in microbial fuel cell studies. Energy Environ Sci. 2 (2), 215-219 (2009).
- Okamoto, A., Hashimoto, K., Nealson, K. H., Nakamura, R. Rate enhancement of bacterial extracellular electron transport involves bound flavin semiquinones. Proc Natl Acad Sci U S A. 110 (19), 7856-7861 (2013).
- Zhang, X., Li, X., Zhao, X., Li, Y. Factors affecting the efficiency of a bioelectrochemical system: a review. RSC Adv. 9 (34), 19748-19761 (2019).
- Kornienko, N., Zhang, J. Z., Sakimoto, K. K., Yang, P., Reisner, E. Interfacing nature's catalytic machinery with synthetic materials for semi-artificial photosynthesis. Nat Nanotechnol. 13 (10), 890-899 (2018).
- Glasser, N. R., Saunders, S. H., Newman, D. K. The colorful world of extracellular electron shuttles. Annu Rev Microbiol. 71 (1), 731-751 (2017).
- Gemünde, A., Lai, B., Pause, L., Krömer, J., Holtmann, D. Redox mediators in microbial electrochemical systems. ChemElectroChem. 9 (13), e202200216 (2022).
- Kundu, B. B., et al. Extracellular respiration is a latent energy metabolism in Escherichia coli. bioRxiv. , (2024).
- O'Brien, J. P., Malvankar, N. S. A simple and low-cost procedure for growing Geobacter sulfurreducens cell cultures and biofilms in bioelectrochemical systems. Curr Protoc Microbiol. 43 (1), A.4K.1-A.4K.27 (2016).
- Su, L., Fukushima, T., Ajo-Franklin, C. M. A hybrid cyt c maturation system enhances the bioelectrical performance of engineered Escherichia coli by improving the rate-limiting step. Biosens Bioelectron. 165, 112312 (2020).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유