6.4 : Quantificação do Calor
Energia Térmica
Microscopicamente, a energia térmica é a energia cinética associada ao movimento aleatório de átomos e moléculas. A temperatura é uma medida quantitativa de “quente” ou “frio”, que depende da quantidade de energia térmica. Quando os átomos e moléculas em um objeto se movem ou vibram rapidamente, eles têm uma energia cinética média (KE) mais alta (ou energia térmica mais alta), e o objeto é percebido como “quente”, ou é descrito como estando a uma temperatura mais alta. Quando os átomos e moléculas se movem lentamente, eles têm KE média mais baixa (ou energia térmica mais baixa), e o objeto é percebido como “frio”, ou é descrito como estando a uma temperatura mais baixa.
Partindo do princípio de que não ocorre qualquer reação química ou mudança de fase (como fusão ou vaporização), aumentar a quantidade de energia térmica em uma amostra de matéria fará com que a sua temperatura aumente, enquanto que diminuir a quantidade de energia térmica em uma amostra de matéria fará com que a sua temperatura diminua.
Calor
O calor (q) é a transferência de energia térmica entre dois corpos a temperaturas diferentes. O fluxo de calor aumenta a energia térmica de um corpo e diminui a energia térmica do outro. O calor flui espontaneamente do quente para o frio (ou seja, apenas uma direção) e continua até que as duas substâncias estejam à mesma temperatura. As alterações no calor são medidas através de alterações na temperatura.
A unidade SI de calor, trabalho, e energia é o joule. Um joule (J) é definido como a quantidade de energia utilizada quando uma força de 1 newton move um objecto 1 metro. Tem o seu nome em honra do físico Inglês James Prescott Joule. Um joule equivale a 1 kg m2/s2, que também é chamado de 1 newton–metro. Um quilojoule (kJ) são 1000 joules. Para padronizar a sua definição, uma caloria foi definida como sendo igual a 4,184 joules.
Transferência de Energia Térmica
A capacidade térmica (C) de um corpo de matéria é a quantidade de calor (q) que ele absorve ou liberta quando sofre uma mudança de temperatura (ΔT) de 1 grau C (ou equivalentemente, 1 kelvin):
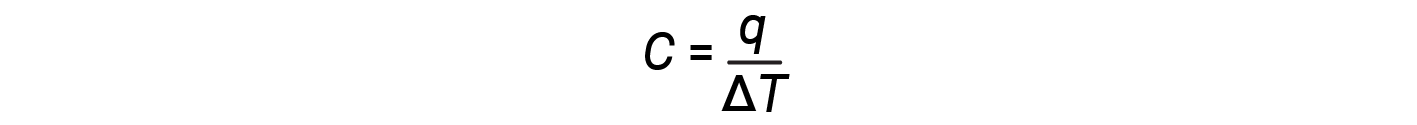
A capacidade térmica é determinada tanto pelo tipo como pela quantidade de substância que absorve ou liberta calor. Portanto, a capacidade térmica é uma propriedade extensa — o seu valor é proporcional à quantidade da substância. Por exemplo, considere as capacidades de calor de duas frigideiras de ferro fundido. A capacidade térmica da frigideira grande é cinco vezes maior do que a da frigideira pequena porque, embora ambas sejam feitas do mesmo material, a massa da frigideira grande é cinco vezes maior do que a massa da frigideira pequena. Mais massa significa que mais átomos estão presentes na frigideira maior, por isso é preciso mais energia para fazer todos esses átomos vibrarem mais rapidamente. A capacidade térmica da frigideira de ferro fundido pequena é encontrada ao observar que são necessários 18.140 J de energia (q) para aumentar a temperatura da frigideira em 50,0 °C (ΔT):

A frigideira de ferro fundido maior, feita com a mesma substância, requer 90.700 J de energia (q) para aumentar a sua temperatura em 50,0 °C (ΔT). A frigideira maior tem uma capacidade térmica (proporcionalmente) maior porque a maior quantidade de material requer uma quantidade (proporcionalmente) maior de energia para produzir a mesma alteração de temperatura:

A capacidade térmica específica (c) de uma substância, geralmente designada por “calor específico”, é a quantidade de calor necessária para aumentar a temperatura de 1 grama de uma substância em 1 grau Celsius (ou 1 kelvin):

A capacidade térmica específica depende apenas do tipo de substância que absorve ou liberta calor. É uma propriedade intensiva—por isso não depende da quantidade da substância. Por exemplo, a frigideira de ferro fundido pequena tem uma massa de 808 g. O calor específico do ferro (o material utilizado para preparar o recipiente) é, por conseguinte:

A frigideira grande tem uma massa de 4040 g. Utilizando os dados para esta frigideira, também podemos calcular o calor específico do ferro:

Embora a frigideira grande seja mais maciça do que a frigideira pequena, uma vez que ambas são feitas do mesmo material, ambas produzem o mesmo valor de calor específico (para o material de construção, ferro). Observe que o calor específico é medido em unidades de energia por temperatura por massa e é uma propriedade intensiva, sendo derivado de uma relação de duas propriedades extensivas (calor e massa). A capacidade térmica molar, também uma propriedade intensiva, é a capacidade térmica por mole de uma determinada substância e tem unidades de J/mol⋅°C.
A água tem um calor específico relativamente elevado (cerca de 4,2 J/g⋅°C para o líquido e 2,09 J/g⋅°C para o sólido); a maioria dos metais tem um calor específico muito mais baixo (geralmente menos de 1 J/g⋅°C). Sabendo a massa (m) de uma substância e o seu calor específico (c), pode-se determinar a quantidade de calor, q, que entra ou sai da substância, medindo a variação de temperatura (ΔT) antes e depois de o calor ser ganho ou perdido:
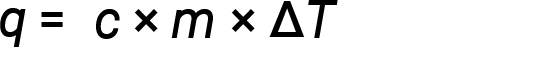
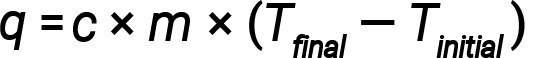
Se uma substância ganhar energia térmica, a sua temperatura aumenta, a sua temperatura final é superior à temperatura inicial, Tfinal − Tinicial tem um valor positivo, e o valor de q é positivo. Se uma substância perder energia térmica, a sua temperatura diminui, a temperatura final é inferior à temperatura inicial, Tfinal − Tinicial tem um valor negativo, e o valor de q é negativo.
Observe que a relação entre calor, calor específico, massa, e mudança de temperatura pode ser usada para determinar qualquer uma dessas quantidades (não apenas calor) se as outras três forem conhecidas ou puderem ser deduzidas.
Este texto é adaptado de OpenStax Chemistry 2e, Section 5.1: Energy Basics e OpenStax Chemistry 2e, Section 5.3: Enthalpy.
Do Capítulo 6:

Now Playing
6.4 : Quantificação do Calor
Termoquímica
53.8K Visualizações

6.1 : Princípios Básicos de Energia
Termoquímica
36.9K Visualizações

6.2 : Primeira Lei da Termodinâmica
Termoquímica
31.4K Visualizações

6.3 : Energia Interna
Termoquímica
28.7K Visualizações

6.5 : Quantificação do Trabalho
Termoquímica
19.0K Visualizações

6.6 : Entalpia
Termoquímica
34.7K Visualizações

6.7 : Equações Termoquímicas
Termoquímica
28.2K Visualizações

6.8 : Calorimetria de Pressão Constante
Termoquímica
84.6K Visualizações

6.9 : Calorimetria de Volume Constante
Termoquímica
26.8K Visualizações

6.10 : Lei de Hess
Termoquímica
44.4K Visualizações

6.11 : Entalpia de Formação Padrão
Termoquímica
41.0K Visualizações

6.12 : Entalpias de Reações
Termoquímica
31.4K Visualizações
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados