6.9 : Calorimetria de Volume Constante
Os calorímetros são úteis para determinar o calor libertado ou absorvido por uma reação química. Os calorímetros de xícara de café foram concebidos para funcionar a uma pressão (atmosférica) constante e são convenientes para medir o fluxo de calor (ou a alteração da entalpia) que acompanha os processos que ocorrem na solução a uma pressão constante. Um tipo diferente de calorímetro que opera em volume constante, coloquicamente conhecido como calorímetro de bomba, é usado para medir a energia produzida por reações que produzem grandes quantidades de calor e produtos gasosos, como reações de combustão. (O termo “bomba” provém da observação de que estas reações podem ser suficientemente vigorosas para se assemelharem a explosões que poderiam danificar outros calorímetros.)
A primeira lei da termodinâmica sugere que a mudança na energia interna (ΔE) de uma reação é a soma do calor (q) e do trabalho (w).
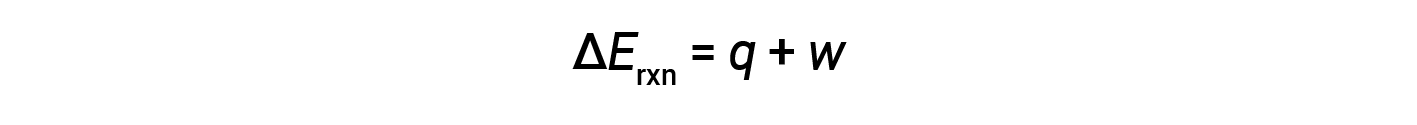
Em reações gasosas, o trabalho realizado é do tipo pressão-volume, resultando assim em alterações no volume da reação.
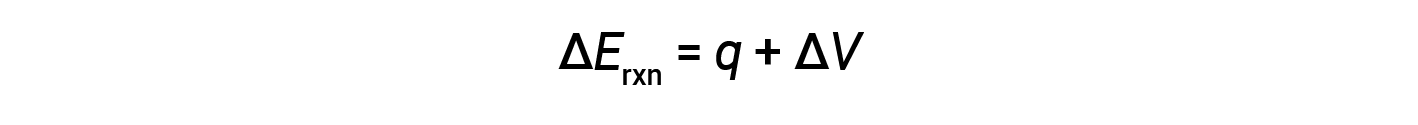
Os calorímetros de bomba foram concebidos para funcionar a um volume constante, de modo a que o volume da reação não possa mudar (ΔV = 0).
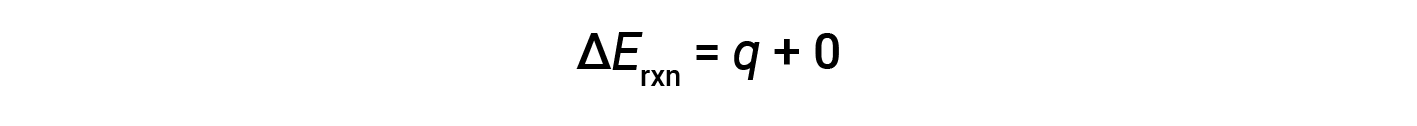
Portanto, o trabalho realizado é zero, e o calor (qv) medido com um calorímetro de bomba é equivalente à mudança na energia interna da reação.
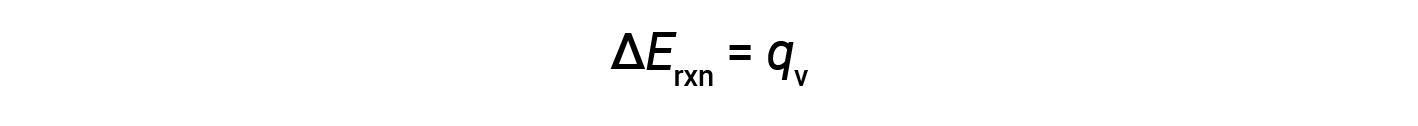
Um calorímetro de bomba consiste em um recipiente de aço robusto que contém os reagentes e está submerso em água. A amostra é colocada na bomba, que é então enchida com oxigénio a alta pressão. É utilizada uma pequena faísca elétrica para incendiar a amostra. A energia produzida pela reação é absorvida pela bomba de aço e pela água circundante. O aumento da temperatura (ΔT) é medido e, juntamente com a capacidade térmica conhecida do calorímetro (Ccal), é utilizado para calcular o calor absorvido pelo conjunto inteiro do calorímetro (qcal).
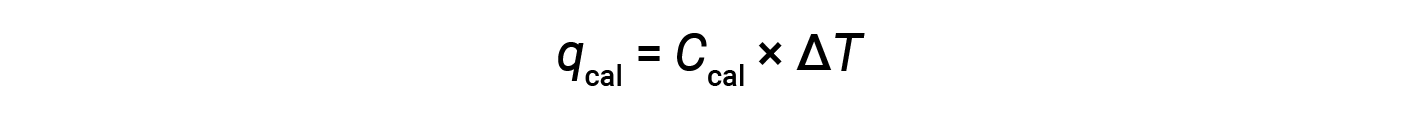
Uma vez que o calorímetro está isolado e não se perde calor para o ambiente, o calor obtido pelo calorímetro é igual ao calor libertado pela reação.
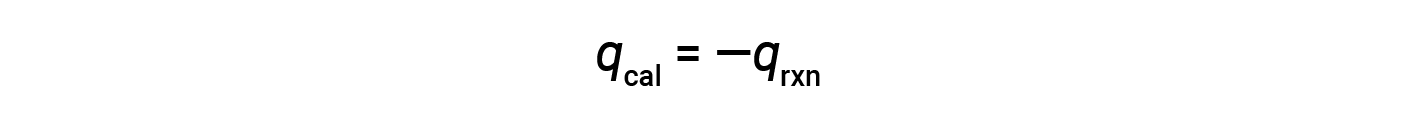
Devido a condições de volume constantes, o calor evoluído na reação corresponde à mudança de energia interna.
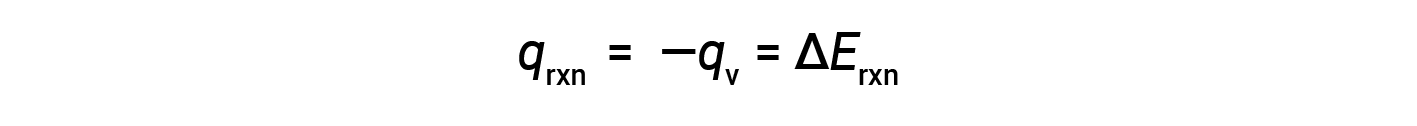
Esta é a alteração de energia interna para a quantidade específica de reagente submetido a combustão. ΔErxn por mole de um reagente específico é obtida dividindo o valor pelo número de moles que realmente reagiram.
Os calorímetros de bomba requerem calibração para determinar a capacidade térmica do calorímetro e garantir resultados precisos. A calibração é realizada através de uma reação com um q conhecido, como uma quantidade medida de ácido benzóico incendiada por uma faísca de um fio de fusível de níquel que é pesado antes e depois da reação. A alteração da temperatura produzida pela reação conhecida é utilizada para determinar a capacidade térmica do calorímetro. A calibração é geralmente realizada sempre que o calorímetro é utilizado para recolher dados de investigação.
Este texto é adaptado de Openstax, Chemistry 2e, Section 5.2: Calorimetry.
Do Capítulo 6:

Now Playing
6.9 : Calorimetria de Volume Constante
Termoquímica
26.8K Visualizações

6.1 : Princípios Básicos de Energia
Termoquímica
36.9K Visualizações

6.2 : Primeira Lei da Termodinâmica
Termoquímica
31.4K Visualizações

6.3 : Energia Interna
Termoquímica
28.7K Visualizações

6.4 : Quantificação do Calor
Termoquímica
53.8K Visualizações

6.5 : Quantificação do Trabalho
Termoquímica
19.0K Visualizações

6.6 : Entalpia
Termoquímica
34.7K Visualizações

6.7 : Equações Termoquímicas
Termoquímica
28.2K Visualizações

6.8 : Calorimetria de Pressão Constante
Termoquímica
84.6K Visualizações

6.10 : Lei de Hess
Termoquímica
44.4K Visualizações

6.11 : Entalpia de Formação Padrão
Termoquímica
41.0K Visualizações

6.12 : Entalpias de Reações
Termoquímica
31.4K Visualizações
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados