7.8 : O Princípio da Incerteza
Werner Heisenberg considerou os limites de precisão que podem ser medidos como propriedades de um eletrão ou outras partículas microscópicas. Ele determinou que existe um limite fundamental para a precisão com que se pode medir a posição de uma partícula e o seu momentum simultaneamente. Quanto mais precisa for a medição do momentum de uma partícula, menos precisa será a posição na mesma altura e vice-versa. É a isto que se chama agora o princípio da incerteza de Heisenberg. Ele relacionou matematicamente a incerteza da posição e a incerteza do momentum à quantidade que envolve a constante de Planck.
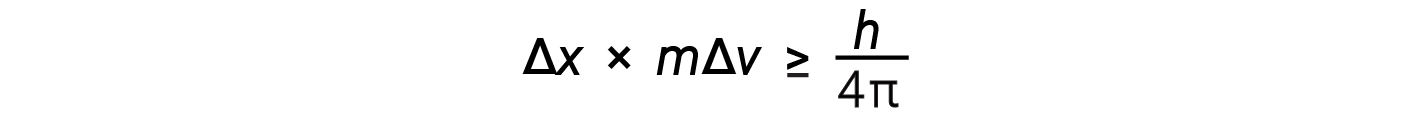
Esta equação calcula o limite para saber com precisão a posição simultânea de um objeto e o seu momentum.
Assim, quanto mais precisa for a posição do eletrão, menos precisa é a sua velocidade e vice-versa. Por exemplo, pode-se prever onde uma bola de baseball aterraria fora do campo observando a sua posição e velocidade iniciais e considerando o efeito da gravidade e do vento, etc. A trajectória da bola de baseball pode ser estimada.
No entanto, para um eletrão, a posição e a velocidade não podem ser determinadas simultaneamente. Por conseguinte, não é possível determinar uma trajectória para o eletrão de um átomo. Este comportamento é indeterminado. Em vez da localização precisa de um eletrão, pode-se falar em termos da probabilidade de encontrar um eletrão em uma determinada região do átomo, que é uma densidade de probabilidade. Pode ser indicado como psi quadrado (ψ2). Quanto maior for a probabilidade de encontrar um eletrão numa região específica, maior será o valor de psi quadrado. Com base nisto, os átomos são descritos como consistindo de um núcleo rodeado por uma nuvem de eletrões.
O princípio de Heisenberg impõe limites máximos ao que é possível conhecer na ciência. O princípio da incerteza pode ser mostrado como uma consequência da dualidade onda-partícula, que está no coração do que distingue a teoria quântica moderna da mecânica clássica.
Este texto é adaptado de Openstax, Chemistry 2e, Section 6.3: Development of Quantum Theory.
Do Capítulo 7:

Now Playing
7.8 : O Princípio da Incerteza
Estrutura Eletrônica dos Átomos
22.9K Visualizações

7.1 : A Natureza Ondulatória da Luz
Estrutura Eletrônica dos Átomos
48.1K Visualizações

7.2 : O Espectro Eletromagnético
Estrutura Eletrônica dos Átomos
52.3K Visualizações

7.3 : Interferência e Difração
Estrutura Eletrônica dos Átomos
30.6K Visualizações

7.4 : Efeito Fotoelétrico
Estrutura Eletrônica dos Átomos
29.1K Visualizações

7.5 : O Modelo de Bohr
Estrutura Eletrônica dos Átomos
49.9K Visualizações

7.6 : Espectros de Emissão
Estrutura Eletrônica dos Átomos
49.5K Visualizações

7.7 : O Comprimento de Onda de De Broglie
Estrutura Eletrônica dos Átomos
25.2K Visualizações

7.9 : O Modelo Mecânico-Quântico de um Átomo
Estrutura Eletrônica dos Átomos
41.7K Visualizações

7.10 : Números Quânticos
Estrutura Eletrônica dos Átomos
34.1K Visualizações

7.11 : Orbitais Atômicos
Estrutura Eletrônica dos Átomos
32.9K Visualizações

7.12 : O Princípio da Exclusão de Pauli
Estrutura Eletrônica dos Átomos
33.9K Visualizações

7.13 : As Energias das Orbitais Atômicos
Estrutura Eletrônica dos Átomos
23.6K Visualizações

7.14 : O Princípio de Aufbau e a Regra de Hund
Estrutura Eletrônica dos Átomos
43.9K Visualizações

7.15 : Configuração Eletrônica de Átomos com Múltiplos Elétrons
Estrutura Eletrônica dos Átomos
37.9K Visualizações
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados