Werner Heisenberg considerou os limites de precisão que podem ser medidos como propriedades de um eletrão ou outras partículas microscópicas. Ele determinou que existe um limite fundamental para a precisão com que se pode medir a posição de uma partícula e o seu momentum simultaneamente. Quanto mais precisa for a medição do momentum de uma partícula, menos precisa será a posição na mesma altura e vice-versa. É a isto que se chama agora o princípio da incerteza de Heisenberg. Ele relacionou matematicamente a incerteza da posição e a incerteza do momentum à quantidade que envolve a constante de Planck.
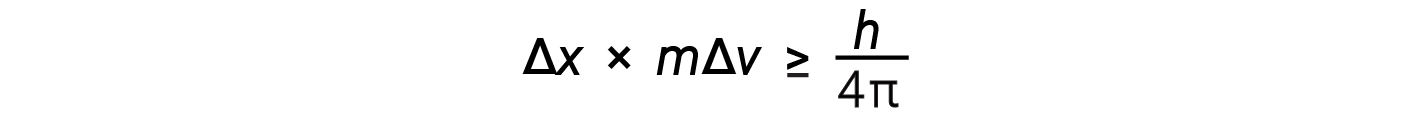
Esta equação calcula o limite para saber com precisão a posição simultânea de um objeto e o seu momentum.
Assim, quanto mais precisa for a posição do eletrão, menos precisa é a sua velocidade e vice-versa. Por exemplo, pode-se prever onde uma bola de baseball aterraria fora do campo observando a sua posição e velocidade iniciais e considerando o efeito da gravidade e do vento, etc. A trajectória da bola de baseball pode ser estimada.
No entanto, para um eletrão, a posição e a velocidade não podem ser determinadas simultaneamente. Por conseguinte, não é possível determinar uma trajectória para o eletrão de um átomo. Este comportamento é indeterminado. Em vez da localização precisa de um eletrão, pode-se falar em termos da probabilidade de encontrar um eletrão em uma determinada região do átomo, que é uma densidade de probabilidade. Pode ser indicado como psi quadrado (ψ2). Quanto maior for a probabilidade de encontrar um eletrão numa região específica, maior será o valor de psi quadrado. Com base nisto, os átomos são descritos como consistindo de um núcleo rodeado por uma nuvem de eletrões.
O princípio de Heisenberg impõe limites máximos ao que é possível conhecer na ciência. O princípio da incerteza pode ser mostrado como uma consequência da dualidade onda-partícula, que está no coração do que distingue a teoria quântica moderna da mecânica clássica.
Este texto é adaptado de Openstax, Chemistry 2e, Section 6.3: Development of Quantum Theory.
Do Capítulo 7:

Now Playing
7.8 : O Princípio da Incerteza
Estrutura Eletrônica dos Átomos
22.7K Visualizações

7.1 : A Natureza Ondulatória da Luz
Estrutura Eletrônica dos Átomos
47.8K Visualizações

7.2 : O Espectro Eletromagnético
Estrutura Eletrônica dos Átomos
52.1K Visualizações

7.3 : Interferência e Difração
Estrutura Eletrônica dos Átomos
29.6K Visualizações

7.4 : Efeito Fotoelétrico
Estrutura Eletrônica dos Átomos
29.0K Visualizações

7.5 : O Modelo de Bohr
Estrutura Eletrônica dos Átomos
49.0K Visualizações

7.6 : Espectros de Emissão
Estrutura Eletrônica dos Átomos
48.5K Visualizações

7.7 : O Comprimento de Onda de De Broglie
Estrutura Eletrônica dos Átomos
25.1K Visualizações

7.9 : O Modelo Mecânico-Quântico de um Átomo
Estrutura Eletrônica dos Átomos
41.4K Visualizações

7.10 : Números Quânticos
Estrutura Eletrônica dos Átomos
33.9K Visualizações

7.11 : Orbitais Atômicos
Estrutura Eletrônica dos Átomos
32.7K Visualizações

7.12 : O Princípio da Exclusão de Pauli
Estrutura Eletrônica dos Átomos
32.8K Visualizações

7.13 : As Energias das Orbitais Atômicos
Estrutura Eletrônica dos Átomos
23.5K Visualizações

7.14 : O Princípio de Aufbau e a Regra de Hund
Estrutura Eletrônica dos Átomos
41.8K Visualizações

7.15 : Configuração Eletrônica de Átomos com Múltiplos Elétrons
Estrutura Eletrônica dos Átomos
36.8K Visualizações
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados