7.8 : 불확정성 원리
베르너 하이젠버그는 전자 또는 기타 미세 입자의 특성을 얼마나 정확하게 측정할 수 있는지의 한계를 고려했습니다. 그는 입자의 위치와 그 모멘텀을 동시에 측정할 수 있는 방법에 근본적인 한계가 있다고 판단했습니다. 입자의 모멘텀을 정확하게 측정할수록 해당 위치가 덜 정확하다는 것이 알려져 있으며 그 반대의 경우도 마찬가지입니다. 이것이 바로 하이젠베르크 불확실성 원칙이라고 불린다. 그는 위치의 불확실성과 플랑크의 상수와 관련된 수량에 대한 모멘텀의 불확실성을 수학적으로 관련시적으로 관련시합니다.
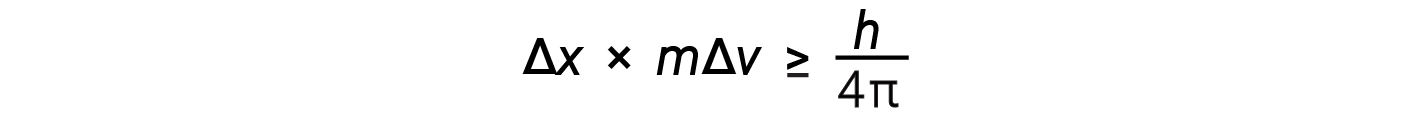
이 방정식은 객체의 동시 위치와 그 모멘텀을 얼마나 정확하게 알 수 있는지에 대한 한계를 계산합니다.
따라서 전자의 위치가 더 정확할수록 속도가 정확하지 않으며 그 반대의 경우도 마찬가지입니다. 예를 들어, 야구가 초기 위치와 속도를 지적하고 중력과 바람 등의 효과를 고려하여 외야에 착륙할 위치를 예측할 수 있습니다. 야구의 궤적을 추정할 수 있습니다.
그러나 전자의 경우 위치와 속도를 동시에 결정할 수 없습니다. 따라서 원자의 전자에 대한 궤적을 결정할 수 없습니다. 이 동작은 불확실합니다. 전자의 정확한 위치 대신, 확률 밀도인 원자의 특정 영역에서 전자를 찾을 확률에 대해 이야기할 수 있습니다. 그것은 psi 정사각형(ψ2)로표시 될 수있다. 특정 영역에서 전자를 찾을 확률이 높을수록 psi 사각형의 값이 커지입니다. 이를 바탕으로 원자는 전자 구름에 둘러싸인 핵으로 구성된 것으로 설명된다.
하이젠베르크의 원칙은 과학에서 알 수 있는 것에 궁극적인 제한을 부과합니다. 불확실성 원리는 현대 양자 이론을 고전 역학과 구별하는 것의 중심에 있는 파성 입자 이중성의 결과로 표시될 수 있습니다.
장에서 7:

Now Playing
7.8 : 불확정성 원리
원자의 전자 구조
22.9K Views

7.1 : 빛의 파장
원자의 전자 구조
48.2K Views

7.2 : 전자기파 스펙트럼
원자의 전자 구조
52.4K Views

7.3 : 간섭과 회절
원자의 전자 구조
30.8K Views

7.4 : 광전효과
원자의 전자 구조
29.2K Views

7.5 : 보어 모델
원자의 전자 구조
50.1K Views

7.6 : 방출 스펙트럼
원자의 전자 구조
49.7K Views

7.7 : 드브로이 파장
원자의 전자 구조
25.2K Views

7.9 : 원자의 양자역학 모델
원자의 전자 구조
41.7K Views

7.10 : 양자수
원자의 전자 구조
34.1K Views

7.11 : 원자 궤도(오비탈)
원자의 전자 구조
33.0K Views

7.12 : 파울리의 배타원리
원자의 전자 구조
34.0K Views

7.13 : 원자 궤도(오비탈)의 에너지
원자의 전자 구조
23.6K Views

7.14 : 쌓음 원리와 훈트 규칙
원자의 전자 구조
44.1K Views

7.15 : 다전자 원자의 원자 배치
원자의 전자 구조
38.0K Views
Copyright © 2025 MyJoVE Corporation. 판권 소유