14.8 : O Princípio de Le Chatelier: Alteração do Volume (Pressão)
Para equilíbrios de fase gasosa, podem ocorrer alterações nas concentrações de reagentes e produtos com volume e pressão alterados. A pressão parcial, P, de um gás ideal é proporcional à sua concentração molar, M.
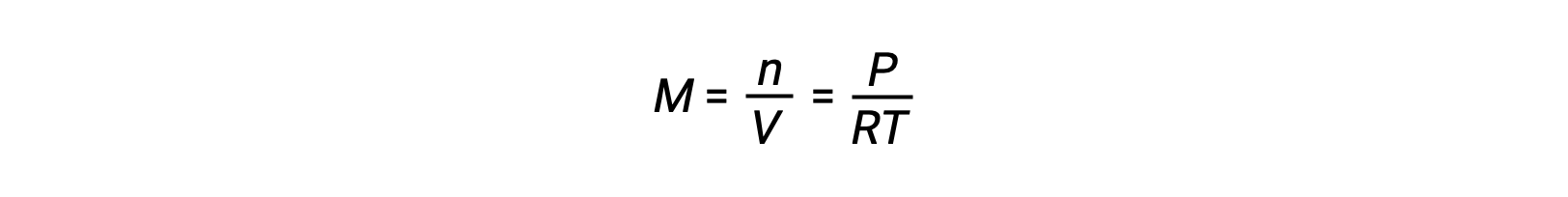
Assim, as alterações nas pressões parciais de qualquer reagente ou produto são essencialmente alterações nas concentrações; portanto, essas alterações produzem os mesmos efeitos nos equilíbrios. Além da adição ou remoção de reagentes ou produtos, as pressões (concentrações) das espécies de fase gasosa em equilíbrio também podem ser alteradas alterando o volume ocupado pelo sistema. Uma vez que todas as espécies de fase gasosa em equilíbrio ocupam o mesmo volume, uma certa mudança de volume irá causar a mesma alteração de concentração tanto para os reagentes como para os produtos. A fim de discernir que deslocamento, se houver, esse tipo de stress irá induz, a estequiometria da reação deve ser considerada.
No equilíbrio, a reação N2 (g) + O2 (g) ⇌ 2 NO (g) é descrita pelo quociente de reação
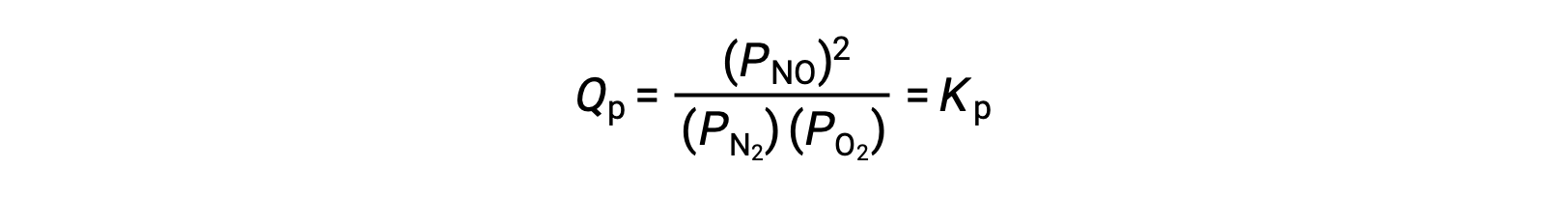
Se o volume ocupado por uma mistura em equilíbrio destas espécies for diminuído por um factor de 3, as pressões parciais das três espécies serão aumentadas por um factor de 3:
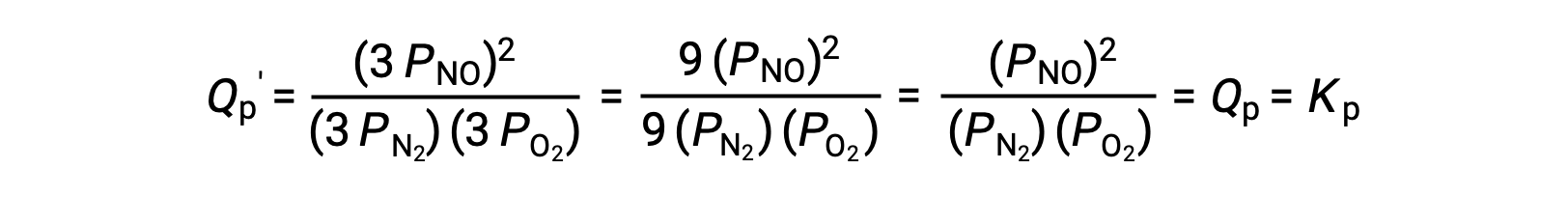
Assim, a alteração do volume desta mistura de fase gasosa em equilíbrio não resulta em uma alteração do equilíbrio.
Um tratamento semelhante de um sistema diferente, 2 SO2 (g) + O2 (g) ⇌ 2 SO3 (g), no entanto, produz um resultado diferente:
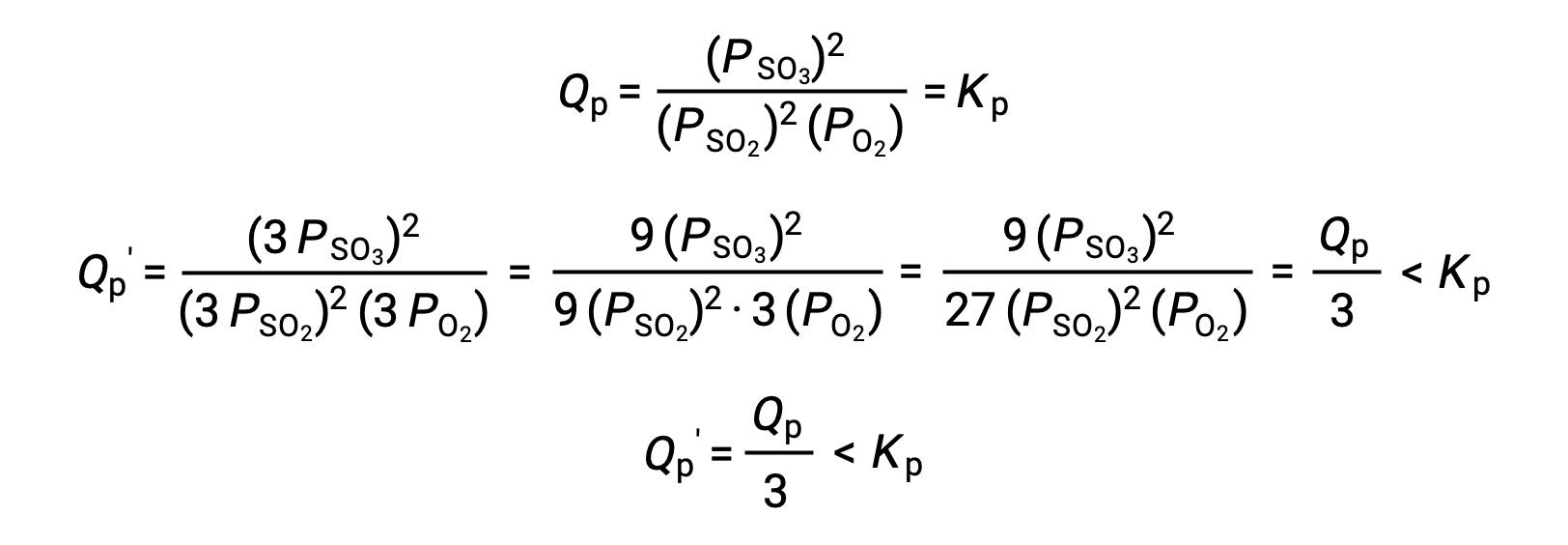
Neste caso, a mudança de volume resulta em um quociente de reação menor do que a constante de equilíbrio, e assim o equilíbrio vai mudar para a direita.
Estes resultados ilustram a relação entre a estequiometria de um equilíbrio de fase gasosa e o efeito de uma alteração da pressão induzida por volume (concentração). Se as quantidades molares totais de reagentes e produtos forem iguais, como no primeiro exemplo, uma mudança de volume não altera o equilíbrio. Se as quantidades molares de reagentes e produtos forem diferentes, uma alteração no volume deslocará o equilíbrio em uma direção que melhor “se adapte” à alteração do volume. No segundo exemplo, três moles de reagente (SO2 e O2) produzem dois moles de produto (SO3), pelo que a diminuição do volume do sistema faz com que o equilíbrio se mova para a direita, uma vez que a reação nessa direção produz menos gás (2 mol) do que a reação inversa (3 mol). Por outro lado, aumentar o volume deste sistema de equilíbrio resultaria em uma mudança na direção dos reagentes.
Este texto foi adaptado de Openstax, Chemistry 2e, Section 13.3 Shifting Equilibria: LeChatelier’s Principle.
Do Capítulo 14:

Now Playing
14.8 : O Princípio de Le Chatelier: Alteração do Volume (Pressão)
Equilíbrio Químico
33.8K Visualizações

14.1 : Equilíbrio Dinâmico
Equilíbrio Químico
49.8K Visualizações

14.2 : A Constante de Equilíbrio
Equilíbrio Químico
46.2K Visualizações

14.3 : Equilíbrio para Reações Gasosas e Reações Heterogêneas
Equilíbrio Químico
24.3K Visualizações

14.4 : Cálculo da Constante de Equilíbrio
Equilíbrio Químico
30.6K Visualizações

14.5 : Quociente da Reação
Equilíbrio Químico
47.8K Visualizações

14.6 : Cálculo das Concentrações de Equilíbrio
Equilíbrio Químico
47.2K Visualizações

14.7 : O Princípio de Le Chatelier: Alteração da Concentração
Equilíbrio Químico
57.1K Visualizações

14.9 : O Princípio de Le Chatelier: Alteração da Temperatura
Equilíbrio Químico
28.8K Visualizações

14.10 : A Aproximação do x Pequeno
Equilíbrio Químico
45.7K Visualizações
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados