16.13 : Precipitação de Íons
Previsão de Precipitação
A equação que descreve o equilíbrio entre o carbonato de cálcio sólido e os seus iões solvatados é:
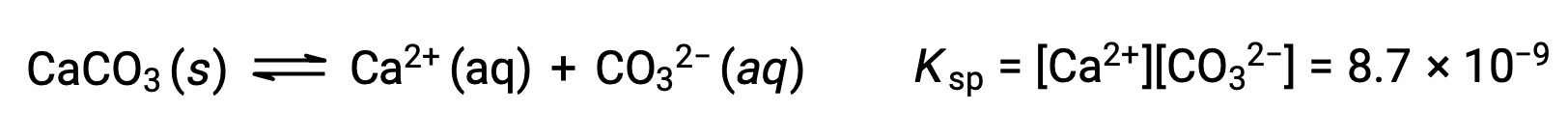
É importante perceber que esse equilíbrio se estabelece em qualquer solução aquosa contendo iões Ca2+ e CO32–, não apenas em uma solução formada por água saturada com carbonato de cálcio. Considere, por exemplo, a mistura de soluções aquosas dos compostos solúveis carbonato de sódio e nitrato de cálcio. Se as concentrações de iões de cálcio e carbonato na mistura não produzirem um quociente de reação, Q, que exceda o produto de solubilidade, Ksp, então não ocorrerá precipitação. Se as concentrações de iões produzirem um quociente de reação superior ao produto de solubilidade, então ocorrerá precipitação, diminuindo essas concentrações até que seja estabelecido o equilíbrio (Q = Ksp). A comparação de Q com Ksp para prever a precipitação é um exemplo da abordagem geral para prever a direção de uma reação. Para o caso específico dos equilíbrios de solubilidade:
Q < Ksp: A reação prossegue na direção direta (a solução não está saturada; não é observada precipitação)
Q > Ksp: A reação prossegue na direção inversa (a solução está supersaturada; ocorrerá precipitação)
Em soluções que contenham dois ou mais iões que possam formar compostos insolúveis com o mesmo contraião, pode ser utilizada uma estratégia experimental chamada precipitação selectiva para remover iões individuais da solução. Aumentando a concentração do contraião de forma controlada, os iões em solução podem ser precipitados individualmente, assumindo que as suas solubilidades de composto são adequadamente diferentes. Em soluções com concentrações iguais de iões alvo, o ião que forma o composto menos solúvel irá precipitar primeiro (com a menor concentração de contraiões). Os outros iões precipitam-se posteriormente à medida que as solubilidades dos seus compostos são alcançadas.
Precipitação de Halogenetos de Prata
Uma solução contém 0,00010 mol de KBr e 0,10 mol de KCl por litro. AgNO3 é gradualmente adicionado a esta solução. O que se forma primeiro, AgBr sólido ou AgCl sólido?
Os dois equilíbrios envolvidos são:
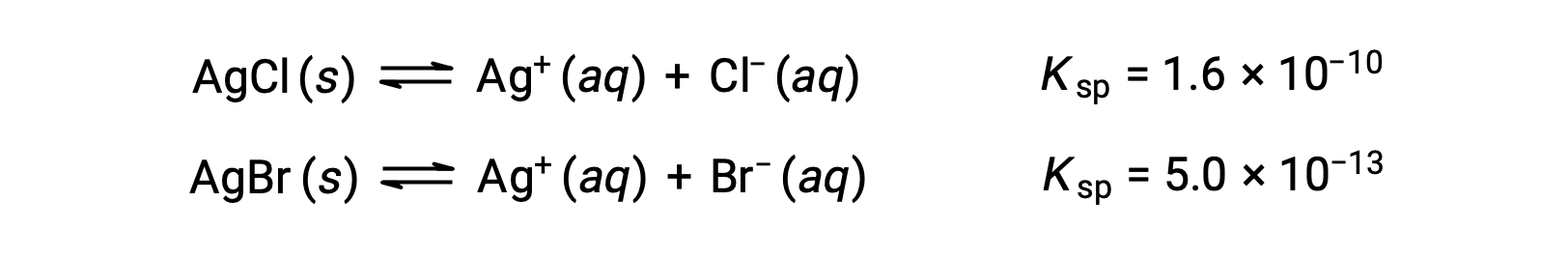
Se a solução contivesse concentrações mais ou menos iguais de Cl– e Br–, então o sal de prata com menor Ksp (AgBr) precipitaria primeiro. No entanto, as concentrações não são iguais, pelo que deve ser calculado a [Ag+] a que AgCl começa a precipitar e a [Ag+] a que AgBr começa a precipitar. O sal que se forma à menor [Ag+] precipita primeiro.
AgBr precipita quando Q = Ksp para AgBr
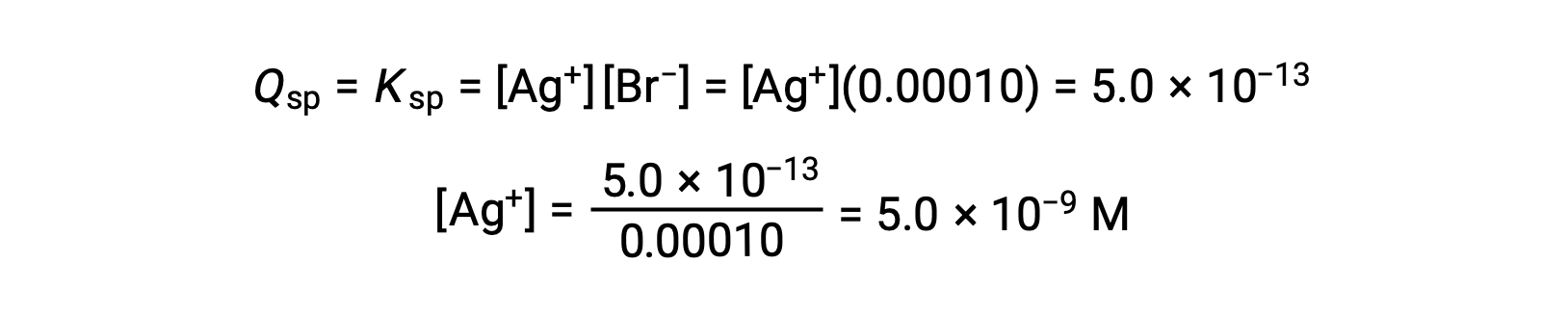
AgBr começa a precipitar quando [Ag+] é 5,0 × 10−9 M.
Para AgCl:
AgCl precipita quando Q é igual a Ksp para AgCl (1,6 × 10-10). Quando [Cl–] = 0,10 M:
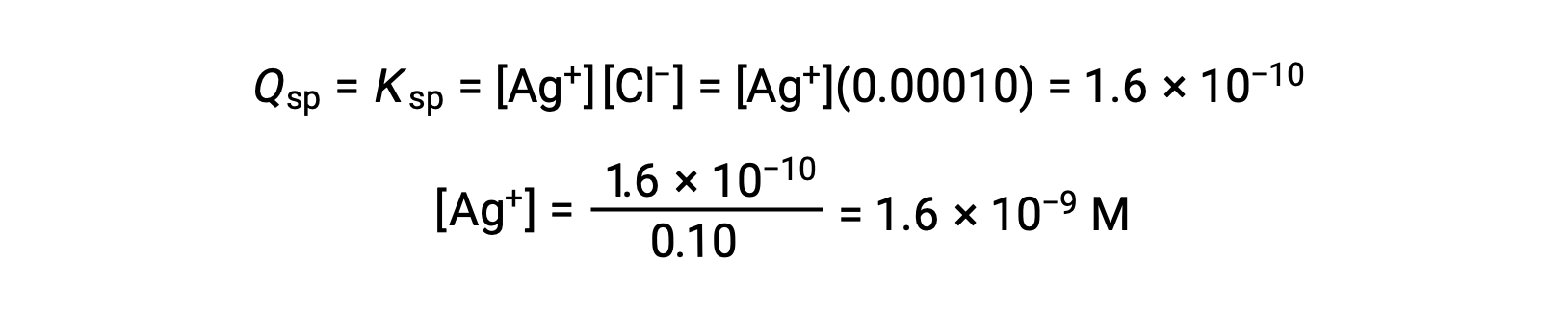
AgCl começa a precipitar quando [Ag+] é 1,6 × 10-9 M.
AgCl começa a precipitar a uma menor [Ag+] do que AgBr, pelo que AgCl começa a precipitar primeiro. Note que a concentração de iões cloreto da mistura inicial era significativamente maior que a concentração de iões brometo, e assim o cloreto de prata precipita primeiro apesar de ter um Ksp maior que o de brometo de prata.
Este texto é adaptado de Openstax, Chemistry 2e, Chapter 15.1: Precipitation and Dissolution.
Tags
Do Capítulo 16:

Now Playing
16.13 : Precipitação de Íons
Equilíbrio Ácido-Base e Solubilidade
27.4K Visualizações

16.1 : Efeito de Íon Comum
Equilíbrio Ácido-Base e Solubilidade
40.8K Visualizações

16.2 : Tampões
Equilíbrio Ácido-Base e Solubilidade
163.2K Visualizações

16.3 : Equação de Henderson-Hasselbalch
Equilíbrio Ácido-Base e Solubilidade
67.9K Visualizações

16.4 : Cálculo de Alterações de pH em uma Solução Tampão
Equilíbrio Ácido-Base e Solubilidade
52.4K Visualizações

16.5 : Eficácia dos Tampões
Equilíbrio Ácido-Base e Solubilidade
48.3K Visualizações

16.6 : Cálculos de Titulação: Ácido Forte - Base Forte
Equilíbrio Ácido-Base e Solubilidade
28.9K Visualizações

16.7 : Cálculos de Titulação: Ácido Fraco - Base Forte
Equilíbrio Ácido-Base e Solubilidade
43.7K Visualizações

16.8 : Indicadores
Equilíbrio Ácido-Base e Solubilidade
47.6K Visualizações

16.9 : Titulação de um Ácido Poliprótico
Equilíbrio Ácido-Base e Solubilidade
95.5K Visualizações

16.10 : Equilíbrio de Solubilidade
Equilíbrio Ácido-Base e Solubilidade
51.8K Visualizações

16.11 : Fatores que Afetam a Solubilidade
Equilíbrio Ácido-Base e Solubilidade
32.9K Visualizações

16.12 : Formação de Íons Complexos
Equilíbrio Ácido-Base e Solubilidade
23.0K Visualizações

16.14 : Análise Qualitativa
Equilíbrio Ácido-Base e Solubilidade
20.0K Visualizações

16.15 : Curvas de Titulação Ácido-Base
Equilíbrio Ácido-Base e Solubilidade
126.0K Visualizações
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados