17.3 : Segunda Lei da Termodinâmica
Na procura de identificar uma propriedade que possa prever de forma confiável a espontaneidade de um processo, um candidato promissor foi identificado: entropia. Os processos que envolvem um aumento da entropia do sistema (ΔS > 0) são muitas vezes espontâneos; no entanto, são abundantes exemplos do contrário. Ao expandir a consideração das mudanças de entropia para incluir as imediações, pode-se chegar a uma conclusão significativa sobre a relação entre esta propriedade e espontaneidade. Nos modelos termodinâmicos, o sistema e as imediações compreendem tudo, ou seja, o universo, e assim o seguinte é verdadeiro:

Para ilustrar esta relação, considere novamente o processo de fluxo de calor entre dois objetos, um identificado como o sistema e o outro como as imediações. Há três possibilidades para tal processo:
- Os objetos estão a temperaturas diferentes e o calor flui do objeto mais quente para o objeto mais frio. Observa-se que isto ocorre espontaneamente. Designar o objeto mais quente como o sistema e invocar a definição de entropia produz o seguinte:
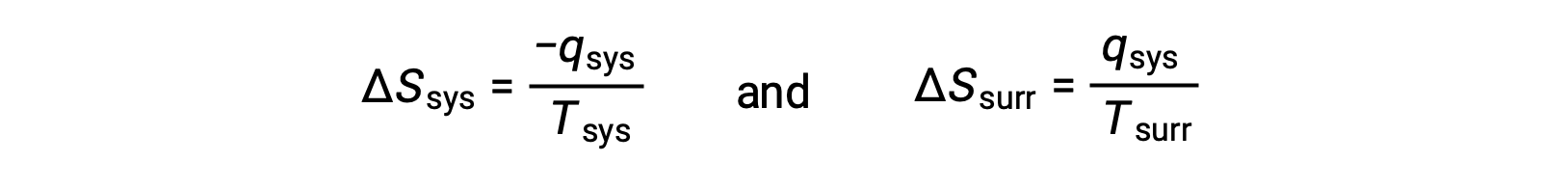
As magnitudes de −qsys e qsys são iguais, denotando os seus sinais aritméticos opostos a perda de calor pelo sistema e ganho de calor pelas imediações. ComoTsys > Tsurr neste cenário, a diminuição da entropia do sistema será menor do que o aumento da entropia das imediações, e assim a entropia do universo irá aumentar:
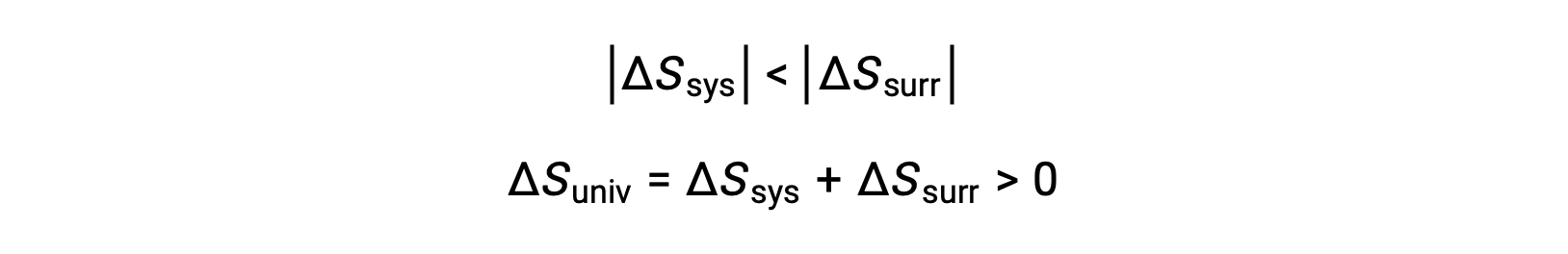
- Os objetos estão a temperaturas diferentes e o calor flui do objeto mais frio para o mais quente. Isto nunca se observa ocorrer espontaneamente. Designando novamente o objeto mais quente como o sistema e invocando a definição de entropia, obtém-se o seguinte:
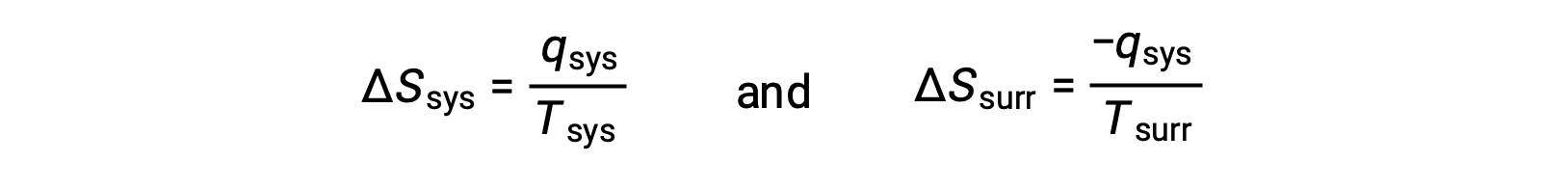
os sinais aritméticos de qsys denotam o ganho de calor pelo sistema e a perda de calor pelas imediações. A magnitude da alteração da entropia para o ambiente será novamente maior do que a do sistema, mas neste caso, os sinais de alterações de calor (ou seja, a direção do fluxo de calor) irão produzir um valor negativo para ΔSuniv. Este processo envolve uma diminuição na entropia do universo.
- Os objetos estão essencialmente à mesma temperatura, Tsys ≈ Tsurr, e assim as magnitudes das alterações da entropia são essencialmente as mesmas para o sistema e imediações. Nesse caso, a alteração de entropia do universo é zero, e o sistema está em equilíbrio.
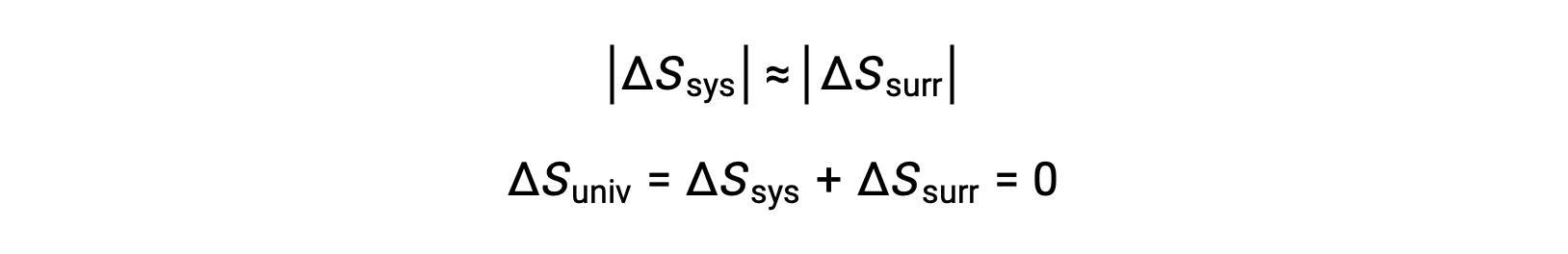
Esses resultados levam a uma afirmação profunda sobre a relação entre entropia e espontaneidade conhecida como a segunda lei da termodinâmica: Todas as mudanças espontâneas causam um aumento na entropia do universo. Um resumo dessas três relações é fornecido na tabela abaixo.
| A Segunda Lei da Termodinâmica | |
| ΔSuniv > 0 | espontânea |
| ΔSuniv < 0 | não espontânea (espontânea na direção oposta) |
| ΔSuniv = 0 | em equilíbrio |
Para muitas aplicações realistas, as imediações são vastas em comparação com o sistema. Em tais casos, o calor ganho ou perdido pelas imediações como resultado de algum processo representa uma fração muito pequena, quase infinitesimal, da sua energia térmica total. Por exemplo, a combustão de um combustível no ar envolve a transferência de calor de um sistema (as moléculas de combustível e oxigénio que estão a sofrer a reação) para imediações infinitamente mais maciças (a atmosfera da terra). Como resultado, qsurr é uma boa aproximação de qsys, e a segunda lei pode ser indicada como a seguinte:
sys, and the second law may be stated as the following:Openstax, Chemistry 2e, Chapter 16.2: The Second and Third Law of Thermodynamics.
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados