17.8 : Cálculo de Alterações de Energia Livre Padrão
A alteração de energia livre para uma reação que ocorre nas condições padrão de pressão de 1 bar e a 298 K é designada por alteração de energia livre padrão. Uma vez que a energia livre é uma função de estado, o seu valor depende apenas das condições dos estados inicial e final do sistema. Uma abordagem conveniente e comum para o cálculo de alterações de energia livres para reações físicas e químicas é através do uso de compilações amplamente disponíveis de dados termodinâmicos de estado padrão. Um método envolve o uso de entalpias e entropias padrão para computar mudanças de energia livre padrão, ΔG°, de acordo com a seguinte relação.
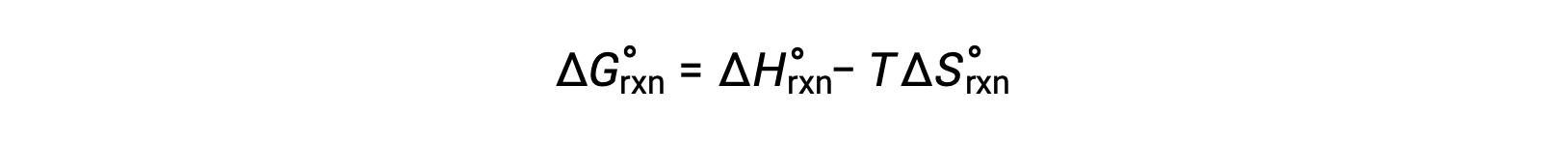
A alteração de energia livre padrão para uma reação também pode ser calculada a partir dos valores da energia livre padrão de formação ΔGf° dos reagentes e produtos envolvidos na reação. A energia livre padrão de formação é a alteração de energia livre que acompanha a formação de um mole de uma substância a partir dos seus elementos nos seus estados padrão. Semelhante à entalpia padrão de formação, ΔGf° é, por definição, zero para substâncias elementares em condições normais de estado. Para a reação
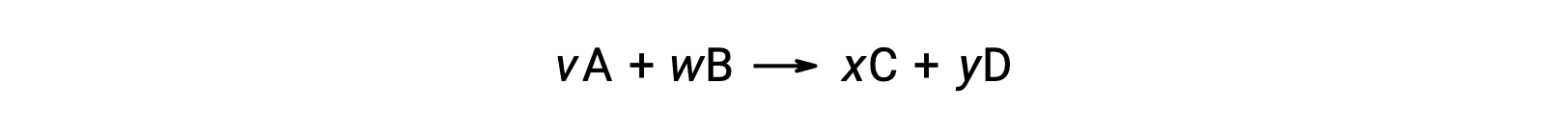
a alteração de energia livre padrão à temperatura ambiente pode ser calculada como
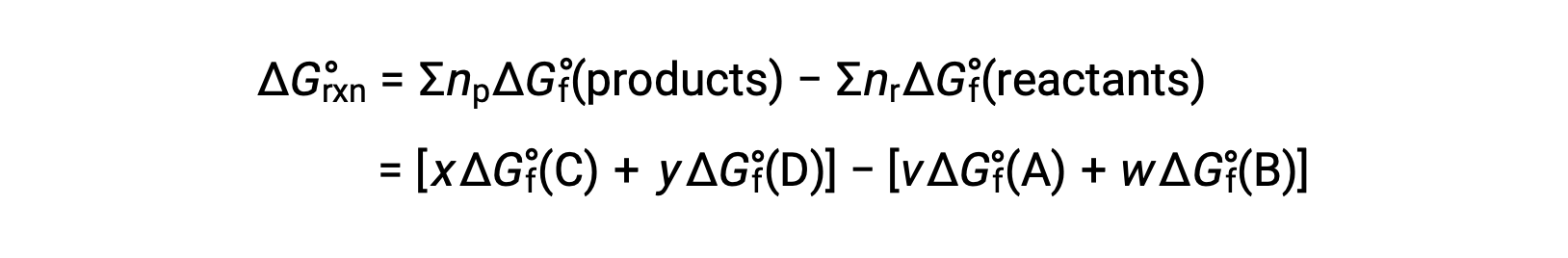
O uso de energias livres de formação para computar alterações de energias livres para reações como descrito acima é possível porque ΔG é uma função do estado, e a abordagem é análoga ao uso da Lei de Hess na computação de alterações de entalpia. Considere a vaporização da água como um exemplo:
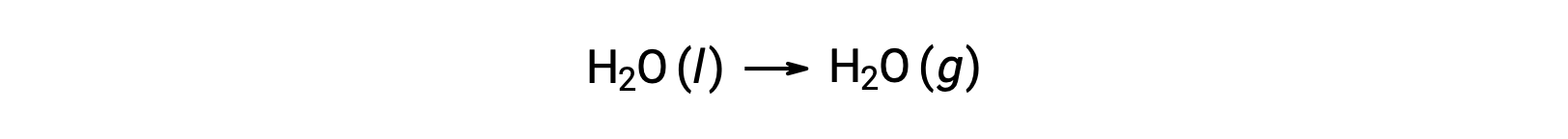
Uma equação que representa este processo pode ser derivada adicionando as reações de formação para as duas fases da água (invertendo necessariamente a reação para a fase líquida). A alteração de energia livre para a reação somada é a soma das alterações de energia livre para as duas reações adicionadas:
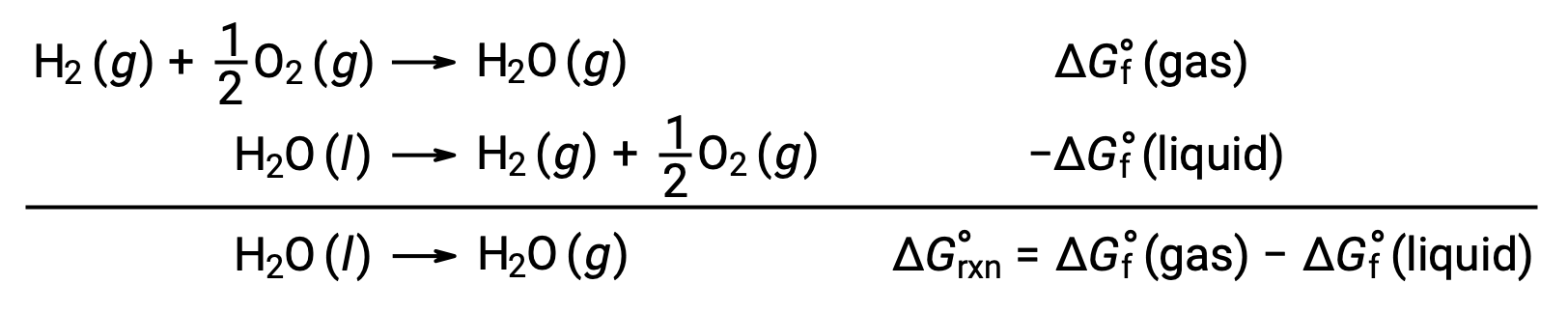
Essa abordagem também pode ser utilizada nos casos em que uma reação não espontânea é permitida pelo acoplamento a uma reação espontânea. Por exemplo, a produção de zinco elementar a partir de sulfureto de zinco é termodinamicamente desfavorável, como indicado por um valor positivo para ΔG°1:
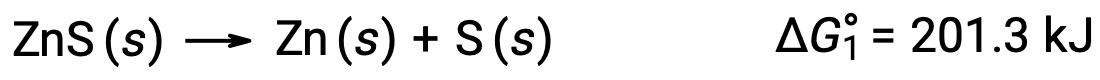
O processo industrial de produção de zinco a partir de minérios sulfídicos envolve a ligação desta reação de decomposição à oxidação termodinamicamente favorável do enxofre:

A reação acoplada exibe uma alteração de energia livre negativa e é espontânea:
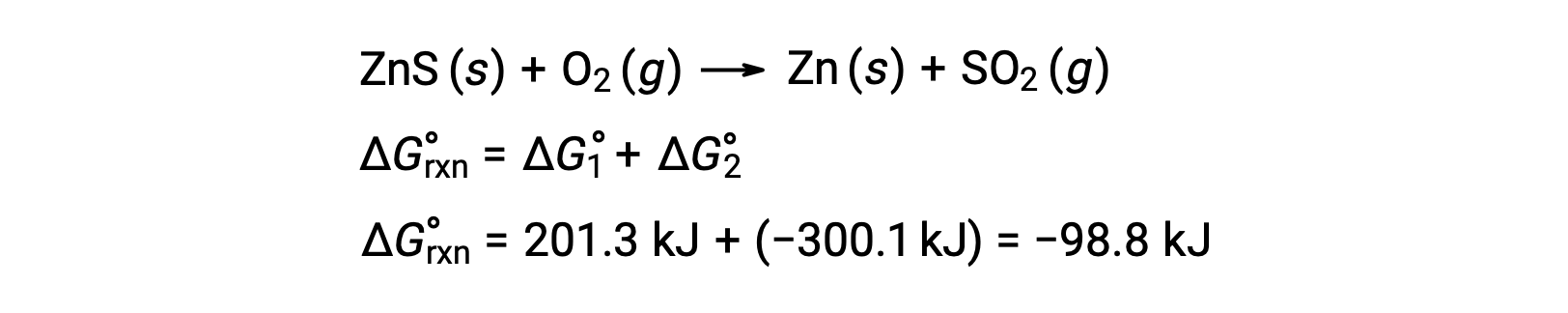
Este processo é normalmente realizado a temperaturas elevadas, pelo que este resultado obtido utilizando valores de energia livre padrão é apenas uma estimativa. No entanto, a essência do cálculo é verdadeira.
Este texto é adaptado de Openstax, Chemistry 2e, Chapter 16.4: Free Energy.
Tags
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados
