18.3 : Células Voltaicas/Galvânicas
Reações Químicas Espontâneas
Reações redox espontâneas ocorrem abundantemente na natureza. A reação química que ocorre em uma pilha AA descartável que alimenta os nossos controlos remotos é um exemplo de uma reação redox espontânea. Outro exemplo é a imersão de fio de cobre enrolado em uma solução aquosa de nitrato de prata. A reação mostra uma mudança de cor gradual e visualmente impressionante, de incolor a azul brilhante e a formação de um precipitado cinzento no fio de cobre. Nesta experiência, o cobre sofre oxidação para formar iões cuprosos, que tornam a solução azul, enquanto que os iões de prata são reduzidos para formar um precipitado prateado no fio.
A reação pode ser resumida da seguinte forma:
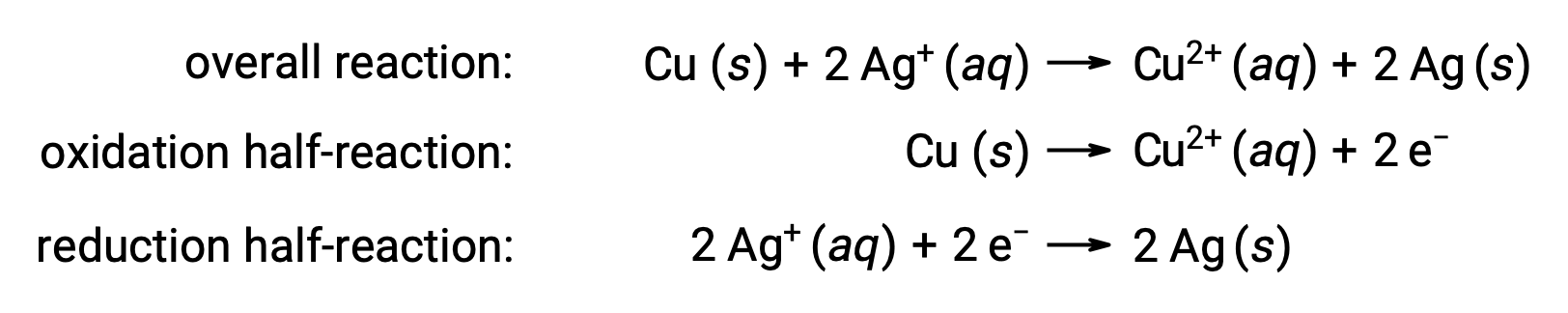
Aqui, há uma transferência direta e espontânea de eletrões do fio de cobre para os iões de prata aquosos.
Células Eletroquímicas e Células Galvânicas
Suponha que um dispositivo contém todos os reagentes e produtos de um sistema redox, mas impede o contacto físico entre os reagentes. Portanto, a transferência direta de eletrões é impedida; em vez disso, ocorre indiretamente através de um circuito externo que entra em contacto com os reagentes separados. Os dispositivos deste tipo são geralmente referidos como células eletroquímicas.
Uma célula eletroquímica é um instrumento no qual uma corrente elétrica é gerada por uma reação redox sem contacto direto entre os átomos que reagem. As células eletroquímicas nas quais uma corrente é criada devido a uma reação redox espontânea são conhecidas como células galvânicas ou fotovoltaicas (de seu nome devido a Luigi Galvani e Alessandro Volta).
Componentes de uma Célula Galvânica
Uma célula galvânica baseada na reação espontânea entre cobre e prata(I) está representada na Figura 1. Uma célula galvânica típica consiste em duas semi-células, cada uma contendo um par, ou casal, redox conjugado de um único reagente. A semi-célula à esquerda contém o par Cu(0)/Cu(II) na forma de uma folha de cobre sólida e uma solução aquosa de nitrato de cobre. A semi-célula da direita contém o par Ag(I)/Ag(0) como folha de prata sólida e uma solução aquosa de nitrato de prata. Um circuito externo é conectado a cada semi-célula na sua folha sólida, o que significa que as folhas Cu e Ag funcionam como um elétrodo. A reação ocorre na interface entre a mistura de reação de cada semi-célula e o seu respectivo elétrodo. O ânodo é o elétrodo no qual ocorre oxidação e carrega carga negativa, enquanto que o catodo é o elétrodo no qual ocorre redução, e carrega carga positiva.
As duas semi-células estão ligadas por uma ponte salina, que é um tubo em U invertido contendo um gel ou pasta de um eletrólito inerte, como o cloreto de potássio ou o nitrato de amónio. A ponte salina ajuda a manter as misturas de reação separadas, garantindo o equilíbrio de carga da reação. A reação espontânea desta célula produz catiões Cu2+ na semi-célula anódica e consome iões Ag+ na semi-célula catódica, resultando em um fluxo compensatório de iões inertes da ponte salina que mantém o equilíbrio de carga. A ponte salina fornece um fluxo de iões inertes, assegurando que a reação continua a neutralizar a acumulação de iões positivos e negativos no ânodo e no cátodo. Assim, concentrações crescentes de Cu2+ na semi-célula anódica são equilibradas por um influxo de NO3− da ponte salina, enquanto que um fluxo de Na+ para a semi-célula catódica compensa a diminuição da concentração de Ag+.
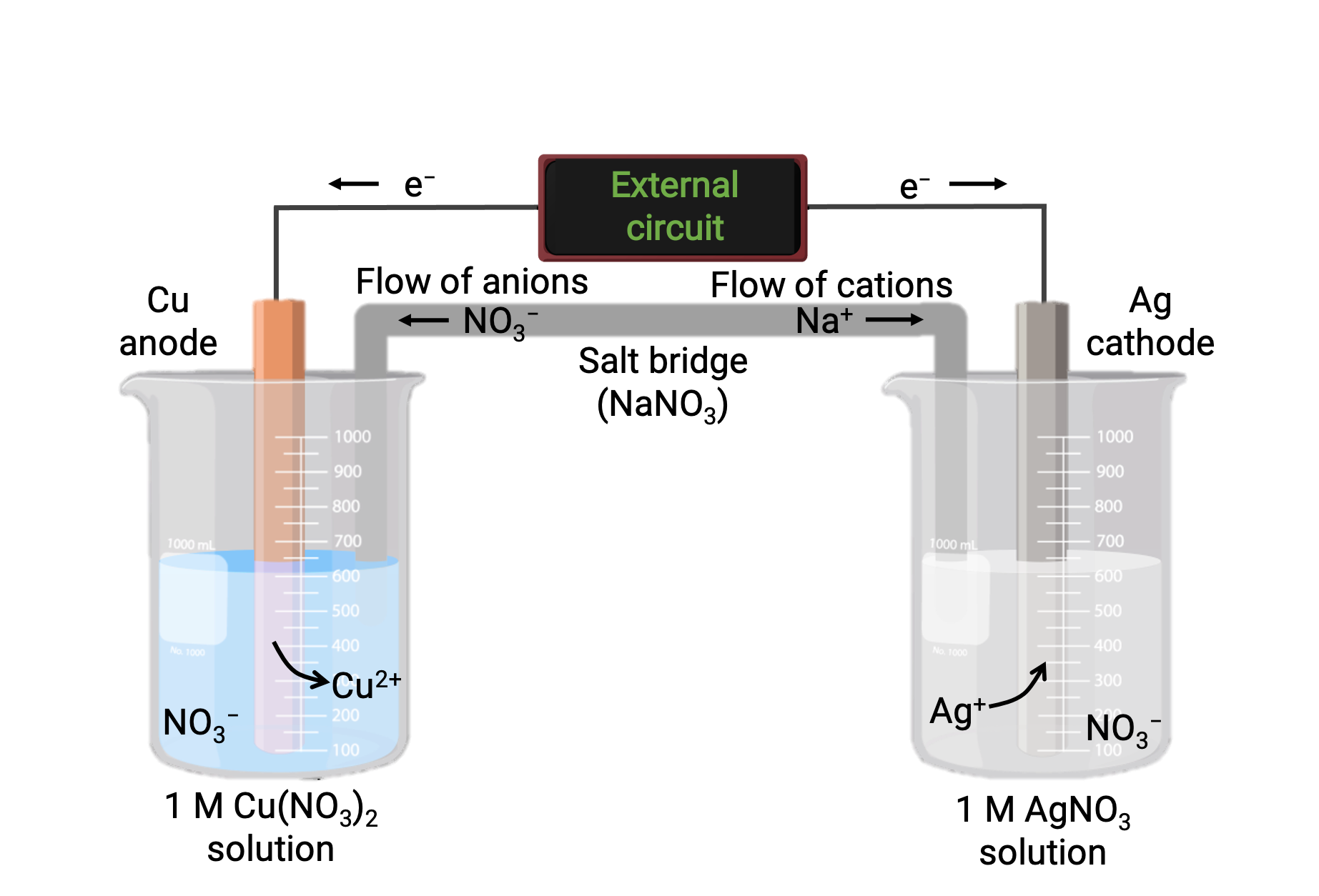
Figura 1: Célula galvânica baseada na reação espontânea entre iões de cobre e prata(I).
Representação de uma Célula Galvânica utilizando Esquemas de Células ou Notações de Células
A célula galvânica é representada simbolicamente utilizando esquemas de células ou notações de células.
No esquema de células, todas as interfaces entre as fases dos componentes são representadas por linhas paralelas verticais.
Se dois ou mais componentes existirem na mesma fase, eles serão separados na representação usando vírgulas.
O ânodo é representado à esquerda do esquema e o cátodo à direita.
Uma linha vertical dupla indica uma ponte salina ou uma partição porosa entre as duas semi-reações.
Por convenção, o esquema começa com o ânodo e prossegue da esquerda para a direita, identificando fases e interfaces encontradas dentro da célula, terminando com o cátodo.
Por exemplo, a célula galvânica acima é composta por um ânodo de cobre sólido imerso em nitrato de cobre(II) aquoso ligado através de uma ponte salina a uma solução aquosa de nitrato de prata(I) imersa em um cátodo de prata sólida. A conversão desta afirmação para simbolismo seguindo as diretrizes acima resulta no esquema de célula:
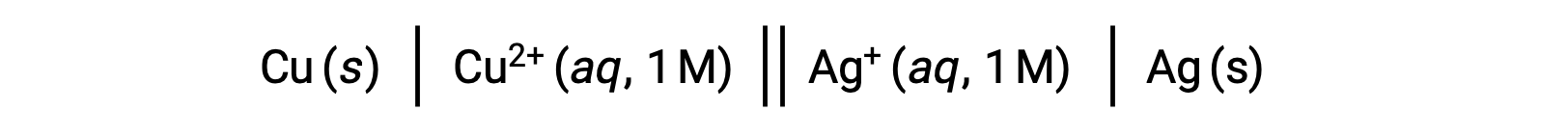
Este texto é adaptado de Openstax, Chemistry 2e,17.2 Galvanic Cells.
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados
