16.15 : Curvas de Titulação Ácido-Base
Uma curva de titulação é um gráfico de alguma propriedade da solução em comparação com a quantidade de titulante adicionado. Para titulações ácido-base, o pH da solução é uma propriedade útil para monitorizar, uma vez que varia de forma previsível com a composição da solução e, por conseguinte, pode ser utilizado para monitorizar o progresso da titulação e detectar o seu ponto final. A titulação ácido-base pode ser realizada com um ácido forte e uma base forte, um ácido forte e uma base fraca, ou uma base forte e um ácido fraco.
Para uma titulação efetuada para 25,00 mL de HCl a 0,100 M (ácido forte) com 0,100 M de uma base forte NaOH, a sua curva de titulação pode ser observada a vermelho na Figura 1a. Para uma titulação efetuada para 25,00 mL de CH3COOH a 0,100 M (ácido fraco) com NaOH a 0,100 M, a sua curva de titulação pode ser observada a amarelo na Figura 1b.
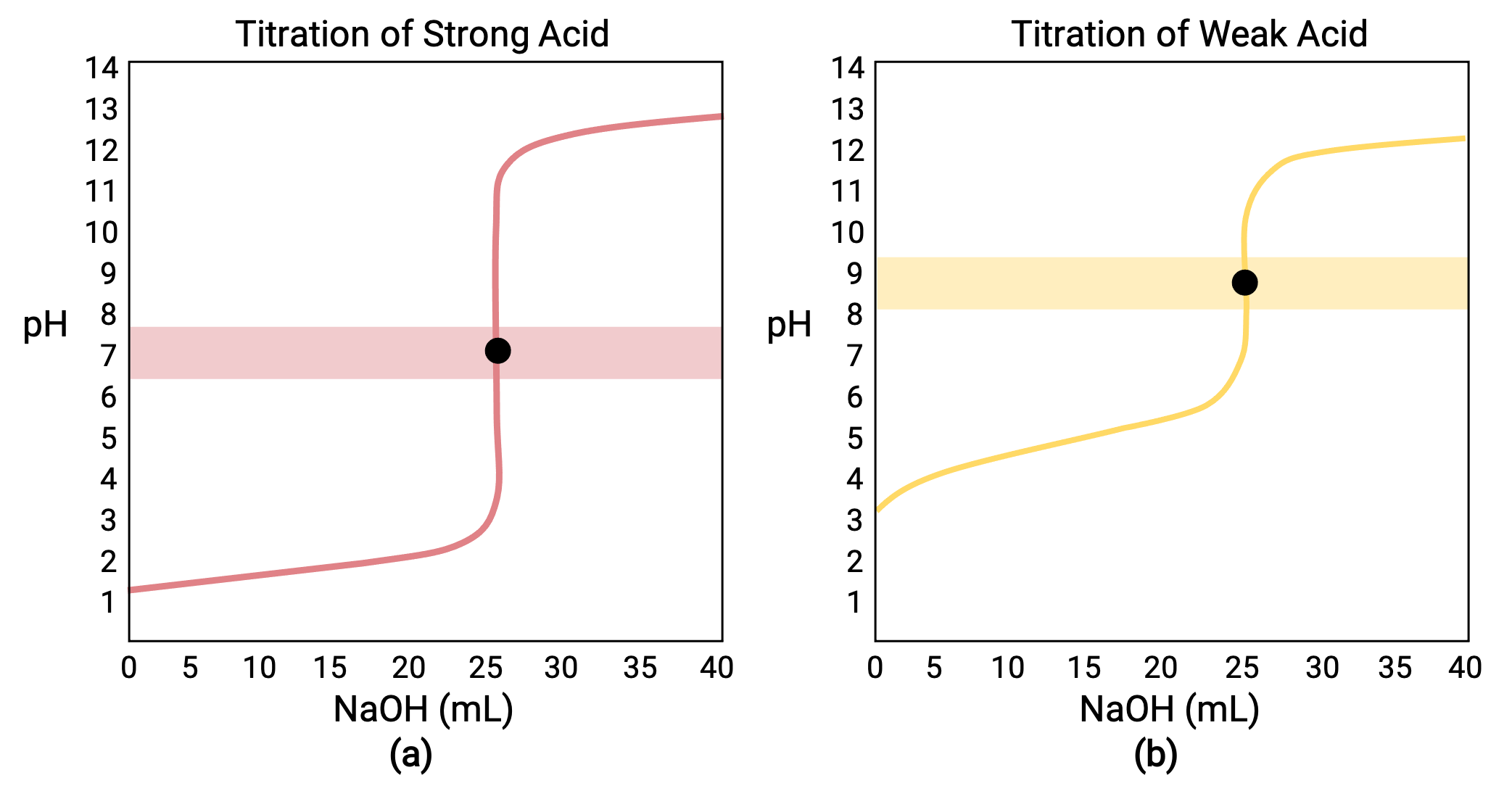
Figura 1 (a) A curva de titulação para a titulação de 25,00 mL de HCl a 0,100 M (ácido forte) com NaOH a 0,100 M (base forte) tem um ponto de equivalência de pH 7,00. (b) A curva de titulação para a titulação de 25,00 mL de ácido acético a 0,100 M (ácido fraco) com NaOH a 0,100 M (base forte) tem um ponto de equivalência de pH 8,72.
A titulação de uma base forte ou fraca com um ácido forte tem uma curva em forma de S semelhante; no entanto, a curva é invertida, uma vez que o pH irá começar na região básica e irá diminuir com a adição do ácido forte. A titulação de um ácido ou base fracos pode também ser utilizada para determinar Ka ou Kb, respectivamente.
As quatro fases de uma titulação:
- Estado inicial (volume de titulante adicionado = 0 mL): o pH é determinado pelo ácido titulado; uma vez que as duas amostras de ácido estão igualmente concentradas, o ácido fraco apresenta um pH inicial superior
- Ponto de pré-equivalência (0 mL < V < 25 mL): o pH da solução aumenta gradualmente e o ácido é consumido por reação com o titulante adicionado; a composição inclui ácido que não reagiu e o produto da reação, a sua base conjugada
- Ponto de equivalência (V = 25 mL): observa-se um aumento drástico do pH, à medida que a composição da solução passa de ácida para neutra (para a amostra de ácido forte) ou básica (para a amostra de ácido fraco), com o pH determinado por ionização da base conjugada do ácido
- Ponto de pós-equivalência (V > 25 mL): o pH é determinado pela quantidade de excesso de base forte titulante adicionada; uma vez que ambas as amostras são tituladas com o mesmo titulante, ambas as curvas de titulação parecem semelhantes nesta fase.
Este texto é adaptado de Openstax, Chemistry 2e, Section 14.7: Acid-base Titrations.
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados