É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Geração de humanos CD40-activated células B
Resumo
Neste vídeo, apresentamos a Ex vivo Geração e expansão de células CD40-activated B (CD40-B) a partir de células mononucleares do sangue periférico (PBMC) de estimulação com CD40 ligante e interleucina-4.
Resumo
Células CD40-activated B (CD40-células B) foram identificados como uma fonte alternativa de imuno-estimulatórias células apresentadoras de antígenos (APC) para imunoterapia de câncer 1-3. Em comparação com as células dendríticas (DCs), a melhor caracterizada APC, as células CD40-B têm várias propriedades biológicas distintas e técnicos. Semelhante ao DCs, as células B mostram um aumento da expressão de MHC e moléculas co-estimulatórias (Fig.1b), apresentam uma forte capacidade migratória e apresentação de antígenos presentes de forma eficiente para células T, após a estimulação com a interleucina-4 e CD40 ligante (CD40L). No entanto, em contraste com DCs imaturas ou maduro, as células CD40-B expressar a tríade completa nó de linfa homing consistindo de CD62L, CCR7/CXCR4 e função antígeno leucocitário-1 (LFA1, CD11a/CD18), necessário para homing para órgãos linfóides secundários (Fig.1a) 3. Células CD40-B pode ser gerado sem dificuldades a partir de quantidades muito pequenas de sangue periférico que pode ser expandida in vitro de quantidades muito grandes de alta-pura-B CD40 células de câncer (> 10 9 células por paciente) de doadores saudáveis, bem como pacientes (Figura 1C, d) 1,4.
Neste protocolo que demonstrar como obter totalmente ativado CD40-B a partir de células PBMC humana. Moléculas-chave para a cultura de células são CD40 ligante, a interleucina-4 (IL-4) e ciclosporina A. (CsA), que são reabastecidos em um ciclo de 3-4 dias de cultura Para fins de laboratório CD40-estimulação é fornecida por células que expressam NIH/3T3 recombinante ligante CD40 humano (tCD40L NIH/3T3) 5. Para evitar a contaminação com os não-transfectadas células, a expressão do ligante CD40 humano no transfectants tem de ser verificados regularmente (Fig.2).
Após 14 dias CD40-B culturas de células consistem de mais de 95% de células B puro e uma expansão de células CD40-B com mais de 65 dias é frequentemente possível, sem qualquer perda de função de 1, 4. Células CD40-B de forma eficiente recolher, processar e apresentar antígenos às células T 6. Eles não só naϊve prime, mas também expandir células T de memória 7,8. Células CD40-B ativado pode ser usado para estudo de células B ativação, diferenciação e função. Além disso, eles representam uma ferramenta promissora para a vacinação preventivo ou terapêutico contra tumores 9.
Protocolo
O protocolo para a geração de células CD40-activated B da CMSP é dividido em duas partes: Parte A demonstra a preparação de CD40 ligante expressar NIH/3T3 células, que serão usados como células da placa-bound alimentador. Parte B descreve a cultura CD40-B real.
A. Preparação de células alimentadoras (tCD40L NIH/3T3)
O NIH/3T3 tCD40L é uma linha de células aderentes murino de fibroblastos, que nunca deve tornar-se completamente confluentes. As células são, portanto, dividido por duas vezes por semana. Cultura há mais de seis semanas não é recomendado.
- Remova o meio de idade a partir da cultura primária com uma pipeta estéril e lavar as células com 10 mL de PBS 1x. Aspirar o PBS após a lavagem.
- Adicionar 4 mL Tripsina / EDTA em um frasco de 75 cm 2 por 5-10 minutos a 37 ° C. Use tocando suave para retirar as células.
- Adicionar 10 mL de meio de tipo selvagem e giratória suavemente.
- Transferir a suspensão de células em um tubo de 50 mL com uma pipeta estéril e girar a células para baixo a 225 xg por 5 min.
- Remover o sobrenadante e ressuspender o sedimento em 10 mL de meio de tipo selvagem. Conte o número de células de uma alíquota da suspensão de células e preparar três tubos de 50 mL com o número adequado de células:
- 1,5 x 10 6 células para subcultura
- 0,2 x 10 6 células / poço de irradiação utilizadas para a cultura de células CD40-B
- restante para congelar (se necessário).
- Spin the células para baixo de 225 xg por 5 min.
- Remover o sobrenadante.
- Para subcultura: ressuspender 1,5 x 10 6 células em 10 mL de médio tipo selvagem em um frasco de 75 centímetros de cultura de células 2 (densidade celular de 1,5 x 10 5 células / mL), adicione G-418 [0,7 mg / mL] e incubar as células em 37 ° C com 5% de CO 2. Dividir as células duas vezes por semana.
- Para a cultura de células CD40-B: Você precisa de 1,2 x 10 6 células para uma placa de 6 poços. Ressuspender as células em meio de tipo selvagem com uma densidade de 0,1 x 10 6 células / mL e irradiar-los em 78 Gy. Placa de 2 mL da suspensão de células em cada poço e incube-os a 37 ° C com 5% de CO 2. Utilize este placas preparado para a estimulação de células B, quando tCD40L NIH/3T3 células são aderente (pelo menos 4 horas: verificar a aderência com o microscópio, não espere mais de 24 h para iniciar a estimulação de células B). (Continue com B.)
B. CD 40-B de cultura de células
I. Elaboração de PBMCs para CD40-estimulação (dia 0):
Por favor note: antes de continuar determinar que as células de alimentação são aderentes. Sempre adicionar novas soluções de interleucina-4 e ciclosporina A para o meio de crescimento imediatamente antes da utilização.
- Tome PBMCs, fresco ou descongelado adequadamente. Ressuspender PBMCs duas vezes em 50mL de PBS 1x para lavá-los e spin down primeira vez em 265 xg por 7 min e uma segunda vez em xg 190 para 7 min para remover outras células. Elimine o sobrenadante e ressuspender as células em 20 mL de PBS. Determinar o número de células em uma alíquota da suspensão de células.
- Spin down quantidade necessária de células em 225 xg por 5 min. Para uma placa de 6 poços 4 x 10 6 células / poço são necessários, portanto, 24 x 10 6 células por placa.
- Remover o sobrenadante e ressuspender o CMSP em 1 x 10 6 células / mL em CD40-B meio de cultura fresco suplementado com 50 U / mL de IL-4 como fator de crescimento e 0,63 ciclosporina mcg / mL para evitar A conseqüência de células T (concentrações indicados referem-se a um meio de cultura mL!).
- Remover o sobrenadante de 6 bem-placa pré-incubadas com tCD40L NIH/3T3 células.
- Lavar o aderente tCD40L NIH/3T3 células com 2 mL de PBS por poço em primeiro lugar e em uma segunda etapa com 2 mL de CD40-B médio de lavar roupa.
- Delicadamente adicionar 4 mL de suspensão PBMC (1 x 10 6 células / mL) a cada poço da placa de 6 poços.
- Incubar as células a 37 ° C com 5% de CO 2.
- No dia 7, reculture as células (Continue com o 3.2.).
II. Recultivo de CD40 células-B (7 º dia e depois a cada 3-4 dias):
- Clusters de colheita de células CD40-B a partir de 6 bem-chapa pela ressuspensão com uma pipeta de 10 mL e piscina-los em um tubo de 50 mL.
- Girar a 225 xg por 7 minutos e substituir completamente o sobrenadante com CD40-B médio de lavar roupa. Contando a quantidade de células de uma alíquota, gire a células para baixo a 225 xg por 5 minutos. Ressuspender as células CD40-CD40-B em B meio de cultura a uma concentração de 1 x 10 6 células / mL.
- Adicionar novas soluções de interleucina-4 em uma concentração de 50 U / mL e 0,63 ciclosporina mcg / mL A ao meio.
- Remover o sobrenadante de uma placa de 6 poços de pré-incubadas com tCD40L NIH/3T3 células.
- Lave as células aderentes com 2 mL de PBS por poço em primeiro lugar e em uma segunda etapa com 2 mL de CD40-B médio de lavar roupa.
- Gentilmente adicione 4 mL (1 x 10 6 células / mL) de suspensão CD40-B a cada poço da placa de 6 poços.
- Incubar as placas a 37 ° C com 5% de CO 2.
- Células subcultura novamente a cada 3-4 dias para acabar com alta pureza células CD40-B ativadas após um total de 14 dias.
C. Resolução de problemas - O que se as células CD40-B não crescem?
- Você tem verificado para CD40 ligante expressão de células de alimentação?
- A placa-bound células alimentadoras usado para a estimulação não deve ser mais de 24h?
- É uma possível contaminação com micoplasma?
- Foi a solução interleucina-4 utilizada para a suplementação recém descongeladas e tiveram a atividade biológico adequado?
- Ciclosporina A foi adicionado na concentração correta?
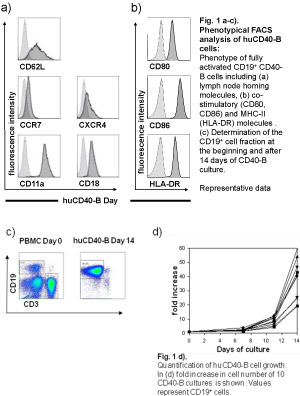
Figura 1. Por favor, clique aqui para uma versão maior da figura 1.
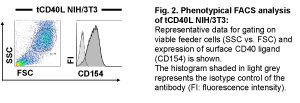
Figura 2. Por favor, clique aqui para uma versão maior da figura 2.
Access restricted. Please log in or start a trial to view this content.
Materiais
A. Preparação de Media:
| Name | Company | Catalog Number | Comments |
| Alimentador celular médio do tipo selvagem | Alimentador meio de seleção de célula | ||
| Reagente | Concentração | Reagente | Concentração |
| DMEM-Ham / F12 | DMEM-Ham / F12 | ||
| L-Glutamina | 365 mcg / mL | L-Glutamina | 365 mcg / mL |
| FBS | 10% | FBS | 10% |
| HEPES | 10 mM | HEPES | 10 mM |
| Gentamicina | 15 mcg / mL | Gentamicina | 15 mcg / mL |
| G-418 | 0,7 mg / mL | ||
| CD40-B médio de lavar | CD40-B meio de cultura | ||
| Reagente | Concentração | Reagente | Concentração |
| IMDM | IMDM | ||
| L-Glutamina | 584 mcg / mL | L-Glutamina | 584 mcg / mL |
| HEPES | 25 mM | HEPES | 25 mM |
| Gentamicina | 15 mcg / mL | Gentamicina | 15 mcg / mL |
| rh Transferrina | 50 mg / mL | ||
| Insulina rh | 5 mg / mL | ||
| AB-Humanserum | 10% | ||
B. Diversos Reagentes:
| Reagente | Companhia | Despacho n. |
| F12 DMEM / Ham | PAA | Nenhum gato: E15-813 |
| IMDM | Invitrogen Gibco ® | REF 21980-032 |
| PBS Dulbecco (10x) | PAA | Cat Não H15-011 |
| AB-soro humano | Invitrogen | Cat Não 34005100 |
| holo-transferrina humana | Sigma | Cat Não T0665 |
| Insulina humana | Sigma | Cat Não I2643 |
| Gencin ® | Selecione Delta | Arte Sem 7395800 |
| Interleucina-4 humana recombinante | Immunotools | Cat Não 11130045 |
| Ciclosporina A | Novartis | Cat Não NDC 0078-0109-01 |
| FBS | LONZA | Cat Não DE14-802C |
| Tampão HEPES | PAA | Cat Não S11-001 |
| G-418 Sulfato | PAA | Cat Não P02-012 |
| Tripsina / EDTA (10x) | Invitrogen Gibco ® | REF 15400-054 |
Fontes C. Diversos:
| Reagente | Companhia | Despacho n. |
| Pipeta estéril dicas | Sarstedt | |
| 6-bem placa | NUNC | Não Cat 140675 |
| 50mL tubo cônico | BD Falcon ™ | Não Cat 352070 |
| Frasco de cultura de tecidos | SARSTEDT | Cat Não 83.1813.002 |
Referências
- Schultze, J. L. CD40-activated human B cells: an alternative source of highly efficient antigen presenting cells to generate autologous antigen-specific T cells for adoptive immunotherapy. J Clin Invest. 100, 2757-2765 (1997).
- Schultze, J. L., Grabbe, S., vonBergwelt-Baildon, M. S. DCs and CD40-activated B cells: current and future avenues to cellular cancer immunotherapy. Trends Immunol. 25, 659-664 (2004).
- Bergwelt-Baildon, M. von CD40-activated B cells express full lymph node homing triad and induce T-cell chemotaxis: potential as cellular adjuvants. Blood. 107, 2786-2789 (2006).
- Wiesner, M. Conditional immortalization of human B cells by CD40 ligation. PLoS ONE. 3, 1464-14 (2008).
- Urashima, M., Chauhan, D., Uchiyama, H., Freeman, G. J., Anderson, K. C. CD40 ligand triggered interleukin-6 secretion in multiple myeloma. Blood. 85, 1903-1912 (1995).
- Lapointe, R., Bellemare-Pelletier, A., Housseau, F., Thibodeau, J., Hwu, P. CD40-stimulated B lymphocytes pulsed with tumor antigens are effective antigen-presenting cells that can generate specific T cells. Cancer Res. 63, 2836-2843 (2003).
- von Bergwelt-Baildon, M. S. Human primary and memory cytotoxic T lymphocyte responses are efficiently induced by means of CD40-activated B cells as antigen-presenting cells: potential for clinical application. Blood. 99, 3319-3325 (2002).
- Kondo, E. CD40-activated B cells can be generated in high number and purity in cancer patients: analysis of immunogenicity and homing potential. Clin Exp Immunol. 155, 249-256 (2009).
- Mason, N. J. RNA-loaded CD40-activated B cells stimulate antigen-specific T-cell responses in dogs with spontaneous lymphoma. Gene Ther. 15, 955-965 (2008).
Access restricted. Please log in or start a trial to view this content.
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados