É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
In vivo como Cultura Wholemount organotípicas murino da retina
Neste Artigo
Resumo
Este artigo vídeo demonstra o estabelecimento de culturas de retina organotípicas wholemount e um procedimento para análise de cytospin exogenamente efeitos induzidos. Organotípicas retina culturas wholemount imitar o In vivo Situação e facilitar consideravelmente a acessibilidade dos retinas murino para manipulações experimentais, contornando as desvantagens de clássicos modelos animais murino.
Resumo
Ablações alvo de genes e análise de modelos animais é a estratégia clássica para se matricular a função do gene específico da retina. No entanto, transgênicos, modelos de mouse retina específicos ou condicional knockout freqüentemente exibem letalidade precoce ou sofrem de malformações graves, impedindo uma análise para além embrionárias ou início de estágios pós-natal.
Cultura de células primárias é uma alternativa para investigar os efeitos da aplicação exógena fatores recombinantes, superexpressão de genes ou siRNA mediada knockdown do gene em um ambiente controlado. Cultura de células dissociadas tem a vantagem de que os sinais endógenos atingindo as células-alvo são reduzidos, facilitando assim a identificação de exogenamente efeitos desencadeados após manipulação farmacológica. No entanto, importantes interações célula-célula são inicialmente destruída por digestão enzimática ou dissociação mecânica, mesmo se re-agregados culturas retinospheroid 1 são utilizados.
Pelo contrário, organotípicas retina culturas wholemount fornecer um sistema próximo ao fisiológico situação in vivo com as interações e conexões neuronais 2-5 ainda preservada.
Neste artigo apresentamos uma video passo a passo de demonstração (1) o estabelecimento de in vivo da retina-como organotípicas culturas wholemount incluindo peculiaridades dissecção da embrionárias, pós-natal e adulto olhos murino e (2) um procedimento de dissociação e cytospin para análise de neuronal apoptose e proliferação das células da retina em wholemounts organotípicas, por exemplo, após a cultura na presença de fatores aplicada exogenamente recombinante.
Protocolo
Todos os equipamentos e reagentes têm de ser comprados estéril ou deve ser de calor ou vapor esterilizado ou esterilizado com ETOH 70%.
Os autores afirmam que experiências em animais foram realizados de acordo com as Comunidades Europeias Directiva do Conselho (86/609/CEE), seguindo as orientações do NIH sobre o cuidado e uso de animais em procedimentos experimentais e os regulamentos estabelecidos pelo animal Institucional Cuidado e Uso Committee (IACUC) da Universidade de Duisburg-Essen (Alemanha).
Parte 1: Enucleação de olhos murino de diferentes estágios de desenvolvimento
Enucleação dos olhos embrionárias
- Acasalamentos tempo grávidas são criados e na manhã do dia em que um plug vaginal é detectado em acasalar fêmeas é designada 0 dias de gestação.
- A fêmea grávida, foi sacrificado por deslocamento cervical quando o desenvolvimento dos embriões chegou ao estágio desejado (aqui: dia embrionário (E) 15) e fixado em uma placa de cera 6.
- A parede abdominal é umedecido com ETOH 70%, corte ao longo da linha média e os retalhos cutâneos são fixados lateralmente por pinos 6.
- O uterusses são removidos do abdômen, individual e transferidos para um copo com PBS frio 6.
- Os embriões são separados, transferidos para uma placa de Petri e parede do útero e as membranas embrionárias são removidos cuidadosamente pelo uso de fórceps 6.
- Embriões são mortos por decapitação.
- Olhos são enucleados ser o uso da multa, fórceps curvos, "descascar" os olhos da órbita ocular.
Enucleação dos olhos pós-natal e adulto
- Filhotes jovens são mortos por decapitação, filhotes e adultos por deslocamento cervical.
- Até estágio pós-parto P15, o ponto de tempo em ratos abrir os olhos, fendas dos olhos tem que ser mecanicamente aberta pelo uso de fórceps e alargada por dois cortes transversais das pálpebras com uma tesoura de mola.
- Olhos são enucleados com a ajuda de uma pinça curva, aplicando a pressão à órbita.
Nota: Em dia pós-natal 2, os ossos ainda estão orbital cartilaginoso, é importante para não aplicar pressão demasiada ao tentar remover os olhos.
Pelo contrário, nos ratos adultos, os ossos são firmes orbital. Assim, a fim de enuclear os olhos é suficiente para aplicar pressão à órbita sem aumentar as fendas dos olhos de antecedência.
Parte 2: Dissecção da embrionário, pós-natal e adulto retinas murino
Dissecção das retinas
- Os olhos são colocados em uma placa de Petri pequena com PBS estéril e as camadas ao redor dos olhos são removidos sob um microscópio de dissecação.
- Para remover as camadas externas do olho, em estágios pós-natal e os olhos de adulto, o nervo óptico tem que ser cortado com a ajuda de uma tesoura de mola ou off prensado por fórceps tão perto da base quanto possível.
- Por sua vez o olho, de modo que a parte de trás com o buraco onde o nervo óptico originalmente residiam é voltado para você. Entrar no espaço sub-retiniano entre retina e epitélio pigmentar com as pontas de dois pinça muito fina a partir do local onde o nervo óptico penetraram as camadas do olho.
Nota: Normalmente, o epitélio pigmentar pode ser facilmente identificado por sua cor escura. Em algumas linhagens de camundongos mutantes - especialmente em animais albinos - esta camada de pigmento pode, no entanto, não ser coloridas e, portanto, não podem ser facilmente detectar. - Remover o epitélio pigmentar com a membrana coróide e esclera associadas com cuidado rasgando para ambos os lados com as duas pinças.
- Descolar as camadas até o nível da córnea, em seguida, vire o copo olho para o lado da lente e retire a córnea, juntamente com epitélio pigmentar, membrana coróide e esclera, enquanto segurando o copo restante da retina pelo fórceps outros.
- Segure o vítreo, juntamente com a lente pequena e enquanto rasgando com uma pinça, mantenha o wholemount retina no lugar com a pinça segundo.
Nota: Ao dissecar os olhos embrionárias, certifique-se de remover completamente o triangular, barraca-como plexo capilar debaixo do corpo vítreo, juntamente com o vítreo.
No olho do adulto, o vítreo precisa ser compreendido nas laterais e cuidados tem que ser tomado para não furar o vítreo com as pontas do fórceps como seu conteúdo é viscosa e adere ao fórceps, o que dificulta a sua remoção. - Para a cultura wholemount organotípicas os copos da retina são coletados em uma placa de 96 poços contendo 200 meio modificado Dulbecco águia mL (veja abaixo).
Nota: Entre dissecação de retinas individual, manter o prato de coleta de 96 poços contendo meio de cultura na incubadora como o pH do meio de cultura é desencadeada por CO 2, através do sistema carbonato.
Parte 3: wholemount organotípicas murino da retinacultura
- Prepare 500 ml de cultura por meio modificado ponderação 7.8g Dulbecco águia / mistura de nutrientes HAM F-12 (DMEM) e NaHCO 3 0,6 g e dissolver tanto em água MiIliQ. Ajustar o pH a 7,15. Adicionar 50mg apo-transferin, 50μl putrescin (stock: 60mg/ml), 50μl selenito de sódio (stock: 52μg/ml), progesterona (stock: 60μg/ml), e 2,5 ml de gentamicina (200 mM) sob o capô. Homogeneizar e filtrar através de um filtro superior do frasco. Imediatamente antes do uso adicionar 10μl glutamina (200 mM) por ml de meio de cultura.
Nota: Este meio de soro e insulin-livre pode ser armazenado a 4 ° C por até 2 semanas e utilizado para experimentos de indução de apoptose como nenhuma insulina neutraliza os efeitos. Se incubação de wholemounts por mais de 24h é desejada e as taxas de morte celular não será avaliado, soro de insulina (por exemplo, soro fetal bovino; FCS) ou suplementos deve ser adicionado para melhorar as taxas de sobrevivência. - Antes de iniciar a cultura, a wholemounts da retina são pré-incubadas por 15 min a 37 ° C com 200 mL quente, pH balanceado DMEM contendo hialuronidase 0,5 mg para pré-digerir a hialuronidase contendo interna e externa da membrana limitante da glia M ller células, facilitando a penetração de substâncias aplicadas exogenamente.
- Retinas são transferidos para uma placa de 24 poços, com tão poucos quanto possível hialuronidase e culta como wholemounts organotípicas em 2ml Dulbecco modificado quimicamente definido médio águia.
Nota: Para transferir as retinas, use uma pipeta de 1ml e cortar a ponta da pipeta alguns milímetros para alargar a abertura. Para os olhos do embrião, a 200 mL ponta da pipeta é suficiente. As arestas de corte deve ser alisado por inserção e torção de uma ponteira segundo.
Por 24-48 horas a curto prazo as culturas, todas as etapas podem ser executadas no banco, mas se a contaminação das culturas passa a ser um problema, deve-se trabalhar sob o capô. - Culturas são mantidos por 24-48 horas a 37 ° C em uma atmosfera de 5% CO 2 e, por exemplo submetidos ao tratamento farmacológico com fatores recombinantes.
Parte 4: A dissociação de culturas de retina wholemounts
- Após o tempo de cultura desejada, retinas são coletados em tubos Eppendorf de 2 ml com fundo redondo contendo 850 mL PBS e 50 ul de soro bovino albumina (BSA; 30 mg / ml).
- Coloque os tubos Eppendorf com retinas em um bloco de aquecimento, aquecido a 37 ° C.
- Adicionar 25 mL de colagenase (200 U / ml) e 25 mL de hialuronidase (20mg/ml) a cada tubo Eppendorf e começar a dissociar as retinas em suspensão única célula por 3 passa através de uma pipeta Pasteur siliconizada.
- Adicionar 10 mL de tripsina (1mg/ml), espere por 3-5 min, e então lentamente pipeta 3-5 vezes para cima e para baixo com siliconizado pipeta Pasteur mecanicamente dissociar o tecido.
- Adicionar 10 ml DNase I (5mg/ml), mais uma vez esperar por 3-5 min, em seguida, lentamente pipeta 3-5 vezes para cima e para baixo com siliconizado Pasteur pipeta.
Nota: O tempo de incubação para dissociação enzimática varia e depende do tamanho dos olhos e do estágio de desenvolvimento, respectivamente. Verificar o estágio de digestão enzimática do tecido com cuidado pipetando cima e para baixo. - Se a suspensão de células não é homogênea por agora, mas ainda contém agregados de células grandes, adicione tripsina adicional de 10 mL e 10 ml DNase I.
- Quando a suspensão de células é homogênea, a digestão do tecido é interrompido pela adição de 10 mL de EDTA (0,5 M), tubos Eppendorf são removidos do aquecedor e as suspensões de células são fixadas por 1h pela adição de 1 ml, paraformaldeído gelo fresco frio de 8% (PFA) em temperatura ambiente em um agitador de rotação.
Parte 5: Lavagem de suspensões de células dissociadas
- A suspensão celular é centrifugado por 5 min a 4 ° C e em 0,2 rcf em uma centrífuga de resfriamento.
- O sobrenadante é descartado eo pellet é ressuspenso em 1ml de PBS contendo 3mg/ml BSA.
- Depois de repetir essas etapas de lavagem duas vezes, a pelota é, finalmente, re-suspenso em 500 mL de PBS contendo 3mg/ml BSA, EDTA 5mM e azida de sódio a 0,1%.
Nota: A adição de ácido de sódio permitir o armazenamento da suspensão celular por vários dias a 4 ° C. No entanto, se uma coloração imunocitoquímica se seguirão, não adicionar ácido de sódio para o buffer de ressuspensão, pois isso resulta em perda de qualidade de coloração.
Parte 6: Cytospin de células em suspensão de apoptose e análise quantitativa da proliferação
- A lâmina de microscópio fosco-end, um filtro cytospin com um ou dois furos e um funil cytospin são inseridos em um clipe de slides cytospin. O clipe de slides é fechada e posicionada no rotor cytospin.
- A suspensão de células dissociadas é homogeneizada suavemente pipetando para cima e para baixo.
Nota: Dependendo do estágio de desenvolvimento da retina, a suspensão de células a partir do procedimento de dissociação pode precisarser diluído com PBS para obter um número contável de células. - Uma alíquota (100 ml) da suspensão de células é aplicada a um funil cytospin.
Nota: Quando pipetar a suspensão celular para o funil, a ponta da pipeta deve atingir todo o caminho até o fundo do funil. É importante não avançar com o ponto de pressão segundo a pipeta, pois isso cria bolhas de ar, que será visível no local de células após a cytospin e dificulta a contagem de células. - A suspensão de células é avistado em uma lâmina de 700 rpm por 7 min.
- Para a determinação do efeito de fatores exógena aplicada sobre os níveis de apoptose de células podem ser marcadas com 4 ',6-diamidino-2-phenylindole (DAPI; 2μg/ml), montado com fluorescentes meio de montagem. Mudanças na apoptose de células pode ser determinada através da contagem, pelo menos, 1000 células (que compreende pelo menos 10 núcleos picnóticos) nos pontos de células cytospin ea taxa de morte celular é calculada como porcentagem de células contagem total de 3,4.
Nota: Como alternativa, a distribuição de núcleos apoptóticos podem ser avaliados em flatmounts 3 ou criostato sections4 de culturas de retina por wholemounts TdT mediada rotulagem final dUTP nick (TUNEL). - Para a detecção de proliferação celular, BrdU (5 mM) pode ser adicionado 6h antes do fim da cultura e da incorporação de BrdU visualizado em cytospins de homogenatos de células através de coloração imunocitoquímicos usando um anticorpo anti-BrdU (por exemplo, do Desenvolvimento Estudos Hibridoma Bank, Iowa, EUA).
- O efeito do tratamento em diferentes tipos de células da retina pode ser visualizado na cytospins por anticorpos específicos, como o neurônio Brn3a (marcador de células ganglionares) ou opsina (fotorreceptor marcador) e contracoloração com DAPI.
Parte 7: Resultados Representante
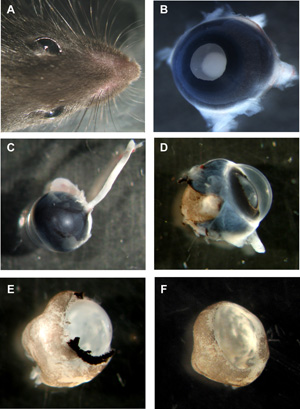
Figura 1: Passos na preparação de murino organotípicas wholemounts da retina
A Chefe do mouse com ambos os olhos. B olho murino com o lado lente para cima, todas as camadas ainda no lugar. C olho murino da parte traseira com o nervo óptico ainda ligado. D olho murino com esclera e epitélio pigmentar parcialmente removida. E retina murino com epitélio da córnea, esclera e pigmento completamente removido, mas cristalino e vítreo ainda no lugar. F copo retina murino wholemount com lente e vítreo removido. Por favor, clique aqui para ver uma versão ampliada da figura 1.
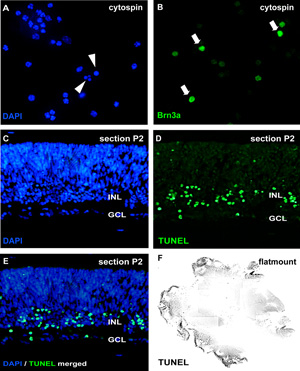
Figura 2: Análise de organotípicas retina culturas wholemount por cytospin e seções
Para a análise da apoptose, cytospins de suspensões de células dissociadas estão manchadas pelo DAPI e núcleos picnóticos podem ser distinguidos pela fragmentação nuclear ou condensação da cromatina (setas em A). Alternativamente, as seções wholemount (CE, dia retina de camundongos pós-natal (P) 2) ou flatmount retina (F) pode ser submetido a um ensaio de TUNEL e contrastado com DAPI (E). O efeito do tratamento em diferentes tipos de células da retina pode ser visualizado na cytospins por anticorpos específicos de neurônios, como o marcador de células ganglionares Brn3a (setas em B) GCL, camada de células ganglionares;. INL, camada interna em potencial nuclear. Por favor, clique aqui para ver uma versão ampliada da figura 2.
Discussão
A vantagem de 2-5 murino organotípicas culturas de retina wholemount mais de dissociação, monocamada, retinospheroid ou re-agregados 3D culturas esferóide 1 encontra-se na preservação de interações e conexões neuronais, simulando a situação in vivo. Em comparação com os relatórios anteriores 2, o nosso artigo de vídeo oferece uma demonstração detalhada das peculiaridades em enucleação dos olhos murino e dissecção de retinas de diferentes estágios d...
Agradecimentos
Os autores gostariam de agradecer a E. de la Rosa e AI Valenciano para ajuda inicial com o estabelecimento das culturas organotípicas e U. Laub e U. Gerster para assistência técnica.
Materiais
| Name | Company | Catalog Number | Comments | |
| Mice | Animal | Charles River Laboratories | ||
| Dissection microscope | Tool | Carl Zeiss, Inc. | ||
| PBS | Reagent | Sigma-Aldrich | PBS should be cold (> 4°C) and sterile | |
| Dulbecco`s modified eagle`s medium / nutrient mixture F-12 Ham | Reagent | Sigma-Aldrich | D 8900 | DMEM / F-12 |
| Apo-transferin | Reagent | Sigma-Aldrich | T 1147 | |
| Putrescin | Reagent | Sigma-Aldrich | P 5780 | |
| Sodium selenite | Reagent | Sigma-Aldrich | S 9133 | |
| Progesterone | Reagent | Sigma-Aldrich | P 6149 | |
| Gentamicine | Reagent | Invitrogen | ||
| L-Glutamine | Reagent | Invitrogen | 25030-024 | 200 mM (100X), liquid |
| Bovine serum albumine (BSA) | Reagent | Carl Roth Gmbh | 8076.3 | 30 mg/ml |
| Collagenase | Reagent | Sigma-Aldrich | C 0773 | 200 U/ml |
| Trypsin | Reagent | Sigma-Aldrich | T4799 | From porcine pancreas; 1 mg/ml |
| Hyaluronidase | Reagent | Sigma-Aldrich | H 3884 | 200 mg/ml |
| DNase I | Reagent | Roche Group | 1 284 932 | 10 mg/ml |
| EDTA | Reagent | Sigma-Aldrich | E 6511 | |
| Silicone solution | Reagent | SERVA Electrophoresis | 35130 | |
| Paraformaldehyde (PFA) | Reagent | Sigma-Aldrich | P6148 | 8% PFA in 0.1M phosphate buffer (pH 7.4). |
| 4’,6-diamidino-2-phenylindole dihydrochloride | Reagent | Sigma-Aldrich | D 0542 | DAPI |
| Fluorescent Mounting Medium | Reagent | Dako | S3023 | |
| BrDU | Reagent | Sigma-Aldrich | B 9285 | |
| 96-well plates | Tool | Falcon BD | 3072 | |
| 24-well plates | Tool | Falcon BD | 3047 | |
| Pasteur pipettes | Tool | Brand GmbH | 747720 | |
| Forceps DUMONT #5 | Tool | Fine Science Tools | 11252-30 | bevelled very fine shanks (0.05 mm x 0.02 mm tip) |
| Forceps DUMONT #7 | Tool | Fine Science Tools | 11271-30 | curved shanks (0.07 mm x 0.10 mm tip) |
| Spring scissors,straight, 8cm | Tool | Fine Science Tools | 15000-00 | fine, small straight blades |
| Standard scissors, straight, sharp/blunt | Tool | Fine Science Tools | 14007-14 | Use for decapitation or cervical dislocation |
| Eppendorf tubes | Tool | Eppendorf | 2ml; round bottom for better precipitation of pellet during centrifugation /cytospin | |
| Cooling centrifuge | Tool | Eppendorf | ||
| Rotation shaker | Tool | CAT | ||
| Cytospin | Tool | Thermo Fisher Scientific, Inc. |
Referências
- Rieke, M., Gottwald, E., Weibezahn, K. -. F., Layer, P. G. Tissue reconstruction in 3D-spheroids from rodent retina in a motion-free, bioreactor-based microstructure. Lab. Chip. 8, 2006-2213 (2008).
- Donovan, S. L., Dyer, M. A. Preparation and square wave electroporation of retinal explant cultures. Nature Protocols. 1, 2710-2718 (2006).
- Duenker, N., Valenciano, A. I., Franke, A., Hernandez-Sanchez, C., Dressel, R., Behrendt, M., de Pablo, F., Krieglstein, K., de la Rosa, E. J. Balance of pro-apoptotic transforming growth factor-beta and anti-apoptotic insulin effects in the control of cell death in the postnatal mouse retina. Eur. J. Neurosci. 22, 28-38 (2005).
- Franke, A. G., Gubbe, C., Beier, M., Duenker, N. Transforming growth factors beta and Bone morphogenetic proteins: Cooperative players in chick and murine programmed retinal cell death. J. Comp. Neurol. 495, 263-278 (2005).
- de la Rosa, E. J., Díaz, B., De Pablo, F. Organoculture of the chick embryonic neuroretina. Curr. Top. Dev. Biol. 36, 133-144 (1998).
- Dohle, D. S., Pasa, S. D., Gustmann, S., Laub, M., Wissler, J. H., Jennissen, H. P., Duenker, N. Chick ex ovo culture and ex ovo CAM assay: How it really works. J Vis Exp. 32, (2009).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados