Method Article
Modelos experimentais para estudo da fisiologia epitélio pigmentar da retina e Fisiopatologia
Neste Artigo
Resumo
Nós fornecemos um método reprodutível para monocamadas confluentes de cultura humana fetal células epitélio pigmentar da retina (hfRPE) células que apresentam morfologia, fisiologia, polaridade, e proteína e os padrões de expressão gênica do tecido nativo adulto. Este trabalho foi estendido para um modelo animal de várias doenças oculares.
Resumo
Nós desenvolvemos um processo de cultura de células que podem produzir grandes quantidades de monocamadas confluentes de humanos primários do epitélio pigmentar da retina fetal (hfRPE) culturas com características morfológicas, fisiológicas e genéticas de RPE humano nativo. Essas culturas de células hfRPE apresentam pigmentação pesado, e microscopia eletrônica mostram extensa microvilosidades da membrana apical. Os complexos juncionais foram identificados com a rotulagem de imunofluorescência de várias proteínas de junção tight. Polaridade epitelial e função dessas culturas facilmente reproduzível primárias assemelham previamente estudados modelos de mamíferos de RPE nativa, incluindo humanos. Estes resultados foram estendidos pelo desenvolvimento de intervenções terapêuticas em vários modelos animais da doença de olho humano. Temos focado em estratégias para a remoção de acúmulo de líquido anormal na retina ou no espaço sub-retiniano. O espaço extracelular subretiniana separa os segmentos fotorreceptoras externa ea membrana apical do RPE e é crítico para a manutenção de anexos da retina e toda uma série de RPE / retina interações.
Protocolo
1. Tecido fetal humano
Todas as pesquisas de tecidos humanos relacionados segue os princípios da Declaração de Helsinki e do NIH conselho de revisão institucional. Olhos do feto são obtidos por um procurador independente, Advanced Resources Bioscience (ABR, Alameda, CA), a partir de doadores aleatórios de 16 a 22 semanas de gestação, colocado em RPMI-1640 contendo tubos de media (fornecido pela ABR), embalado em gelo e entregues por um serviço durante a noite prioridade de entrega. Tecidos permanecem viáveis até 48 horas após enucleação.
2. Meio de cultura celular
MEM-alfa modificado médio (Sigma-Aldrich) é usado como meio base para preparar 5% e 15% de soro contendo meios para cultura de células RPE (EPR médio; Tabela 1 abaixo).
| Nome | Sigma | Gibco | Quantidade | Armazenamento |
| MEM, alpha modificação | M-4526 | 500 mL | 4 ° C | |
| N1 suplemento | N-6530 | 5 mL | 4 ° C | |
| Penicilina-estreptomicina | 15140-148 | 5 mL | -20 ° C | |
| Glutamax - I | 35050 | 5 mL | -20 ° C | |
| Não aminoácidos essenciais | M-7145 | 5 mL | 4 ° C | |
| * THT | -80 ° C | |||
| Taurina | T-0625 | 125 mg | ||
| Hidrocortisona | H-10 0396 | 10 mg | ||
| Triiodo-thyronin | T-5516 | 0,0065 mg | ||
| Fetal bovino ** soro | 5% ou 15% | -80 ° C |
Tabela 1. Humana Componentes RPE Fetal Médio de Preparação de 500 mL Médio
THT * é feito através da dissolução taurina hidrocortisona-triiodo-thyronin em 1 1,5 mL PBS antes de fazer o meio. Alíquotas múltiplas são feitas e armazenadas a -80 ° C para simplificar a preparação cultura do meio de cultura.
** Soro fetal bovino não é obtido da Sigma-Aldrich ou Gibco.
Soro fetal bovino utilizado na preparação de mídia é obtido a partir de Atlanta Biologicals (Norcross, GA). Cada frasco do soro é inactivado pelo calor (56 ° C durante 1 hora) antes do uso. Para garantir a consistência quantidades de cultura de células grandes de soro de um mesmo lote são comprados e armazenados em -20 ° C até serem utilizados para a preparação de meios de comunicação. Células pouco semeada a partir de um lote específico de células hfRPE são cultivadas em 24 - ou 12 - placas bem por algumas semanas em meios contendo 20% FBS de lotes diferentes. As células que mais cresce melanated com a morfologia RPE mais clássico (paralelepípedos) indicam um lote apropriado soro que pode ser usado para cultura de células.
Meio de cultura celular também contém: N1 suplemento (Sigma-Aldrich) 1:100 mL / mL, Glutamax / penicilina-estreptomicina 1:100 mL / mL (Gibco), e solução de aminoácido não essencial (Sigma-Aldrich) 1:100 mL / mL. Além disso, hidrocortisona (20 mg / L), taurina (250 mg / L) e triiodo-thyronin (0,013 mg / L) (THT) é preparado antes dissolvendo esses três componentes em PBS para uma concentração final de 1:500 (mL / mL). Alíquotas de THT são armazenadas a 80 ° C até que adicionadas ao meio de RPE.
3. Cultura de células
Após a recepção, globos intactos são lavados em solução antimicótica antibiótico (diluído 10X;.. Cat sem 15240-096; Invitrogen) e gentamicina (1 mg / mL) por 3 a 5 minutos (Figura 1 abaixo). 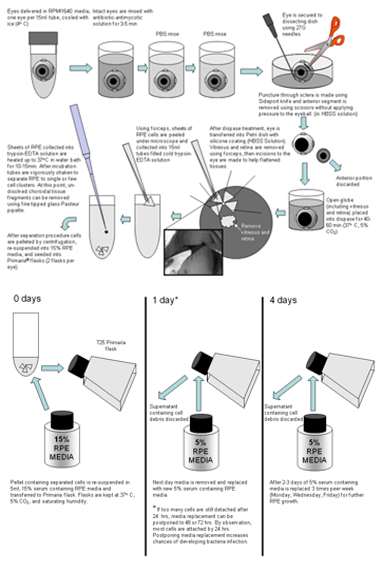
Figura 1. Depois que os antibióticos de incubação são enxaguados duas vezes com meio, como HBSS ou PBS. Um globo ocular no momento em que é transferido para 10 centímetros prato de Petri com revestida com Sylgard-184 (WPI) e fixado com 27G agulhas. Usando uma faca de corte raso porta lateral (Alcon) é feita uma incisão através da esclera abaixo do corpo ciliar (1 / 3 da distância do equador do globo ocular para a superfície anterior). Esta incisão é usado para iniciar um corte circular para a remoção da porção anterior do olho. Este corte é feito usando um revestimento de carboneto de tungstênio-tesoura curva íris com uma lâmina serrilhada (FST). Antes da remoção da parte anterior do olho, um corte é feito através do corpo vítreo, para evitar desmontar o retina do RPE no pólo posterior. Após a parte anterior do olho é removido, o pólo posterior é incubada com dispase-I a solução (2 U / mL, gato não 04942086001;.. Roche Diagnostics, Indianapolis, IN) em 5% meio contendo soro de 40-60 minutos em 37 ° C-CO 2 5%. Após o tratamento dispase, os pólos posterior são transferidos para um HBSS em placas de Petri com o silício estofamento (Sylgard 184; Dow Corning, Midland, MI) e dissecados em quadrantes ou pedaços maiores para aplainar suficientemente tecidos. Em seguida, a retina é gentilmente removido com uma pinça. Camadas de uma única célula RPE foram descascadas e em folhas coletadas diretamente em solução de tripsina-EDTA (Gibco, # 25200-056) frio. Após o RPE são coletados, tubos com tecidos em tripsina-EDTA são selados e transferidos para banho-maria durante 10-15 minutos a 37 ° C. Após 10 minutos de incubação, os tubos são agitados vigorosamente para separar RPE em pequenos grupos. Se a separação não é completa, os tubos são colocados de volta em banho-maria por mais 5 minutos. Depois de tripsina-EDTA de incubação, os tubos são inspecionados quanto a possíveis não-dissolvido grupos de células mistas. Qualquer aglomerados observados são removidos com ponta fina de vidro Pasteur pipeta. Depois de girar para baixo (1,4 rpm em centrífuga clínica para 4 minutos), as células hfRPE são re-suspensas em media RPE 15% e, em seguida, colocada em frascos Primaria (exemplo: gato não 08-772-45; Fisher Scientific, Pittsburgh, PA.. ). Este meio é substituído após um dia com o meio RPE 5% de soro contendo, e alterações subseqüentes foram feitas a cada 2 a 3 dias. Após 3 a 4 semanas, as células tornaram-se confluentes e uniformemente pigmentados. Eles são, então, tripsinizados em 0,25% de tripsina-EDTA por 10 a 15 minutos, re-suspenso em 15% de soro contendo RPE meio de cultura celular, e semeados em inserções de cultura de células claras em 150 a 200K células por poço (Transwell; Corning Costar, Corning, NY), utilizando pastilhas de 12 mm de diâmetro, 0,4 pores-um, as membranas de poliéster (exemplo: gato não 07-200-161, Fisher Scientific)... Antes da semeadura, os poços foram revestidos com matriz extracelular humano (10 mg em 150 mL por poço HBSS, gato não 354237;.. BD Biosciences, Franklin Lakes, NJ) e curado com luz UV na capa de duas horas. Em alguns casos, o procedimento foi repetido tripsinização pela segunda vez, para coletar as células que se soltou após o tripsinização primeiro. O mesmo protocolo (excluindo revestimento com ECM) foi utilizada para células de cultura nos frascos para gerar a população P1 de células. Essas células foram utilizados em experimentos, quando eles tinham uma resistência do tecido total de ≥ 200 Ω • cm 2 e foram uniformemente pigmentados.
Por favor, clique aqui para aumentar a figura 1 .
4. Procedimentos passo a passo
- Prepare 12 bem-placa com múltiplas soluções (para cada olho 4 poços necessário):
- adicione a solução de antibiótico antimicótico 10x - 1 poço / olho
- adicionar PBS / HBSS solução para enxaguar - 2 poços / olho
- adicione a solução de dispase - 1 poço / olho
- Prepare dissecar placa de Petri por desembalar 5 agulhas de fixação e preenchê-lo com HBSS
- Olhos descompactar e colocá-los em solução antibiótica-antimicótica por 3-5 minutos (preparado no passo 1)
- Lave os olhos em dois poços (preparado na etapa 1) com PBS / HBSS, em seguida, transferi-los para dissecar prato.
- Muscular excessiva caimento e tecido conjuntivo ao redor dos olhos
- Usando 27G agulhas seguras (pino para baixo ao silício base) olhos em dissecar prato alinhá-las de uma forma onde enfrenta córnea.
- Usando uma faca porta lateral fazer incisão abaixo córnea, onde o corte circular começará
- Usando uma tesoura iris fazer corte ao redor dos olhos, em seguida, usando a tesoura mesmo cortar vítreo e levante porção anterior do olho de distância.
Nota: nos passos 3-8 evitar qualquer pressão excessiva mecânica para globo ocular. - Transferência de olho aberto na solução dispase (preparado no passo 1)
- Incubar copo olho por 40-60 minutos a 37 ° C com 5% de CO 2
- Substituir solução HBSS em dissecar prato com um doce.
- Transferência de olho de solução para dispase prato de dissecação.
- Olho posição na placa de Petri (copo globo ocular para cima) e seguro com duas agulhas 27G.
- Levantar delicadamente retina parcialmente separados e usando uma tesoura corte da retina retina de distância do nervo óptico. Descartar retina.
- Com uma tesoura de íris fazer uma incisão da periferia do olho em direção ao nervo óptico.
- Usando todos os cinco agulhas 27G achatar olho camada de RPE fazendo muito bem esticado.
- Com uma tesoura corte da retina fazer circular ao redor do nervo óptico que separa camada de RPE do apego ao nervo óptico.
Nota: os passos 13-17 pode ser feito com baixa ampliação ou sem microscópio estéreo - Estereomicroscópio ajustar a ampliação 250xou mais e encontrar borda da folha de RPE perto do nervo óptico ao longo do corte feito pela íris tesoura.
- Utilizando duas pinças de membrana separadas RPE-Bruch da camada de tecido da coróide. Ela pode exigir algumas tentativas para encontrar área ao longo da borda, onde a conexão de RPE e coróide é mais fraco.
- Coloque folhas de RPE em solução de tripsina-EDTA frio em 15 mL do tubo
- Após o RPE são coletados tubos, boné e transferência com tecidos em tripsina-EDTA em banho-maria por 10-15mins a 37 ° C.
- Após 10 minutos de incubação, agitar vigorosamente tubos de 15 mL para separar RPE em pequenos grupos. Se a separação não é completa, coloque os tubos de volta em banho-maria por mais 5 minutos.
- Inspecione os tubos para possíveis não-dissolvido grupos de células mistas. Qualquer aglomerados observados devem ser removidas com ponta fina de vidro Pasteur pipeta.
- Spin para baixo (1,4 rpm em centrífuga clínica para 4 minutos) células hfRPE, remover o sobrenadante e ressuspender as células em 15% RPE mídia (9 total ml)
- Coloque 3 mL de suspensão de células em frascos Primaria adicionar 2 mL da nova media 15% RPE, frasco lugar em incubadora até o dia seguinte (37 ° C CO, 5% 2)
5. Resultados representante
Validação funcional de cultura de células hfRPE
Em experimentos anteriores, temos usado essas culturas primárias para determinar a expressão de polarização, e função de proteínas transportadoras de membrana plasmática e identificar rotas de sinalização específicas que regulam a função RPE 11/01 Estas características são acumulados à medida que fornecem uma validação conjunto de propriedades que podem ser aplicadas a cada geração celular. Os experimentos resumidos a seguir identificar as proteínas que determinam o transporte de fluidos transepitelial ea integridade da via paracelular. Estes experimentos in vitro foram validadas em um modelo animal de retina re reatamento-6.
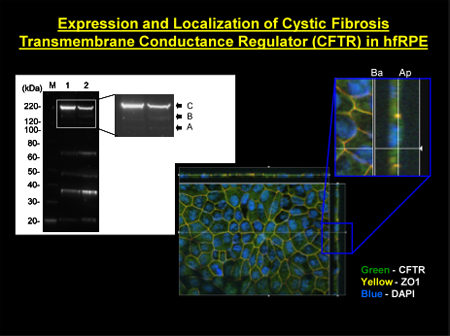
Figura 2. Localização de CFTR em células hfRPE painel superior esquerdo:. CFTR foi detectada em células hfRPE usando membrana enriquecido extratos. M, marcador de peso molecular; raia 1, as principais madura (banda C) e imaturo (bandas A e B) do painel inferior Centro: localização imunofluorescência de CFTR (selo verde) do painel direito superior: vista de seção transversal ampliada através do plano z mostrando.. máxima intensidade de projeção através do eixo z. ZO-1 (marcado em vermelho) serve como um marcador junção apertada delineando os lados apical e basolateral da RPE. DAPI (azul) rótulos dos núcleos localizados próximos à membrana basal. ZO-1 aparece como amarelo / laranja, já que fluorescence suas sobreposições etiqueta vermelha verde do CFTR.
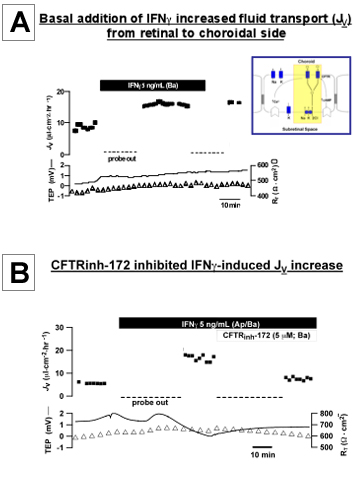
Figura 3. IFNγ induzida por alterações fisiológicas no hfRPE A:. Adição de IFNγ ao banho basal aumentou transporte de fluidos transepitelial (J v) em monocamada de primárias, as células cultivadas hfRPE J v é plotado como uma função do tempo no rastreamento de topo e fluido líquido. absorção (apical ao banho basal) é indicada por valores positivos; potencial transepitelial (TEP) e resistência do tecido total (R T) são plotados como uma função do tempo nos traços de fundo. B: adição de CFTRinh-172 (5 mM) ao banho basal inibiu o IFNγ estimulada J aumentar v.
Abaixo está um exemplo de experiências com animais modelo confirmando hfRPE achados in vitro. Neste experimento, criado artificialmente descolamento de retina foi significativamente reduzida após a adição de IFNg à superfície exterior do olho (Figura 4 A, B). Este efeito pode ser parcialmente bloqueada por: (1) adição de bloqueador de cAMP (Figura 4D), (2) completamente bloqueada após a adição de bloqueadores cAMP JAK +. As imagens abaixo são obtidos utilizando scanner outubro
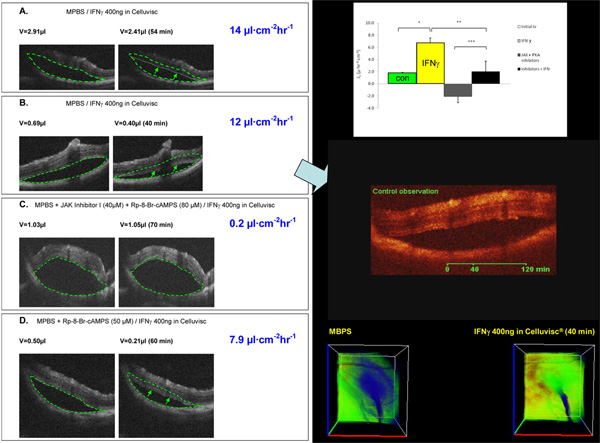
Figura 4. Experimentos in vivo descolamento de retina. Os procedimentos para estes experimentos in vivo foram previamente descritos em detalhe 6. Nesses experimentos, descolamento de retina foram criados no olho de rato pela injeção de 0,5-3 mL de solução de PBS modificado para o espaço sub-retiniano (SRS), sozinho ou com uma combinação de JAK-STAT e os inibidores da via de PKA. Cada experimento teve um período de controle inicial de 40-70 min após a criação do descolamento de retina. Durante este tempo, a taxa de variação do volume bolha foi medida para garantir a estabilidade bolha. Tomografia de coerência óptica de imagem (Instituto de Física Aplicada, Russian Academy of Science, Nizhniy Novgorod, Rússia) foi usado para medir a evolução no tempo da mudança de volume no SRS.
O tempo de re-vol anexoume mudança foi medida por tomografia de coerência óptica (OCT). Imagens outubro de quatro experimentos diferentes (painéis à esquerda; AD) que mostram uma alteração na dimensão descolamento (setas em A, B e D) após a adição de IFNγ na superfície anterior para 40-70 min. Os painéis A e B mostram que IFNγ aumento Jv de sua taxa de controle (≈ 2 l • • cm 2 hr -1) a 14 e 12 mL • cm 2 • h-1, respectivamente. Após adição de JAK-STAT e os inibidores da via de PKA (C e D), o IFNγ - as taxas de absorção induzida foram significativamente reduzida para 0,2 e 7,9 mL • cm 2 • h-1, respectivamente. Setas indicam o limite da bolha para comparação com a área delimitada dentro da linha tracejada, (volume inicial). Lado direito da figura: top painel de resumo das taxas de medida Jv de várias experiências; meio do painel do filme ( clique aqui ); inferior do painel 3D seções do experimento resumidos na B. Falsa em azul indica a extensão espacial de desprendimento em t = 0 e 40 min após a adição de INFγ.
Todos os experimentos com animais foram conduzidos em conformidade com a Associação para Pesquisa em Visão e Oftalmologia declaração. O protocolo foi aprovado pelo Comitê de Cuidados Animal e Uso do National Institutes of Health.
Discussão
Nos experimentos, descrevemos modificações adicionais de nossas técnicas previamente publicados 3 projetado para agilizar as várias etapas necessárias para a produção consistente hfRPE culturas primárias com um maior número de células disponíveis por olho. Cada mudança no procedimento original foi rigorosamente testado em fisiologia múltiplas e experimentos de biologia molecular para assegurar que as mudanças não introduzir artefatos e sendo continuamente testado por muitos outros laboratórios usando essas células. Finalmente, experimentos adicionais foram realizados para comparar os resultados in vitro a perturbações semelhantes em modelos animais.
Divulgações
Agradecimentos
Agradecemos Lab membros Jeffrey Adijanto, Tina Banzon, Li Rong, Qin Wan, Congxiao Zhang, Jing Zhao, Connie Zhi, Awais Zia, Natalia Strunnikova para ajudar na caracterização destas culturas de células. Um agradecimento especial a Jing Zhao, Zhi Connie, e Banzon Tina pela sua ajuda na manutenção de grandes estoques de culturas de células.
Este trabalho foi financiado pelo National Institutes of Health Research Program intramuros.
Materiais
Instrumentos necessários para o protocolo de dissecação
- Microscópio estéreo - todos disponíveis com x250 ampliação de giro necessário para dissecção
- Prato de dissecação - por exemplo, Kimble 100 x 20mm # 23062 (um por dissecção) de qualquer fonte
- Sylgard 184 - Cat WPI. # SYLG184 *
* Para preparar dissecar prato seguir Sylgard 184 incluídas instruções de mistura, despeje elastômero líquido misturado em placa de Petri para formar 5-8mm camada. Permitir elastômero de cura para pelo menos 24 horas. Prato com elastômero curado pode ser esterilizada com etanol 70% e reutilizado várias vezes (~ 100 vezes) - 27 G de agulhas BD PrecissionGlide 1 ¼ comprimento (5 por dissecção) de qualquer fonte
- Solução 1X HBSS contendo Ca e Mg sais - Cat # 14025 GIBCO 500ml (bom para dissecções múltiplas).
- Iris tesoura serrilhada carboneto de lâmina, curvo - FST Cat # 14559-11 (um).
- Tesouras da retina - Katena Cat # K4-5300 (um).
- Fórceps - por exemplo, Dumont Tweezers # 5 com pontas polidas de Cat WPI # 500085 (2 peças).
- Sideport faca - Alcon, clearcut 1mm, Bevel Dual, Cat angular # 8065921540.
- Centrífuga 15ml tubo - (um em cada olho) em qualquer fonte
- Pasteur de vidro pipeta - (uma por dissecção) de qualquer fonte
- Placa de 12 poços (um por dissecção) de qualquer fonte
- Primaria 25 centímetros Frasco de 2 - (2-3 em cada olho) em qualquer fonte
Referências
- Bharti, K., Miller, S. S., Arnheiter, H. The new paradigm: Retinal pigment epithelium cells generated from embryonic stem cells or induced pluripotent cells. Pigment Cell & Melanoma Research. , Forthcoming Forthcoming.
- Strunnikova, N. V., Maminishkis, A., Barb, J. J., Wang, F., Zhi, C., Sergeev, Y., Chen, W., Edwards, A. O., Stambolian, D., Abecasis, G., Swaroop, A., Munson, P. J., Miller, S. S., S, S. Transcriptome analysis and molecular signature of human retinal pigment epithelium. Hum Mol Genet. 19 (12), 2468-2486 (2010).
- Miller, S. S., Maminishkis, A., Li, R., Adijanto, J. Chapter 184: Phototransduction: RPE transport Retina Phototransduction: RPE transport. Encyclopedia of the Eye. , Elsevier. 2540-2540 (2010).
- Bryant, D. M., Mostov, K. E. From cells to organs: Building polarized tissue. Nature Reviews. Molecular Cell Biology. 9 (11), 887-901 (2008).
- Maminishkis, A., Chen, S., Jalickee, S., Banzon, T., Shi, G., Wang, F. E., Ehalt, T., Hammer, J. A., Miller, S. S. Confluent monolayers of cultured human fetal retinal pigment epithelium exhibit morphology and physiology of native tissue. Invest Ophthalmol Vis Sci. 47, 3612-3624 (2006).
- Shi, G., Maminishkis, A., Banzon, T., Jalickee, S., Li, R., Hammer, J., Miller, S. S. Control of chemokine gradients by the retinal pigment epithelium. Invest Ophthalmol Vis Sci. 49, 4620-4630 (2008).
- Economopoulou, M., Hammer, J., Wang, F. E., Fariss, R., Maminishkis, A., Miller, S. S. Expression, localization, and function of junctional adhesion molecule-C (JAM-C) in human retinal pigment epithelium. Invest Ophthalmol Vis Sci. 50 (3), 1454-1463 (2008).
- Li, R., Maminishkis, A., Banzon, T., Wan, Q., Jalickee, S., Chen, S., Miller, S. S. IFN{gamma} Regulates Retinal Pigment Epithelial Fluid Transport. Am J Physiol Cell Physiol. 297, C1452-C1465 (2009).
- Li, R., Maminishkis, A., Wang, F. E., Miller, S. S. PDGF-C and -D induced proliferation/migration of human RPE is abolished by inflammatory cytokines. Invest Ophthalmol Vis Sci. 48, 5722-5732 (2007).
- Maminishkis, A., Jalickee, S., Blaug, S. A., Rymer, J., Yerxa, B. R., Peterson, W. M., Miller, S. S. The P2Y(2) receptor agonist INS37217 stimulates RPE fluid transport in vitro and retinal reattachment in rat. Invest Ophthalmol Vis Sci. 43, 3555-3566 (2002).
- Wang, F. E., Zhang, C., Maminishkis, A., Dong, L., Zhi, C., Li, R., Zhao, J., Majerciak, V., Gaur, A. B., Chen, S. MicroRNA-204/211 alters epithelial physiology. FASEB J. 24, (2010).
- Adijanto, J., Banzon, T., Jalickee, S., Wang, N. S., Miller, S. S. CO2-induced ion and fluid transport in human retinal pigment epithelium. J Gen Physiol. 133, 603-622 (2009).
- Li, R., Maminishkis, A., Zahn, G., Vossmeyer, D., Miller, S. S. Integrin alpha5beta1 mediates attachment, migration, and proliferation in human retinal pigment epithelium: relevance for proliferative retinal disease. Invest Ophthalmol Vis Sci. 50, 5988-5996 (2009).
- Peterson, W. M., Meggyesy, C., Yu, K., Miller, S. S. Extracellular ATP activates calcium signaling, ion, and fluid transport in retinal pigment epithelium. J Neurosci. 17, 2324-2337 (1997).
- Voloboueva, L. A., Liu, J., Suh, J. H., Ames, B. N., Miller, S. S. R)-alpha-lipoic acid protects retinal pigment epithelial cells from oxidative damage. Invest Ophthalmol Vis Sci. 46, 4302-4310 (2005).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados