É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Acessível usando Arrays LED para Foto Estimulação de Neurônios
Neste Artigo
Resumo
Adulto-nascido neurônios expressando ChR2 pode ser manipulado em preparações fatia eletrofisiológicos, a fim de examinar sua contribuição para a função olfativa de circuitos neurais.
Resumo
Eletrofisiologia fatia padrão tem permitido aos pesquisadores sondar os componentes individuais dos circuitos neurais gravando respostas elétricas de células individuais em resposta a elétrica ou farmacológica 1,2 manipulações. Com a invenção de métodos para controle de neurônios geneticamente opticamente alvo (optogenética), os pesquisadores agora têm um nível sem precedentes de controle sobre grupos específicos de neurônios na preparação fatia padrão. Em particular, fotossensível channelrodopsina-2 (ChR2) permite que os pesquisadores para ativar os neurônios com 3,4 luz. Ao combinar calibração cuidadosa de LED com base em fotoestimulação de ChR2 com eletrofisiologia fatia padrão, somos capazes de sonda com maior detalhe o papel de adulto-nascido interneurônios no bulbo olfativo, o primeiro relé central do sistema olfativo. Usando a expressão viral de ChR2-YFP especificamente no adulto-nascido neurônios, podemos controlar seletivamente jovens adultos-nascido neurônios em um ambiente de mais umd neurônios maduros. Nosso controle óptico usa um sistema simples e barato LED, e vamos mostrar como esse sistema pode ser calibrado para entender como muita luz é necessária para evocar spiking atividade de neurônios individuais. Por isso, lampejos de luz azul pode controlar remotamente o padrão de disparo de ChR2-transduzidas células recém-nascido.
Protocolo
1. Calibração óptico: Power LED de medição
- Anexar uma matriz de LEDs para um dissipador de calor ativa refrigerada por uma ventoinha e apor este aparato LED / dissipador de calor para uma lente colimadora.
- Troque a lâmpada usada em iluminação com LED brightfield / heatsink / fan / aparelho lente. Este aparelho deve ser cuidadosamente posicionado de modo que o feixe colimado LED viaja ao longo de um caminho reto em direção à lente óptica condensador. Verifique se o dissipador de calor / ventilador está devidamente aterrado para um terreno comum do sistema.
- Unidade de matriz LED com uma fonte de alimentação que pode dar pulsos rápidos e quadrado da corrente. Esta fonte de alimentação pode ser controlado por um pulso TTL 5V proveniente de um gerador de pulsos.
- Centro do feixe colimado ao longo do caminho da luz definida entre o diafragma de campo ea lente condensador. Idealmente, o feixe de LED será ligeiramente sobrecarregue o diafragma de campo totalmente aberto. Tipicamente, um feixe mais firmemente colimado LED vai encher esta abertura menos, e vai produzir morpoder e à custa de uniformidade. Em nossa configuração, aumentamos a uniformidade de luz, escolhendo uma lente colimadora que projetam uma imagem ligeiramente ampliada da matriz de LED no seu plano conjugado no diafragma consenser.
- Atingir a iluminação Kohler, concentrando-se o condensador, para que a imagem do diafragma de campo (o diafragma mais próximo da fonte de luz) é focada na câmara de slice (fig. 1). Um tecido de papel fino lente pode agir como uma tela de projeção para visualizar a imagem focalizada do diafragma de campo em outras profundidades.
- Perfurar uma série de furos de diâmetro conhecido em um material opaco. Coloque um desses pequenos furos sobre o sensor óptico de um poder metros. Coloque o medidor de energia no palco exemplar e centro do medidor de energia sobre a imagem focada do diafragma de campo simplesmente movendo o medidor de energia até que dá uma leitura máxima. Apor metros o poder nesta posição.
- Totalmente aberta todas as aberturas (diafragma e Aberturacampo diafragma). Sistematicamente mover a câmara anexada fatia metros / potência em relação ao caminho óptico óptico e calcular a uniformidade de potência óptica dentro da área iluminada. Construir o enredo uniformidade para o seu sistema. Se o microscópio está configurada corretamente com iluminação Kohler centrado em foco o objetivo, a potência máxima deve ser diretamente abaixo do objetivo, e as regiões fora deste foco agora deve receber uma quantidade conhecida de energia de acordo com o enredo uniformidade.
- Para cada tamanho de pinhole, construir uma curva padrão de potência óptica versus superfície pinhole. Ao ajustar a corrente de entrada para a matriz de LED, produzir esta curva em múltiplos níveis de potência e de cada curva de calcular a potência por mm2. Se a matriz de LEDs é para ser usado para correção óptica, certifique-se de introduzir elementos de óptica necessários para remendar (condensadores, pinholes e filtros) para saber a quantidade de luz é transmitido sob iluminação patching.
- Lançando o medidor de potência paraenfrentar o objetivo, calcular a intensidade de iluminação em 470nm quando a lâmpada de mercúrio está ligado.
- Adicionar uma fatia ao vivo para a câmara, e reconstruir as curvas padrão para determinar a potência de luz transmitida através do tecido cerebral de espalhamento.
2. Procedimento corte e Eletrofisiologia
Uma parte: Preparação Slice
- Anestesiar (60 mg / kg cetamina e Xilazina 2mg/kg) e decapitar o mouse. Dissecar o cérebro no líquido cerebral espinhal artificial (ACSF, em mM: 124 NaCl, KCl 3, 1,3 MgSO 4, 26 NaHCO 3, 1,25 NaHPO 4, 20 glicose, 2 CaCl 2; ~ 310mOsm, pH 7,4, quando borbulhou com uma mistura de O2 de 95% e 5% CO 2 5,1), tomando cuidado para não danificar os bulbos olfatórios. Separar os dois hemisférios e colocar em agar com a superfície ventral, mesmo com uma borda (para seções horizontal).
- Cola o ágar e superfície dorsal de cada hemisfério cortical à vibrAtome chuck, e, lentamente, encher a banheira com gelo frio ACSF. Fatia da superfície ventral em 300 seções M, transferindo cada seção para aquecido (34-36 ° C) e ACSF oxigenado, permitindo-lhes recuperar para 30-45 minutos.
Parte B: Medição patch soltas do Threshold para Spike
- Depois de trazer as fatias à temperatura ambiente por 30 minutos, coloque delicadamente uma fatia na câmara de gravação da câmara de microscópio sob perfusão constante de ACSF oxigenado.
Em risco de excessivamente estimulante ChR2 neurônios infectados, a presença de EYFP-ChR2 pode ser confirmado sob epifluorescência (fig. 2) - Puxe eletrodos de vidro em um extrator da pipeta (Sutter P-97). Preencha este eletrodo com ACSF. Quando colocada no banho ACSF a resistência da ponta deve ficar entre 70-10 Mohms.
- Sob iluminação fluorescente, localizar a fatia de um neurônio ChR2-EYFP saudável com morfologia maduro. Também localizar essa soma neurônio sob a ótica patching.
- Com pressão positiva de luz atravessou a ponta do eletrodo, menor o eletrodo de patch para o neurônio identificados fluorescente. Quando o contato da membrana é feita de forma rápida liberação de pressão positiva e aplique uma pequena quantidade e breve de sucção através da ponta. Um selo giga-ohm deve ser feita entre a membrana plasmática e as paredes do eletrodo patch.
- Mesmo que um giga-selo não é formado, se o eletrodo está suficientemente perto de uma atividade dos neurônios fluorescentes spiking deve produzir um potencial campo mensuráveis local. Ativar ChR2 neste neurônio, piscando doses diferentes de luz. Porque a luz da dose é uma função tanto do poder LED e duração, calcular a quantidade de luz que é necessário evocar um potencial de ação em múltiplos poderes e durações (fig. 2b). Também observar o quanto spiking ocorre sob a iluminação de mercúrio da lâmpada.
3. Resultados representativos:
Em nosso microscópio (Olympus BX51WI), o nosso LED é in linha com duas aberturas e uma lente condensador, mantendo assim o caminho óptico original da fábrica instalada lâmpada de arco. Fechando tanto o diafragma de campo e Abertura do diafragma, podemos alcançar contraste brightfield suficientes para gravações de patch-clamp (fig. 1b). Com todos os diafragmas totalmente aberta expomos a fatia ao poder máximo de luz para channelrodopsina ativação (fig. 1a). Em nosso microscópio, essa configuração patching produz luz de densidade que é de aproximadamente três ordens de magnitude menor do que a densidade de campo máxima cheia (4,1 μW / mm 2 versus 6,88 mW / mm 2).
Vemos etiquetagem robusta do adulto-nascido grânulo bulbo olfatório e semanas após a infecção neurônios periglomerular lentiviral de migrar neuroblastos no fluxo migratório rostral (fig. 2) A gravação solta-patch a partir de um único adulto-nascido ChR2-EYFP expressar célula granular indica que a 5 ms na estimulação máximahum alimentação (6,88 mW / mm 2) é suficiente para evocar spiking (fig. 2b). Desde nível de expressão varia entre as células, a quantidade de luz que passa o limiar a espiga vai variar e deve ser descrito estatisticamente para cada tipo de célula de interesse.
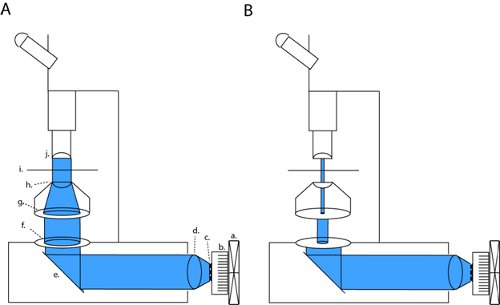
Figura 1. LED de configuração matriz para full-campo fotoestimulação e patch-clamp eletrofisiologia fatia. Para ativar channelrodopsina (ChR2) projetamos um feixe colimado através de aberturas dos fundos aberta e óptica condensador (a). Esta configuração pode ser alterada em óptica de alto contraste patching por fechar completamente o diafragma de campo ea largura da modulação do diafragma de campo (b). Abreviaturas: a. ventilador, dissipador de calor b., c. matriz de LEDs, d. colimação lente, espelho e., f. diafragma de campo, g. diafragma de abertura, h. lente condensadora, i. sample palco, j. objetivo.
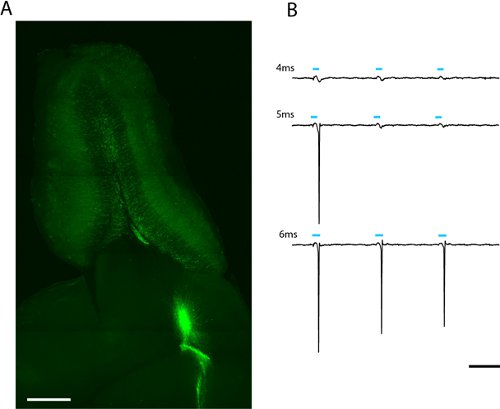
Figura 2. Imagem de uma fatia horizontal de 300μm bulbo olfatório de patch clamp e de todo o campo fotoestimulação (a). Lentivirally células infectadas pelo adulto-nascido grânulo expressar ChR2-EYFP pode ser visto irradiando a partir do núcleo do bulbo olfatório. A luz da dose necessária para evocar spiking pode ser encontrada, aumentando a duração do flash LED (b). O limite para essa célula granular foi 5ms em intensidade LED completa (2.43mW/mm 2). Escala em (a) = 500μm, escala em (b) = 50ms.
Discussão
Nos últimos anos temos visto uma explosão na popularidade de ferramentas para pesquisa em neurociência optogenetic 6. Como resultado, é cada vez mais importante para diminuir a barreira de entrada para laboratórios que desejam começar a usar estas novas ferramentas. Aqui nós descrevemos como conduzir uma adaptação simples e de baixo custo e calibração de um equipamento de patch-clamp convencionais, de modo que ele pode fazer de campo total estimulação óptica de channelrodopsina-expressando neur?...
Divulgações
Não há conflitos de interesse declarados.
Agradecimentos
Este trabalho foi financiado pela empresa de seguros de vida "AG2R-La Mondiale-", Ecole des Neurociências de Paris (PEV), a Agence Nationale de la Recherche "ANR-09-NEUR-004" no quadro de "NEURON ERA-NET "do 7 º PQ programa pela Comissão Europeia, e da Fundação Pasteur. Sebastien Wagner foi apoiado pela Fundação Letten.
Materiais
| Name | Company | Catalog Number | Comments |
| Ketamine | Imalgène 1000 | 100 mg/ml | |
| Xylazine | Rompun | 2% | |
| NaCl | Sigma-Aldrich | S5886 | &nbps; |
| KCl | Sigma-Aldrich | P5405 | |
| MgSO4 | Sigma-Aldrich | M1880 | |
| NaHCO3 | Sigma-Aldrich | S5761 | |
| NaHPO4 | Sigma-Aldrich | S5011 | |
| Glucose | Sigma-Aldrich | G7021 | |
| CaCl2 | Sigma-Aldrich | C7902 | |
| Agarose | Sigma-Aldrich | A9539 | |
| Pipette Puller | Sutter Instrument Co. | P-97 | |
| Glass Capillaries | Harvard Apparatus | GC150T-10 | 1.5 mm O.D./1.17 mm I.D. |
| LED array | Bridgelux | BXRA-C2000 | |
| Collimating lens | Thorlabs Inc. | LEDC1 | 40 mm beam diameter |
| Power supply | A1W Electronik | HKO2800 | 2.8 amp |
| Optical power meter | Thorlabs Inc. | PM 100 | |
| Heatsink | Thermaltake | A1838 | Silent Boost K8 |
| Fan | Thermaltake | A1838 | Silent Boost K8 |
| Vibratome | Leica Microsystems | VT1200S |
Referências
- Nissant, A. Adult neurogenesis promotes synaptic plasticity in the olfactory bulb. Nature Neuroscience. 12, 728-730 (2009).
- Apicella, A. Pyramidal Cells in Piriform Cortex Receive Convergent Input from Distinct Olfactory Bulb Glomeruli. Journal of Neuroscience. 30, 14255-14260 (2010).
- Boyden, E. S. genetically targeted optical control of neural activity. Nature. 8, 1263-1263 (2005).
- Bardy, C. where new inhibitory neurons release neurotransmitters in the adult olfactory bulb. The Journal of Neuroscience. 30, 17023-17034 (2010).
- Grubb, M. S. Functional maturation of the first synapse in olfaction: development and adult neurogenesis. The Journal of neuroscience. 28, 2919-2932 (2008).
- Zhang, F. Circuit-breakers: optical technologies for probing neural signals and systems. Nature reviews. Neuroscience. 8, 577-581 (2007).
- Grossman, N. Multi-site optical excitation using ChR2 and micro-LED array. Journal of neural engineering. 7, 16004-16004 (2010).
- Dhawale, A. K. Non-redundant odor coding by sister mitral cells revealed by light addressable glomeruli in the mouse. Nature neuroscience. 13, 1404-1412 (2010).
- Weick, J. P. Functional control of transplantable human ESC-derived neurons via optogenetic targeting. Stem cells. 28, 2008-2016 (2010).
- Toni, N. Neurons born in the adult dentate gyrus form functional synapses with target cells. Nature Neuroscience. 11, 901-907 (2008).
- Grubb, M. S., Burrone, J. Channelrhodopsin-2 Localised to the Axon Initial Segment. PLoS ONE. 5, e13761-e13761 .
- Tye, K. M. Amygdala circuitry mediating reversible and bidirectional control of anxiety. Nature. 471, 358-362 (2011).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados