É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Construindo um hidrogel de colágeno para a entrega de células-tronco carregado microesferas
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
Um grande obstáculo em terapias com células-tronco atuais é determinar o método mais eficaz para entregar essas células para tecidos do hospedeiro. Aqui, nós descrevemos um método de entrega de quitosana-base que é eficiente e simples na abordagem, ao mesmo tempo permitindo que as células-tronco adiposas para manter a sua multipotency.
Resumo
As células estaminais multipotenciais têm sido mostrados para ser extremamente útil no campo da medicina regenerativa 1-3. No entanto, a fim de utilizar essas células eficazmente para a regeneração de tecidos, um número de variáveis devem ser tidos em conta. Estas variáveis incluem: o volume total e área de superfície do local de implantação, as propriedades mecânicas do tecido e do microambiente do tecido, que inclui a quantidade de vascularização e os componentes da matriz extracelular. Portanto, os materiais que estão sendo utilizados para entregar estas células deve ser biocompatível com uma composição química definida, mantendo uma força mecânica que imita o tecido hospedeiro. Estes materiais também deve ser permeável ao oxigénio e nutrientes para proporcionar um microambiente favorável para as células para anexar e proliferar. A quitosana, um polissacárido catiónico com excelente biocompatibilidade, pode ser facilmente modificada quimicamente e tem uma elevada afinidade para se ligarem a in vivo macromolecules 4-5. A quitosana imita a porção de glicosaminoglicano da matriz extracelular, permitindo-lhe funcionar como um substrato para a migração de adesão celular, e proliferação. Neste estudo, utilizam quitosano na forma de microesferas para entregar células-tronco adiposas (ASC) em uma base de colagénio tridimensional andaime 6. Uma razão de célula-a-microesfera ideal foi determinada com respeito ao tempo de incubação e densidade celular para atingir o número máximo de células que poderiam ser carregados. Uma vez ASC são semeados no microesferas de quitosano (CSM), eles são incorporados em um andaime de colagénio e pode ser mantido em cultura durante períodos prolongados. Em resumo, este estudo fornece um método para entregar precisamente células-tronco dentro de um andaime tridimensional biomaterial.
Protocolo
1. Isolando derivadas de tecido adiposo células-tronco (ASC)
Nota: Todos os procedimentos foram realizados à temperatura ambiente, a menos que indicado de outra forma.
- Isolar adiposo epididimal e perirenal rato e lavar com solução de Hank estéril tamponada de sal (HBSS) contendo 1% de soro fetal bovino (FBS), como descrito anteriormente 6.
- Picar o tecido e transferir 1-2 g em 25 mL de HBSS contendo FBS a 1% para um tubo de 50 mL e centrifugação a 500 g durante 8 minutos à temperatura ambiente.
- Recolher o de flutuação livre camada de tecido adiposo e transferência para 125 mL balão Erlenmeyer e trata-se com 25 mL de colagenase tipo II (200 U / mL) em HBSS durante 45 min a 37 ° C num agitador orbital (125 rpm).
- Cuidadosamente remover a fracção de líquido (abaixo de óleo e da camada adiposo) e filtrar sequencialmente através de um filtro 100-iM e 70 mícrons de nylon de malha. Centrifugar o filtrado a 500 g durante 10 min à temperatura ambiente, aspirar o supernatant, e lavar a pelete duas vezes com 25 ml de HBSS.
- Ressuspender o sedimento de células em 50 mL de meio de crescimento (Meio MesenPRO RS Basal) suplementado com MesenPRO Suplemento de Crescimento RS, antibiótico-antimicótico (100 U / mL de penicilina G, 100 ug / mL de sulfato de estreptomicina, e 0,25 ug / mL Anfotericina B) , e 2 mM de L-glutamina e as células de pipeta em 2 T75 frascos (25 ml balão /).
- Cultura da ASC em um 5% de CO 2 incubadora humidificada a 37 ° C (passagem 2-4 ASC são utilizados para todas as experiências).
2. Preparação de microesferas (CSM)
Nota: Todos os procedimentos foram realizados à temperatura ambiente, a menos que indicado de outra forma.
- CSM são preparados por um processo de emulsificação de água-em-óleo, juntamente com uma técnica de coacervação iónica usando o nosso protocolo anterior 6. Emulsionar uma solução aquosa de quitosano (6 mL de 3% w / v de quitosano em ácido acético 0,5 M) em 100 ml de uma mistura de fase de óleo consistindo de sojaóleo, n-octanol (1:2 v / v) e 5% de sorbitano-mono-oleato de emulsionante (Span 80), utilizando sobrecarga (1700 rpm) e agitação magnética (1000 rpm), simultaneamente, em direcções opostas. Este método de dupla resultará uma mistura que micelas formadas no início antes de reticulação ocorre podem permanecer em solução e não assentam no fundo. Além disso, a barra de agitação magnética SIDA em DE-agregação de quitosano durante micela formação e rigidization.
- A mistura é agitada continuamente durante aproximadamente 1 hora até uma emulsão de água-em-óleo estável é obtido. Reticulação iónica é iniciada com a adição de 1,5 mL de 1% de hidróxido de w / v de potássio em n-octanol min a cada 15 durante 4 h (24 ml no total).
- Depois de se completar a reacção de reticulação, lentamente decantar a fase de óleo da mistura contendo CSM e imediatamente adicionar as esferas a 100 mL de acetona. Lave as esferas com acetona até que a fase de óleo é completamente removido.
- Secam-se as esferas recuperados em um exsicador de vácuo e analyze inalterado. O tamanho médio de partícula CSM, área de superfície por miligrama e da unidade de volume cúbico foi determinada utilizando analisador de tamanho de partícula.
- Para as experiências subsequentes, lavar CSM três vezes com água estéril para remover os sais residuais e esterilizar com álcool absoluto.
3. Determinando o número de grupos amino livres no CSM
Nota: Todos os procedimentos foram realizados à temperatura ambiente, a menos que indicado de outra forma.
- Determinar o número de grupos amino livres presentes na CSM após reticulação iónica usando o ensaio de ácido benzenossulfónico trinitro (TNBS), de Bubins e Ofner 7. Incubar 5 mg de microesferas com 1 mL de 0,5% de solução de TNBS em um tubo de vidro de 50 mL durante 4 h, a 40 ° C e hidrolisar com a adição de 3 mL de HCl 6N a 60 ° C durante 2h.
- Arrefecer as amostras à temperatura ambiente, e extrair os TNBS livres por adição de 5 mL de água desionizada e 10 mL de acetatoéter.
- Aquecer uma alíquota de 5 ml da fase aquosa para 40 ° C num banho de água durante 15 min para evaporar qualquer éter residual, arrefecer até à temperatura ambiente, e diluir com 15 mL de água.
- Medir a absorvância a 345 nm com um espectrofotómetro com solução TNBS sem quitosana como em branco eo quitosano utilizado para a preparação CSM para determinar o número total de grupos amino. Estimar o número de grupos amino livres da MSC em relação ao quitosano.
4. Carregando ASC no CSM
Nota: Todos os procedimentos foram realizados à temperatura ambiente, a menos que indicado de outra forma.
- Equilibrar 5 mg de CSM esterilizado de seção 2,5 em HBSS estéril durante a noite e adicionar um poro tamanho 8 mícrons membrana inserção placa de cultura (24-bem placa).
- Após o CSM se estabeleceram para a membrana, aspirar cuidadosamente os HBSS e adicionam-se 300 uL de meio de crescimento para o interior da inserção e 700 uL de meio de crescimento para the fora da pastilha.
- Ressuspender o ASC na concentração apropriada (1 x 10 4 a 4 x 10 4) em 200 uL de meio de crescimento e de sementes ao longo do CSM dentro do inserto placa de cultura. O volume final de meio de cultura dentro da inserção, após a semeadura, é de 500 uL.
- Incubar a seeded ASC à CSM por 24 h em um 5% de CO 2 incubadora humidificada a 37 ° C.
5. Determinação da porcentagem de ASC Carregando e viabilidade celular em CSM
Nota: Todos os procedimentos foram realizados à temperatura ambiente, a menos que indicado de outra forma.
- Após a incubação, recolher o CSM ASC-carregado num tubo de microcentrífuga de 1,5 ml estéril, sem perturbar as células que migraram para a membrana de inserção.
- Remover o meio residual e adicionar 250 uL de meio de crescimento fresco para o tubo.
- Para cada tubo 25 uL de MTT [3 - (4,5-dimethylthiozole-2-il) -2,5-difeniltetrazólio]solução (5 mg / mL) e incubar durante 4 h em um 5% de CO 2 incubadora humidificada a 37 ° C.
- Após a incubação, o meio de remover, adicionar 250 uL de sulfóxido de dimetilo, e vórtice a mistura durante 2-5 minutos para solubilizar o formazan complexo.
- Centrifugar a CSM em 2700 X g durante 5 min, e determinar a absorvância sobrenadante medida a 570 nm 630 nm, utilizando como referência.
- Determinar o número de células associado com o MSC em relação ao valor de absorvância obtidos a partir de um número conhecido de ASC viável.
6. Caracterizando ASC-CSM-incorporado gel de colágeno
Nota: Todos os procedimentos foram realizados à temperatura ambiente, a menos que indicado de outra forma.
- Mistura ASC-carregado CSM (5 mg contendo ≈ 2 x 10 4 células) com colagénio de tipo 1 (7,5 mg / mL), extraído a partir de tendão da cauda de rato de acordo com o método de Bornstein 8 e fibrilam depois de ajustar o pH para 6,8 utilizando 2 N de NaOH.
- Adicionar a mistura de colagénio-ASC-CSM fibrilada para uma placa de 12 poços e incubar durante 30 min a uma em 5% de CO 2 incubadora humidificada a 37 ° C.
- Depois de fibrilação completa, incubar os géis de colagénio-ASC-CSM-se até 14 dias, em um 5% de CO 2 incubadora humidificada a 37 ° C.
- Libertação e migração de células de CSM no gel foram observadas utilizando técnicas de microscopia padrão.
7. Os resultados representativos
No presente estudo, nós desenvolvemos uma estratégia in vitro para proporcionar células-tronco de microesferas de quitosano (CSM) em um gel de colagénio andaime. CSM poroso de tamanho uniforme (175-225 um de diâmetro) e composição foram preparados e utilizados como transportadores de células (Figura 2). Após a incubação com a ASC CSM, as células ligado a uma concentração de 2 x 10 4 cells/5mg de MSC. As células foram capazes de espalhar sobre a microesfera, enquanto estende filopodiosnas fendas porosas do microesfera (Figura 3). Uma vez que a célula CSM-carregado foram misturadas com o gel de colagénio, as células imediatamente começou a migrar para os géis (Figura 4).
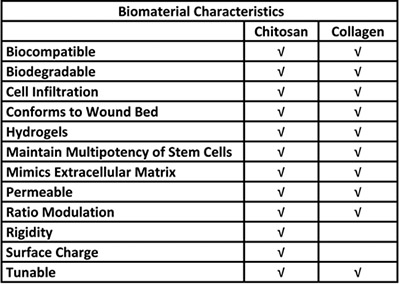
Tabela 1. Vantagens biológicos para o uso de quitosano e de colagénio em um sistema de entrega de células estaminais.
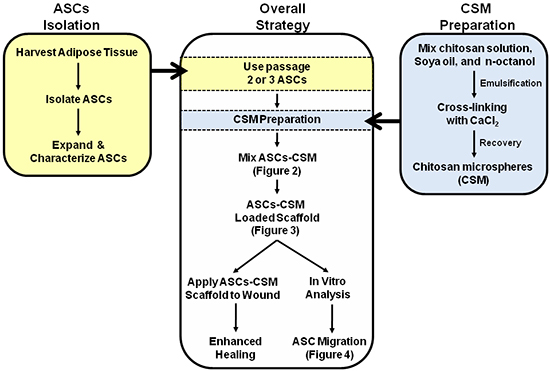
Figura 1. Esquemático que representa a estratégia geral para a utilização dupla de ASC-CSM andaimes de colagénio carregados. Figuras 2, 3 e 4 são anotadas no interior da esquemática para auxiliar com a interpretação das imagens.
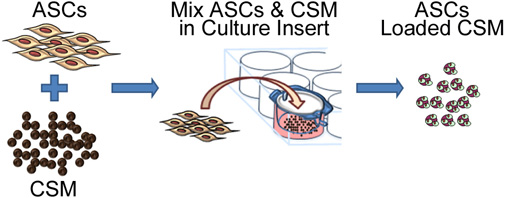
Figura 2. Representação esquemática representando o processo de semear as células estaminais para quitosano. O process envolve co-cultura com ASC CSM em um 8 - mM tamanho dos poros da membrana de inserção placa de cultura. Após 24 horas, as microesferas são removidos do inserto e estão prontos para incorporação numa matriz biomaterial.
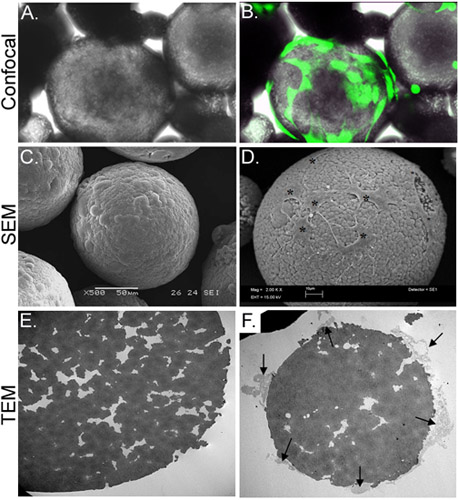
Figura 3. Caracterização morfológica de CSM-carregado com ASC. O painel A representa uma micrografia de luz de ASC-carregado CSM, enquanto o painel B mostra o mesmo campo de visão, sobreposto com uma imagem obtida por microscopia de fluorescência confocal. ASC foram pré-carregado com calceína AM (verde). O painel C mostra uma imagem de uma imagem SEM de uma microesfera descarregado, enquanto o painel D mostra células carregadas no microesfera (asteriscos). A imagem MET em E painel mostra uma secção transversal de uma microesfera descarregado. Uma multidão de poros e fendas estão localizados ao longo da microesfera. Painel F mostra uma microesfera transversalmente com as células (setas) ligado e estendendo filopodia na CREvícios. Ampliações originais: A & B = 70X; C = 500x, D = 2.000 x; E & F = 2.500 x.

Figura 4. A migração de ASC a partir do CSM para o colagénio tridimensional andaime. Os painéis A e B representam a CSM com células migrando do microesfera e para dentro da matriz de colagénio no dia 3 (A setas,). O painel B mostra uma cultura semelhante depois de 12 dias. Microscopia electrónica de transmissão (TEM) imagens são representadas em C, D e E. Os asteriscos em C e D mostram uma microesfera que tem sido transversalmente com as células de migrar para longe da microesfera (setas). Maior ampliação de painel D está representado na painel E, e mostra filopodia célula ligado às fibrilas de colagénio (inserção). Aumento original: A & B = 100x; C & D = 6.000 x; E = 20.000 x, inset = 150.000 x.
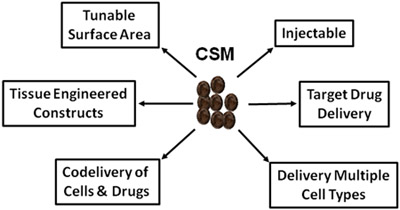
Figura 5.Esquema representando os usos vastas CSM na medicina regenerativa e entrega da droga.
Access restricted. Please log in or start a trial to view this content.
Discussão
Um grande obstáculo na terapia de células-tronco base é o desenvolvimento de métodos eficientes para a entrega de células para as regiões especificadas para a reparação. Devido ao paciente a variabilidade do paciente, o tipo de tecido, tamanho da lesão e da profundidade, a metodologia de células estaminais entrega deve ser determinada numa base de caso-a-caso. Embora a incorporação de células-tronco dentro de uma matriz e entregá-los para o local da ferida parece ser uma abordagem lógico seguinte para a e...
Access restricted. Please log in or start a trial to view this content.
Divulgações
Não há interesses conflitantes financeiros existem.
Alerta
As opiniões ou afirmações contidas neste documento são as opiniões pessoais dos autores e não devem ser interpretadas como oficial ou refletindo as opiniões do Departamento de Defesa ou o Governo dos EUA. Os autores são funcionários do governo dos EUA, e este trabalho foi elaborado como parte das suas funções oficiais. Todo o trabalho foi apoiado pelo EUA Pesquisa Médica do Exército e do Comando de Material. Este estudo foi realizado ao abrigo de um protocolo revisto e aprovado pelo Comitê de Ética Médica EUA Exército e do Comando de Material Conselho de Revisão Institucional, e de acordo com o protocolo aprovado.
Agradecimentos
DOZ é apoiado por uma subvenção concedida à Fundação de Genebra. SN foi apoiado por uma bolsa pós-doutorado da Iniciativa Engenharia de Tecidos Pittsburgh.
Access restricted. Please log in or start a trial to view this content.
Materiais
| Name | Company | Catalog Number | Comments |
| Nome do reagente / equipamentos | Companhia | Número de catálogo | Comentários |
| Hanks BalancedSalt Solução (HBSS) | Gibco | 14175 | Consumível |
| Soro Fetal Bovino | Hyclone | SH30071.03 | Consumível |
| Colagenase do Tipo II | Sigma-Aldrich | C6685 | Consumível |
| 70-iM de nylon de malha de filtro | BD Biosciences | 352350 | Consumível |
| 100-iM de nylon de malha de filtro | BD Biosciences | 352360 | Consumível |
| MesenPRO Sistema Meio de Crescimento | Invitrogen | 12746-012 | Consumível |
| L-glutamina | Gibco | 25030 | Consumível |
| T75 frasco de cultura de tecidos | BD Biosciences | 137787 | Consumível |
| Chitosan | Sigma-Aldrich | 448869 | Consumível |
| Ácido Acético | Sigma-Aldrich | 320099 | Consumível |
| N-octanol | Acros Organics | 150630025 | Consumível |
| Sorbitano-mono-oleato | Sigma-Aldrich | S6760 | Consumível |
| Hidróxido de Potássio | Sigma-Aldrich | P1767 | Consumível |
| Acetona | Fisher Scientific | L-4859 | Consumível |
| Etanol | Sigma-Aldrich | 270741 | Consumível |
| Trinitro benzenossulfónico | Sigma-Aldrich | P2297 | Consumível |
| Ácido clorídrico | Sigma-Aldrich | 320331 | Consumível |
| Éter etílico | Sigma-Aldrich | 472-484 | Consumível |
| 8 m de tecido Placa Insere Cultura | BD Biosciences | 353097 | Consumível |
| 1,5 ml tubos de microcentrífuga | Pescador | 05-408-129 | Consumível |
| Reagente MTT | Invitrogen | M6494 | Consumível |
| Sulfóxido de dimetilo | Sigma-Aldrich | D8779 | Consumível |
| Qtracker celular Labeling Kit (Q rastreador 655) | Sondas moleculares | Q2502PMP | Consumível |
| Colágeno tipo 1 | Travigen | 3447-020-01 | Consumível |
| Hidróxido de Sódio | Sigma-Aldrich | S8045 | Consumível |
| 12-Bem Cultura Pratos Tecido | BD Biosciences | 353043 | Consumível |
| Centrifugar | Eppendorf | 5417R | Equipamento |
| Orbital Shaker | New Brunswick Scienctific | C24 | Equipamento |
| Incubadora de CO umidificado com Air-5 2% | Thermo Scientific | Modelo 370 | Equipamento |
| Agitador | IKA | Visc6000 | Equipamento |
| Agitador Magnético | Corning | PC-210 | Equipamento |
| Exsicador de vácuo | - | - | Equipamento |
| Analisador de Tamanho de Partícula | Malvern | STP2000 Spraytec | Equipamento |
| Banho de água | Fisher Scientific | Isotemp210 | Equipamento |
| Espectrofotômetro | Beckman | Beckman Coulter Espectrofotômetro DU800UV/Visible | Equipamento |
| Vórtice | Diagger | 3030a | Equipamento |
| Leitora | Molecular Devices | Spectramax M2 | Equipamento |
| Luz / microscópio de fluorescência | Olimpo | IX71 | Equipamento |
| Microscópio confocal | Olimpo | FV-500 Laser Scanning microscópio confocal | Equipamento |
| Microscópio Eletrônico de Varredura | Carl Zeiss MicroImaging | Leo 435 VP | Equipamento |
| Microscópio eletrônico de transmissão | JEOL | JEOL 1230 | Equipamento |
Referências
- Krampera, M. Mesenchymal stem cells for bone, cartilage, tendon and skeletal muscle repair. Bone. 39, 678-683 (2006).
- Patrick, C. W. Tissue engineering strategies for adipose tissue repair. Anat. Rec. 263, 361-366 (2001).
- Pountos, I., Giannoudis, P. V. Biology of mesenchymal stem cells. Injury. 36, Suppl 3. S8-S12 (2005).
- Kim, I. Y. Chitosan and its derivatives for tissue engineering applications. Biotechnol. Adv. 26, 1-21 (2008).
- Shi, C. Therapeutic potential of chitosan and its derivatives in regenerative medicine. J. Surg. Res. 133, 185-192 (2006).
- Natesan, S. Adipose-derived stem cell delivery into collagen gels using chitosan microspheres. Tissue Eng. Part. A. 16, 1369-1384 (2010).
- Bubnis, W. A., Ofner, C. M. 3rd The determination of epsilon-amino groups in soluble and poorly soluble proteinaceous materials by a spectrophotometric method using trinitrobenzenesulfonic acid. Anal. Biochem. 207, 129-133 (1992).
- Bornstein, M. B. Reconstituted rattail collagen used as substrate for tissue cultures on coverslips in Maximow slides and roller tubes. Lab Invest. 7, 134-137 (1958).
- Benoit, D. S. Integrin-linked kinase production prevents anoikis in human mesenchymal stem cells. J. Biomed. Mater. Res. A. 81, 259-268 (2007).
- Nuttelman, C. R., Tripodi, M. C., Anseth, K. S. Synthetic hydrogel niches that promote hMSC viability. Matrix Biol. 24, 208-218 (2005).
- Shanmuganathan, S. Preparation and characterization of chitosan microspheres for doxycycline delivery. Carbohydr. Polym. 73, 201-211 (2008).
- Haque, T., Chen, H., Ouyang, W., Martoni, C., Lawuyi, B., Urbanska, A., Prakash, S. Investigation of a new microcapsule membrane combining alginate, chitosan, polyethylene glycol and poly-L-lysine for cell transplantation applications. Int. J. Artif. Organs. 28, 631-637 (2005).
- Goren, A., Dahan, N., Goren, E., Baruch, L., Machluf, M. Encapsulated human mesenchymal stem cells: a unique hypoimmunogenic platform for long-term cellular therapy. FASEB J. 24, 22-31 (2010).
- Zielinski, B. A., Aebischer, P. Chitosan as a matrix for mammalian cell encapsulation. Biomaterials. 15, 1049-1056 (1994).
- Girandon, L., Kregar-Velikonja, N., Božikov, K., Barliç, A. In vitro Models for Adipose Tissue Engineering with Adipose-Derived Stem Cells Using Different Scaffolds of Natural Origin. Folia Biol. (Praha). 57, 47-56 (2011).
- Baruch, L., Machluf, M. Alginate-chitosan complex coacervation for cell encapsulation: effect on mechanical properties and on long-term viability. Biopolymers. 82, 570-579 (2006).
- Wei, Y., Gong, K., Zheng, Z., Wang, A., Ao, Q., Gong, Y., Zhang, X. Chitosan/silk fibroin-based tissue-engineered graft seeded with adipose-derived stem cells enhances nerve regeneration in a rat model. J. Mater. Sci. Mater. Med. , (2011).
- Wang, Q., Jamal, S., Detamore, M. S., Berkland, C. PLGA-chitosan/PLGA-alginate nanoparticle blends as biodegradable colloidal gels for seeding human umbilical cord mesenchymal stem cells. J. Biomed. Mater. Res. A. 96, 520-527 (2011).
- Alves da Silva, M. L., Martins, A., Costa-Pinto, A. R., Correlo, V. M., Sol, P., Bhattacharya, M., Faria, S., Reis, R. L., Neves, N. M. Chondrogenic differentiation of human bone marrow mesenchymal stem cells in chitosan-based scaffolds using a flow-perfusion bioreactor. J. Tissue Eng. Regen. Med. , (2010).
- Kang, Y. M., Lee, B. N., Ko, J. H., Kim, G. H., Kang, K. N., Kim da, Y., Kim, J. H., Park, Y. H., Chun, H. J., Kim, C. H., Kim, M. S. In vivo biocompatibility study of electrospun chitosan microfiber for tissue engineering. Int. J. Mol. Sci. 11, 4140-4148 (2010).
- Bozkurt, G., Mothe, A. J., Zahir, T., Kim, H., Shoichet, M. S., Tator, C. H. Chitosan channels containing spinal cord-derived stem/progenitor cells for repair of subacute spinal cord injury in the rat. Neurosurgery. 67, 1733-1744 (2010).
- Leipzig, N. D., Wylie, R. G., Kim, H., Shoichet, M. S. Differentiation of neural stem cells in three-dimensional growth factor-immobilized chitosan hydrogel scaffolds. Biomaterials. 32, 57-64 (2011).
- Altman, A. M., Gupta, V., RÃos, C. N., Alt, E. U., Mathur, A. B. Adhesion, migration and mechanics of human adipose-tissue-derived stem cells on silk fibroin-chitosan matrix. Acta Biomater. 6, 1388-1397 (2010).
- Altman, A. M., Yan, Y., Matthias, N., Bai, X., Rios, C., Mathur, A. B., Song, Y. H., Alt, E. U. IFATS collection: Human adipose-derived stem cells seeded on a silk fibroin-chitosan scaffold enhance wound repair in a murine soft tissue injury model. Stem Cells. 27, 250-258 (2009).
- Machado, C. B., Ventura, J. M., Lemos, A. F., Ferreira, J. M., Leite, M. F., Goes, A. M. 3D chitosan-gelatin-chondroitin porous scaffold improves osteogenic differentiation of mesenchymal stem cells. Biomed. Mater. 2, 124-131 (2007).
Access restricted. Please log in or start a trial to view this content.
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados