Method Article
Visualização de Propriocepção em
Neste Artigo
Resumo
Um método para immunostain e visualizar os órgãos chordotonal em larvas e pupas de Drosophila melanogaster É descrito.
Resumo
Propriocepção é a capacidade para detectar o movimento, ou posição, das partes do corpo por responder a estímulos que surgem dentro do corpo. Em drosófilas e outros insetos propriocepção é fornecida por órgãos sensoriais especializados denominados órgãos chordotonal (chos) 2. Tal como muitos outros órgãos em Drosophila, CHOS desenvolver duas vezes durante o ciclo de vida da mosca. Primeiro, os Chos larvas se desenvolvem durante a embriogênese. Em seguida, os Chos adultos começam a se desenvolver nos discos imaginais de larvas e continuar a diferenciar durante a metamorfose.
O desenvolvimento de Chos larvais durante a embriogênese tem sido extensivamente estudada 10,11,13,15,16. A peça central de cada Cho é uma unidade sensorial composto de um neurônio e uma célula scolopale. A unidade sensorial é esticado entre dois tipos de células acessórias que se ligam à cutícula através de células especializadas de fixação epidérmicas 1,9,14. Quando uma mosca movimentos larva, o deslocamento relativo do ecélulas de fixação pidermal conduz ao alongamento da unidade sensorial e abertura consequente específicos transientes receptores potenciais vanilóides (TRPV) canais no segmento exterior do dendrite 8,12. O sinal de eliciada é então transferido para o circuito gerador central padrão locomotora no sistema nervoso central.
CHOs múltiplas têm sido descritas na mosca adulta 7. Estes estão localizados perto das articulações dos apêndices mosca adulta (patas, asas e cabrestos) e no tórax e abdômen. Além disso, várias centenas de CHOs formam colectivamente o órgão de Johnston na antena adulto que acústico transduzir a energia mecânica 3,5,17,4.
Em contraste com o amplo conhecimento sobre o desenvolvimento de CHOs em estádios de desenvolvimento embrionário, muito pouco se sabe sobre a morfologia destes órgãos durante estádios larvares. Além disso, com a excepção de CHOs femorais 18 e do órgão de Johnston, o nosso conhege sobre o desenvolvimento e estrutura de CHOs na mosca adulta é muito fragmentária.
Aqui nós descrevemos um método para a coloração e visualização de CHOs em larvas de terceiro ínstar e pupas. Este método pode ser aplicado em conjunto com ferramentas genéticas para caracterizar melhor a morfologia e compreender o desenvolvimento das várias CHOs em tempo real.
Protocolo
Antes de começar
- Crescer as culturas mosca desejados. Manter os frascos uncrowded (aproximadamente 30 moscas por 50 frasco ml). Deixe as moscas depositam ovos para apenas um dia em cada frasco. Isto irá fornecer as larvas abastecimento alimentar suficiente e permitir-lhes atingir o tamanho máximo antes rastejando para fora do alimento. Mantenha os frascos dentro da temperatura adequada até larvas de terceiro estádio começam a vagar na parede do frasco.
- Preparar um estoque fresca de solução salina tamponada com fosfato (PBS) e PBT (0,1% de Tween em PBS). Manter 10 ml de PBS em gelo.
- Preparar 1-5 ml de fixador fresco (formaldeído a 4% em PBT) e mantê-lo em gelo. Usamos formaldeído 37-38% engarrafada como uma solução estoque.
1. Dissecção e fixação de larvas de terceiro estádio
- Escolha um errante larva de terceiro instar a partir da parede do frasco e colocá-la numa queda de 50 ul de PBS gelado sobre uma placa de dissecação Sylgard (feita de elastómero 184 Sylgard kit de silicone, Dow Corning Corporation, em umatecido prato de cultura).
- Mantenha a larva lado, dorsal para cima, perto dos ganchos da boca, utilizando fórceps finos (Dumont # 5 fórceps), e ater um pino de insectos (minutien, 0,1 mm, de aço inoxidável), através do cérebro a larva da.
- Agarre a extremidade posterior da larva com a pinça, puxe-a delicadamente e esticar a larva suavemente longitudinalmente. Fure outro pino inseto entre os dois espiráculos posteriores.
- Tesoura de mola usando cortar duas incisões horizontais na parede do corpo (perpendicular ao eixo anterior-posterior), perto de os pinos anterior e posterior.
- Usando as tesouras de mola cortar a parede do corpo larval ao longo da linha média dorsal a partir do anterior à incisão posterior.
- Remover órgãos internos (intestino, glândulas salivares, túbulos de Malpighi, etc) ea traquéia usando uma pinça fina. Lavar suavemente uma vez ou duas vezes com PBS.
- Pegue os dois retalhos de parede do corpo com pinças, esticar-los e fixá-los à placa através de dois pinos de insetos para cada lado.
- Remover o PBS e adicionar 50 uL de solução de fixação (formaldeído a 4% em PBT). Incubar 20 minutos à temperatura ambiente.
- Remover o fixador. Lavar duas vezes com PBS. Retire os alfinetes de insetos. Usando uma tesoura de mola cortou a cabeça ea cauda larval deixando um filete retangular. Transferir o tecido fixado a um tubo de Eppendorf, refrigerada com PBS.
- Quando um número suficiente de larvas são fixos, pode-se continuar directamente para a coloração de anticorpos. Se a coloração imediata não é desejado, as larvas fixa deverá ser lavado 3 vezes, 5 minutos cada, com etanol a 95% e armazenadas em etanol a 95% a -20 ° C.
2. Dissecção e Fixação de pupas
Parte I
- Atender aos frascos como para a fixação das larvas, até larvas de terceiro estádio começam a pupariate. Examinar os tubos todos os larvas hora e marca que pupariated. Permitir que a pupas marcada para desenvolver 30-40 horas a 24 ° C, ou 24-27 horas a 29 ° C.
- Utilizando uma pinça fina escolher 20-30 pupas de thidade e adequado e coloque-os num prato de porcelana escura multi-bem de dissecação. Tenha cuidado para não danificar os tecidos de interesse.
- Extraia o pupas do caso pupal. Comece descascando o opérculo e continue até a pupa é gratuito. Coloque a pupa em um poço cheio de PBT. Continue a extrair todos pupas. Passos 2,4-2,6 deve ser feito em pequenos lotes de cinco pupas de cada vez.
- Coloque cinco pupas sobre uma superfície plana entre os poços do prato de dissecação. Usando uma faca dissecção micro corte da ponta da cabeça e da ponta posterior do abdómen (alternativamente, é possível usar dois pares de pinças para rasgar furos em ambas as extremidades de pupas).
- Mantenha a pupa no local usando fórceps finos e utilizar uma seringa de 1 mL para lavar os órgãos internos do pupa, por injecção de PBT através da abertura anterior.
- Lava-se a dissecados brevemente pupa por imersão em um poço cheio com PBS e movê-lo para o fixador frio em um tubo de Eppendorf mantido em gelo.
- Incubar durante uma noite (ON) a 4 ° C.
Parte II
- Descarte o fixador e lavar as pupas três vezes, 5 minutos cada, com PBT. Mantenha a pupas lavado em gelo.
- Encher dois poços do prato de dissecação com PBT. Usando um polietileno Pasteur pupas transferência pipeta vários a um dos poços.
- Mover uma pupa de cada vez para o segundo poço. O uso de dois pares de pinças com pontas afiadas perfeitamente alinhadas, retire a cutícula transparente pupa da asa: assegurar a pupa para o fundo do poço, utilizando um par de pinças, e suavemente rasgar a cutícula usando o segundo par de pinças. Uma vez que a cutícula estiver rasgado, retire-a da asa. Tenha cuidado para não desconectar a asa da pupa. Depois de descascar a cutícula da lâmina asa, continue descascando a cutícula da dobradiça asa (onde os Chos asas estão localizados).
- Depois de descascar a cutícula asa, uma pode tentar descascando a cutícula perna de uma maneira semelhante.Muitas pernas são susceptíveis de serem perdidos no processo, mas, apesar do baixo rendimento, esta etapa é altamente recomendável uma vez que melhora a coloração de Chos perna. Os Chos do haltere e abdômen pode ser visualizado sem mais descascando a cutícula.
- Coloque a 'desenrolada' pupa em um tubo de Eppendorf preenchido com metanol e manter à temperatura ambiente. Continuar descascando a cutícula de toda a pupas, e adicioná-los ao mesmo tubo. Pelo menos 10 pupas bem descascadas devem ser coletadas para cada coloração.
- Remover o metanol e lava-se três vezes, 5 minutos cada, com etanol a 95%. Pupas fixo pode ser mantida por longos períodos de tempo em etanol a 95% a -20 ° C.
3. A imunocoloração de larvas e pupas
- Lavar o tecido fixado com PBT três vezes, 30 minutos cada, à temperatura ambiente. As larvas podem ser lavados com agitação suave sobre uma placa rotativa. As pupas são lavados sem agitação.
- Substituir o PBT com tampão de bloqueio (PBT + 5% de nsoro de cabra ormal) e incubar ON a 4 ° C.
- Remover o tampão de bloqueio e incubar com anticorpos primários (diluído em tampão de bloqueio) ON a 4 ° C.
- Lavar quatro vezes com PBT como descrito no passo 3.1.
- Remover o PBT e incubar com anticorpos secundários (diluído em tampão de bloqueio) ON a 4 ° C.
- Lavar duas vezes com PBT e uma vez com PBS como descrito no passo 3.1.
- Substituir o PBS com meio de montagem (Dako Médio fluorescente de montagem (Dako Cytomation, Glostrup, Dinamarca) e incubar a 4 ° C em.
4. Montagem de larvas
- As larvas são montados sobre uma lâmina de microscópio em uma gota de meios de montagem com a sua cutícula virada para baixo e musculatura da parede do corpo voltada para cima. Coloque uma pequena gota de meio de montagem em uma lamínula limpa e usá-lo para cobrir a preparação. Não aplique pressão sobre as larvas montado.
5. Montagem de pupas
- Preparar duas lâminas de microscópiocom uma gota de meio de montagem, uma para a dissecção ea segunda para a montagem.
- Coloque pupas vários sobre uma das lâminas.
- Usando uma tesoura de mola remover a cabeça ea parte posterior do abdômen.
- Separa-se a meia dorsal do tórax a partir da metade ventral cortando entre as asas e as pernas.
- Colocar as partes do corpo dissecados do pupa sobre a segunda lâmina de microscópio em uma gota de solução de montagem. Certifique-se de que as asas e as pernas estão esticadas para fora e tentar minimizar sobreposição de tecidos, tanto quanto possível.
- Colocar uma gota de meio de montagem numa lamela e colocá-la sobre a amostra. Não aplique pressão sobre a amostra montada.
6. Os resultados representativos
Um exemplo de imuno-coradas CHOs de larva de terceiro instar é mostrado na Figura 1. Este exemplo mostra um segmento muito bem esticada abdominal em que sete dos oito CHOs são claramente visíveis. Os neurônios são laboratóriomodelada com MAb22C10 (1:20, obtido a partir do Banco Developmental Hybridoma Estudos da Universidade de Iowa); a tampa, ligamento, tampão de fixação e as células de fixação do ligamento são rotulados com anti-αTub85E (1:10, Klein et ai,. 2010). Os anticorpos secundários para coloração fluorescente foram Cy3, ou Cy5-conjugado anti-mouse/rabbit (1:200, Jackson Immunoresearch Laboratories). As amostras foram visualizadas por microscopia confocal (LSM 510, Zeiss).
Um aglomerado de CHOs asa na veia ventral radial de um 35 hr de idade pupa é mostrado na Figura 2.

A Figura 1 (A) ilustração esquemática dos seis tipos de células que constituem um órgão Ch único:. De fixação tampa (CA), tampão (C), scolopale (S), neurónio (N), o ligamento (L) e do ligamento de fixação (LA ). O órgão de LCh5, em que cinco CHOs estão agrupados, é esticado em todo o grupo de músculos laterais transversais (LT1-4). O músculo lateral longitudinal (LL1), ventral músculos longitudinais (VL1-4) e do músculo oblíquo lateral (LO1) também são ilustradas. Células do tendão são ilustrados como esferas marrons (tirado de Klein et al., 2010). (B) Um segmento abdominal de uma larva de terceiro instar visto em uma ampliação de 10x. Sete dos oito CHOs presentes em cada segmento abdominal são evidentes: cinco órgãos laterais que juntos formam o órgão pentascolopidial (LCh5), um único órgão lateral (LCh1) e um de dois CHOs ventral (VChB). Os neurónios (N) dos CHOs são rotulados com o marcador neuronal MAb 22C10 (vermelho). O ligamento (L), tampão (C) e as células de fixação (LA, CA) são marcadas com anti-αTub-85E (azul). As células do tampão e do ligamento são adicionalmente marcado com um repórter da GFP específica CHO-abrigando um elemento regulador do locus dei (Nachman et ai, dados não publicados).
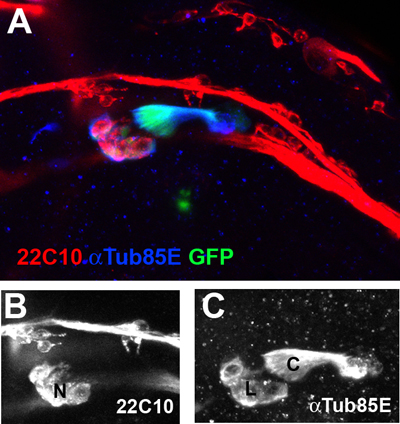
Figura 2. Os órgãos asa chordotonal na veia ventral radial são vistos com uma ampliação de 40x. Os neurónios (N) são marcados com os 22C10 marcador neuronal (vermelho, B). O ligamento (L) e tampa (C) as células são co-marcadas com anticorpos anti-αTub85E (azul, C) e um repórter específica CHO-GFP transgene (Nachman et ai, dados não publicados).
Discussão
O protocolo descrito neste vídeo oferece uma maneira de visualizar Chos proprioceptivos durante as fases de larva e pupa. Estudos sobre a estrutura eo desenvolvimento de Chos proprioceptivos têm sido até agora restrita principalmente para estágios embrionários e larvais discos imaginais. Assim, muitos aspectos de fases posteriores de desenvolvimento, de Chos tanto de larvas e adultos, são ainda desconhecidas. O protocolo descrito, em combinação com comuns ferramentas genéticas em Drosophila, pode ser utilizado para identificar e estudar novos genes e vias que desempenham um papel em fases posteriores do desenvolvimento CHOs. Este protocolo foi optimizado para a visualização de CHO, mas pode ser adaptado para a coloração de outros tecidos, tais como as asas pupa 6.
Divulgações
Não há conflitos de interesse declarados.
Agradecimentos
Os autores gostariam de agradecer ao Banco do Desenvolvimento de Estudos Hybridoma da Universidade de Iowa para enviar-nos anticorpos. Este trabalho foi suportado por uma concessão (n º 29/08) de The Science Foundation Israel. AS também é apoiado por uma bolsa de pesquisa da DFG (Deutsche Forschungsgemeinschaft).
Materiais
| Name | Company | Catalog Number | Comments |
| Nome do reagente / ferramenta | Companhia | Número de catálogo | Comentários |
| Dumont # 5 (ou # 55) fórceps, biologie ponta | FST | 11252-20 ou 11252-10 (Ou pinça semelhantes) | |
| Austerlitz aço inoxidável pinos de insetos, minutiens 0,1 mm | Roboz Co Instrumento cirúrgico | RS-6083-10 | |
| Sylgard 184 kit elastômero de silicone | Dow Corning Corporation | 240.4019862 | |
| Vannas micro tesoura (em linha reta, 7,5 cm de lâmina, 3mm) | AS Mdeizintechnik GmbH | 11-590-00 | Tesoura Primavera Vannas com especificações idênticas pode ser comprado de Roboz Cirúrgica Instrument Co. |
| Orbital - Rotamax-120 | Heidolph | N / A | |
| Dako Fluorescente Meio de Montagem | Dako Cytomation, Glostrup, Dinamarca | DK-5302392 | |
| X10 formulação PBS | 2 gr / lit KCl, 2 gr / lit KH 2 PO 4, 80 gr / lit NaCl, 21,7 gr / lit Na 2 2 O HPO4.7H | A qualidade de PBS é crítica para o sucesso deste protocolo | |
| PBT | X1 PBS + 0,1% de Tween 20 | ||
Referências
- Brewster, R., Bodmer, R. Origin and specification of type II sensory neurons in Drosophila. Development. 121, 2923-2936 (1995).
- Caldwell, J. C., Miller, M. M., Wing, S., Soll, D. R., Eberl, D. F. Dynamic analysis of larval locomotion in Drosophila chordotonal organ mutants. Proc. Natl. Acad. Sci. U.S.A. 100, 16053-16053 (2003).
- Eberl, D. F. Feeling the vibes: chordotonal mechanisms in insect hearing. Curr. Opin. Neurobiol. 9, 389-393 (1999).
- Eberl, D. F., Boekhoff-Falk, G. Development of Johnston's organ in Drosophila. Int. J. Dev. Biol. 51, 679-687 (2007).
- Eberl, D. F., Hardy, R. W., Kernan, M. J. Genetically similar transduction mechanisms for touch and hearing in Drosophila. J. Neurosci. 20, 5981-5988 (2000).
- Egoz-Matia, N., Nachman, A., Halachmi, N., Toder, M., Klein, Y., Salzberg, A. Spatial regulation of cell adhesion in the Drosophila wing is mediated by Delilah, a potent activator of βPS integrin expression. Dev Biol. 351, 99-109 (2011).
- Field, L. H., Matheson, T. Chordotonal organs of insects. Advances in Insect Physiology. 27, 1-228 (1998).
- Gong, Z., Son, W., Chung, Y. D., Kim, J., Shin, D. W., McClung, C. A., Lee, Y., Lee, H. W., Chang, D. J., Kaang, B. K. Two interdependent TRPV channel subunits, inactive and Nanchung, mediate hearing in Drosophila. J. Neurosci. 24, 9059-9066 (2004).
- Inbal, A., Volk, T., Salzberg, A. Recruitment of ectodermal attachment cells via an EGFR-dependent mechanism during the organogenesis of Drosophila proprioceptors. Dev. Cell. 7, 241-250 (2004).
- Jarman, A. P., Grau, Y., Jan, L. Y., Jan, Y. N. atonal is a proneural gene that directs chordotonal organ formation in the Drosophila peripheral nervous system. Cell. 73, 1307-1321 (1993).
- Jarman, A. P., Sun, Y., Jan, L. Y., Jan, Y. N. Role of the proneural gene, atonal, in formation of Drosophila chordotonal organs and photoreceptors. Development. 121, 2019-2030 (1995).
- Kim, J., Chung, Y. D., Park, D. Y., Choi, S., Shin, D. W., Soh, H., Lee, H. W., Son, W., Yim, J., Park, C. S. A TRPV family ion channel required for hearing in Drosophila. Nature. 424, 81-84 (2003).
- Klein, Y., Halachmi, N., Egoz-Matia, N., Toder, M., Salzberg, A. The proprioceptive and contractile systems in Drosophila are both patterned by the EGR family transcription factor Stripe. Dev. Biol. 337, 458-470 (2010).
- Matthews, K. A., Miller, D. F., Kaufman, T. C. Functional implications of the unusual spatial distribution of a minor alpha-tubulin isotype in Drosophila: a common thread among chordotonal ligaments, developing muscle, and testis cyst cells. Dev. Biol. 137, 171-183 (1990).
- Okabe, M., Okano, H. Two-step induction of chordotonal organ precursors in Drosophila embryogenesis. Development. 124, 1045-1053 (1997).
- Rusten, T. E., Cantera, R., Urban, J., Technau, G., Kafatos, F. C., Barrio, R. Spalt modifies EGFR-mediated induction of chordotonal precursors in the embryonic PNS of Drosophila promoting the development of oenocytes. Development. 128, 711-722 (2001).
- Todi, S. V., Sharma, Y., Eberl, D. F. Anatomical and molecular design of the Drosophila antenna as a flagellar auditory organ. Microsc. Res. Tech. 63, 388-399 (2004).
- zur Lage, P., Jarman, A. P. Antagonism of EGFR and notch signalling in the reiterative recruitment of Drosophila adult chordotonal sense organ precursors. Development. 126, 3149-3159 (1999).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados