É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Alterações de monitoramento da concentração de cálcio intracelular e eficácia sináptica no Molusco
Neste Artigo
Resumo
Demonstramos como alterações na concentração do cálcio intracelular livre e eficácia sináptica podem ser monitorizados simultaneamente num gânglio de preparação Aplysia. Nós imagem de cálcio intracelular utilizando um corante fluorescente, o laranja de cálcio, e induzir e controlar a transmissão sináptica, com cortantes (intracelular) eléctrodos.
Resumo
Tem sido sugerido que alterações no cálcio intracelular mediar a indução de um certo número de importantes formas de plasticidade sináptica (facilitação, por exemplo homossináptica significa) 1. Estas hipóteses podem ser testadas simultaneamente monitorizar alterações de cálcio intracelular e alterações na eficácia sináptica. Nós demonstrar como este pode ser realizado através da combinação de imagens com as técnicas de gravação de cálcio intracelulares. Nossos experimentos são realizados em um gânglio vestibular do molusco Aplysia californica. Esta preparação tem um número de características vantajosas, experimentalmente: Ganglia pode ser facilmente removido do Aplysia e experimentos usar neurónios adultos que fazem conexões sinápticas normais e têm uma distribuição normal do canal de iões. Devido à baixa taxa metabólica do animal, e as temperaturas relativamente baixas (14-16 ° C) que são naturais para Aplysia, as preparações são estáveis durante longos períodos de tempo. > ent "Para detectar alterações de cálcio intracelular livre, vamos utilizar a versão celular impermeante de cálcio Orange 2, que é facilmente" carregado "em um neurônio através de iontoforese. Quando este corante fluorescente de comprimento de onda longo liga ao cálcio, aumenta a intensidade de fluorescência. cálcio Orange tem rápidas propriedades cinéticas 3 e, ao contrário de corantes raciométrica (por exemplo, Fura 2), não requer nenhuma roda de filtros para imagens. É bastante foto estável e menos fototóxica do que outros corantes (por exemplo, fluo-3) 2,4. Assim como todos os não-raciométrica corantes, cálcio Laranja indica alterações relativas na concentração de cálcio. Mas, uma vez que não é possível em conta as variações na concentração de corante, devido às operações de carga e de difusão, que não pode ser calibrado para proporcionar as concentrações de cálcio absolutos.
Uma posição vertical, fixo platina do microscópio composto, foi utilizado para os neurónios de imagem com uma câmara CCD capaz de gravação de cerca de 30 quadros por segundo. Em Aplysia esta resolução temporalé mais do que adequada para detectar mesmo um único pico de alteração induzida na concentração de cálcio intracelular. Eletrodos pontiagudos são simultaneamente usado para induzir e gravar a transmissão sináptica em neurônios identificados pré e pós-sináptica. Na conclusão de cada teste, um script personalizado combina eletrofisiologia e dados de imagem. A fim de assegurar a sincronização adequada usamos um pulso de luz a partir de um diodo emissor de luz montado na porta da câmara do microscópio. Manipulação dos níveis de cálcio pré-sinápticos (por exemplo, através da injeção intracelular EGTA) nos permite testar hipóteses específicas, sobre o papel do cálcio intracelular na mediação de várias formas de plasticidade.
Protocolo
1. Preparação
- Anestesiar os animais por injecção de 75-100 ml de solução isotónica de cloreto de magnésio. O Aplysia usamos para imagiologia são geralmente 150-200 gramas e são obtidos a partir Marinus Scientific.
- Pin o animal anestesiado para um prato coberto de cera. Agulhas de seringa funcionam bem para esta finalidade; técnicas estéreis não são necessárias. Utilizando uma pinça e tesouras brutas padrão fazer uma incisão no pé do animal e expor a massa bucal. Localizar o gânglio vestibular. Com uma tesoura de mola e pinça fina, cuidadosamente livre gânglio cortando todos os nervos vestibulares.
- Remover o gânglio e colocá-lo em um prato de Sylgard revestido contendo água do mar artificial. Coloque pinos de insectos poucos através dos nervos bucais para estabilizar o gânglio. Desheath o gânglio vestibular utilizando fórceps e tesouras ultrafinas de mola, de modo a expor os neurónios para gravação intracelular. Em seguida, re-pin o gânglio utilizando cerca de 15 insetos bem (minutien) pinos. O gânglio deve ser mantido firmemente no lugar como qualquer movimento será problemático durante o exame.
2. Prepare Eletrodos
- Puxe eletrodos utilizando tubos de vidro com filamento capilar (por exemplo, WPI TW100F-4) e um puxador. Configurações devem ser individualmente determinados a criar eletrodos da resistência necessária. Quando cheio com 3 M KAc (acetato de potássio) a resistência de eléctrodo é geralmente cerca de 10 MOhms se os eléctrodos estão a ser chanfrada, ou a cerca de 5 MOhms, se o passo de chanfradura é omitido.
- Encher um conjunto de eléctrodos com uma solução contendo 3 M KCl mM KAc/30 utilizando uma seringa e agulha Microfil. Estes eléctrodos será usado para electrofisiologia.
- Encher um segundo conjunto de eléctrodos com o corante indicador de cálcio, por imersão da extremidade traseira do eléctrodo em corante, previamente reconstituído com aprox. 40 ul de água destilada para a tintura 500 ug. Quando a ponta do eléctrodo tem preenchido, de volta encher cerca de 1/4 de polegadada extremidade do eléctrodo com 200 mM de KCl para garantir um bom contacto eléctrico.
- É benéfico para biselar os eléctrodos, pois isso facilita a injecção de corante e reduz os danos causados pela penetração de membrana múltiplos. Usamos uma beveler personalizada que gera um fluxo de uma suspensão de pó de água salgada / alumina. O eléctrodo é montada num suporte e a ponta entra na corrente em um ângulo de 45 °. Resistência do eletrodo é continuamente monitorada ea chanfradura encerrado quando a resistência atinge cerca de 5 MOhm para eletrodos Kac preenchidos. Os eléctrodos são chanfradas cheios de corante para uma igual quantidade de tempo e, tipicamente, têm resistências de MOhm 15-20.
3. Carregando o corante indicador de cálcio
- Coloque a preparação em uma plataforma de eletrofisiologia e localizar visualmente o neurônio pré-sináptico de interesse. Muitas das nossas experiências são feitas com um neurónio sensorial identificado utilizada durante a alimentação, B21 5, 6. A positio relativamente fixan, tamanho (~ 100 mm), e de forma alongada soma B21 tornam-no fácil de localizar.
- Empalar o neurónio de interesse com um eléctrodo que contém o corante indicador de cálcio. B21 identidade pode ser verificada por empalar o neurónio pós-sináptico B8. Despolarização da B21 com ~ atual nA 8 irá desencadear picos e resultar em facilitar PSPs em B8 7.
- Injectar corante no neurónio pré-sináptico de interesse pela passagem impulsos hiperpolarizantes (tipicamente -15 nA, 1 Hz, ciclo de trabalho de 75%) durante cerca de 30 minutos. Se corante é bem sucedida, soma do neurônio vai adquirir uma cor rosada. Remover o eléctrodo de corante contendo pelo lentamente retirando-o do neurónio.
- Deixar a preparação de cerca de 30 minutos para permitir que o corante se difunda nos processos finos que fazem contacto com sináptico neurónios do seguidor.
4. Imagem de cálcio e gravação eletrofisiológico
- Colocar a preparação no Microsc imagingope. O prato com a preparação é realizada em uma plataforma de arrefecimento com pedaços de Permagum cordão de vedação que, ao contrário de argila, mantém-se pegajoso quando molhado. O microscópio palco fixo concentra movendo o objetivo. A fase permanece estacionário, o que permite anexar manipuladores magnéticos montados. Como a alta ampliação torna vibrações (especialmente o movimento lateral) um problema, a configuração de imagem inteiro deve ser colocado sobre uma plataforma de isolamento de vibração.
- Empalar os neurônios pré-sinápticos e pós-sinápticos com eletrodos contendo solução eletrolítica normal.
- Selecione um bloco de filtro adequado para a imagem de cálcio Laranja (excitação 549 nm, nm de emissão 576) 8 e ajustar a câmera. A maioria das câmeras CCD científicos permitem que o investigador de escolher um subconjunto de células CCD que são lidos fora. Além disso, as células podem ser combinados (binned). A seleção de um subconjunto menor velocidade aumenta, enquanto binning aumenta a sensibilidade. Estas duas configurações, em conjunto com o tempo de exposição, determinara taxa de quadros ou seja, quantas imagens podem ser adquiridas por segundo. Configurações adequadas imagem será uma área de 580 x 350 um 2 com 500 x 300 pixels (usando uma lente de 10x e um adaptador de câmera 0,5 x). Adicionar filtros de densidade neutra ao caminho de luz para ajustar a intensidade de iluminação para a quantidade mínima que proporciona a exposição correcta com um tempo de exposição de <25 ms. Estas definições devem resultar em uma taxa de quadros de cerca de 30 Hz - que na Aplysia é rápido o suficiente para a imagem pico único evocado alterações de cálcio. Finalmente, feche a abertura de campo de modo que apenas a área fotografada é iluminado.
- No software de imagem de marcar regiões do neurônio que deseja medir. No Elements AR software isso é feito no "Tempo de medição" seção colocando regiões de interesse (ROI). B21 é um neurônio bipolar e trabalho anterior demonstrou que os seus contatos processo lateral neurônio pós-sináptico de juros de 9. Nós geralmente imagem sutiã, primário, secundário e terciárionches do processo de colocação de um perfil por ROI sobre cada parte do neurónio. Um ROI adicional ao lado do neurónio corante cheio é medido para proporcionar um valor de fundo, que é depois subtraída de todos os outros pontos de dados.
- Instrua a aquisição de eletrofisiologia (nestes experimentos de Spike II) para aguardar um sinal de disparo fornecida pelo "quadro de leitura" do sinal da câmera. Iniciar a aquisição de imagem (Elementos AR); Ponto II irá automaticamente iniciar a gravação quando a câmera tira seu primeiro quadro. Você também pode usar uma saída TTL do Poder 1401 brevemente ligar um LED montado na porta do microscópio câmera. Isto irá proporcionar um sinal de sincronização de imagem e subsequentemente dados electrofisiológicos.
- Estimular o neurônio pré-sináptico, injetando uma série de breves despolarizantes pulsos de corrente na freqüência desejada. É importante para controlar cada impulso (por exemplo, com um osciloscópio estímulo provocado) para determinar se o potencial de acção é successfully gerado. Enquanto Laranja cálcio é muito foto-estável em relação a outros corantes, é uma boa idéia para gravar um ensaio clínico sem estimulação para verificar a quantidade tingir branqueamento ocorre.
- Em experiências nas quais as concentrações de cálcio intracelular são manipulados, uma droga tal como EGTA é introduzido no neurónio pré-sináptico e das etapas de estimulação e de aquisição de dados descritos acima são repetidos.
5. Análise de dados representativos
- Exportar os dados de imagem (a lista de valores de intensidade medidos para cada ROI) escrevendo em um arquivo de texto. Um script personalizado de Spike II pode importar o arquivo de texto. Este script também normaliza os valores da sonda com área individual e subtrai o valor da sonda do fundo. Os pontos de dados são, em seguida, juntamente com os dados representados como uma electrofisiologia "virtual RealWave" do canal. O "canal processo / função de mudança de tempo" no filme de Spike II é usada para alinhar precisamente a imagem de dados points, utilizando o sinal de LED como referência.
- Para obter os valores como percentagem de alteração, analisar os dados de imagem por meio do cálculo da variação relativa da fluorescência como dF / o = F (FF o) / F o. F o indica o nível de fluorescência antes do estimulo e F a fluorescência durante o estímulo.
6. Resultados representativos
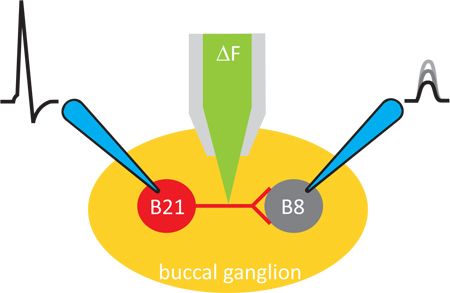
Figura 1. Esquema geral da experiência. As experiências são realizadas em preparações ganglionares de Aplysia. Alterações de cálcio intracelular são gravadas com um corante fluorescente, que é introduzido no iontoforeticamente o neurónio pré-sináptico. Neurónios pré-e pós-sinápticos são então empalado com eléctrodos afiadas, de modo que a transmissão sináptica pode ser induzida e controlada.

Figura 2. imagem de cálcio intracelular e gravação de neurônios identificados no gânglio vestibular de Aplysia. (A) Foto do ramo imaged lateral do neurônio B21. A caixa indica a região medida de interesse. (B1) estimulação intracelular de B21 evoca potenciais de ação (traço inferior) e facilitando potenciais pós-sinápticos (PSP) no pós-sináptica dos neurônios seguidor B8 (meio de rastreamento) fazendo com que ele também disparar potenciais de ação. Aumentos na fluorescência de cálcio pré-sináptica são mostrados no traçado superior. (B2) Efeito do EGTA pré-sináptica na facilitação homossináptica significa. EGTA foi intracelularmente injectado B21 ~ 15 minutos antes da estimulação intracelular. Pensa-se que EGTA é um quelante de cálcio de acção lenta, que a baixas concentrações não é suficientemente rápida para eliminar a transmissão sináptica. Note-se a redução do sinal de cálcio generalizada e a correspondente diminuição da amplitude PSP. (C) A amplitude PSP correlaciona-se com a pré-sináptica calcium sinal. Clique aqui para ver maior figura .
Discussão
Nós demonstramos técnicas que podem ser usadas para controlar simultaneamente a concentração de cálcio intracelular e avaliar a eficácia da transmissão sináptica. Estas técnicas são úteis para determinar o modo como diversas formas de plasticidade de curto prazo são mediados.
A formação de imagens é realizada com um microscópio de fluorescência e câmara CCD. Estes requisitos equipamentos são relativamente modestos quando comparados com a maioria funcionais de imagem set-up...
Divulgações
Não temos nada a revelar.
Agradecimentos
A PHS Grant (MH51393) apoiaram este trabalho. Alguns dos Aplysia usamos são fornecidas pelo Nacional de Recursos para Aplysia, da Universidade de Miami, Grant RR10294 do Centro Nacional de Pesquisa de Recursos, NIH.
Materiais
| Name | Company | Catalog Number | Comments |
| Nome do reagente | Companhia | Número de Catálogo | Comentário |
| Cálcio Laranja | Invitrogen | C-3013 | |
| EGTA | Sigma | E-4378 | |
| Cálcio kit padrão de calibração | Invitrogen | C-3008MP | útil para testar a sensibilidade e a gama dinâmica do sinal |
| Hexa-hidrato de cloreto de magnésio | Sigma | M0250 | utilizado em solução 0,33 M de anestesiar animais |
Reagentes Tabela 1. Usado.
| Nome Equipamento | Companhia | Comentário |
| FN-1 microscópio vertical fluorescência | Nikon Instruments | com Narishige ITS-FN1 etapa |
| NMN-21 manipuladores | Narishige | montado no palco com ímãs |
| CoolSNAP HQ 2 câmera CCD | Fotometria | |
| NIS elementos AR (Versão 3.22) | Nikon Instruments | software de imagem usado para adquirir dados de fluorescência |
| 10X/0.3w Plano Fluor objetivo | Nikon Instruments | esta lente de imersão em água tem uma longa distância de trabalho de 3,5 mm |
| X-Cite 120 lâmpadas de metal haleto PC | EXFO | utilizado para imagiologia de fluorescência |
| LS-DWL lâmpada halógena | Sumica | |
| ET-CY3 conjunto de filtros | Tecnologia Chroma | ; |
| Poder 1401 conversor A / D | Cambridge Electronic Design | amostragem foi feita em 3 kHz |
| Ponto II (Versão 7.07) | Cambridge Electronic Design | software usado para adquirir dados de eletrofisiologia |
| SEC-10 LX amplificador | NPI eletrônica | usado com um andar de entrada 10X |
| Amplificador modelo 410 | Brownlee precisão | utilizado para amplificar e filtrar o sinal |
| WS-4 | menos k Tecnologia | isolamento de vibração para imagens |
| plataforma de resfriamento | feitos | placa de metal através do qual é bombeada água gelada, a uma taxa variável |
Tabela 2. Equipamento utilizado.
Referências
- Zucker, R. S., Regehr, W. G. Short-term synaptic plasticity. Annu. Rev. Physiol. 64, 355-405 (2002).
- Eberhard, M., Erne, P. Calcium binding to fluorescent calcium indicators: Calcium green, calcium orange and calcium crimson. Biochem. Biophysical Res. Comm. 180, 209-215 (1991).
- Escobar, A. L., Velez, P., Kim, A. M., Cifuentes, F., Fill, M., Vergata, J. L. Kinetic properties of DM-nitrophen and calcium indicators: rapid transient response to flash photolysis. Eur. J. Physiol. 434, 615-631 (1997).
- Ivanov, A. I., Calabrese, R. L. Modulation of spike-mediated synaptic transmission by presynaptic background Ca2+ in leech heart interneurons. J. Neurosci. 23, 1206-1218 (2003).
- Rosen, S. C., Miller, M. W., Evans, C. G., Cropper, E. C., Kupfermann, I. Diverse synaptic connections between peptidergic radula mechanoafferent neurons and neurons in the feeding system of Aplysia. J. Neurophysiol. 83, 1605-1620 (2000).
- Ludwar, B. C. h., Evans, C. G., Jing, J., Cropper, E. C. Two distinct mechanisms mediate potentiating effects of depolarization on synaptic transmission. J. Neurophysiol. 102, 1976-1983 (2009).
- Evans, C. G., Ludwar, B. C. h., Askansas, J., Cropper, E. C. Effect of holding potential on the dynamics of homosynaptic facilitation. J. Neurosci. 31, 11039-11043 (2011).
- Haugland, R. P. . The Handbook. , (2005).
- Borovikov, D., Evans, C. G., Jing, J., Rosen, S. C., Cropper, E. C. A proprioceptive role for an exteroceptive mechanoafferent neuron in Aplysia. J. Neurosci. 20, 1990-2002 (2000).
- Goldberg, J. H., Yuste, R. Chapter 38: A practical guide: Two-photon calcium imaging of spines and dendrites. Imaging in Neuroscience and Development. , (2005).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados