É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Isolamento e cultivo de células neurais embrionárias de ratos: um protocolo rápido
Neste Artigo
Resumo
Nós descrevemos uma metodologia rápida para isolar e cultivar os neurônios do hipocampo e cortical a partir de embriões de roedores. Este protocolo permite a realização de experimentos em que quase puras culturas neuronais são necessários.
Resumo
Estamos descrevendo um método rápido para dissociar cultura e os neurônios do hipocampo ou cortical a partir de embriões de ratos E15-17. O procedimento pode ser aplicado com sucesso para o isolamento de rato e humanos neurónios primários e progenitores neurais. Neurónios dissociadas são mantidas em meio isento de soro até várias semanas. Estas culturas podem ser utilizados para nucleofection, imunocitoquímica, a preparação de ácidos nucleicos, bem como electrofisiologia. Mais velhos culturas neuronais também podem ser transfectadas com uma taxa de uma boa eficiência de transdução por lentivirus e, de forma menos eficiente, com fosfato de cálcio ou de lípidos métodos baseados em tais como lipofectamina.
Protocolo
1. Poli-D-lisina (PDL): Preparação
- Adicionar 5 ml de ddH2O estéril a 5 mg de PDL para se obter uma solução stock de 1 mg / ml.
- Misture solução estoque pipetando várias vezes.
- Use imediatamente ou guarde Poly-D-lisina solução a 2-8 ° C.
2. Poli-D-lisina (PDL): Revestimento de plástico pratos de cultura de células
- Dilui-se a solução de reserva com PDL estéril ddH2O para a concentração final de 10 ug / ml.
- Pipetar solução suficiente para um prato 60 milímetros para cobrir a área de cultura de superfície (3 ml para um prato de 60 mm).
- Balançar suavemente para assegurar mesmo revestimento da superfície da cultura.
- Incubar as placas revestidas à temperatura ambiente (RT) durante a noite.
- No dia seguinte, geralmente o dia de dissecção, remover a solução de poli-D-Lisina por aspiração e lavar brevemente com 3 ml de estéril DDQ 2 O. Repetir este passo. Após a segunda lavagem, remover a água completamente por aspiração.
- As placas podem ser armazenadas a 4 ° C durante até três semanas.
3. Poli-D-lisina (PDL) e laminina: Preparação e revestimento de vidro de duas câmaras lâminas
- Mistura PDL (1 mg / ml) e laminina (1 mg / ml) soluções de reserva em estéril ddH2O para a concentração final de 10 e 5 ug / ml, respectivamente.
- Pipetar solução suficiente em poços de um vidro de duas câmaras de deslizamento para cobrir a área da superfície de cultura (1 ml para cada poço de um vidro de 2 bem duas câmaras de slides).
- Balançar suavemente para assegurar mesmo revestimento da superfície da cultura.
- Incubar as placas revestidas a noite à RT.
- No dia seguinte, remover a solução de revestimento de poli-D-Lisina-laminina através de aspiração e lava-se brevemente duas vezes com 1 ml de estéril DDQ 2 O. Após a segunda lavagem, remover a água completamente por aspiração.
- Lâminas de câmara pode ser armazenada a 4 ° C durante até três semanas.
Nota: Qualquer slide câmara de vidro podem ser revestidas following protocolo esta. Muitas vezes usamos as lâminas duas câmaras porque cada slide fornece a configuração de controle de teste experimental (por exemplo, sem tratamento contra tratada, não transfectadas contra transfectadas).
4. Dissecção Neuronal e Cultura
- Aquecer os seguintes reagentes em um banho de água 37 ° C:
- TrypLE Express no seu original garrafa de 100 ml.
- Neurobasal/B27 médio completo (ver tabela I). O volume aquecida depende do número de pratos para ser revestido (30 ml por exemplo, para dez pratos de 60 mm banhados).
- Adicionar 3 ml de solução fria E o Hibernate para quatro pratos de 60 mm de cultura e 13 ml para uma BD de 15 ml Falcon tubo de polipropileno de alta claridade cônica.
- Adicionar 25-30 ml de meio de dissecção fria (ver Tabela II, o Dr. Olimpia Meucci, comunicação pessoal) para cada um de três pratos de cultura de 100 mm. Estas placas, contendo um grande volume de meio, será usado para lavar os embriões imediatamente após a suaremoção das bolsas amnióticas (passos 4.7 e 4.8).
- Euthanize um E17 rato timed grávida de CO 2 em conformidade com a Política Pública de Serviços de Saúde sobre a Atenção Humanizada e Uso de Animais de Laboratório e sob um cuidado animal institucional aprovado e usar o protocolo.
- Pulverizar abdómen inferior com EtOH a 70% e cortar medialmente através da pele e dos músculos com um par de tesouras expondo o útero e embriões.
- Remover todos os fetos e colocá-los em um prato de 100 mm estéril contendo um excesso de meio de dissecção fria (25-30 ml, ver passo 4.3).
- Corte embriões usando uma tesoura pequena de bolsa amniótica e colocá-los no prato de 100 mm contendo meio segundo dissecção fria.
- Lavar os embriões à temperatura ambiente por suavemente inclinação prato a 100 mm durante 5-10 segundos. Em seguida, transferir os embriões enxaguado para o prato milímetros terceiro 100 contendo meio de dissecação. Duas lavagens em meio de excesso são geralmente suficiente para remover todos os vestígios de sangue. No entanto, se nesário, lavar uma vez mais utilizando um prato de 100 mm fresco contendo 25-30 ml de meio de dissecção a frio.
- Usando uma pinça estereomicroscópio e curvo, extrair cérebro de cada embrião rato puxando a pele e crânio. Coloque cérebro inteiro em um dos pratos de 60 mm (tipicamente, com não mais de 5 cérebros por placa) com frio Hibernate E. Mantenha estas placas em gelo.
- Tomar um prato de cada vez e, sob um microscópio de dissecação, separar os hemisférios e isolar os córtices cerebrais remoção do mesencéfalo e as meninges.
- Opcional: cérebros de corte ao longo da linha média, extrair hipocampos, e siga o procedimento abaixo para isolar os neurônios do hipocampo.
- Colete todos os córtices dissecados em 15 ml tubo transparente cônico contendo 13 ml de frio Hibernate E. Deixe o córtex cerebral sobre o gelo até que todas as dissecções são concluídas. Devido ao seu pequeno tamanho, hipocampos dissecados podem ser recolhidos num tubo de Eppendorf de 1,5 ml em vez de um tubo de 15 ml. Se desejado, a este passo córtices ouhipocampos pode ser colocada num frasco criotubo contendo 1 ml de Hibernate E + 2% B27 + gentamicina (50 ug / ml) + Fungizone (250 ng / ml) na proporção de 2-4 córtices ou 2-4 hipocampos por frasco. O tecido cerebral pode ser armazenada a 4 ° C no escuro, durante até uma semana (mais tarde vezes não têm a ser testado ainda). Quando necessário, usar fórceps finos para transferir o tecido do cérebro para um tubo de 15 ml contendo Hibernate E e, em seguida, seguir o protocolo a seguir para isolar os neurónios.
- Transferir o tubo para um capuz de cultura de tecidos. Permitir que os córtices para assentar no fundo do tubo e, então, cuidadosamente remover o sobrenadante.
- Adicionar 13 ml de E Hibernate fresco para o tubo de 15 ml cónico, permitir córtices assentar no fundo do tubo e cuidadosamente remover o sobrenadante. Repita este passo mais 2 vezes e, após a última lavagem, remover cuidadosamente todas as mídias.
- Enzimaticamente digerir córtices cerebrais por adição de 1-2 ml (dependendo do número de córtices; usar menos para o isolamento hipocampos) de Tr quentesypLE Express. Selar a tampa do tubo com Parafilm e flutuar o tubo num banho de água 37 ° C durante 10 minutos.
- Pulverizar o tubo com etanol a 70% antes de abrir a tampa e adicionar 10 ml de Hibernate E. Permitir os córtices para assentar no fundo do tubo e remover o sobrenadante. Repita este passo três vezes para lavar TrypLE Express. Na última etapa, remova cuidadosamente todos os meios de comunicação.
- Suavemente triturar (4-5 vezes) os córtices em 2 ml de meio completo utilizando Neurobasal/B27 um incêndio-polido vidro Pasteur (aproximadamente 1 mm de diâmetro). Tenha cuidado para evitar bolhas.
- Repita mais 4-5 vezes com uma pipeta de Pasteur estéril de vidro menor em diâmetro (ou seja, uma pipeta de cerca de milímetros de diâmetro 1/2-3/4). Não use uma pipeta Pasteur menor do que isso, ou ele vai destruir as células.
- Permitir que as restantes peças de tecido (em geral, muito poucos, se houver) para resolver.
- Transferir a suspensão de célula única superior a um tubo de 15 ml-nova, deixando para trás peças estabelecidos de tecido. Pelether diluir a suspensão de células até 10-12 ml com Neurobasal/B27 meio completo.
- Misturar bem e diluir as células para a contagem por adição de 10 ul de suspensão de células a 490 ul de solução de contagem de 50x (ver tabela III) em um tubo de Eppendorf de 1,5 ml.
- Células da placa sobre placas revestidas PDL na densidade de 5,0 x 10 4 cm / 2. Se nucleofection é para ser realizado, recomendamos plaqueamento das células em uma concentração mais elevada (8-10 x 10 4 cm / 2).
- Normalmente, nós dissecar 9-10 fetos por experiência, como cerca de 13 x 10 6 neurônios são derivados de cada feto E17. Se os embriões são necessários mais, certifique-se que o procedimento todo não durar mais de duas horas.
- Se desejado, 24 horas após o isolamento, 10 mM de citosina-β-D-arabinofuranoside (AraC) pode ser adicionado a cada prato, a fim de impedir a proliferação glial. No entanto, este passo não é necessário uma vez que Neurobasal/B27 médio inibe a proliferação glial, Conforme as recomendações do fabricante (Invitrogen / Gibco).
- Neurónios podem ser utilizados para experiências após 4-5 dias in vitro, embora o tempo exacto depende estágio de diferenciação desejado. Temos culturas de neurónios por até 4 semanas sem uma diminuição significativa na sobrevivência (Figura 1).
- Para a cultura de estendida, substituir meio de cultura a cada semana com meio preparado de fresco Neurobasal/B27 completa.
5. Os resultados representativos
Neurónios cultivados em lâminas câmara de vidro pode ser submetido a imunocitoquímica. A Figura 1 mostra uma imagem típica de um neurónio cortical fixado após cinco dias em cultura e immunolabeled com anti-MAP-2 anticorpo para mostrar os processos neuronais.
A Figura 2 mostra uma imagem representativa de um neurónio de rato hipocampal após 3 semanas em cultura. A morfologia neuronal de uma célula diferenciada totalmente é realçada por MAP-2 immunolabeling (MAP-2 marcador neuronal, rato clone de anticorpo monoclonal AP-20, Gene Tex, Irvine, CA), seguindo um procedimento padrão como descrito anteriormente 1. As imagens foram visualizadas com o Eclipse Nikon E400 microscópio vertical de fluorescência equipado com câmera aquática EXI (Qimaging), motorizado eixo Z, e SlideBook5 aquisição / deconvolução software (Intelligent imagem Innovations, Inc., Denver, CO). Uma série de imagens tridimensionais de cada imagem individual foram deconvoluídos para uma imagem bidimensional e resolvidas, ajustando o sinal de corte com a intensidade de máximo próximo para aumentar a resolução.
A Figura 3 mostra pureza das culturas neuronais. Lisados de proteínas foram obtidos a partir de DIV7 culturas neuronais de rato (CTX) ea partir de um caso de glioblastoma humano (GBM). Como esperado, o lisado neuronal é fortemente positiva para a proteína neuronal MAP-2 e negativo para a GFAP marcador astrocítica; enquanto o lisado de proteína GBM é f negativoou MAP-2 e positiva para GFAP.
Embora em nosso protocolo que temos vindo a utilizar Hibernate E por vários anos como dissecar e lavagem médio, recentemente, têm explorado o uso adicional e muito prático de se preservar tecidos cerebrais para uso posterior. A Figura 4 ilustra alguns dias in vitro 5 (DIV5) cultura de neurónios corticais de rato isolado a partir de córtices mantidos a 4 ° C durante uma semana em Hibernate E + B27 após a sua dissecção original a partir dos embriões. Os neurónios foram plaqueados em um copo de duas câmaras lâmina revestida com PDL e laminina, como descrito anteriormente. A imagem adquirida foi deconvoluídos usando SlideBook5 aquisição / software desconvolução como descrito acima (Figura 2).

Figura 1. Imagem representativas de um neurónio cortical nucleofected com pmaxGFP (Amaxa, Lonza, Walkersville, MD) e immunolabeled com MAP-2 Anticorpo, em vermelho. Aumento original de 100x.
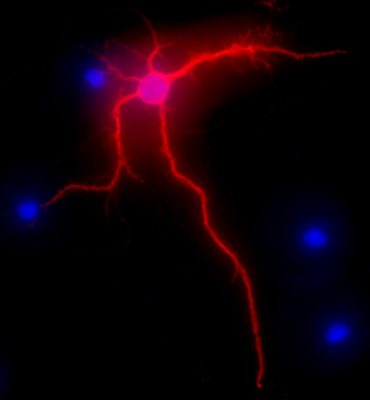
Figura 2. Imagem representativas mostrando MAP-2 imunomarcação, em vermelho, de neurónios do hipocampo após 3 semanas em cultura. Coloração DAPI, em azul, mostra núcleos celulares. Aumento original de 40x.

Figura 3. Western blot mostrando pureza das culturas de células neuronais. 30 ug de rato lisados de proteínas neuronais e humana GBM foram separados por electroforese e submetido a análise de Western blot seguindo procedimentos padrão 1. Anti-MAP-2 era um anticorpo policlonal de coelho a partir de sinalização celular (Danvers, MA), anti-GFAP anticorpo foi um monoclonal de ratinho da Chemicon (Millipore, Billerica, MA), e do rato anticorpo monoclonal anti-GRB2 era de Laboratories Transdução BD ( MD, faíscas). GRB2 foi utilizado como um controlo de carga.

A Figura 4. Imagens representativos de 5 dias in vitro (DIV5) neurónios corticais de ratos obtidos a partir de córtices deixadas no Hibernate E + B27 a 4 ° C durante uma semana após a sua dissecção. A) O contraste de fase de neurónios cultivados sobre um vidro de duas câmaras de slides. Aumento original 20X. B) imunofluorescência mostrando a expressão de MAP-2 em processos neuronais, em verde, a cultura foi negativo para a GFAP astrocitária marcador. Coloração DAPI, em azul, indica núcleos celulares. Aumento original de 40x.
Discussão
O método de dissecção e cultura de neurónios do hipocampo de ratos e cortical aqui descrito permite a realização de experiências usando quase puros culturas neuronais cultivadas num meio quimicamente definido (Figura 3). Embora os protocolos para os neurónios de cultura quase puros em meios isentos de soro foram anteriormente descritos 2,3,4, há alterações importantes feitas em nosso método. Diferente de protocolos tradicionais (isto é, Banker et al.) 5, temos substitu...
Divulgações
Não há conflitos de interesse declarados.
Agradecimentos
Agradecemos Jonna Ellis para a assistência editorial. O projeto descrito foi apoiada por número Prêmio R01MH079751 (PI: F. Peruzzi) do Instituto Nacional de Saúde Mental. O conteúdo é da exclusiva responsabilidade dos autores e não representam necessariamente as opiniões oficiais do Instituto Nacional de Saúde Mental ou o National Institutes of Health.
Materiais
| Name | Company | Catalog Number | Comments |
| Reagente | Concentração | ||
| Neurobasal | 98% | ||
| B27 | 2% | ||
| Glutamax | 0,5 mM |
Quadro I. Neurobasal/B27 meio completo.
| Reagente | Concentração |
| Glicose | 16 mM |
| Sacarose | 22 mM |
| HEPES | 10 mM |
| NaCl | 160 mM |
| KCl | 5 mM |
| Na 2 HPO 4 | 1 mM |
| KH 2 PO 2 | 0,22 mM |
| Gentamicina | 50 ug / ml |
| Fungizone | 250 ng / ml |
| pH | 7,4 |
| Osmolaridade | 320-330 mOsm |
Tabela II. Meio de dissecção.
| Reagente | Volume (uL) |
| Neurobasal/B27 meio completo | 240 |
| Trypan azul 0,4% | 250 |
| Total | 490 |
Tabela III. 50x Contando solução.
| Reagente | Companhia | Cat. número |
| E Hibernate | Brainbits | 767171 |
| Neurobasal | Gibco, Invitrogen | 21103-049 |
| B27 | Gibco, Invitrogen | 17504-044 |
| Fungizone | Gibco, Invitrogen | 15290-018 |
| De sulfato de gentamicina | Sigma Aldrich | G1264 |
| Glutamax mM 200 | Gibco, Invitrogen | 35050 |
| TrypLE expresso vermelho w / o fenol | Gibco, Invitrogen | 12604 |
| Citosina-β-D-arabinofuranoside cloridrato | Sigma Aldrich | C6645 |
| Poli-D-Lisina | Sigma Aldrich | P6407 |
| A laminina 1 mg / ml | Millipore | CC095 |
| HEPES | Sigma Aldrich | H3375 |
| Trypan azul 0,4% | Gibco, Invitrogen | 15250 |
Tabela IV. Reagentes específicos.
| Equipamento | Companhia | Cat. número |
| Microscópio estéreo | Olimpo | SZ61 |
| Pinças grandes | FST | 11022-14 |
| Pinça de ponta fina | Moria | MC40B |
| Micro pinça de ponta fina | Moria | MC31 |
| Afiadas tesouras | Roboz | RS-6820 |
| Micro tesoura de dissecção | FST | 91460-11 |
| Dissecando Micro tesoura curva | FST | 14067-11 |
| Vidro 2-câmara lâminas | Lab-Tek | 154461 |
| 60 pratos mm | BD Falcon | 353002 |
| Placas de 100 mm | Corning | 430167 |
| 15 ml tubos | BD Falcon | 352099 |
| 1,5 ml frasco crio-tubo | Nunc | 375353 |
Equipamentos Quadro V. específico.
Referências
- Aprea, S. Tubulin-mediated binding of human immunodeficiency virus-1 Tat to the cytoskeleton causes proteasomal-dependent degradation of microtubule-associated protein 2 and neuronal damage. J. Neurosci. 26, 4054-4062 (2006).
- Kivell, B. M., McDonald, F. J., Miller, J. H. Serum-free culture of rat post-natal and fetal brainstem neurons. Brain Res. Dev. Brain Res. 120, 199-210 (2000).
- Kivell, B. M., McDonald, F. J., Miller, J. H. Method for serum-free culture of late fetal and early postnatal rat brainstem neurons. Brain Res. Brain Res. Protoc. 6, 91-99 (2001).
- Brewer, G. J. Serum-free B27/neurobasal medium supports differentiated growth of neurons from the striatum, substantia nigra, septum, cerebral cortex, cerebellum, and dentate gyrus. J. Neurosci. Res. 42, 674-683 (1995).
- Banker, G., Goslin, K. . Culturing nerve cells. , (1998).
- Eletto, D. Inhibition of SNAP25 expression by HIV-1 Tat involves the activity of mir-128a. J. Cell Physiol. 216, 764-770 (2008).
- Gualco, E. IGF-IR-dependent expression of Survivin is required for T-antigen-mediated protection from apoptosis and proliferation of neural progenitors. Cell Death Differ. 17, 439-451 (2010).
- Gage, F. H. Survival and differentiation of adult neuronal progenitor cells transplanted to the adult brain. Proc. Natl. Acad. Sci. U.S.A. 92, 11879-11883 (1995).
- Keyser, D. O., Pellmar, T. C. Synaptic transmission in the hippocampus: critical role for glial cells. Glia. 10, 237-243 (1994).
- Pfrieger, F. W., Barres, B. A. Synaptic efficacy enhanced by glial cells in vitro. Science. 277, 1684-1687 (1997).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados