Method Article
Uma abordagem semi-quantitativa para avaliar formação de biofilmes usando o desenvolvimento da colônia enrugado
Neste Artigo
Resumo
Nós fornecer um método simples, semi-quantitativa para investigar a formação de biofilme In vitro. Este método tira vantagem do IAM Zeiss 2000-C microscópio de dissecção (com acessório de câmara) para monitorar a duração eo padrão de formação de biofilme, conforme avaliado pelo desenvolvimento de colônias rugosas.
Resumo
Biofilmes ou superfície inscritos comunidades de células encapsuladas em uma matriz extracelular, representam um estilo de vida comum para muitas bactérias. Dentro de um biofilme, as células bacterianas apresentam frequentemente alterada fisiologia, incluindo maior resistência aos antibióticos e outros estresses ambientais 1. Além disso, os biofilmes podem desempenhar papéis importantes na série de micróbios interações. Biofilmes se desenvolvem quando bactérias de transição individual, células planctônicas para formar complexos, multicelulares comunidades 2. No laboratório, biofilmes são estudados por avaliação do desenvolvimento de fenótipos de biofilme específicos. Um fenótipo de biofilme comum envolve a formação de enrugadas ou rugoso colónias bacterianas em agar sólido meios 3. Formação da colônia enrugado fornece um meio particularmente simples e úteis para identificar e caracterizar as cepas bacterianas que exibem fenótipos biofilme alterados, e para investigar as condições ambientais que a formação de biofilme impacto. Wriformação de colónias nkled serve como um indicador da formação de biofilme em uma variedade de bactérias, incluindo ambas as bactérias Gram-positivas, tais como Bacillus subtilis 4, e bactérias gram-negativas, tais como Vibrio cholerae 5, Vibrio parahaemolyticus 6, Pseudomonas aeruginosa 7, e Vibrio fischeri 8.
A bactéria marinha V. fischeri tornou-se um modelo para a formação de biofilme devido ao papel fundamental do biofilme durante a colonização do hospedeiro: biofilmes produzidos por V. fischeri promover a sua colonização das havaianas bobtail lula 8-10 Euprymna scolopes. Importante, fenótipos de biofilme observados in vitro correlaciona com a capacidade de V. células fischeri para efetivamente colonizar animais hospedeiros: linhagens deficientes para a formação de biofilme in vitro possuem um defeito de colonização 9,11, enquanto as estirpes apresentando aumentofenótipos de biofilme são reforçadas para a colonização 8,12. V. fischeri, portanto, fornece um sistema modelo simples para avaliar os mecanismos pelos quais as bactérias regulam a formação de biofilmes e como biofilmes colonização do hospedeiro impacto.
Neste relatório, nós descrevemos um método semi-quantitativo para avaliar a formação de biofilme com V. fischeri como um sistema modelo. Este método envolve o cuidado manchas de culturas bacterianas em concentrações e volumes definidos para meios de agar sólidos; uma cultura manchado é sinónimo de uma única colónia bacteriana. Esta técnica "cultura manchado 'pode ser utilizado para comparar os fenótipos de biofilme em bruto individuais, especificados prazos pontos (ponto final de testes), ou para identificar e caracterizar os fenótipos de biofilme sutis através do tempo-curso ensaios de desenvolvimento de biofilme e medições do diâmetro das colônias , que é influenciada pela formação de biofilmes. Assim, esta técnica fornece uma análise semi-quantitativa da formação de biofilme, pormitting avaliação do timing e padrões de desenvolvimento colônia enrugado e do tamanho relativo da estrutura de desenvolvimento, características que vão além da simples morfologia geral.
Protocolo
1. Caracterização inicial e Considerações
- A formação de biofilme é geralmente influenciada pela densidade e taxa de crescimento celular. Portanto, é necessário determinar a taxa de crescimento (aumento na densidade óptica (OD) ao longo do tempo) e rendimento (número de células final) da estirpe (s) de interesse através da realização de curva de crescimento simples e ensaios de chapeamento de células. Os defeitos de crescimento, ou uma falta de correlação entre OD eo número de células, deve ser tomado em consideração na interpretação dos resultados a partir de manchas experimentos.
- Incluir os controles apropriados positivos e negativos sobre a mesma placa quando se avalia a formação de colônia enrugado, como a variação entre a chapa ea placa menor pode impactar o desenvolvimento de biofilme.
- Identificar as melhores condições para manchar, ie, aqueles que revelam as diferenças mais distintas entre o controlo e mutante (s) de interesse. Crescer as estirpes em cultura líquida sob várias condições, tais como meios diferentes ou temperaturas, ea fase diferentes de crescimento (fase exponencial ou estacionária) antes de manchas. UL ponto 10 da cultura em densidades de células diferentes para os meios apropriados, e incubar à temperatura desejada até morfologias de colónias tornam-se aparentes.
- O ensaio de ponto final envolve a avaliação de formação de colónias enrugada num ponto de tempo predeterminado depois de manchas (isto é, 48 horas). Esta avaliação é útil para as estirpes que apresentam (ou propostas a apresentar) defeitos graves na formação do biofilme.
- O ensaio de curso de tempo avalia a formação de colónias enrugada ao longo de um período de tempo (ie, a cada hora) pós-manchas. Este ensaio permite uma avaliação semi-quantitativa da formação de biofilme, permitindo a determinação do início da formação de colónias enrugada e desenvolvimento padrão ao longo de um período de tempo. A duração da experiência e do número de pontos de recolha para um curso de tempo deve ser determinada em experiências preliminares.
- Para acompanhar facilmente o tempo pós-spotting, fixado emImer para contar.
2. Avaliação microscópica da morfologia da colônia enrugado em V. fischeri
- Inocular V. células fischeri em 5 ml de LB-Sal (LBS) médio 13 (1% [w / v] triptona, 0,5% [w / v] extracto de levedura, 2% [w / v] cloreto de sódio, 50 mM de Tris-HCl [ pH 7,5]) contendo antibióticos quaisquer necessárias e incubar, com agitação, durante a noite a 28 ° C. Na manhã, a subcultura as células com uma diluição de 1:100 em 5 ml de meio fresco e LBS incubar sob as mesmas condições até que as células tenham atingido a densidade óptica desejada 600 (por exemplo, OD 600 = 0,2 ou 0,5).
- Pipeta de 1 ml da cultura para um tubo de microcentrífuga e centrifugar de um conjunto de microcentrífuga à velocidade máxima durante um minuto. Remover o sobrenadante por aspiração. Lave as células para remover meios residuais e componentes extracelulares por ressuspender o pellet em 1 ml de estéreis de 70% água do mar artificial (ASW) (35 mM de MgSO4-7H 2 O, 7 mM de CaCl2-2H 2 O, 210 mM de NaCl, 7 mM de KCl) e repetindo o centrifugação. Ressuspender o sedimento lavado em 1 ml de ASW a 70%.
- Assegure-se que cada amostra contém o mesmo número de células, tal como estimado pelo OD a 600 nm. Faça os ajustes necessários por diluição de amostras mais concentradas com adicional de 70% ASW. Em experiências preliminares, as culturas no local em vários valores iniciais OD para determinar uma OD óptima de partida para um dado conjunto de estirpes ou condições. Os melhores resultados são obtidos para V. fischeri quando manchas são gerados a partir de culturas com uma DO de aproximadamente 0,2.
- Manchar 10 uL das células lavadas em LBS placas contendo qualquer antibiótico necessárias. Quando detectar uma cultura em um prato, certifique-se de pipeta o equilíbrio (com o dedo) logo acima da superfície do ágar. Manchar verticalmente, não a um ângulo, e ejectar o líquido lentamente para a distribuição uniforme do local. Normalmente cada linhagem é avistado uma vez por placa (até 6 pontos por placa) sagacidade,h placas múltiplas (2-3) por experimento.
- Para garantir que a cultura manchado permanece uniformemente distribuída, permitir que o local para secar antes de mover a placa para a incubadora. Inverter as placas e incubar-los a 28 ° C.
- Monitorar a morfologia do início mancha crescente horária em 12-15 horas após a inoculação. Nós usamos um escopo de dissecação (Zeiss STEMI 2000-C) com um acessório de câmara (ProgRes C10 PLUS) eo CapturePro ProgRes e programas de software ImageJ para observar e documentar morfologia da colônia e para avaliar o início e progressão da formação da colônia enrugado.
- Para a configuração específica listada na etapa 2.5, os pontos são iluminados por baixo por uma fase de vidro transparente com CE 1500 CL fonte de luz fria, enquanto as imagens são capturadas a partir de cima. Esta configuração é ideal para imagens de desenvolvimento colônia enrugado porque V. fischeri colônias (manchas) são translúcidas.
- Na ausência do equipamento específico listado em rep 2,5, monitor morfologia da colônia enrugado usando qualquer microscópio de dissecação que permite a visualização colônia completa e tem uma fonte de luz ajustável e, idealmente, uma câmera acoplada. Se necessário, uma câmara digital também pode ser utilizado na ausência de uma câmara em anexo, mas isto não é o ideal.
- Para melhor visualizar o desenvolvimento de colónias enrugada, é necessário ajustar a intensidade da iluminação e ângulo de reflexão debaixo das colónias de bactérias tais que a morfologia tridimensional dos biofilmes em desenvolvimento podem ser discernidas. Determinar as condições de iluminação óptimas que fornecem a maior contraste entre a colónia manchado eo fundo de agar circundante, de tal modo que a arquitectura (rugas) da colónia é claramente distinguível.
- Em alguns casos, a cor da colónia manchado também deve ser tido em consideração, como alterações na cor de colónias pode ocorrer durante a formação do biofilme. Ajustar a intensidade eo ângulo da fonte de iluminação para revelaressas mudanças sutis na coloração. Uma vez que as configurações adequadas são alcançados, mantê-las para a duração da experiência.
- Note-se como o tempo decorrido desde o momento da inoculação para o momento em que a formação de colónias enrugada inicia para cada estirpe ou condição. Definir o início da formação de colónias enrugada como o ponto de tempo em que a formação de padrões e estruturas 3D (isto é, formando estrias na borda exterior ou 'ondulações' ocorrendo no centro) é primeiro aparente. As células mutantes podem apresentar diminuição ou aumento do tempo para o início da formação de colónias enrugada (por exemplo, a fig. 2).
- Documentar o início eo desenvolvimento de formação de colónias enrugada através da captura de imagens digitais apropriados. É importante usar a mesma ampliação aquando da recolha de imagens ao longo da experiência. Mudar o ponto de vista do óculo do microscópio para a tela de computador utilizando a alavanca localizada na parte traseira da câmara. Ao alternar entre a oculare visualização de tela do computador, ajustar a vista e se concentrar em conformidade.
- Antes de culturas de imagem manchados, a tampa da placa de Petri é tipicamente removido para proporcionar a imagem mais clara. No entanto, este é um passo opcional, como culturas manchados pode ser trabalhada através da tampa utilizando a configuração descrita nos passos 2.5 e 2.6.
- Em cada ponto de tempo após o início da formação da colônia enrugado, observe o padrão de desenvolvimento colônia enrugado. A arquitetura pode desenvolver a partir de dentro para fora, ou fora para dentro Esta avaliação fornece um mecanismo para distinguir os biofilmes formados por estirpes diferentes ou em condições diferentes.
- Medir o diâmetro da colónia desenvolvimento em cada ponto de tempo. Isto pode ser feito manualmente ou digitalmente utilizando um programa de software associado. Se isso for feito digitalmente, utilizar o programa de software ProgRes CapturePro e primeiro calibrar a barra de escala para a ampliação específico utilizado na experiência. Incluir a barra de escala em cada imagem capturada.
- Para calcular o diâmetro de colônias usando o programa de software ImageJ, abra cada arquivo de imagem. Padronizar a barra de escala da seguinte forma: Selecione a opção "linha reta" na barra de ferramentas. Sobrepor a barra de escala incorporado com uma linha reta de mesmo comprimento e largura. Selecione "Definir Escala" da guia "Analisar". No "conhecido distância" caixa, insira o comprimento correspondente (como determinada a partir da barra de escala original, ou seja, 2 mm) e selecione "OK".
- Use o "Straight line" opção para inserir uma linha horizontal em todo o local. Sob a guia Analisar, selecione "Measure". Na janela de resultados novos, o comprimento calculado será fornecido. Obter uma segunda medição através da inserção de uma linha perpendicular através do local. Re-calcular o diâmetro. Gravar a média das duas medições. Gráfico o diâmetro médio para cada mancha em cada ponto de tempo usando um programa de software, como Excel.
- O fim da experiência ocorre quer a um ponto de tempo especificado, ou quando não existe qualquerdesenvolvimento do biofilme. Uma vez que o fim é alcançado, consolidar as imagens em uma figura (s) para visualizar o desenvolvimento do padrão ao longo do tempo usando um programa como o PowerPoint.
3. Os resultados representativos
Nestes experimentos utilizamos V. fischeri como um organismo modelo para estudar a formação de biofilmes por avaliação do desenvolvimento de colónias enrugadas sobre uma superfície de agar sólido. Biofilme produtoras de cepas de V. formam colônias fischeri com arquitetura 3D extensiva no prazo de 40 h (Fig. 1) 8,9,14. Quando examinado ao longo de um curso de tempo, torna-se aparente que a formação de colónias enrugada por uma estirpe de controlo inicia tão cedo quanto cerca de 12 h pós-inoculação (dependendo das condições específicas) (fig. 2) 9. Em contraste, a formação de biofilmes por um mutante representativo é atrasada em aproximadamente 4 h, não dar início até aproximadamente 16 h pós-inoculação 9. REPEAts desses experimentos sugerem que o tempo foi relativamente consistente, fazer esta avaliação semi-quantitativa 9. Uma medida semi-quantitativa segundo de formação de biofilmes faz uso da mudança de diâmetro da colónia desenvolver ao longo do tempo. Como mostrado na fig. 3A, uma estirpe de biofilme-competente formas representativas de colónias que aumento da complexidade e do diâmetro em relação a uma estirpe representativa que não formam o biofilme. Medições cuidadosas ao longo do tempo dos diâmetros das colónias formadas por estas duas estirpes revelou que o tamanho das colónias de biofilme-competentes aumentada a uma taxa maior do que as colónias de biofilme-negativas, e no ponto de tempo final os dois diferiam em quase 2 - dobragem (Fig. 3B). Assim, embora as imagens de um tempo representativo tardia ou "ponto final" morfologia das colónias frequentemente são mostrados na literatura, adicionais, semi-quantitativa dados podem ser recolhidos que irá permitir uma melhor compreensão do defeito do biofilme.
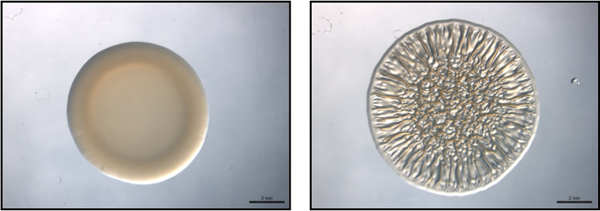
Figura 1. Fim ponto de ensaio. Esta figura é um exemplo de um ensaio de ponto final usando representativos não-biofilme formadoras (esquerda) e de formação de biofilme (à direita) estirpes de V. fischeri. Estas imagens foram recolhidas a 40 h pós-spotting. Estas imagens foram geradas com o tipo selvagem V. fischeri que contém um controle de vetores (não de formação de biofilme) ou um RSCS parte superexpressão do plasmídeo (de formação de biofilme) e eram do conjunto de dados coletados por Morris et al., 2011.
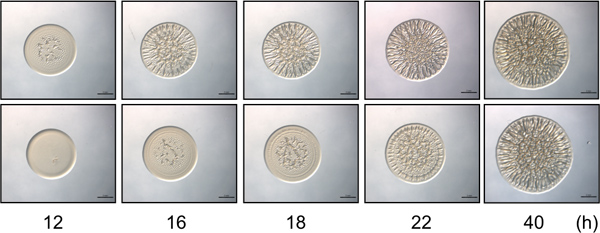
Figura 2. Ensaio curso. O painel superior contém imagens representativas de formação de biofilmes por uma estirpe de controlo biofilme-competente de V. fischeri ao longo de um curso de tempo seleccionado. Iniciação de formação de biofilme é evidente a 12 h. O painel inferior contém i representantemages de uma estirpe mutante de V. fischeri que apresenta um atraso (4 h) no início da formação de colónias enrugada ao longo do tempo, com a formação de biofilmes de início às 16 h pós-inoculação. Note-se que menos 40 horas, as estirpes de aspecto semelhante na intensidade e padronização de formação de biofilme, enquanto as diferenças subtis entre estas estirpes são observados apenas nos pontos de tempo anterior. Estas imagens foram geradas com RSCS superexpressão do tipo selvagem e mutante Sype V. células fischeri e eram parte do conjunto de dados coletados por Morris et al., 2011.
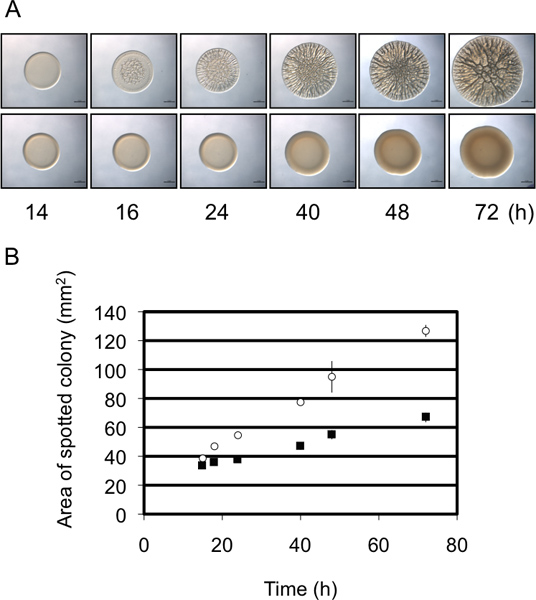
Figura diâmetro Colony 3. Como uma análise semi-quantitativa da formação de biofilmes. (A) curso Tempo de formação de biofilmes por representativos biofilme formadoras (painel superior) e não-biofilme-forming (painel inferior) das cepas de V. fischeri. Note-se que a estirpe de formação de biofilme apresenta um maior aumentode diâmetro ao longo do tempo em relação à estirpe não-biofilme de conformação. Estas imagens foram geradas com o tipo selvagem V. fischeri contendo um RSCS parte superexpressão do plasmídeo (de formação de biofilme) ou um controle de vetores (não de formação de biofilme) e eram do conjunto de dados coletados por Morris et al., 2011. (B) Uma representação gráfica do aumento do diâmetro colónia ao longo do tempo por as duas estirpes de painel A. Estes dados foram gerados utilizando o software ImageJ e Excel, conforme descrito no protocolo.
Discussão
Neste trabalho, nós descrevemos um método semi-quantitativo para avaliar a formação de biofilme com V. fischeri como um organismo modelo. Especificamente, nós utilizamos um microscópio de dissecação com anexo câmara para monitorizar a formação de biofilmes e desenvolvimento como a formação de colónias enrugada ao longo do tempo sobre uma superfície de agar sólido. Neste protocolo, destacamos dois tipos específicos de métodos que comumente usam para avaliar a formação da colônia enrugado. O primeiro é o ensaio de ponto final, o que nos permite observar a final, arquitetura geral 3D, padronização, e diâmetro de uma cultura manchado em um ponto selecionado de tempo "final". Esta abordagem é mais útil para a avaliação estirpes mutantes ou condições que conduzem a defeitos dramáticas na formação de biofilmes. No entanto, essa abordagem não faz distinção entre diferenças mais sutis que ocorrem em momentos antes de o selecionado de ponto final. Para acompanhar mais de perto a formação de colônia enrugado, nós usamos um ensaio de evolução no tempo, que nos permite identificar o início de wrinkled formação de colônias e observar a sua evolução no tempo. Como um resultado desta abordagem, as diferenças mais subtis no momento da formação de colónias enrugada, a arquitectura 3D, e padronização pode ser identificado. Utilizou-se este ensaio curso de tempo para gerar dois semi-quantitativos ensaios de formação de biofilmes. Em primeiro lugar, o momento em que uma estirpe começa a desenvolver arquitectura 3D pode ser comparada com a de estirpes de controlo. Nós descobrimos que o atraso na formação de biofilmes de um mutante particular sob as mesmas condições é razoavelmente consistente 9. Por exemplo, nos dados mostrados na fig. 2, o mutante de forma consistente exibiram um atraso de cerca de 4 h em iniciar a formação de biofilmes. Uma medida semi-quantitativa segundo de formação de biofilme é a alteração no tamanho do diâmetro da colónia enrugada (spot). Descobrimos que o diâmetro das colónias enrugadas progressivamente difere da do não-biofilme colónias, atingindo cerca de uma diferença de 2 vezes no ponto de tempo final (Fig. 3 ) (Morris e Visick, dados não publicados). Até o momento, não observamos um fenótipo sem a outra (ou seja, a formação de biofilme sem um aumento no diâmetro das colônias) (dados não publicados), embora continue a ser possível que alguns mutantes irão se comportar de forma diferente. Na verdade, tem sido relatado para V. cholerae que algum resultado colônias amassado em um aumento substancial no diâmetro das colônias, enquanto outros não 15. Ainda assim, avaliar a mudança de diâmetro ao longo do tempo poderia ajudar na caracterização de mutantes de biofilme potenciais e / ou fornecer uma medida adicional quantitativa de mutantes com atrasos no desenvolvimento. Das duas medidas de formação de biofilme (tempo e de diâmetro), determinando o início da formação de colónias enrugado é mais sensível, mas também mais subjectiva, do que a determinação do diâmetro do local. Mesmo assim, ambas as medidas proporcionar uma avaliação semi-quantitativa de um fenótipo que é extremamente útil para os investigadores de biofilme, mas não é facilmente passível de quantification.
Ao realizar ensaios manchados cultura, é importante considerar as condições ambientais em que as cepas manchados são cultivadas. Formação de colônias enrugada é freqüentemente influenciada por várias condições ambientais, incluindo a disponibilidade de nutrientes, temperatura e umidade. Para reduzir a variabilidade entre as experiências, é útil para padronizar estas condições o máximo possível (ie padronizar as placas de agar para um volume definido e cultivando as estirpes manchados a uma temperatura controlada). Para o controlo adicional para a variabilidade entre os experimentos spotting, é importante incluir as estirpes de controlo adequadas dentro de cada conjunto de experiências. Finalmente, quando a interpretação dos dados a partir destes ensaios, é necessária a realização de qualquer uma experiência várias vezes (3 +), especialmente quando avaliar diferenças subtis na formação de colónias enrugada (eg, um atraso na formação de biofilme ou diferenças de padronização). Algumas limitações do presente protocolo são: 1) detering se as células têm um defeito no crescimento pode ser difícil: o crescimento de células em cultura líquida pode não reflectir com precisão as taxas de crescimento em meios sólidos, e uma determinação precisa do crescimento do biofilme formadoras de células, que podem ficar juntos, pode não ser possível; 2) as estirpes com defeitos de crescimento vai ser problemático para analisar; 3) pode não ser possível distinguir diferenças de diâmetro entre as estirpes com fenótipos de biofilme subtis, 4) para as estirpes que não crescem em um anel concêntrico, pode não ser possível medir com precisão mudanças de diâmetro, 5), enquanto padronização podem ser observados durante a formação do biofilme, não há maneira de quantificar a padronização do biofilme resultante; e 6) não há maneira de medir a dimensão Z-do biofilme com este conjunto experimental . Apesar destas limitações, este protocolo, no entanto, fornece um meio para obtenção de dados numéricos para auxiliar na avaliação da formação da colônia enrugado.
Neste protocolo, nós utilizamos um imagem específicasistema (ou seja, um microscópio Zeiss dissecação e ProgRes CapturePro software de imagem) para observar e avaliar a formação de colônia rugosa. O sistema de imagem descrita aqui é poderosa: a capacidade de detectar o início da formação de colónias enrugada, e, assim, avaliar o desenvolvimento com uma abordagem ao longo do tempo, é grandemente aumentada através do uso de um microscópio de dissecação. No entanto, se esta tecnologia não está disponível, o protocolo pode ser adaptado para uso com outro equipamento, incluindo uma câmara digital simples com um foco de zoom. Embora este protocolo centra-se na avaliação do desenvolvimento de colónias enrugado, também poderia ser modificado para avaliar a formação de película, uma forma de biofilme que se desenvolve quando as células estão a crescer em cultura líquida estaticamente. Este protocolo também pode ser útil na avaliação de outros indicadores de formação de biofilme, incluindo a incorporação de corantes específicos para as colônias manchados durante o desenvolvimento do biofilme. Estes incluem, mas não estão limitados a, corantes, tais como Congo Red e calcofluou que pode ligar à celulose, um componente comum de biofilmes bacterianas 16. Além disso, este protocolo, embora desenvolvido para utilização com V. fischeri, não está limitada a este organismo, mas pode ser generalizada para estudar a formação de biofilme em numerosos organismos diferentes, tais como Bacillus subtilis 4, Vibrio cholerae 5, Vibrio parahaemolyticus 6, 7 e Pseudomonas aeruginosa, que todos apresentam a formação de colónias enrugada. Finalmente, também pode ser adaptado para estudar morfologias de colónias outros que têm um padrão de desenvolvimento, tais como, potencialmente, o padrão que ocorre durante o crescimento de Myxococcus xanthus 17 e desenvolvimento de estruturas aéreas em Pseudomonas aeruginosa 18. Este protocolo é, portanto, de uso geral para os pesquisadores de microbiologia e biofilme.
Divulgações
Não há conflitos de interesse declarados.
Agradecimentos
Este trabalho foi suportado pelo NHI R01 concessão GM59690 concedido a KLV.
Materiais
| Name | Company | Catalog Number | Comments |
| Nome do Equipamento | Companhia | Número de Catálogo | Comentários |
| Zeiss STEMI 2000-C microscópio de dissecção | Zeiss | 45505300000000000 | (Obtidas através de microscópio Lukas) |
| ProgRes C10 PLUS | JENOPTIK Optical Systems GmbH | 017953-602-26 | Câmera anexo (obtidas através de microscópio Lukas) |
| CL 1500 CE Fonte de Luz Fria | Zeiss | 4355400000000000 | (Obtidas através de microscópio Lukas) |
| ProgRes CapturePro | JENOPTIK Optical Systems GmbH | Software livre com câmera registrado | Programa de computador para captura de imagem |
| Image J | NIH | O software livre a partir de:ij / download.html "target =" _blank "> http://rsb.info.nih.gov/ij/download.html | Programa de computador para medições de diâmetro |
Referências
- Donlan, R. M., Costerton, J. W. Biofilms: survival mechanisms of clinically relevant microorganisms. Clin. Microbiol. Rev. 15, 167-167 (2002).
- Stoodley, P., Sauer, K., Davies, D. G., Costerton, J. W. Biofilms as complex differentiated communities. Annu. Rev. Microbiol. 56, 187(2002).
- Branda, S. S., Vik, S., Friedman, L., Kolter, R. Biofilms: the matrix revisited. Trends Microbiol. 13, 20(2005).
- Branda, S. S. Fruiting body formation by Bacillus subtilis. Proc. Natl. Acad. Sci. U.S.A. 98, 11621-11621 (2001).
- Beyhan, S. Regulation of rugosity and biofilm formation in Vibrio cholerae: comparison of VpsT and VpsR regulons and epistasis analysis of vpsT, vpsR, and hapR. J. Bacteriol. 189, 388(2007).
- Enos-Berlage, J. L., Guvener, Z. T., Keenan, C. E., McCarter, L. L. Genetic determinants of biofilm development of opaque and translucent Vibrio parahaemolyticus. Mol. Microbiol. 55, 1160(2005).
- Merritt, J. H., Brothers, K. M., Kuchma, S. L., O'Toole, G. A. SadC reciprocally influences biofilm formation and swarming motility via modulation of exopolysaccharide production and flagellar function. J. Bacteriol. 189, 8154-8154 (2007).
- Yip, E. S., Geszvain, K., DeLoney-Marino, C. R., Visick, K. L. The symbiosis regulator rscS controls the syp gene locus, biofilm formation and symbiotic aggregation by Vibrio fischeri. Mol. Microbiol. 62, 1586-1586 (2006).
- Morris, A. R., Darnell, C. L., Visick, K. L. Inactivation of a novel response regulator is necessary for biofilm formation and host colonization by Vibrio fischeri. Mol. Microbiol. 82, 114(2011).
- Nyholm, S. V. Roles of Vibrio fischeri and nonsymbiotic bacteria in the dynamics of mucus secretion during symbiont colonization of the Euprymna scolopes light organ. Appl. Environ. Microbiol. 68, 5113(2002).
- Yip, E. S., Grublesky, B. T., Hussa, E. A., Visick, K. L. A novel, conserved cluster of genes promotes symbiotic colonization and σ54-dependent biofilm formation by Vibrio fischeri. Mol. Microbiol. 57, 1485(2005).
- Mandel, M. J. A single regulatory gene is sufficient to alter bacterial host range. Nature. 458, 215(2009).
- Graf, J., Dunlap, P. V., Ruby, E. G. Effect of transposon-induced motility mutations on colonization of the host light organ by Vibrio fischeri. J. Bacteriol. 176, 6986(1994).
- Geszvain, K., Visick, K. L. The hybrid sensor kinase RscS integrates positive and negative signals to modulate biofilm formation in Vibrio fischeri. J. Bacteriol. 190, 4437(2008).
- Krasteva, P. V. Vibrio cholerae VpsT regulates matrix production and motility by directly sensing cyclic di-GMP. Science. 327, 866(2010).
- Romling, U. Characterization of the rdar morphotype, a multicellular behaviour in Enterobacteriaceae. Cell Mol. Life. Sci. 62, 1234(2005).
- Berleman, J. E., Chumley, T., Cheung, P., Kirby, J. R. Rippling is a predatory behavior in Myxococcus xanthus. J. Bacteriol. 188, 5888(2006).
- Lee, K., Veeranagouda, Y. Ultramicrocells form by reductive division in macroscopic Pseudomonas aerial structures. Environ. Microbiol. 11, 1117(2009).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados