Method Article
Processamento da mamoplastia redutora e tecidos humanos Mastectomia para cultura de células
Neste Artigo
Resumo
Um método para processar o material de descarte mamária humana cirúrgico é descrito. Tecido transformado, sob a forma de Organóides, podem ser armazenadas congeladas indefinidamente ou colocadas em cultura para crescimento a longo prazo. Este método permite a análise experimental da biologia celular epitelial humana normal, e os efeitos das perturbações exógenas.
Resumo
Exame experimental de comportamento epitelial humana normal das células mamárias (HMEC), e como normal, as células adquirem propriedades anormais, pode ser facilitada por sistemas de cultura in vitro, que maior precisão do modelo em biologia vivo. A utilização de material derivado humano para estudar a diferenciação celular, envelhecimento, senescência, e imortalização é particularmente vantajosa tendo em conta as muitas diferenças significativas moleculares nestas propriedades entre as células humanas e de roedores comumente utilizado 1-2. Células mamárias apresentam um sistema modelo conveniente, porque grandes quantidades de tecidos normais e anormais estão disponíveis devido à freqüência da mamoplastia redutora e cirurgias de mastectomia.
A glândula mamária consiste de uma mistura complexa de muitos tipos de células diferentes, por exemplo, tecido adiposo, epitelial, mesenquimal, endoteliais. As células epiteliais são responsáveis pela função diferenciada mamária de lactação,e são também a origem da grande maioria dos cancros da mama humanos. Nós desenvolvemos métodos para processar tecidos de glândula mamária de descarte cirúrgicos em puros componentes epiteliais, bem como células mesenquimais 3. O material processado pode ser armazenado congelado indefinidamente, ou iniciados em cultura primária. O material de descarte cirúrgico é transportado para o laboratório e manualmente dissecado para enriquecer para o tecido epitelial contendo. Digestão posterior do tecido dissecado usando colagenase e hialuronidase tiras de material a partir do epitélio do estroma na membrana basal. Os pedaços resultantes pequenas da árvore epitelial (Organóides) pode ser separado a partir do estroma digerido por filtração sequencial sobre membranas de dimensão de poro fixa. Dependendo do tamanho do poro, podem ser obtidas fracções consistindo em maiores ductais / alveolar peças, aglomerados menores alveolar, ou células do estroma. Temos observado crescimento superior quando as culturas são iniciadas como Organóides em vez de dissociada células individuais. Colocação de Organóides na cultura usando a mídia de baixo estresse indutores suporta crescimento de longo prazo de HMEC normal com marcadores de linhagem tipos múltiplos (mioepiteliais, progenitor, luminal) 4-5. Um número suficiente de células podem ser obtidas a partir de tecido de um indivíduo para permitir o exame experimental extenso usando lotes de células padronizados, bem como o uso de interrogação modalidades de elevada capacidade.
HMEC cultivadas têm sido empregues numa vasta variedade de estudos que examinam os processos normais que regulam o crescimento, diferenciação, o envelhecimento, e senescência, e como estes processos normais são alteradas durante a transformação maligna e imortal 4-15,16. Os efeitos do crescimento na presença de material de matriz extracelular, outros tipos de células, e / ou a cultura em 3D pode ser comparado com o crescimento em 5,15 plástico. HMEC cultivadas, a partir de células normais, fornecer um sistema experimental para examinar os factores tratável quepode impulsionar ou prevenir o envelhecimento humano e carcinogênese.
Protocolo
1. Processamento de tecido e Digestão
- Obtenção de tecido mamário humano como material de descarte de procedimentos cirúrgicos. Mammoplasties de redução pode fornecer células normais ou benignos; fibroadenomas e ginecomastias fornecer células benignas; tecidos não tumorais mastectomia (contralateral ou periférico a um tumor, ou subcutânea) proporcionar células que podem variar de normal benigno para microtumors contenham. Garantir a aprovação do IRB adequada existe antes de obter o material de descarte. Todo o material deve ser tratado segundo pelo sangue regulamentos patógenos.
- Coloque o material em recipientes estéreis contendo tampão ou meios de comunicação (por exemplo, 1:1 Meio Modificado por Dulbecco Eagle e de Ham F-12) suplementado com 100 U / ml de penicilina, estreptomicina 100 ug / ml, 5 ug / ml de Fungizone, 50U/ml polimixina B, e 10% de soro fetal bovino, e o transporte para o laboratório, a 4 ° C. Tecido mamoplastia de redução podem ser armazenados ou expedidos a 4 ° C durante 72 horas sem afectar significativamente sua viabilidade celular bsequent. Pequenos pedaços de não-redução do tecido mamoplastia pode exigir um processamento mais rápida.
- Separa-se as áreas epiteliais a partir da matriz de estroma de tecido adiposo, o tecido conjuntivo e os vasos sanguíneos, utilizando uma combinação de escalpelo esterilizado, fórceps e tesouras. Corte pedaços de tecido com uma tesoura e coloque em um prato de vidro esterilizado grande (por exemplo, 150 mm). Suavemente dissecar as áreas epiteliais, que aparecem como fios brancos incorporados na matriz de estroma yellower, utilizando as pinças para segurar o material e o bisturi para raspar o material grosseiramente gordo. Para facilitar a digestão, cortar o tecido epitelial em pedaços mais pequenos de ~ 3-4 mm utilizando bisturis opostos e colocá-las num tubo de ensaio de 50 ml. Se grandes quantidades de tecido estão a ser processados, frescos lâminas de bisturi pode ser necessária. Remover material gorduroso do prato para eliminação de acordo com os regulamentos institucionais.
- Em tecidos altamente fibrosos (por exemplo, a injecção subcutânea mastectomies com doença fibrocística grave), não haverá mais sólido branco, material não epiteliais. , Pode ser difícil para dissecar as células epiteliais a partir de matrizes fibrosas tais. Pedaços grandes de material fibroso pode ser cortado em pedaços mais pequenos que sejam ~ 1-3 mm quadrado de área e digerido separadamente.
- Colocar o tecido epitelial dissecados para um tubo de centrífuga cónico (50 ml ou 15 ml) com o tecido que compreende não mais do que um terço do volume do tubo. Traga o tubo até ao volume total, deixando apenas um pequeno espaço de ar para permitir a mistura, durante a rotação, através de um tecido de mistura de digestão (DME/F-12 ou equivalente, 10 insulina ug / ml, os antibióticos como acima, e a concentração final de 10 % de FCS, 200 U de colagenase bruta / ml e 100 hialuronidase U / ml.
- Colocar os tubos em um tubo de rotor HulaMixer e rodar de 360 ° a 8 rpm durante a noite a 37 ° C.
- Centrifugar os tubos a 600 xg durante 5 min. Descarte a gordura sobrenadante e meio de acordo de eliminaçãoção aos regulamentos institucionais.
- Verifique a conclusão da digestão, diluindo uma pequena alíquota do sedimento em meio. A digestão é completa quando o exame microscópico mostra aglomerados de células (Organóides) com estruturas de aparência suave ductais, alveolar ou ductal-alveolar livre de estroma em anexo (Figura 1A). Tecidos mamoplastia de redução geralmente ainda apresentam estroma anexado após uma digestão durante a noite e vai exigir tempo de digestão adicional.
- Ressuspender o sedimento digerido na mistura fresca de tecido de digestão e re-incubar com rotação a 37 ° C durante mais uma hora 4-12. Repita os passos 1.6 e 1.7. Se a digestão é ainda incompleta, novamente adicione a mistura de digestão para o sedimento e re-incubar com rotação a 37 ° C durante a noite. A concentração de enzimas pode ser reduzido para evitar a sobre-digestão durante a noite.
- Quando está completa a digestão, centrifugar os tubos a 600 xg durante 5 min, aspirar o digestion mistura, ressuspender o pellet em média, mais antibióticos a cerca de 15 mL/50 tubo ml, 5 ml ml/15 tubo.
2. Filtração e congelação do material digerido
- Transferir alíquotas de sedimento ressuspenso em um filtro estéril 100 mM ao longo de um tubo estéril de 50 ml. Deixe que a fuga de meio para dentro do tubo, em seguida, lavar novamente os Organóides no topo 1-2x vezes com 2-3 ml de meio. Repetir até que todo o sedimento ressuspenso foi transferido. Se existem demasiados Organóides sobre o filtro e o meio não drena facilmente, utilizar um novo filtro (s) para o restante material. Cuidadosamente virar o filtro (s) em cima de outro tubo estéril e lavar os Organóides para dentro do tubo com mais meio. Este é o 100 piscina organóides jim.
- Levar o material que drenado para dentro do tubo original de 50 ml e repetir o processo de 2,1 utilizando um filtro de 40 | iM, para se obter o 40 piscina organóides um, o qual contém principalmente estruturas alveolares. O material que drenado em thtubo e constitui a piscina filtrado, que contém aglomerados individuais / pequeno de células mesenquimais e epiteliais e pequenos pedaços da vasculatura.
- Pellet os 100 um, 40 um, e piscinas de filtrado a 600 xg durante 5 min.
- Aspirar a reconstituir, o sobrenadante de cada tubo em CPM II (DME/F-12 ou equivalente com FCS 44% e 6% de DMSO) com cerca de 1 ml de CPMII por 0,1 ml de concentrado de pellet. Manter a 4 ° C.
- Semente de um prato de ensaio para os dois conjuntos de organóides colocando 0,1 ml de material de ressuspenso para a cultura de um tecido gota 35 milímetros prato plástico a gota, como em 3.2 abaixo. O pool de filtrado pode ser directamente semeado em plástico de cultura de tecidos com meio de fibroblastos (DME/F-12 ou equivalente com 10 ug / ml de insulina e 10% de FBS).
- O material restante alíquota ressuspenso em ampolas de congelação Nunc de tipo (1 ml / ampola 2 mL). Congelar durante a noite a -80 ° C e, em seguida, transferir imediatamente para armazenamento em azoto líquido. Não observamos nenhuma perda significativa de viabilidadenas nossas ampolas originais armazenadas congeladas desde o final dos anos 1970.
3. Semeadura Organóides congelados e subcultura de culturas primárias
- Descongelar rapidamente a ampola congelada contendo os Organóides em um banho de água a 37 ° C. Semente as Organóides em 2 a 10 (geralmente 60 ~ 6) pratos mm, ou 1-3 placas de 100 mm, dependendo da estimativa visual do número de Organóides na ampola. Organóides aproximadamente 20-40 semeados por 60 milímetros prato é o ideal.
- Organóides descongelados são cuidadosamente colocados, gota a gota, para a superfície de prato com uma pipeta de 1 ml ou pipeta de Pasteur para uma distribuição uniforme da Organóides. Organóides colocados próximos um do outro terá um espaço limitado para o crescimento, dando origem a menos células de subcultura ou congelamento. Evite arranhar a superfície do prato (células tendem a não crescer últimos superfícies arranhadas). Espere 1-2 minutos para permitir que os Organóides anexar e, em seguida, adicione lentamente meio de crescimento para evitar o desprendimento de Organóides (por exemplo, 2-3 prato milímetros ml/60). Euncubate a 37 ° C na incubadora de CO 2 humidificado. Estas são as culturas primárias. Atualmente usamos M87A + oxitocina meio (X) para o crescimento mais robusto HMEC (Figura 2).
- Depois de um dia, verifique se os Organóides estão ligados. Adicionar meio adicional (por exemplo, 2-3 milímetros ml/60 prato). Migração de células a partir das Organóides deve ser visível por 24-48 h, e excrescência mitótico por 48-72 horas após a sementeira (Figura 1B, C). Às vezes apego é ruim após 24 horas, principalmente se chapeamento Organóides overdigested ou Organóides de mulheres mais velhas, mas a maioria das preparações irá anexar no prazo de 72 horas. Pequenos pedaços de a vasculatura pode juntar e dar origem a excrescência de células de fibroblasto (Figura 1D).
- Alimente culturas pelo menos 3 vezes por semana. As células cultivadas em meios de comunicação do tipo M87A crescer até à confluência próximo dentro de 5-8 dias, dependendo da densidade de sementeira.
- Se não houver crescimento do fibroblasto significativo, tripsinização Diferencial (DT), com base nadesprendimento rápido de fibroblastos a partir do plástico da superfície, é necessária para remover os fibroblastos. Quando as manchas epiteliais tornam-se grandes, mídia aspirado, prato lavagem (por exemplo, 1-2 ml/60 prato mm) com STE (solução salina, tripsina 0,05%, EDTA 0,02%), aspirado, adicione STE ml fresco 0,5 e deixar em temperatura ambiente por cerca de 1 min com a observação microscópica contínua. Quando os fibroblastos separar as células epiteliais, mas são ainda aderente, suavemente, mas nitidamente pancada do lado do prato de encontro a uma superfície dura, para desalojar os fibroblastos e, em seguida, rapidamente, aspire. Lavar uma vez com PBS, e aspirar de novo. Culturas contaminadas com fibroblastos podem precisar de uma DT adicional.
- Subcultura culturas primárias quando grandes manchas epiteliais estão presentes, mas antes de confluência. A densidade de sementeira e organóides anexo irá influenciar o tempo necessário. Para manter a cultura primária e para gerar múltiplas culturas secundárias, espaçadas ao longo do tempo, realizamos Trypsinizations parciais (PT).
- Mídia Aspirar, lavar um prato 60 mm com 1-2 STE ml, adicionar 0,5 ml STE fresco ao prato. Observar descolamento das células ao microscópio, à temperatura ambiente durante 1-5 minutos, com batidas suaves da placa para promover o descolamento das células. Tripsinização deve ser parada quando aproximadamente 50% das células foram separadas. Precoce PTs têm geralmente descolamento celular rápida. Para mais tarde PTs, as células podem ser colocadas a 37 ° C durante mais rápido desprendimento, com monitorização cuidadosa, já que todas as células podem soltar-se rapidamente.
- Adicionar 2 ml de meio contendo soro para o prato, repipette para lavar, e transferir para um tubo estéril de 15 ml. Repita 2x com outros ~ 1-2 ml de meio, adicionar a solução de lavagem para o tubo. Refeed o prato principal e voltar a incubadora. Contar as células no tubo com o hemocitómetro. PTs pode ser repetido cerca de 4 a 8 vezes com recrescimento de células bem nos pratos principais e crescimento a longo prazo dos componentes secundários equivalente subcultivados ou congeladas (células segunda passagem são chamados secundários, uma vez subcultivadas, as células não são eisprimárias NGER). Uma vez que o material organóides já não está presente nas culturas primárias, secundárias subcultivados mostram um declínio no potencial de longo prazo de duplicação da população.
- Para subcultura de componentes secundários, as células de semente directamente a partir do tubo dentro de pratos. Sementeira de 1-2 x 10 mm 5 células/100 prato em meio sólido tal como M87A + X irá conduzir a confluência em 4-7 dias. Acrescentamos toxina da cólera ao meio em segunda passagem para aumentar o potencial proliferativo; toxina da cólera é omitida em cultura primária porque conduz a excrescência de células de várias camadas a partir dos Organóides.
- Para a congelação como secundárias, pellet tubo a 600 xg durante 5 min, e ressuspender em CPMII com uma densidade final de 10 6 células / ml. Alíquota células ressuspensas em ampolas de congelação Nunc de tipo, congelar durante a noite a -80 ° C e, em seguida, transferir imediatamente para armazenamento em azoto líquido.
- Recomenda-se para congelar as células a partir da primeira para a guarda PT, eutilizar células do PT segunda subcultura. PTs adicional pode ser armazenado congelado para uso futuro.
Resultados
Valores representativos para tecidos adequadamente digeridas para Organóides e colocados em cultura são mostrados na Figura 1. Tecido digerido irá mostrar o material ainda está ligado para o exterior destas estruturas, e é provável que tenha algum crescimento de células fibroblásticas em cultura primária, necessitando de DT para remover. Tecido Overdigested vai mostrar menos suaves fronteiras externas, e pode levar mais tempo para anexar em cultura primária. Outgrowth epitelial deve começar dentro de 48-72 h (1B, C). Pequenos pedaços de vascularização (1D) pode ser uma fonte de crescimento de células mesenquimais. Outgrowths epiteliais mostrar populações morfologicamente heterogéneas, com populações proliferativas que contêm misturas de células com marcadores associados com a progenitora, mioepiteliais, e linhagens luminais (1E, 3C-E). Crescimento em meios de baixa tensão, como M87A suplementadas com toxina da cólera e ocitocina vai apoiar superior a longo prazocrescimento do normal pré-estase HMEC em comparação com as formulações anteriores de media (Figura 2). M87A tipo media também irá suportar o crescimento de células luminais e progenitoras através de passagens 4-8 (Figuras 3C-E, 4), depois disso, a maioria dos marcadores de linhagem de células mostram apenas mioepiteliais. HMEC cultivadas em plástico podem conservar a sua capacidade de formar 3D adequada da auto-organização em micropatterned 3D micropoços, com células luminais interior de células mioepiteliais (Figura 4A, B), e de modo a formar estruturas organizadas, quando plaqueadas em Matrigel (4C, D).
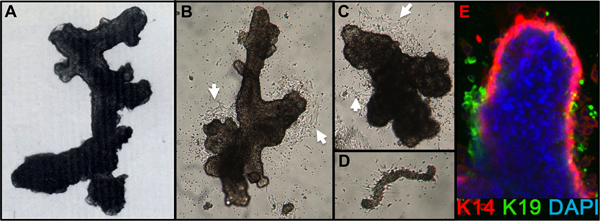
Figura 1. Organóides HMEC e cultura primária. (A) organóides mostrando ductal-alveolar estrutura após a digestão e filtração. (B, C) que mostra a estrutura Organóides ductal e alveolar de 2 dias após a colocação em cultura primária; observe a célula inicial outgrowth (setas brancas). (D) pequeno vaso sanguíneo ligado e com o início de crescimento de fibroblastos de culturas mesmas B, C. (E) excrescência de células epiteliais de cultura primária organóides após 4 dias. Linhagens são identificados por coloração com anticorpos anti-K14 (vermelho) e K19 (verde); núcleos foram coradas com DAPI (azul). Luminal (K14-/K19 +, verde), mioepitelial (K14 + /-K19, vermelho), e progenitor (K14 + / + K19, amarelo), as células são visíveis. As células não coradas são observados no núcleo organóides devido à penetração de anticorpos incompletos.
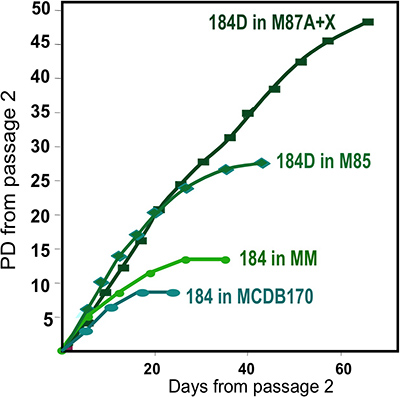
Figura 2. Crescimento das culturas HMEC em diferentes formulações de mídia. Organóides obtidos de um indivíduo, a amostra 184, foram iniciados na cultura principal, utilizando diferentes formulações de mídia. Melhor crescimento a longo prazo, é obtido utilizando a nossa formulação mais recente, M87A + oxitocina (X) 4. Este meio também suportacrescimento de várias linhagens de HMEC (ver fig. 1E). Uma formulação de meios anteriormente, MM 3 fornecida crescimento menos robusto, enquanto que um meio isento de soro, MCDB170 (MEGM comercial) 17 leva a indução rápida da ciclina quinase p16 inibidor INK4a e selecção para as células aberrantes 7,11,13.
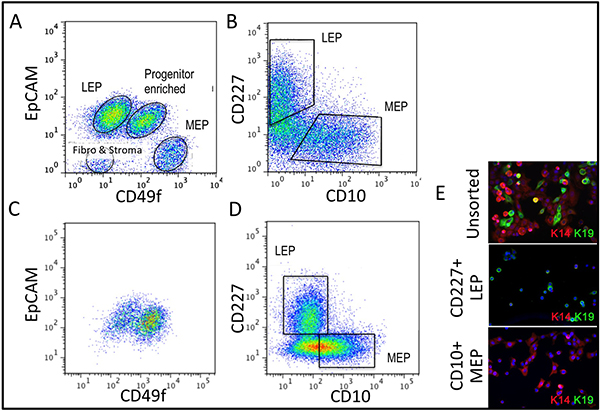
Figura 3. Comparação da diversidade na linhagem Organóides incultas e HMEC cultivadas a 4 ª passagem análise FACS. (A, B) de um organóides, uncultured dissociado enzimaticamente para a expressão (A) de EpCAM e 6 CD49f/alpha integrina, e (B) CD227/Muc1 e CD10/CALLA. (C, D) A análise FACS de 4 de passagem pré-estase HMEC para a expressão de (C) e EpCAM CD49f/alpha 6 integrina, e (D) e CD227/Muc1 CD10/CALLA. P identificávelopulations são rotulados como LEP (expressando luminal marcadores EpCAM ou CD227), MEP (expressando marcadores mioepiteliais CD49f ou CD10), ou PROG (enriquecido no CD49f + / EpCAM população +). Note-se que, durante a adaptação a regulação cultura de mudanças EpCAM e CD49f comparação com Organóides não cultivados. (E) Unsorted HMEC e FACS enriquecido LEP e MEP a 4 ª passagem corados para análise de imunofluorescência de queratina K14 (MEP marcador) e K19 (LEP marcador) para verificar a identificação linhagem. Manchado núcleos com DAPI aparecem em azul.
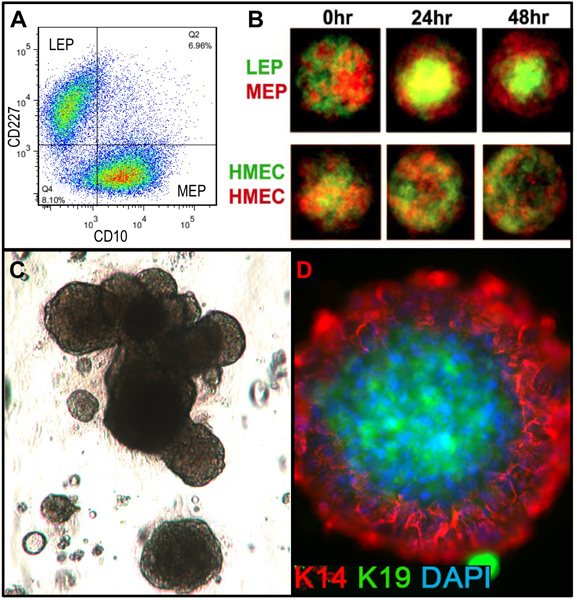
Figura 4. HMEC cultivadas são capazes de formar estruturas organizadas com relações em in vivo como linhagem quando colocados em microambientes apropriados. (A) pré-estase 4 ª passagem HMEC foram FACS enriquecido into luminal LEP e linhagens de MEP mioepiteliais, utilizando marcadores para CD227 e CD10, com estas linhagens verificada por expressão de K14 e K19 (não mostrado). (B) Quando misturados em micropatterned micropoços, as células cultivadas são capazes de auto-organização em bicamadas com MEP na parte externa e interna da LEP [adaptado de Chanson et al. 5]. LEP marcado por fluorescência (verde) e MEP (vermelho) foram fotografadas com um microscópio confocal de 0 h, 24 h, e 48 h após a adição ao micropoços (superior). Controle HMEC foram arbitrariamente rotulados com etiquetas vermelhas ou verdes fluorescentes (mais baixa). (C) imagem de campo brilhante de células progenitoras enriquecidas com FACS (c-kit +) plaqueadas em 3D de cultura (Matrigel) e cultivadas durante 18 dias. Estruturas resultantes podem exibir morfogênese alveolar. (D) As estruturas foram extraídos de Matrigel e coradas para detectar K14 e K19; núcleos foram contrastadas com DAPI. Análise de imunofluorescência mostra estruturas organizadas com pola luminal e basal corretorança.
Discussão
O método de processamento de tecido mamário humano aqui apresentada permite a obtenção de células epiteliais mamárias puros da mistura heterogénea de tipos de células no coração humano. A filtração através de poros de tamanho fixo, permite a separação de diferentes fracções de glândula mamária (por exemplo, ductal e ductal-alveolar vs alveolar) a partir da matriz estromal digerido. Isogénicas fibroblastos mamarias podem ser obtidas para coincidir com as células epiteliais. Material digerido congelado manteve viabilidade bom por mais de 30 anos. Este método tem trabalhado com sucesso em todos os mas muito fibrosos tecidos mamários, e é simples de executar. Outras variações de processamento de tecido mamário que existem não fornecem fracções epiteliais que são tão viáveis, limpo, ou separados. Colocação de Organóides processados em cultura com baixas indutoras de stress mídia, como M87A permite crescimento de longo prazo de HMEC com marcadores de linhagem múltiplos. HMEC que foram cultivadas em plástico ainda mantêm a capacidade de géneroste estruturas 3D com normal em relacionamentos vivo-como linhagem. Estas culturas HMEC são adequados para investigação experimental extenso, incluindo produção elevada, de comportamento normal e HMEC fatores que podem impulsionar ou inibir a senescência e transformação.
Divulgações
Não há conflitos de interesse declarados.
Agradecimentos
MAL, JCG, e MRS são suportados pela NIA (R00AG033176 e R01AG040081) e pelo Laboratório de Pesquisa e Desenvolvimento Directed, EUA Departamento de contrato de Energia # DE-AC02-05CH11231.
Materiais
| Name | Company | Catalog Number | Comments |
| Vidro de Petri 15 centímetros | VWR | 89000-308 | |
| Scissors 6.5 " | VWR | 82027-594 | |
| Fórceps 8 " | VWR | 82027-436 | |
| Bisturis descartáveis | Miltex | 4-411 | |
| Colagenase | SIGMA | C0130 | |
| Hialuronidase | SIGMA | H3506 | |
| Insulina | SIGMA | I5500 | |
| DMSO | SIGMA | D8418 | |
| Pennicillin estreptomicina / | Life Technologies | 15140-122 | |
| Fungizone | Life Technologies | 15290-018 | |
| Polimixina B sulfato | Life Technologies | 21850-029 | |
| Soro Fetal Bovino | Life Technologies | 26140-087 | |
| Tripsina 0,05% 100 ml | Life Technologies | 25300-054 | |
| DMEM/F12 | Life Technologies | 11039-021 | |
| HulaMixer | Life Technologies | 159-20D | |
| Célula de 100 um filtro | BD Falcon | 352360 | |
| 40 um coador de células | BD Falcon | 352340 | |
| Tubos de 15 ml | Greiner Bio-One | 188-261 | |
| Tubos de 50 ml | Greiner Bio-One | 227-261 | |
| Pratos TC 10 centímetros | Greiner Bio-One | 664-160 | |
| Pratos de CT 6 centímetros | Greiner Bio-One | 628-160 | |
| Frascos criogênicos | Nalgene | 5000-1020 | |
| Heamocytometer | Hauser Científico | 1490 | |
| Centrifugador | Eppendorf modelo | 5702 |
Referências
- Prowse, K. R., Greider, C. W. Developmental and tissue-specific regulation of mouse telomerase and telomere length. Proc. Natl. Acad. Sci. U.S.A. 92, 4818-4822 (1995).
- Gil, J., Peters, G. Regulation of the INK4b-ARF-INK4a tumour suppressor locus: all for one or one for all. Nat. Rev. Mol. Cell Biol. 7, 667-677 (2006).
- Stampfer, M. R., Hallowes, R., Hackett, A. J. Growth of Normal Human Mammary Epithelial Cells in Culture. In Vitro. 16, 415-425 (1980).
- Garbe, J. C., Bhattacharya, S., Merchant, B., Bassett, E., Swisshelm, K., Feiler, H. S., Wyrobek, A. J., Stampfer, M. R. Molecular distinctions between the stasis and telomere attrition senescence barriers demonstrated by long-term culture of normal human mammary epithelial cells. Cancer Res. 69, 7557-7568 (2009).
- Chanson, L., Brownfield, D., Garbe, J. C., Kuhn, I., Stampfer, M. R., Bissell, M. J., LaBarge, M. A. Self-organization is a dynamic and lineage-intrinsic property of mammary epithelial cells. Proc. Natl. Acad. Sci. U.S.A. 108, 3264-3269 (2011).
- Stampfer, M. R., Bartley, J. C. Induction of transformation and continuous cell lines from normal human mammary epithelial cells after exposure to benzo(a)pyrene. Proc. Natl. Acad. Sci. U.S.A. 82, 2394-2398 (1985).
- Brenner, A. J., Stampfer, M. R., Aldaz, M. Increased p16 expression with first senescence arrest in human mammary epithelial cells and extended growth capacity with inactivation. Oncogene. 17, 199-205 (1998).
- Olsen, C. L., Gardie, B., Yaswen, P., Stampfer, M. R. Raf-1-induced growth arrest in human mammary epithelial cells is p16-independent and is overcome in immortal cells during conversion. Oncogene. 21, 6328-6339 (2002).
- Stampfer, M. R., Garbe, J., Nijjar, T., Wigington, D., Swisshelm, K., Yaswen, P. Loss of p53 function accelerates acquisition of telomerase activity in indefinite lifespan human mammary epithelial cell lines. Oncogene. 22, 5238-5251 (2003).
- Chin, K., Ortiz de Solorzano, C., Knowles, D., Jones, A., Chou, W., Rodriguez, E. G., Kuo, W. -. L., Ljung, B. -. M., Chew, K., Myambo, K., Miranda, M., Krig, S., Garbe, J., Stampfer, M., Yaswen, P., Gray, J. W., Lockett, S. J. In situ analysis of genome instability in breast cancer. Nat Gene. 36, 984-988 (2004).
- Li, Y., Pan, J., Li, J. -. L., Lee, J. -. H., Tunkey, C., Saraf, K., Garbe, J. C., Whitley, M. Z., Jelinsky, S. A., Stampfer, M. R., Haney, S. A. Transcriptional changes associated with breast cancer occur as normal human mammary epithelial cells overcome senescence barriers and become immortalized. Mol. Cancer. 6, (2007).
- Garbe, J. C., Holst, C. R., Bassett, E., Tlsty, T., Stampfer, M. R. Inactivation of p53 function in cultured human mammary epithelial cells turns the telomere-length dependent senescence barrier from agonescence into crisis. Cell Cycle. 6, 1927-1936 (2007).
- Novak, P., Jensen, T. J., Garbe, J. C., Stampfer, M. R., Futscher, B. W. Step-wise DNA methylation changes are linked to escape from defined proliferation barriers and mammary epithelial cell immortalization. Cancer Res. 69, 5251-5258 (2009).
- Vrba, L., Garbe, J. C., Stampfer, M. R., Futscher, B. W. Epigenetic regulation of normal human mammary cell type specific miRNAs. Genom Res. 21, 2026-2037 (2011).
- LaBarge, M. A., Nelson, C. M., Villadsen, R., Fridriksdottir, A., Ruth, J. R., Stampfer, M. R., Petersen, O. W., Bissell, M. J. Human mammary progenitor cell fate decisions are products of interactions with combinatorial microenvironments. Integr. Biol. 1, 70-79 (2009).
- Garbe, J. C., Pepin, F., Pelissier, F., Sputova, K., Fridriksdottir, A. J., Guo, D. E., Villadsen, R., Park, M., Petersen, O. W., Barowsky, A., Stampfer, M. R., Labarge, M. A. Accumulation of multipotent progenitors with a basal differentiation bias during aging of human mammary epithelia. Cancer Res. 72, 3687-3701 (2012).
- Hammond, S. L., Ham, R. G., Stampfer, M. R. Serum-free growth of human mammary epithelial cells: rapid clonal growth in defined medium and extended serial passage with pituitary extract. Proc. Natl. Acad. Sci. U.S.A. 81, 5435-5439 (1984).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados