É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Injeção estereotáxica de um vetor viral para manipulação genética condicional no Cabo de Rato Spinal
Neste Artigo
Resumo
Vetores virais permitem a manipulação de genes alvo. Nós demonstramos um método para a expressão de genes condicionais ou ablação da medula espinhal de rato, utilizando a injecção estereotáxica de um vector viral no corno dorsal, um local proeminente de contacto sináptico entre os aferentes primários e os neurónios de somatossensorial no sistema nervoso central.
Resumo
Intraparenquimatosa injecção de um vector viral permite a manipulação genética condicional em populações distintas de neurônios ou regiões específicas do sistema nervoso central. Nós demonstramos uma técnica de injecção estereotáxica que permite a expressão do gene alvo ou silenciamento no corno dorsal da medula espinal do rato. O procedimento cirúrgico é breve. Ele requer laminectomia de uma única vértebra, fornecendo para a recuperação rápida do animal e da motilidade perfeita da coluna vertebral. Injecção controlada de um pequeno volume vector suspensão a baixa velocidade e à utilização de uma micro-seringa com cânula de vidro biselado minimizar a lesão dos tecidos. A resposta imunitária local do vector depende das propriedades intrínsecas do vírus empregue, na nossa experiência, é menor e de curta duração quando um vírus adeno-associado recombinante é utilizado. Um gene repórter, tais como a proteína fluorescente verde melhorada facilita a distribuição espacial de controlo do vector, e a eficácia e celular specipecificidade da transfecção.
Introdução
As tecnologias avançadas de manipulação genética condicional no rato permitir abordagens multifacetadas para a exploração de vias sinápticas e ligações funcionais no sistema nervoso central. Os transgenes podem ser regulados por moléculas pequenas efectoras, tais como a doxiciclina que actuam sobre um transactivador controlado por tetraciclina, que pode ser concebido para funcionar como um repressor ou um activador da transcrição de genes, ou tamoxifeno reconhecendo um domínio mutado de ligação ao ligando do receptor de estrogénio 1 . Modificação irreversível transgene geralmente é conseguido por o ácido desoxirribonucléico (DNA) recombinases. Cre (recombinação causas) e FLP (flippase enzima de recombinação) catalisam a excisão, inversão ou translocação de fragmentos de DNA que são ladeadas por loxP (locus de cruzamento x mais, P1) ou Frt (flippase alvo de reconhecimento) sites, respectivamente 1. As aplicações incluem a ativação do gene ou silenciamento e ácido induzível ribonucléico (RNA) interferência 2. Expressão condicional de repórteres fluorescentes ou enzimáticos, tais como β-galactosidase ou fosfatase alcalina pode ser utilizada para rotular os neurónios e examinar a sua organização tópica e conectividade 3. Grandes projectos de mutagênese na América do Norte ( http://www.norcomm.org/index.htm ) e Europa ( http://www.knockoutmouse.org/about/eucomm ) estão produzindo bibliotecas de clones de rato com células-tronco embrionárias condicionais genes alvos e armadilhas que eventualmente cobrem o genoma do rato inteiro. Ratos gerados a partir destes clones podem ser cruzadas com um número crescente de linhas de ratinhos que expressam ADN sob recombinases promotores ou loci específicos para uma determinada população de neurónios para a manipulação de genes selectiva ( http://nagy.mshri.on.ca/cre_new/index . php ).
No entanto, restringir a manipulação de genes a diferentes populações de neurónios ou de regiões de interesse particular não pode ser obtida por segmentação genética sozinho, se um promotor específico para a população de neurónios de interesse não é conhecido ou não expresso por todos os neurónios na região de interesse. Na medula espinal, os desenhos experimentais podem exigir restrição espacial da manipulação genética de um ou dois segmentos crânio-caudal. Injecção estereotáxica de um vector viral que expressa Cre ou Flp permite limitar a recombinação de genes para as regiões na medula espinal de ratos em que os fragmentos de DNA são flanqueados por sítios loxP ou FRT, os chamados alelos floxed ou flrted. Ao contrário de rearranjo do DNA constituinte, que resultaria da hibridização, os animais com ratos que expressam recombinase, esta estratégia também proporciona um controlo temporal sobre a activação do gene ou silenciamento. Os vectores virais que codificam floxed ou flertou transgenes oferecem uma opção inversa de manipulação de genes em ratos expressando a corresponding recombinase jusante de um promotor específico para neurónios. Vários vetores recombinantes com afinidade para os neurônios estão disponíveis 4. De elevada capacidade de adenovírus (gutless), vírus adeno-associados, vírus do herpes simplex e lentivírus são comumente utilizados vectores neurotrópicas. Selecionando o vírus apropriado para uma questão de pesquisa é uma parte crucial do projeto experimental. Tamanho do transgene, via de administração, a especificidade da infecção para os neurónios, em oposição às células da glia, a eficácia da infecção, os efeitos secundários inflamatórios e tóxicos precisam ser considerados 4.
Aqui descrevemos a injecção estereotáxica de um vector viral no corno dorsal da medula espinhal, uma técnica que empregam para a regulação do gene condicional na nossa pesquisa sobre a neurobiologia da dor. O corno dorsal recebe entrada aferente primário neurônios somatossensoriais incluindo neurónios nociceptivos. Interneurônios locais processar as informações antes de neurônios de projeção transmiti-lo a partir decorno dorsal para o cérebro 5. Nós demonstramos que a infecção de neurónios do corno dorsal da coluna vertebral ao nível segmental L4 com um neurotrópica de vírus adeno-associado recombinante (rAAV) que expressa a proteína verde fluorescente melhorada (EGFP) no âmbito de um promotor de citomegalovírus constitucionalmente activo.
Protocolo
O procedimento cirúrgico descrito foi aprovado pelo Animal Care Institucional e Comitê de Uso (IACUC) da Universidade de Columbia.
1. Preparação de Equipamentos e suspensão de partículas de vírus
- Limpar e desinfectar o equipamento, esterilizar os instrumentos cirúrgicos e os picos de entalhe em V que serão utilizados para fixar vértebra L1.
- Puxe e pipetas de vidro bisel. Usamos pipetas que têm um diâmetro da ponta de 40 um e são chanfrados num ângulo de 20 °. Esterilizar as pipetas de vidro.
- Configure o quadro estereotáxico, montar o injetor micro para o manipulador e conectar o injetor para o controlador.
- Prenda uma das pipetas de vidro para o micro usando o kit de conexão de compressão.
- Remover o êmbolo da microsseringa e encher a seringa com óleo mineral. Oil Red O (1 - (2,5-dimetil-4-(2,5-dimethylphenylazo) fenilazo)-2-naftol), podem ser adicionados ao óleo mineral para aumentar a sua visibility. Reinserir o êmbolo e empurre-o para todo o caminho até a ponta. Cuidadosamente evitar a criação de uma bolha de ar.
- Preparar a suspensão de partículas de vírus em um armário de biossegurança. Descongelar o virus congelada em gelo e, imediatamente antes da utilização, diluir com estéril salina tamponada com fosfato com a concentração de partículas desejado.
- Insira o micro para o suporte no injector.
- Pipetar 5 ul da suspensão de vírus para uma folha de plástico, por exemplo Parafilm. Diminuir a ponta da pipeta de vidro para o soltar e puxar o êmbolo para encher a microsseringa. Criar uma pequena bolha de ar na ponta da pipeta para evitar que o entupimento.
2. Laminectomia
- Prepare a área de cirurgia limpando banco e almofada de aquecimento com desinfetante.
- Anestesiar o mouse. Nós usamos anestesia inalatória com isoflurano (3% durante a indução, 2% a 3% durante a manutenção).
- Coloque lubrificante em cada olho, para proteger os olhos de secagem durante o períodooperação.
- Raspar a pele a partir da parte inferior das costas do pescoço do rato e desinfectar a pele com a alternância de toalhetes de um anti-séptico tópico tal como clorhexidina ou povidona-iodo e etanol a 70%. Isolar o local assepticamente preparada com tecido cirúrgico e infiltrar o local da incisão com bupivacaína (0,25%, 1:10 diluídas com solução salina fisiológica).
- Incisão na pele na extremidade caudal da caixa torácica ao longo da linha média (2-3 cm) e separar a fáscia que cobre a lombada.
- Porque a medula espinhal pára de crescer mais cedo durante o desenvolvimento pós-natal do que a coluna vertebral, o segmento vertebral L4 está por baixo da primeira vértebra lombar (L1). Vértebra L1 está localizado à vértebra caudal que mantém o último par de costelas. Identificar e expor vértebra L1, removendo os pequenos músculos e ligamentos da coluna vertebral presos a sua superfície dorsal.
- Ligeiramente levantar e segurar vértebra L1 com uma pinça de Adson. Use uma pinça laminectomia dedicados para remover o portio dorsaln da vértebra (coluna e lâmina) e expor a medula espinhal. Evitar danos na medula espinhal.
- Transferir o rato sobre a placa de aquecimento na armação estereotáxica. Monitorar a temperatura do mouse durante a operação subseqüente.
3. Injeção
- Fix vértebra L1 com picos de entalhe em V. Os picos devem estabilizar a coluna vertebral, de modo que a vértebra não se mover durante a respiração.
- Traga a micro mais perto de modo que a ponta da pipeta é acima do local da laminectomia. Abaixe o êmbolo até que a suspensão de vírus sair da pipeta. Remover a gota, com uma ponta de algodão estéril.
- Posicionar a ponta da pipeta na porção rostral do mais medula espinal exposta. Centro da pipeta acima do sulco posterior mediana, em seguida, passar a ponta 500 mm lateralmente. Diminuir a ponta para a superfície do cabo e punção da dura-máter ou, se estiver a trabalhar com uma pipeta de vidro unbeveled, utilizar uma cânula de aço biselado para perfurar o dura. Baixar a ponta da pipeta de vidro 300 um para a medula espinhal.
- Injectar 1 ul de suspensão de vírus, a uma taxa de 200 nl / min.
- No final da injecção, esperar, pelo menos, 2 minutos antes lentamente retraindo a pipeta.
- Repita os passos 3,3-3,5 na porção mais caudal da medula espinal exposta para obter uma distribuição completa do vector viral em L4 segmento da coluna vertebral. Os dois locais de injecção situam-se rostral e caudal do segmento de L4 para evitar danos no tecido na região-alvo.
4. O fechamento da ferida
- Lançamento vértebra L1 dos grampos de entalhe em V e remover o mouse do quadro estereotáxico.
- Suturar a fascia com 5,0 vicryl. A fáscia fechado oferece cobertura para o site laminectomia.
- Feche a pele com fio de náilon ou grampos cirúrgicos.
5. Cuidados no pós-operatório
- Transferir o mouse para uma gaiola de recuperação, com cama, macio não-particular. Coloque-o em tele laterais para respiração confortável. Monitorar o animal até que ele é totalmente alerta, ambulatório e começa a beber.
- Fornecemos analgesia pós-operatória, durante 72 h, com injecções subcutâneas diárias de carprofeno (5,0 mg / kg).
- Monitorar a recuperação pós-cirúrgica por inspeção diária para os primeiros 3 dias, depois a cada dois dias ou três dias por semana, até que a experiência é completa.
- Remover as suturas ou agrafos 7 a 10 dias após a operação, quando a cicatrização de feridas é completa.
- Eutanásia do animal após a conclusão da experiência.
Resultados
Sucesso rendimentos de transfecção expressão gênica robusto em neurônios do corno dorsal injetado (Figura 1), poupando o corno dorsal do lado contralateral, o corno anterior e gânglios da raiz dorsal.
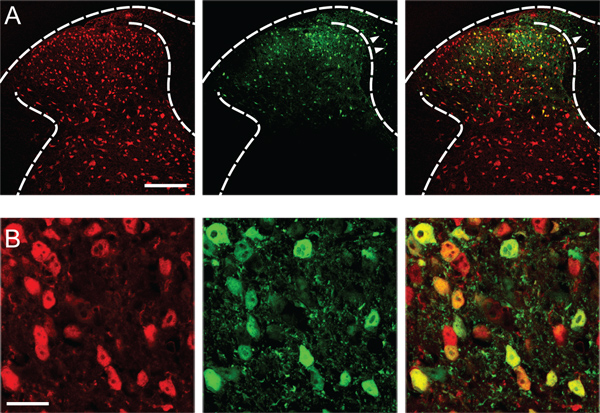
Figura 1. Transfecção dos neurónios do corno dorsal. (A) Expressão do EGFP repórter fluorescente (verde) no corno dorsal esquerda da medula espinhal L4, duas semanas após a inje...
Discussão
Injecção estereotáxica vector permite a segmentação neurónios da espinal medula de aplicações, tais como mapeamento de rede neuronal com base em vírus transsináptica espalhando 6,7 ou optogenética dissecção 8, durante a regeneração axonal de orientação a partir de 9,10 lesão, ou terapia de gene para a prevenção ou tratamento da neurodegeneração 11, 12. Os vectores virais têm sido utilizados para a manipulação de genes na medula espinhal de estudar vias...
Divulgações
Os autores declaram que não têm interesses conflitantes financeiros.
Agradecimentos
Agradecemos Bakhos A. Tannous, Ph.D., Diretor de Desenvolvimento de Vector e Produção no Centro de Neurociências de Massachusetts General Hospital, em Charlestown, Massachusetts, para fornecer-nos com o vetor rAAV-EGFP e João Whang para assistência técnica. Este trabalho foi financiado por subvenções R01 NS050408 (a JS) do Instituto Nacional de Distúrbios Neurológicos e Derrame.
Materiais
| Name | Company | Catalog Number | Comments |
| Nome de material | Companhia | Número de Catálogo | |
| Placa de base da coluna vertebral | David Kopf Instruments | 912 | |
| Instrumento estereotáxico de pequenos animais | David Kopf Instruments | 900 | |
| Rato gás suporte da cabeça anestesia | David Kopf Instruments | 923-B | |
| Ajustáveis montagens de base | David Kopf Instruments | 982 | |
| Picos de entalhe em V | David Kopf Instruments | 987 | |
| Pequeno animal, sistema de controlo de temperatura | David Kopf Instruments | TCAT-2LV | |
| Adson fórceps | Belas Science Tools | 11006-12 | |
| Fórceps laminectomia | Belas Science Tools | 11223-20 | |
| UltraMicroPump (um) com SYS-Micro4 Controlador | Instrumentos de Precisão mundo | UMP3-1 | |
| Micro-65RN | Hamilton | 7633-01 | |
| RN de compressão apropriado, 1 mm | Hamilton | 55750-01 | |
| Borosilicato capilares de vidro | Instrumentos de Precisão mundo | 1B100F-4 | |
| Microgrinder | Narishige | EG-44 |
Referências
- Lewandoski, M. Conditional control of gene expression in the mouse. Nature Reviews Genetics. 2, 743-755 (2001).
- Couto, L. B., High, K. A. Viral vector-mediated RNA interference. Curr. Opin. Pharmacol. 10, 534-542 (2010).
- Luo, L., Callaway, E. M., Svoboda, K. Genetic dissection of neural circuits. Neuron. 57, 634-660 (2008).
- Davidson, B. L., Breakefield, X. O. Viral vectors for gene delivery to the nervous system. Nature Reviews Neuroscience. 4, 353-364 (2003).
- Todd, A. J. Neuronal circuitry for pain processing in the dorsal horn. Nature Reviews Neuroscience. 11, 823-836 (2010).
- Wall, N. R., Wickersham, I. R., Cetin, A., De La Parra, M., Callaway, E. M. Monosynaptic circuit tracing in vivo through Cre-dependent targeting and complementation of modified rabies virus. Proceedings of the National Academy of Sciences of the United States of America. 107, 21848-21853 (2010).
- Lo, L., Anderson, D. J. A Cre-dependent, anterograde transsynaptic viral tracer for mapping output pathways of genetically marked neurons. Neuron. 72, 938-950 (2011).
- Zhao, S., et al. Cell type-specific channelrhodopsin-2 transgenic mice for optogenetic dissection of neural circuitry function. Nature Methods. 8, 745-752 (2011).
- Tang, X. Q., Heron, P., Mashburn, C., Smith, G. M. Targeting sensory axon regeneration in adult spinal cord. J. Neurosci. 27, 6068-6078 (2007).
- Cameron, A. A., Smith, G. M., Randall, D. C., Brown, D. R., Rabchevsky, A. G. Genetic manipulation of intraspinal plasticity after spinal cord injury alters the severity of autonomic dysreflexia. J. Neurosci. 26, 2923-2932 (2006).
- Passini, M. A., et al. CNS-targeted gene therapy improves survival and motor function in a mouse model of spinal muscular atrophy. The Journal of Clinical Investigation. 120, 1253-1264 (2010).
- Lutz, C. M., et al. Postsymptomatic restoration of SMN rescues the disease phenotype in a mouse model of severe spinal muscular atrophy. The Journal of Clinical Investigation. 121, 3029-3041 (2011).
- Chen, S. L., et al. dsAAV type 2-mediated gene transfer of MORS196A-EGFP into spinal cord as a pain management paradigm. Proc. Natl. Acad. Sci. U.S.A. 104, 20096-20101 (2007).
- South, S. M., et al. A conditional deletion of the NR1 subunit of the NMDA receptor in adult spinal cord dorsal horn reduces NMDA currents and injury-induced pain. J. Neurosci. 23, 5031-5040 (2003).
- Tappe, A., et al. Synaptic scaffolding protein Homer1a protects against chronic inflammatory pain. Nat. Med. 12, 677-681 (2006).
- Colle, M. A., et al. Efficient intracerebral delivery of AAV5 vector encoding human ARSA in non-human primate. Human Molecular Genetics. 19, 147-158 (2010).
- Carbajal, K. S., Weinger, J. G., Whitman, L. M., Schaumburg, C. S., Lane, T. E. Surgical Transplantation of Mouse Neural Stem Cells into the Spinal Cords of Mice Infected with Neurotropic Mouse Hepatitis Virus. J. Vis. Exp. (53), e2834 (2011).
- Snyder, B. R., et al. Comparison of adeno-associated viral vector serotypes for spinal cord and motor neuron gene delivery. Hum. Gene Ther. 22, 1129-1135 (2011).
- Towne, C., Pertin, M., Beggah, A. T., Aebischer, P., Decosterd, I. Recombinant adeno-associated virus serotype 6 (rAAV2/6)-mediated gene transfer to nociceptive neurons through different routes of delivery. Mol. Pain. 5, 52 (2009).
- Kaplitt, M. G., et al. Long-term gene expression and phenotypic correction using adeno-associated virus vectors in the mammalian. 8, 148-154 (1994).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados