Method Article
Minimamente Invasiva Estabelecimento de murino ortotópico bexiga Xenoenxertos
Neste Artigo
Resumo
A técnica criada para inocular xenografts ortotópico de câncer de bexiga invasivo primário requer laparotomia e mobilização da bexiga. Este procedimento inflige morbidade significativa nos ratinhos, é tecnicamente difícil e demorado. Por isso, desenvolvemos um de alta precisão, a abordagem percutânea utilizando a orientação do ultra-som.
Resumo
Ortotópico xenografts câncer de bexiga são o padrão ouro para o estudo manipulações moleculares e celulares novos agentes terapêuticos in vivo. As linhas celulares adequadas são inoculados por instilação intravesical (modelo de crescimento invasivo nonmuscle) ou injecção intramural na parede da bexiga (modelo de crescimento invasivo). Ambos os processos são complexos e altamente consumidora de tempo. Além disso, o modelo superficial tem as suas limitações devido à falta de linhas celulares que são a seguir instilação tumorigénico. Injeção intramuros, por outro lado, é marcada pela invasão do procedimento e a morbidade associada para o mouse host.
Com estas limitações em mente, nós modificamos os métodos anteriores para desenvolver uma abordagem minimamente invasiva para a criação de ortotópico xenografts câncer de bexiga. Usando a orientação do ultra-som que temos realizado com sucesso inoculação percutânea das linhas celulares de cancro da bexiga UM-UC1, UM-UC3 e UM-UC13 em 50 nu atímico. Temos sido capazes de demonstrar que esta abordagem é tempo eficiente, preciso e seguro. Com esta técnica, inicialmente, é criado um espaço sob a mucosa da bexiga com PBS, e as células tumorais são então injectado para dentro deste espaço, em uma segunda etapa. O crescimento do tumor é monitorada em intervalos regulares com imagem de bioluminescência e ultra-som. Os volumes médios de tumor aumentou de forma constante nos em todos, mas um de nossos 50 ratos durante o período de estudo.
Em nossa instituição, esta nova abordagem, que permite a inoculação de xenotransplante câncer de bexiga, de forma minimamente invasiva, rápida e altamente precisa, substituiu o modelo tradicional.
Introdução
Pesquisa sobre o câncer é dependente de modelos animais de câncer humano, usando linhas de células derivadas de tumores de pacientes, a fim de aprofundar a nossa compreensão da biologia do tumor. Pois na análise de crescimento vivo sob diferentes estratégias de tratamento de câncer de bexiga modelos murino ortotópico permanecer o padrão de referência 1,2. A inoculação de células de câncer de bexiga humanos em camundongos imunocomprometidos (modelo de xenotransplante) conta com a instilação intravesical ("modelo intravesical") 3,4,5 ou injeção direta na parede da bexiga ("modelo intramural") 6,7. Ambas as técnicas podem também ser realizadas em ratos 8,9.
Instilação intravesical induz a formação de tumores na superfície uroteliais de bexiga, que, em seguida, são passíveis de subsequente instilação intravesical de novos agentes de tratamento. No entanto, o número de linhas de células que são fiavelmente tumorigénicas quando entregues através deste método é limitado ad uma dessas linhas celulares, KU7, foi recentemente demonstrado ser HeLa 4,10. Instilação intravesical também é demorado devido ao tempo de espera necessários, e freqüentemente induz o crescimento do tumor em elementos adjacentes do trato urinário, incluindo uretra, ureter e pelve renal 11. Além disso, a instilação intravesical frequentemente conduz ao crescimento do tumor no chão da bexiga, onde os ureteres entrar na bexiga, e este pode causar a obstrução do tracto superior e insuficiência renal concomitante.
Xenoenxertos de cancro da bexiga invasivo primários que sejam adequados para tratamentos sistémicos são criados através de injecção directa de células tumorais na parede da bexiga 12. Apesar de numerosas linhas celulares de crescer adequadamente, neste modelo, a limitação é a capacidade de invasão do modelo relacionada com a necessidade de uma incisão abdominal 13. O modelo também é um desafio para aprender devido à dificuldade técnica de injeção de células precisamente na parede do músculoda bexiga.
Uma nova abordagem para estabelecer ortotópico primários xenografts câncer de bexiga invasivo em ratos foi desenvolvido em nosso serviço, a fim de colmatar as lacunas existentes do "modelo intramural". Nós fomos capazes de otimizar a, injeção percutânea guiada por ultra-som de células de câncer de bexiga na parede da bexiga anterior, resultando nesta nova técnica para substituir com sucesso o modelo invasivo estabelecida. Além disso, temos, potencialmente, aumentar a precisão e reprodutibilidade do "modelo intramural".
Protocolo
Todos os procedimentos com animais foram realizados de acordo com as diretrizes do Canadian Council on Animal Care (CCAC). O protocolo foi aprovado pelo Comitê Animal Care, da Universidade de British Columbia (número do protocolo: A10-0192).
1. Preparação de Linhas Celulares
- Confirmar a identidade das respectivas linhas celulares de cancro da bexiga humana por DNA fingerprinting 7.
- Para a análise de crescimento de tumores de xenoenxerto por bioluminescência, transfecção de linhas celulares com uma construção lentiviral portador do gene da luciferase de vaga-lume 3.
- Descongelar e expandir linhas de células existentes no meio de Eagle modificado por Dulbecco (DMEM) com 10% de soro fetal bovino (FBS) a 37 ° C em atmosfera húmida 5% de CO2. Passagem das células, pelo menos 3x mas evitar tempos de cultura superior a 3 meses.
2. Preparação da suspensão celular
- Descongele Matrigel. Manter a temperatura abaixo de4 ° C para evitar o aumento da viscosidade do gel.
- Tripsinizar as células a uma confluência de 70% e suspensão em meios de crescimento normal.
- Contar o número de células com um hemocitômetro ou contador automático de células.
- Girar a suspensão de células durante 5 min a 200 x g. Remover o sobrenadante.
- Adicionar o volume apropriado de meio DMEM (10% de FBS) e Matrigel (1:1) de modo a alcançar a concentração de células desejada, que é dependente da linha celular utilizada e da cinética de crescimento desejada (8-15 x 10 6 / ml). O volume injectado de suspensão de células do tumor será de 40 ul.
- Misture bem por pipetagem cima e para baixo (P1000), evitar a criação de bolhas de ar na suspensão.
3. Preparação de Animais
Nota: Devido à necessidade potencial de cateterização transuretral no passo 4.7, camundongos fêmeas são o sexo preferido neste modelo animal.
- Camundongos casa de acordo com gu institucional e cuidados com os animais nacionalidelines. Obter aprovação comitê de ética para todos os experimentos envolvendo ratos.
- Anestesiar os ratos com 3% de mistura de isoflurano / oxigénio. Confirme anesthetization adequado dos animais (por exemplo, falta de resposta aos pitadas dedo do pé).
4. Instalação Experimental
- Cortar a estabilização da bexiga a partir de qualquer tipo de material de plástico rígido liso [Figura 2 I]. Inspecione cuidadosamente a alça e remover quaisquer arestas vivas antes da aplicação para os ratos.
- Montar o animal sobre a mesa aquecida imagem [Figura 1 I] do animal plataforma pequena imagem com monitoramento contínuo dos sinais vitais. Corrigir os membros inferiores com um elástico [Figura 1 III].
- Desinfetar o abdômen com 2% de gluconato de clorexidina e limpe a pele com um cotonete estéril.
- Imobilizar a bexiga com a tira de estabilização da bexiga [Figura 2 II]. Assim, uma evasãoda bexiga durante a injecção intramural no passo 5.6 será evitado.
- Aplique o gel de ultra-som estéril para a parte inferior do abdômen.
- Aproximar lentamente a cabeça da sonda de ultra-som (freqüência de 40 MHz) [Figura 1 IV] para a pele (longitudinal com um ângulo de 45-70 ° craniana) e visualizar a bexiga na tela do ultra-som [Figura 3 I].
- Se a bexiga está vazia, preenchê-lo com 50 ul tampão fosfato estéril, quente (PBS), através de um G angiocateter transuretral 24.
5. Separação das camadas da parede da bexiga
- Anexar uma seringa de 1,0 ml com PBS e ligado a um 30 L, ¾ de agulha (chanfro dirigida anteriormente) para o grampo de seringa.
- Posicionar a agulha no sentido da pele logo acima do osso púbico, em um ângulo de 30-45 ° (80-90 ° em relação ao eixo longitudinal da cabeça da sonda de ultra-sons [Figura 1]).
- Detectar a agulhana tela de ultra-som.
- Lentamente perfurar a pele e os músculos da parede abdominal [Figura 3 II].
- Gire o bisel da agulha 180 ° (agora dirigida posteriormente).
- Inserir a ponta da agulha para dentro da parede da bexiga, sem penetrar na mucosa [Figura 3 III]
- Lentamente injectar 50 ul de PBS entre a camada muscular e mucosa, a fim de criar um espaço artificial [Figura 3 IV].
Nota: Se a mucosa é acidentalmente perfurada durante o passo 5.6, lentamente puxe a agulha e injetar 50 mL de PBS após a camada mucosa tem virado para trás sobre a ponta da agulha. - Retire a agulha.
6. Intramuros inoculação de células de câncer da bexiga
- Anexar uma segunda seringa de 1,0 ml (cheio de células cancerosas suspensas em Matrigel) com a 30 G, ¾ de agulha para a braçadeira de seringa.
- Guiar a ponta da agulha para a mesmaEspaço PBS-cheia, que foi criado no passo 5.7.
- Injecte 40 ul da suspensão de células para dentro deste espaço [Figuras 3 V e VI].
- Retire a agulha.
7. Cuidados de suporte pós-intervencionista
- Desmonte o mouse a partir da plataforma de imagem.
- Manter o animal em um ambiente acolhedor e confortável sob vigilância contínua durante a recuperação da anestesia.
- Depois de recobrar a consciência e retomar a deambulação normal, coloque o animal de volta em sua gaiola.
Resultados
Injeção intramural de três linhagens de células tumorais diferentes (UM-UC1 luc, UM-UC3 Luc e UM-UC13 luc) foi realizada em 50 animais sob ultra-som-orientação em três dias consecutivos. A inoculação foi realizada de forma eficiente (tempo médio de 5,7 min / animal) e não foi associada a complicações intra ou pós-intervenção.
Monitoramento do crescimento do tumor foi realizada por ultra-sonografia e bioluminescência. No dia # 3 um tumor poderia ser detectado por ultra-som na bexiga anterior de todos os 50 animais [Figura 4 I]. 98% dos camundongos mostraram o crescimento do tumor constante durante o período de seguimento [Os quadros 4 e 5]. Após a inoculação do UM-UC3 luc, um rato desenvolvido disseminação do tumor intraperitoneal eo tumor involuído após dia como 7 em um segundo animal [Tabela 1]. Este foi o primeiro grupo de ratinhos inoculados com esta nova técnica.
nt "> Os ratinhos foram sacrificados no dia # 24, # 28 e # 37, após a inoculação de UM-UC3 luc, UM-UC1 luc e de UM-UC13 luc, respectivamente. tumores xenoenxertos foram colhidas e examinadas em hematoxilina e eosina (H & E secções). Todos os tumores foram músculo invasivo e alguns infiltrados na gordura perivesical, mas nenhuma invasão em órgãos adjacentes foi observada [Figura 6 I]. de 60% dos ratinhos portadores de tumores luc UM-UC13 e 20% dos ratinhos portadores de UM-UC3 luc tumores desenvolveram metástases em linfonodos retroperitoneais que foram confirmados por H & E coloração [Figura 6 II].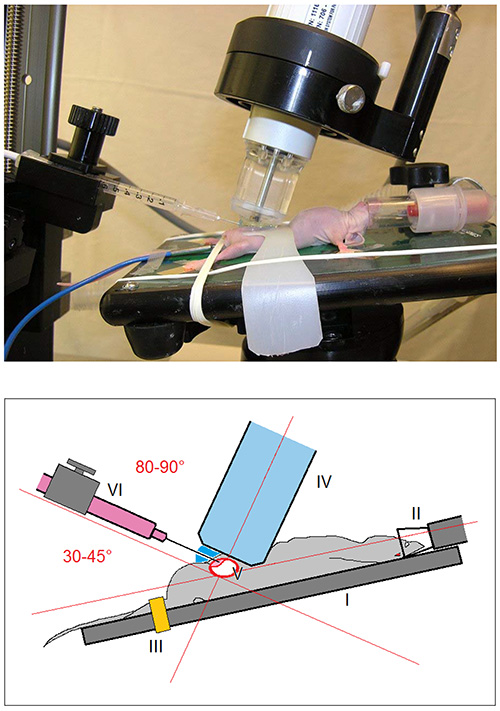
Figura 1. Imagem e ilustração esquemática da configuração experimental. O rato é montado em cima da mesa aquecida operação (I) e realizada sob anestesia ( II) com 3% de mistura de isoflurano / oxigénio. Os membros inferiores são fixados com um elástico (III). Depois de se aproximar da cabeça da sonda de ultra-sons (IV) para a pele (alinhamento longitudinal com um ângulo de 45-70 ° craniana) da bexiga (V) é visualizada no ecrã de ultra-som. Uma seringa com uma agulha 30 G (VI) é guiada para a pele, num ângulo de 30-45 ° (80-90 ° em relação ao eixo longitudinal da cabeça da sonda de ultra-sons).

Figura 2. Imobilização da bexiga. Dimensões e ilustra a construção da correia de estabilização da bexiga (I), A correia está ligada a parte inferior do abdómen e imobiliza a bexiga (II). Assim, uma evasão do bexiga durante a injeção intramural é evitado.
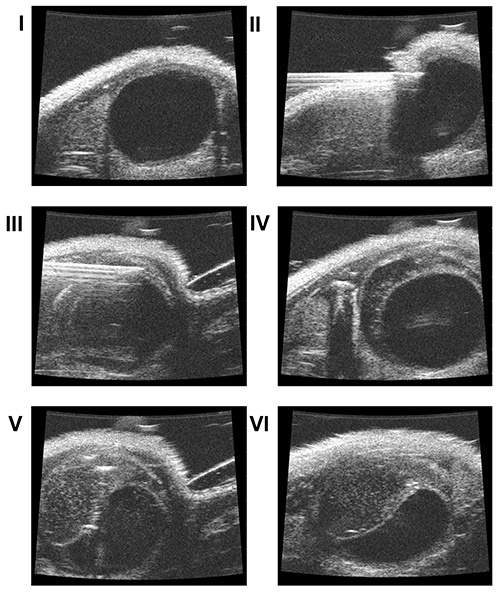
Figura 3. Intramural inoculação de células tumorais. Visualização da bexiga na tela de ultra-sons (I). Perfuração da pele e músculos da parede abdominal (II). A inserção da agulha para dentro da parede da bexiga, sem penetração da mucosa (III). PBS (50 mL) entre a camada muscular e da mucosa após uma injecção lenta (IV). As células tumorais suspensas em Matrigel no espaço criado artificialmente intramural (V, VI).
1123fig4.jpg "/>
Figura 4. . Acompanhamento por ultra-som contínuo acompanhamento por ultra-som mostrou aumento significativo do volume do tumor (I: dia # 3, II: dia # 7, III: dia # 13).
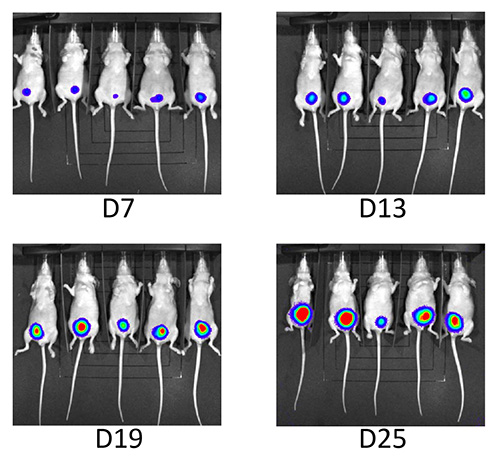
Figura 5. Follow-up por bioluminescência. Contínuo acompanhamento por bioluminescência mostraram aumento constante da luminescência durante o período de estudo.

Figura 6. Histologia do tumor xenoenxerto e metástase linfonodal. In toto secção H & E de um xenotransplante representante tu mor demonstrando crescimento invasivo no músculo sem invasão em órgãos adjacentes (I). 60% dos camundongos com tumores luc UM-UC13 e 20% de camundongos portadores de tumores luc UM-UC3 apresentaram metástases em linfonodos retroperitoneais (II).
| Linhagem de células inoculadas | UM-UC1 luc | UM-UC3 luc | Luc UM-UC13 | |
| Número de ratinhos | 20 | 15 | 15 | |
| Volume injetado, mL | 40 | 50 | 50 | |
| A contagem de células, absoluto | 3,6 x 10 5 | 6 x 10 5 | 5,5 x 10 5 | |
| Tempo por animal, min | 3,4 (± 1,6) | 7,7 (± 3,7) | 6,8 (± 2,9) | |
| Incidência tumoral | 49 (98%) | |||
| 20 (100%) | 14 (93%) | 15 (100%) | ||
| Linfonodo metástase | 0 | 3 (20%) | 9 (60%) | |
| Acompanhamento (dias) | 28 | 22 [antes do tratamento] | 28 [antes do tratamento] | |
| O volume de tumor (mL) | dia 4 | 11,6 (± 1,3) | 12,5 (± 1,7) | 14,4 (± 1,3) |
| final | 394,6 (± 72,4) | 288,7 (± 66,1) | 78,3 (± 13,4) | |
| follow-up | ||||
| Tumor luminescência (fótons / s) | dia 4 | 4,6 x 10 8 | 2,0 x 10 8 | 5,8 x 10 8 |
| (± 9,4 x 10 7) | (± 3,7 x 10 7) | (± 1,3 x 10 8) | ||
| final | 1,9 x 10 10 | 1,4 x 10 10 | 1,5 x 10 10 | |
| follow-up | (± 4,0 x 10 9) | (± 2,3 x 10 9) | (± 1,9 x 10 9) | |
Tabela 1. Injeção de células tumorais de ultra-som-guiada - procedimento e resultados.
Discussão
Quase todos os grandes avanços na terapia do câncer exigirá testes em modelos animais antes de iniciar os ensaios clínicos. Os modelos animais de câncer são ferramentas essenciais que permitem aos pesquisadores estudar a biologia do tumor in vivo. Modelos de xenoenxerto ortotópico permanecer padrão ouro 1,2 e continuar a oferecer o máximo de flexibilidade (em termos de seleção de linhagens de células) e têm a utilidade mais prática.
O procedimento ilustrado é uma modificação minimamente invasiva do modelo ortotópico previamente descrito por 12 Ðîññèÿ et al. Estabelecemos tumores xenoenxerto guiada por ultra-som injeção percutânea de três linhagens celulares diferentes, com uma taxa de sucesso técnico de 100%. Durante acompanhamento contínuo, 98% dos ratos demonstraram aumento constante no volume do tumor.
Ao realizar uma técnica minimamente invasiva, fomos capazes de lidar com as limitações existentes do modelo intramural. Além respecting bem-estar animal, a invasividade reduzida deste processo contribui também para a reprodutibilidade dos experimentos in vivo, pela diminuição do número de complicações cirúrgicas. É altamente eficaz do tempo para evitar uma laparotomia abdominal e necessidade associada para o fechamento da ferida. Fomos capazes de diminuir significativamente o tempo de procedimento por animal para 3,4 min (± 1,6). No entanto, a principal vantagem da nossa nova abordagem é a sua precisão. De alta resolução ultra-sons permite visualizar o espaço criado pela injecção de solução salina sob a mucosa da parede da bexiga. Este primeiro passo de injecção facilita a injecção de células de tumor, num segundo passo e minimiza o risco de derramamento de células de tumor. Isto contrasta com a técnica de injeção intramural após laparotomia, onde é impossível visualizar a colocação da agulha e há sempre um elemento de incerteza em relação à profundidade exata da injeção. Além disso, como estamos a inoculação de células tumorais estritamente na parede da bexiga anterior, growt tumorh na parede posterior da bexiga é evitada. Subsequentemente, a taxa de complicações obstrutivas devido ao crescimento do tumor na proximidade dos orifícios ureterais é extremamente rara. Este efeito permite que acompanha os períodos de crescimento e de tratamento mais longos.
A principal limitação da inoculação do tumor guiada por ultra-som é a necessidade de equipamento técnico adequado. Por conseguinte, o desempenho deste procedimento será provavelmente restrita aos centros que são especializados em modelos animais de cancro humano. Isto deve encorajar a colaboração entre grupos de pesquisa fora dessas instituições e os grupos com experiência em modelagem, tais animais romance.
Embora dependente da familiaridade com ultra-sonografia e alguma destreza manual, este modelo é fácil de aprender sob a instrução competente. O passo chave no processo é a criação de um espaço artificial submucosa da parede da bexiga com solução salina. Uma vez que este espaço é criado sem perfuração of a camada mucosa, que permanece estável durante vários minutos. A orientação da segunda agulha para dentro deste espaço, a fim de inocular as células tumorais são relativamente simples. A principal complicação durante a criação do espaço submucosa é a perfuração da agulha para dentro do lúmen da bexiga. A criação de um espaço na submucosa, no entanto, continua a ser viável. A agulha tem de ser retirada lentamente para dentro da parede da bexiga e da solução salina injectada apenas quando a camada mucosa vira a ponta da agulha. Após esta manobra, o espaço submucosa é menos estável (solução salina escorra para dentro do lúmen da bexiga 30-60 seg) e a injecção de células de tumor tem de ser realizado rapidamente. O derramamento de células de tumor para dentro do lúmen da bexiga podem ocorrer nestes casos com a perfuração da mucosa. Embora a perda de células tumorais a partir do espaço intramuros pode levar a uma diminuição do volume do tumor durante o seguimento, nós nunca ter observado qualquer captação tumoral intravesical.
Outro potencial complication é o derramamento de células tumorais para a cavidade peritoneal através do canal de injecção. Observou-se apenas uma disseminação de células tumorais intraperitoneal em 50 animais, e isso ocorreu em uma de nossas primeiras tentativas. Atribuímos isso à injeção de um volume demasiado importante suspensão de células do tumor. Isto foi corroborado pelo facto de que a redução do volume de 50-40 mL resultou em não mais derramamento intraperitoneal.
Esta inoculação minimamente invasivo de murino ortotópico xenotransplante câncer de bexiga representa uma modificação inovadora do "modelo intramural" existente, beneficiando tanto o investigador e os animais da mesma forma. As vantagens deste modelo de encorajar a sua adaptação a outros órgãos, tais como rim, próstata e fígado, a fim de estabelecer tumores de xenoenxerto ortotópicos de uma forma minimamente invasiva.
Divulgações
Acesso aberto para este vídeo-artigo é patrocinado pela FUJIFILM VisualSonics, Inc.
Agradecimentos
Os autores gostariam de agradecer Eliana Beraldi para a realização de transdução viral de linhagens de células tumorais e Ben Deeley para sua instrução sobre o uso do pequeno animal plataforma ultra-sonografia.
Este projecto foi apoiado pelo Sistema Alemão Foundation (DFG; JA 2117/1-1: 1), o Instituto de Pesquisa Canadian Cancer Society e uma Mentored Médico Scientist Award de Vancouver Coastal Research Institute Health. A plataforma ultra-sonografia foi financiado pela Fundação Canadense para Inovação.
Materiais
| Name | Company | Catalog Number | Comments |
| Chlorhexidine gluconate (2%) | Aplicare | 82-319 | |
| Dulbecco’s Modified Eagle’s Medium (DMEM) | Thermo Scientific | SH3008101 | |
| Fetal bovine serum (FBS) | Thermo Scientific | SH3007103 | |
| Isoflurane | Baxter Corporation | 402-069-02 | |
| Trypsin (0.25%) | Thermo Scientific | SH3004202 | |
| Syringe (1 ml) | BD Bioscience | 309659 | |
| Hypodermic needle (30 G; ¾ in) | Kendall | 830340 | |
| Angiocatheter (24 G) | BD Bioscience | 381112 | |
| Vevo 770 small animal imaging platform | VisualSonics | ||
| RMV 706 ultrasound scanhead | VisualSonics | ||
| IVIS Lumina III | Caliper Life Science |
Referências
- Chan, E., Patel, A., Heston, W., Larchian, W. Mouse orthotopic models for bladder cancer research. BJU Int. 104, 1286-1291 (2009).
- Kubota, T. Metastatic models of human cancer xenografted in the nude mouse: the importance of orthotopic transplantation. J. Cell. Biochem. 56, 4-8 (1994).
- Hadaschik, B. A., et al. A validated mouse model for orthotopic bladder cancer using transurethral tumour inoculation and bioluminescence imaging. BJU Int. 100, 1377-1384 (2007).
- Kang, M. R., et al. An Orthotopic Bladder Tumor Model and the Evaluation of Intravesical saRNA Treatment. J. Vis. Exp. (65), (2012).
- Dobek, G. L., Godbey, W. T. An Orthotopic Model of Murine Bladder Cancer. J. Vis. Exp. (48), (2011).
- Dinney, C. P., et al. Isolation and characterization of metastatic variants from human transitional cell carcinoma passaged by orthotopic implantation in athymic nude mice. J. Urol. 154, 1532-1538 (1995).
- Fu, C., Apelo, C. A., Torres, B., Thai, K. H., Hsieh, M. H. Mouse Bladder Wall Injection. J. Vis. Exp. (53), (2011).
- Xiao, Z., et al. Characterization of a novel transplantable orthotopic rat bladder transitional cell tumour model. Br. J. Cancer. 81, 638-646 (1999).
- Iinuma, S., Bachor, R., Flotte, T., Hasan, T. Biodistribution and phototoxicity of 5-aminolevulinic acid-induced PpIX in an orthotopic rat bladder tumor model. J. Urol. 153, 802-806 (1995).
- Jäger, W., et al. Hiding in plain view: Genetic profiling reveals decades old cross-contamination of bladder cancer cell line KU7 with HeLa. J. Urol. (13), (2013).
- Horiguchi, Y., Larchian, W. A., Kaplinsky, R., Fair, W. R., Heston, W. D. Intravesical liposome-mediated interleukin-2 gene therapy in orthotopic murine bladder cancer model. Gene Ther. 7, 844-851 (2000).
- Dinney, C. P., et al. Isolation and characterization of metastatic variants from human transitional cell carcinoma passaged by orthotopic implantation in athymic nude mice. J. Urol. 154, 1532-1538 (1995).
- Black, P. C., et al. Validating bladder cancer xenograft bioluminescence with magnetic resonance imaging: the significance of hypoxia and necrosis. BJU Int. 106, 1799-1804 (2010).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados