Method Article
Formação Sinapse Inibitória em uma co-cultura-tipo que comportem GABAérgicos espinhosos médios neurônios e células HEK293 expressando estavelmente GABA
Neste Artigo
Resumo
Os mecanismos moleculares que coordenam a formação de sinapses inibitórias GABAergic durante a ontogenia são em grande parte desconhecidos. Para estudar estes processos, temos desenvolvido um sistema modelo de co-cultura que incorpora embrionárias neurónios GABAérgicos espinhoso meio de cultura em conjunto com o rim embrionário humano 293 (HEK293) transfectadas estavelmente células que expressam receptores GABA A funcionais.
Resumo
Inhibitory neurons act in the central nervous system to regulate the dynamics and spatio-temporal co-ordination of neuronal networks. GABA (γ-aminobutyric acid) is the predominant inhibitory neurotransmitter in the brain. It is released from the presynaptic terminals of inhibitory neurons within highly specialized intercellular junctions known as synapses, where it binds to GABAA receptors (GABAARs) present at the plasma membrane of the synapse-receiving, postsynaptic neurons. Activation of these GABA-gated ion channels leads to influx of chloride resulting in postsynaptic potential changes that decrease the probability that these neurons will generate action potentials.
During development, diverse types of inhibitory neurons with distinct morphological, electrophysiological and neurochemical characteristics have the ability to recognize their target neurons and form synapses which incorporate specific GABAARs subtypes. This principle of selective innervation of neuronal targets raises the question as to how the appropriate synaptic partners identify each other.
To elucidate the underlying molecular mechanisms, a novel in vitro co-culture model system was established, in which medium spiny GABAergic neurons, a highly homogenous population of neurons isolated from the embryonic striatum, were cultured with stably transfected HEK293 cell lines that express different GABAAR subtypes. Synapses form rapidly, efficiently and selectively in this system, and are easily accessible for quantification. Our results indicate that various GABAAR subtypes differ in their ability to promote synapse formation, suggesting that this reduced in vitro model system can be used to reproduce, at least in part, the in vivo conditions required for the recognition of the appropriate synaptic partners and formation of specific synapses. Here the protocols for culturing the medium spiny neurons and generating HEK293 cells lines expressing GABAARs are first described, followed by detailed instructions on how to combine these two cell types in co-culture and analyze the formation of synaptic contacts.
Introdução
GABA é um dos primeiros neurotransmissores encontrados no cérebro embrionário, que precede o mais abundante neurotransmissor excitatório glutamato 1. Durante o desenvolvimento, GABA despolariza e excita neurônios imaturos, desempenhando um papel fundamental na regulação da proliferação celular, migração e formação de redes neuronais sem induzir excitotoxicidade. No cérebro adulto, o potencial de inversão para os canais dos receptores GABA A é deslocado para potenciais mais negativos, devido a uma diminuição na concentração intracelular de cloreto. Este efeito é causado por sobre-regulação do cloreto de potássio-co-transportador (KCC2), que transporta cloreto de fora da célula, e, em paralelo, a regulação negativa do transportador-potássio-cloreto de sódio (NKCC1), que tem 2 o efeito oposto.
No cérebro, o GABA liga-se principalmente aos receptores GABA A, quer B ou GABA para mediar rápido ou lento inibição sináptica, respectivaly. Rs GABA A são uma classe de receptores também conhecidos como ionotrópica heteropentamérica ou canais iônicos Cys de circuito fechado por ligante. Duas moléculas de GABA são necessários para a activação do receptor, que é permeável aos iões cloreto e, em menor grau, os iões de bicarbonato. O aumento na condutância do cloreto diminui a eficácia de despolarização, eventos excitatórios na activação do neurónio pós-sináptico 3.
Diversidade estrutural dos Rs GABA A tem sido reconhecida como um fator chave na determinação da sua vasta gama de propriedades funcionais e farmacológicas. Rs nativo GABA A são hetero-pentâmeros compostas por subunidades com múltiplas isoformas classificadas como: α (1-6), β (1-3), γ (1-3), δ, ε, π θ e 3, com um comum topologia transmembranar compreendendo um grande domínio N-terminal extracelular, quatro domínios transmembranares (TMS), e um grande domínio intracelular TMs entre 3 e 4 4. Oβ3 e γ2 subunidades são essenciais para a inibição sináptica e sobrevivência do organismo, porque ratinhos portadores de deleção genética destas subunidades morrer após o nascimento 5,6. Em contraste, as isoformas individuais de α subunidade são importantes para a função das conexões sinápticas específicas no cérebro associada com diferentes comportamentos, tais como a ansiedade, sedação, excitação, e outros, mas não são, individualmente, essencial para a vida 7-9. Rs GABA A são os principais locais de ação para uma variedade de drogas com sedativo potente, hipnóticos, ansiolíticos e efeitos anticonvulsivantes, tais como benzodiazepínicos, barbitúricos, neuroesteróides e anestésicos 7,10,11.
Rs Synaptic GABAA normalmente contêm uma subunidade γ2, duas subunidades β (mais comumente β2 ou β3) e duas subunidades α (α1, α2, α3 ou α5) 12,13. A classe predominante dos receptores extra-sináptica contém a subunidade δ em combinaçãocom duas subunidades α (α4 ou α6) e duas subunidades β (β2 ou β3 14). Localização subcelular de GABA A Rs para axónios, os dendritos ou soma, e inserção na membrana do plasma são dependentes da presença de β-subunidades 15,16. No entanto, a incorporação selectiva de diferentes subtipos de receptores GABA A R em tipos diferentes de sinapses se correlaciona bem com a presença de subunidades α específicos (α1, α2, α3 ou α5) 7,17,18. É importante ressaltar que a eliminação de α1 ou α2 subunidade em ratos provoca alterações ultra-estruturais em sinapses inibitórias 19. Isto sugere que o GABA A RS si pode desempenhar um papel direto na regulação formação de sinapses.
As evidências indicam que o desenvolvimento GABAérgica sinapse é precisamente uma sequência coordenada de eventos, nos quais ambos os alvos neuronais contactado por diferentes tipos de axónios e os receptores inibitórios que são agrupadas emcada classe de sinapse inibitória são seletivos e funcionalmente sintonizados 17,20-22. Este princípio fundamental de especificidade nas sinapses GABAérgicos levanta a questão de como os parceiros de pré e pós-sinápticos reconhecer uns aos outros durante o início de contatos sinápticos.
Os ensaios in vitro de co-cultura foram aplicadas com sucesso para estudar alguns dos mecanismos de formação de sinapses e para testar o papel de proteínas que atravessam a fenda sináptica individuais neste processo. Uma das trans-sinápticos combinações de proteínas comuns interagindo que funcionam bi-direcional para mediar a formação de sinapses e maturação, são o neurexinas (Nrxns) e neuroligins (NLS). Nrxns são proteínas pré-sinápticas que apresentam splicing alternativo dentro de seus domínios de proteínas de ligação do hormônio laminina-neurexin sexo, dando origem a muitas isoformas diferentes 23. Enquanto o Nrxns também interagir com outras proteínas, NLS são pensados para ser seu pa pós-sináptica onipresentertners 24. Juntas, estas proteínas contribuem para manter as membranas pré-sinápticas e pós-sinápticos em estreita e rígida aposição 25. As duas isoformas mais abundantes são NL-1 e NL-2, que estão presentes em excitatórios e inibitórios sinapses, respectivamente 26. Um dos primeiros sistemas de modelo de co-cultura, concebidos para investigar interacções proteína trans-sinápticos, empregues diferentes tipos de células não-neuronais, linhas de células imortais mais comumente, tais como rim embrionário humano (HEK) 293, a sobre-expresso NL- 2. Quando estas células foram cultivadas com neurónios pontine, foi observada uma acumulação de proteínas pré-sinápticos em estreita proximidade com a superfície das células HEK, indicando a formação de contactos de sinapses semelhante. A adição de β-solúvel neurexin a estes co-culturas inibiu a formação de contatos, o que sugere que as interações trans-sinápticas entre Nrxns e NLS são necessários para a formação de contacto sináptico 27. Além disso, a expressão transientede β-neuroxinas em células COS (C V-1 (símia) em O rigin, e que transporta o material genético S V40) co-cultivadas com glutamatérgica dissociada do hipocampo e neurónios GABAérgicos expressão induzida do gephryin proteína pós-sináptica de GABA A e R subunidades γ2 e α2 nos pontos de contato entre esses dois tipos de células 28. Outro exemplo de um modelo de co-cultura utilizado para estudar a formação de sinapses envolvidos células HEK293, transitoriamente transfectadas com as subunidades do receptor GABA A R α2 / β3 / γ2 e NL-2, e uma população mista de neurónios hipotalâmicos 29. Este estudo concluiu que a expressão de NL-2 é uma exigência absoluta para a formação de sinapses inibitórias.
Α1 No entanto, no estudo recente de co-cultura, estavelmente transfectadas / β2 / γ2 GABA A Rs em células HEK293 foram encontrados para ser suficiente para induzir as sinapses funcionais quando co-cultivadas com med GABAérgicosneurônios espinhosos ium, sem a necessidade de proteínas adicionais de adesão trans-sinápticos ou pós-sinápticos. No entanto, foi observado um aumento de destaque na formação e força sinapse quando NL-2 foi co-expressa com GABA A Rs 30. Isto indica que este sistema de modelo de co-cultura tem vantagens sobre os sistemas de modelos anteriormente descritos, com mais evidência um aumento da sensibilidade e fiabilidade da detecção de contacto sináptico. Dois factores importantes que contribuem para a melhoria global na detecção de contactos sinápticos são: i) A utilização de linhas de células estavelmente transfectadas HEK293 com expressão elevada e consistente de R subunidades GABA A na superfície de células individuais. Essa consistência facilita as comparações quantitativas entre diferentes condições de co-cultura. ii) A utilização de uma população pura de neurónios GABAérgicos espinhosas meio cultivado a partir do corpo estriado embrionário 31 remove as ambiguidades e as complicações resultantes da utilização de populações mistas neuronais e alows, por exemplo, a selecção de um dos tipos de receptores GABA A pós-sinápticos R mais apropriados que podem ser comparados uns com os outros durante a formação de sinapses.
Formação de sinapses é pensado para envolver muitos sinais trans-sinápticos dentro complexos de adesão celular pré e pós-sinápticos. Devido à natureza bi-direccional de sinalização sináptica e os números absolutos de moléculas de adesão celular, é difícil identificar os principais componentes envolvidos na formação de sinapses. Assim, a transfecção de uma única proteína de adesão da célula para uma célula não-neuronal (neste caso, os dois alvos pós-sinápticos mais prevalentes para GABAérgicos neurónios espinhosos médios in vivo, α1 / β2 / ou γ2 α1 / β3 / γ2 GABA A Rs 32) grandemente reduz a complexidade de sinais de trans-sináptica disponíveis na superfície pós-sináptico e permite a análise quantitativa rigorosa da eficácia da presente proteína para promover a formação de sinapses.
Protocolo
Sprague-Dawley ratos ou BAB / c camundongos isogênicos (Harlan, Reino Unido, o número de fêmeas grávidas utilizado foi de 30) foram alojados e sacrificados de acordo com o UK Home Office [e directiva Comunidades Europeias Conselho, de 24 de Novembro de 1986 (86/609 / CEE) ] orientações. O projeto foi aprovado formalmente pela Faculdade UCL do Comitê de Ética Farmácia.
1. Preparação de Instrumentos, Meio de Cultura, e pratos
- Ligue e limpar a câmara de fluxo laminar com etanol a 70%, a fim de trabalhar em condições de esterilidade em todas as ocasiões.
- Prepare HEK293 meio de cultura celular, contendo Modified Eagle Médium pH de Dulbecco 7,4 (DMEM, 500 ml), L-glutamina (2 mM), penicilina (50 unidades / ml), estreptomicina (50 ug / ml), e soro fetal bovino (10 %).
NOTA: penicilina e estreptomicina são irritantes. - Preparar o meio de cultura neuronal isento de soro, contendo meio Neurobasal pH 7,4 (500 ml), suplemento B27 (25 ml), L-glutamina (2 mM), penicilina(50 unidades / ml), estreptomicina (50 ug / ml), e glicose (6 mM).
- Prepare-se 500 ml de solução salina tamponada com HEPES (HBSS), contendo HBSS 10x estoque (50 ml), HEPES (1 M) (5 ml) e água (445 ml), pH 7,4.
- Solução salina tamponada com fosfato autoclave (PBS, pH 7,4; 1 L), água (1 L), lamelas de vidro (13 mm de diâmetro) e pipetas de Pasteur de vidro para esterilizar-los.
2. Preparação de HEK293 Linha celular estável expressando α1 / β3 / γ2-GABA A Rs
- Placa de 2x10 6 células HEK293 em uma placa de cultura de tecido de 10 centímetros estéril e incubar a 37 ° С numa atmosfera humidificada com 5% de dióxido de carbono (CO 2) atmosfera (incubadora de CO2), a fim de chegar a 70-90% de confluência durante a noite.
- No dia seguinte, transfectar células HEK293 com o GABA A R ADNc α1 subunidade no vector pcDN 3.1 (+) de expressão que incorpora o gene de resistência a G418 dissulfato (Tabela 1),e o cDNA β3 subunidade GABA A R no vector de expressão que incorpora a fleomicina D1 (Tabela 1) o gene de resistência (tanto sob a regulação de um precoce imediato de CMV), promotor do citomegalovírus humano (), utilizando uma formulação de lipossoma catiónico, que se complexa com negativamente moléculas carregadas de ácidos nucleicos (Tabela 1) de acordo com o protocolo do fabricante.
- Resumidamente, adicionar 500 ul de meio de soro reduzido (pH 7,4; Tabela 1) e 7,5 ug de cada ADNc para construir um tubo de centrífuga de 15 ml estéril, seguido de 15 ul de reagente de transfecção lipossómica de tamponamento, e misturar suavemente antes de deixar à temperatura ambiente durante 5 min.
- A esta mistura, adicionar 8,75 mL de reagente de transfecção lipossómica e misturar suavemente antes de deixar à temperatura ambiente durante 30 min. Seguindo isto, adicionar 3 ml de meio de cultura de células HEK293 (sem antibióticos), pipetar o conteúdo do tubo de centrífuga para cima e para baixo duas vezes, transfer gota a gota sobre as células que crescem em um 10 centímetros prato de cultura de tecidos, e incubar durante 48 horas a 37 ° С numa atmosfera humidificada com 5% de CO2 (incubador de CO2).
- Lavar as células HEK293 suavemente com PBS estéril, pH 7,4, e diluir as células HEK293 transfectadas em novas placas de cultura de 10 centímetros de tecido, nas seguintes proporções: 1: 3, 1: 5, 1: 7, 01:10, 01:15 e 1:20. Isto assegura que as células não se torne excessivamente confluentes.
- Iniciar a selecção das células HEK293 que expressam ambas as subunidades GABA A de P por adição de 800 ug / ml de cada marcador de selecção antibiótico, G418, fleomicina e D1, ao meio de cultura. Incubar as células a 37 ° С numa atmosfera humidificada com 5% de CO2 (incubador de CO 2) e substituir o meio contendo antibiótico (10 ml) a cada 2 dias.
- Quando pequenas colónias brancas começam a formar (geralmente após cerca de 7 dias), seleccionar cuidadosamente uma única colónia de cada um dos pratos e recolhê-la usando uma P1000 estérilponta da pipeta. Transferi-lo para um poço de uma placa de cultura de tecidos de 24 poços contendo 500 ul de meio e ressuspender cuidadosamente por pipetagem do meio para cima e para baixo. Certifique-se de que exatamente uma colônia é transferida em cada poço (um total de 20/05 colônias é aconselhado). Incubar as células a 37 ° С numa atmosfera humidificada com 5% de CO2 (incubador de CO 2) e substituir o meio contendo o antibiótico a cada 2 dias.
- Uma vez que as colónias tornam-se 70-80% confluentes, o meio de pipeta suavemente para cima e para baixo para desalojar as células da parte inferior da placa de 24 poços de cultura de tecidos. Transferir e dividir a suspensão de células entre dois poços de uma placa de 6 poços de cultura de tecidos. Incubar as células a 37 ° С numa atmosfera humidificada com 5% de CO2 (incubador de CO 2) e substituir o meio contendo o antibiótico a cada 2 dias.
- Uma vez que 70-80% confluentes, recolher as células a partir de um dos dois poços que contêm as células provenientes do mesmo cólon únicalisados de proteínas y e se preparar. Resumidamente, as células de lavar 2x com PBS, pH 7,4, e adicionar 200 ul de 2% de dodecilsulfato de sódio (SDS) em PBS, pH 7,4. Recolhe-se o lisado e transferi-lo para o tubo de microcentrífuga. Medir a concentração de proteína utilizando o reagente de proteína BCA (ver Tabela 1), de acordo com o protocolo do fabricante. Analisar a expressão de α1 e β3 subunidades dos receptores GABA A por SDS / PAGE e immunoblotting usando anticorpos específicos de subunidades (específicos anti-α1 coelho e coelho anticorpos GABA A anti-R-β3 específico, consulte a Tabela 1 para obter as informações sobre estes anticorpos).
- Desalojar e transferir apenas os clones positivos a partir dos poços remanescentes para maiores seis centímetros pratos de cultura de tecidos. Incubar as células a 37 ° С numa atmosfera humidificada com 5% de CO2 (incubador de CO 2) e substituir o meio contendo o antibiótico a cada 2 dias.
- Aos poucos, expandir as colônias de células under a selecção de antibiótico, transferindo-os para 10 centímetros pratos de cultura de tecido e, finalmente, para frascos de cultura de tecidos (frascos T-75). Incubar as células a 37 ° С numa atmosfera humidificada com 5% de CO2 (incubador de CO 2) e substituir o meio contendo o antibiótico a cada 2 dias.
- Placa 70.000 células de cada colónia em lamelas de vidro (13 mm de diâmetro) e fixar as células para analisar a expressão de superfície celular e de co-localização de GABA A R subunidades por imunofluorescência.
- Escolher o clone positivo de células HEK293 que expressam níveis elevados de ambas as α1 e β3 subunidades de receptores GABA A, placa de 2 x 10 6 células em uma cultura de tecidos de 10 centímetros estéril prato e incubar a 37 ° С numa atmosfera humidificada com 5% de CO2 ( incubadora de CO 2) durante a noite. Certifique-se de que as células são incubadas em contendo antibióticos (G418 e fleomicina D1) médio em todos os momentos.
- No dia seguinte, transfecção HEK293 células com receptores GABA A R γ2s cDNA da subunidade na pcDNA ™ 3.1 (+) vector de expressão incorporando um gene de resistência à higromicina B usando um reagente de transfecção não lipídico lipossómico (Tabela 1).
NOTA: Este método de transfecção permite uma melhor sobrevida e maior eficiência de expressão de proteínas estranhas em crescimento linhas celulares estáveis lentos que estão sob seleção contínua com antibióticos. - Numa estéril 15 ml tubo de centrífuga, adicionar 250 ul de tampão de condensação e Enhancer DNA (Tabela 1) e 1,4 ug de cDNA γ2s GABA A subunidade de receptor. Adicionar 11.2 ul de Enhancer e vortex durante 1 seg antes de deixar à temperatura ambiente durante 5 min.
- Adicionar 35 ul de não-reagente de transfecção lipossómica de lípido e de vórtice durante 10 segundos antes de deixar à temperatura ambiente durante 10 min. Adicionar 3 ml de G418 / fleomicina-D1 contendo meio de pipeta e o conteúdo do tubo de centrífuga para cima e para baixo duas vezes befminério de transferi-lo gota a gota sobre as células que crescem em um 10 centímetros placa de cultura de tecidos. Incubar as células durante 48 h a 37 ° С numa atmosfera humidificada com 5% de CO2 (incubador de CO2).
- Lavam-se as células cuidadosamente com PBS estéril e diluí-los em novas placas de cultura de 10 centímetros de tecido, nas seguintes proporções: 1: 3, 1: 5, 1: 7, 1:10, 1:15 e 1:20.
- Iniciar a selecção de células α1 / HEK293 β3-expressam a subunidade γ2s por adição de 800 ug / ml de marcador de selecção de antibiótico higromicina B para a G418 / fleomicina-D1 contendo meio. Substituir o meio velho com o G418 fresco / fleomicina D1 / higromicina B contendo o meio (10 ml) a cada 2 dias.
- Repita os passos 2,7-2,12, sob seleção contínua no G418 / meio de cultura celular fleomicina D1 / Higromicina B contendo.
- Armazenar os clones positivos em -140 ° C em meio de cultura celular isento de antibiótico e 10% de dimetilsulfóxido (DMSO) para o uso futuro.
- Teste o nívelde expressão de α1, β3 e γ2s GABA R subunidades por immunoblotting e imunofluorescência em cada clone após a descongelação, porque a expressão pode mudar devido à redução da sobrevivência das células sob seleção antibiótico.
3. Manutenção da Linhas de Células HEK293
- Descongelar uma ampola de células HEK293 controlo ou aquelas que expressam quer α1 Rs / β2 / γ2-GABA A (Tabela 1) ou β3 / Rs / α1 γ2-GABA A (descrito acima) em 10 ml de meio de cultura de células em um 15 ml estéril tubo de centrífuga. Centrifugar a 440 xg durante 5 min para remover o excesso de DMSO.
- Remover sobrenadante e ressuspender as células em 1 ml de meio de cultura de células fresco.
- Primeiro adicionar 9 ml de meio de cultura celular fresco a uma 10 centímetros prato de cultura de tecidos revestidos com poli-D-lisina (0,1 mg / ml) e, em seguida, 1 ml de células ressuspensas. Agitar suavemente, lado-a-lado, para dispersar as células e incubar a 37 ° С num humidificada5% de CO2 (incubador de CO2).
- No dia seguinte, aspirar o meio para remover qualquer resíduo de células e substituir com 10 ml de fresco HEK293 meio de cultura celular.
- Escolha de linhas celulares estáveis com antibióticos para remover quaisquer células que não expressam receptores GABA A R subunidades e, por conseguinte, também falta a expressão de marcadores de resistência a antibióticos. Para a linha / β2 / γ2 celular estável α1, substitua meio normal de cultura de células com meio fresco contendo G418 (800 ug / ml). Para a linha de α1 / β3 / célula γ2, substitua com meio de cultura celular fresco contendo G418 (800 ug / ml), fleomicina D1 (800 ug / ml) e higromicina B (800 ug / ml). CUIDADO! G418 é um irritante e Higromicina B é corrosivo, tóxico e irritante.
- A passagem das células para uma nova placa de cultura de tecidos por sementeira, a uma densidade mais baixa, uma vez atingido> 70% de confluência. Aspirar 10 ml de meio de cultura celular e lavar duas vezes com brevementePBS, pH 7,4. Adicionar 1 ml de solução de tripsina-EDTA, a uma solução de protease de tripsina (tripsina a 0,05%) e um quelante de Ca2 + EDTA (0,02%) em PBS, pH 7,4, para separar as células do prato. CUIDADO! Tripsina-EDTA solução é um irritante.
- Adicionar 10 ml de meio de cultura celular contendo os antibióticos adequados, para o prato e aspirar as células. Centrifuga-se as células a 440 xg durante 5 min e ressuspender-los em 5 ml de meio de cultura celular.
- A passagem das células utilizando uma diluição de 1:10 para um novo frasco de cultura de tecidos (frasco T-75) contendo meio de cultura celular fresco e os antibióticos adequados. Incubar as células a 37 ° С numa atmosfera humidificada com 5% de CO2 (incubador de CO 2) e substituir o meio de dois em dois dias. Passagem das células quando> 70% confluentes (veja o passo 2.8).
4. Preparação de GABAergic Médio espinhoso Neuron Cultura
- Sob condições estéreis preparar um 24 nósll placa com poli-L-lisina (0,1 mg / ml) -Revestido lamelas (13 mm de diâmetro) e incubar a 37 ° С numa atmosfera humidificada com 5% de CO2 (incubador de CO2).
- No dia seguinte, aspirado com uma pipeta o excesso de poli-L-lisina e lava-se lamelas com duas breves 10 segundos e duas lavagens de 5 min longos com água estéril. Adicionar laminina (0,01 mg / ml) durante a noite e incubar a 37 ° С numa atmosfera humidificada com 5% de CO2 (incubador de CO2).
- Higienizar a área de dissecção com etanol 70% e reunir um conjunto de ferramentas de dissecação, como uma pinça curva e reta, tesouras e pinças, e coloque em 70% de etanol para esterilizar completamente os instrumentos de dissecação.
- Coloque a grávida rato / rato sacrificados com CO 2 em suas costas e limpar a pele do seu abdômen com etanol 70%. Aperte a pele com uma pinça e cortar em torno do abdômen através da pele, músculo e peritônio, para revelar os órgãos internos e úterocom embriões claramente. Extrair os embriões (E16-17) a partir do útero e colocá-los em uma placa de Petri com PBS refrigerados.
- Coloque os embriões na capela de fluxo laminar e decapitar as crianças, recolhendo as cabeças em uma nova placa de Petri com HBSS gelada.
- Sob um microscópio de dissecação, dissecar o cérebro usando a pinça curvas e retas. Coloque o cérebro para uma nova placa de Petri contendo gelada HBSS.
- Separe os dois hemisférios cerebrais e retire cuidadosamente as meninges. O corte ao longo da linha do hipocampo e do córtex casca de volta para revelar o corpo estriado. Observe o striatum como uma estrutura branca estriada no anterior do hemisfério.
- Dissecar o corpo estriado e cortá-la em pedaços muito pequenos (1-2 mm de diâmetro) e usar uma pipeta Pasteur polida-fogo para coletar o material em um estéril 15 ml tubo de centrífuga com um volume total de 1 ml. Fogo-de polimento garante que o material é coletado sem ser danificado.
- Usando a ti polido-fogop da pipeta Pasteur, aspirar as células e libertá-los 8-10 vezes. Tomando uma nova pipeta com uma ponta-fogo polonês de aproximadamente 30% do seu diâmetro original (1 mm), triturar a solução mais 4-6 vezes até que ele aparece homogênea.
- Filtrar as células usando um 100 um coador de células de nylon para um tubo de centrífuga estéril fresco.
- Contar as células com um hemocitómetro e placa 70.000 células em 500 ul de meio de cultura neuronal por poço numa placa de cultura de tecidos de 24 poços. Agitar os poços esquerda para a direita e incubar a 37 ° С numa atmosfera humidificada com 5% de CO2 (incubador de CO 2) durante 14 dias in vitro (DIV).
- Após 7 dias, verificar a pureza das culturas neuronais e, se estiverem presentes células da glia, adicionar citosina β-D-arabinósido (Ara-C; 5 fiM) aos poços para parar a sua proliferação. Para fazer isso, remover 250 ul de meio de cultura neuronal (pH 7,4) de cada poço e adicionar 250 ul de meio fresco contêming Ara-C. CUIDADO! Ara-C é um irritante.
5. Co-cultura Preparação
- No dia 11 de cultura neuronal, revestimento de uma placa de 6 poços com poli-D-lisina (0,1 mg / ml) sob condições estéreis e incubar durante a noite a 37 ° С numa atmosfera humidificada com 5% de CO2 (incubador de CO2).
- O dia seguinte (dia 12 de cultura neuronal), aspirar o excesso de poli-D-lisina e lavar os poços e 2x 2x brevemente durante 5 min com água estéril antes da adição de meio de cultura celular fresco (sem antibióticos) para revestir os poços com uma pequena quantidade de soro a partir do meio.
- Aspirar o meio de cultura a partir do balão de cultura de tecidos (T-75). Lavar as células duas vezes com PBS antes da adição de 1 ml de Ca 2+ / Mg 2+ agente -chelating EDTA (0,48 mM) que delicadamente e não enzimaticamente dissocia células. Agita-se as células a separar-los a partir do fundo do balão de tecido.
- Adicionar 10 ml de meio de cultura celular (sem antibióticos, pois isso pode interferir com a transfecção), aspirar as células e os coloque em um tubo de centrífuga estéril. Agregar as células em 440 xg por 5 min usando uma baixa velocidade de bancada centrífuga.
- Remover o sobrenadante e ressuspender as células em 1 ml de meio de cultura de células fresco. Usando um hemocitómetro, e contar as células em placas a uma densidade de 3 x 10 5 células por poço numa placa de 6 poços. Agita-se suavemente e incuba-se durante 24 horas a 37 ° С numa atmosfera humidificada com 5% de CO2 (incubador de CO2).
- No dia seguinte (dia 13 de cultura neuronal) transitoriamente transf as células HEK293 com mCherry cDNA em pcDNA3 construção de expressão utilizando o reagente lipossomal transfecção. Resumidamente, num tubo de microcentrífuga estéril, adicionar 500 ul de meio de soro reduzido e 5 ug de ADNc mCherry. Adicionar 5 mL de reagente lipossomal buffer e misture delicadamente antes de deixar à temperatura ambiente durante 5 min.
- Adicionar 8,75 mL de transfecção reag lipossomalent e misture delicadamente antes de deixar em temperatura ambiente por 30 min. Pipetar o conteúdo do tubo de microcentrífuga para cima e para baixo duas vezes, a transferência de gota a gota, a cada poço na placa de 6 poços de cultura de tecidos e incubar a 37 ° С numa atmosfera humidificada com 5% de CO2 (incubador de CO2).
- O dia seguinte (dia 14 de cultura neuronal), aspirar o meio de cultura de células HEK293 de cada um dos 6 poços e lava-se brevemente cada poço duas vezes com PBS (pH 7,4). Adicionar 300 ul de Ca 2+ / Mg 2+ agente -chelating EDTA (0,48 mM) e 200 ul de tripsina-EDTA - solução a cada poço e incubar a 37 ° С durante 5 min (0,02 0,48 mM).
- Adicionar 1 ml de fresco HEK293 meio de cultura de células por poço (isso mata a tripsina) e aspirar as células destacadas em um estéril 15 ml tubo de centrífuga. Centrifuga-se as células a 440 xg durante 5 min à temperatura ambiente e remover o sobrenadante. Ressuspender o sedimento em 500 ul de meio de cultura neuronal (pH 7,4).
- Usando um hemocitómetro, e contar as células de semente a uma densidade de 30.000 células por poço numa placa de cultura de tecidos de 24 poços contendo neurónios. Agitar a placa para dispersar as células e incuba-se co-culturas a 37 ° С numa atmosfera humidificada com 5% de CO2 (incubador de CO 2) durante 24 h.
6. Análise de Synaptic Contatos e sua atividade
- Depois de 23 horas em co-cultura, investigar a formação de contatos "ativos" entre GABAergic neurônios espinhosos médios e células HEK293 usando absorção de anticorpo específico de domínio luminal anti-synaptotagmin conjugado com um corante fluorescente dependente de atividade (Cy5, ver Tabela 1) .
NOTA: O anticorpo só terá acesso ao domínio luminal de sinaptotagmina, ao qual se liga quando existe uma continuidade entre o lúmen das vesículas sinápticas e espaço extracelular. Isso ocorre especialmente durante a liberação de neurotransmissores, tornando este ANTIBRGANISMO um excelente marcador dos terminais pré-sinápticos activas. - Em primeiro lugar enxaguar as co-culturas com meio neuronal (Neurobasal Um meio, pH 7,4, ver Tabela 1) e adiciona-rato marcado com Cy5 anticorpo anti-sinaptotagmina, diluiu-se a 1:50 em meio neuronal (Neurobasal Um meio, pH 7,4), para o culturas, durante 30 min. Incubar as células durante este tempo a 37 ° С numa atmosfera humidificada com 5% de CO2 (incubador de CO2).
- Para remover o acesso do anticorpo, lavar as co-culturas brevemente três vezes: primeiro com PBS frio normal (pH 7,4), segundo com PBS frio (pH 7,4) contendo NaCl 200 mM, e em terceiro lugar com PBS frio normal (pH 7,4)
- Fixar as células com 300 uL de paraformaldeído a 4% / 4% de sacarose em PBS (PFA, pH 7,4) durante 10 min com agitação. Lavar as células duas vezes brevemente com PBS (pH 7,4), em seguida, com mais duas lavagens de 10 min.
- Adicionar glicina (0,3 M) a cada poço durante 10 minutos com agitação para extinguir PFA.
- Lavar as células briefly duas vezes com PBS (pH 7,4), em seguida, com mais duas lavagens de 10 min antes da adição de 300 ul de solução (1% (w / v) de albumina de soro bovino (BSA) em PBS, pH 7,4) para reduzir a ligação não específica de bloquear Os anticorpos.
- Aspirar a solução de bloqueio e adicionar o anticorpo de cobaia anti-GABA A R-γ2 dirigido contra o γ2 domínio N-terminal 33 (1: 3000 em PBS, pH 7,4) durante a noite a 4 ° С.
- No dia seguinte, aspirar o anticorpo primário a partir dos poços e lavam as células brevemente duas vezes com PBS, em seguida, com mais duas lavagens de 10 min.
- Permeabilizar as células com o Triton X-100 (0,1%) em solução de bloqueio durante 30 minutos à temperatura ambiente.
- Lavar as células duas vezes brevemente com PBS (pH 7,4), em seguida, com mais duas lavagens de 10 min antes de se adicionar quer a descarboxilase do ácido glutâmico anti-rato (GAD) 65 anticorpo (1: 4000, Tabela 1) ou o anticorpo de ratinho anti-sinapsina I ( 1: 1000, Tabela 1) durante 120 min a t quartoemperature.
- Lavar as células duas vezes brevemente com PBS (pH 7,4), em seguida, com mais duas lavagens de 10 min e, em seguida, adicionar solução de bloqueio durante 30 minutos à temperatura ambiente.
- Centrifugar os anticorpos secundários apropriados (tipicamente de cabra anti-IgG de cobaia conjugados com Cy5 porco, de cabra anti-IgG de ratinho conjugado com Alexa Fluor 488 ou de cabra anti-IgG de rato Alexa Fluor 405, todas de 2 ug / ml) para remover os agregados de anticorpos em 21.910 xg durante 10 min, e adicionar anticorpos (1: 750) para solução de bloqueio. Aplicar para poços apropriados para 1 hora e cubra com papel alumínio para proteger os fluoróforos da exposição à luz e conseqüente fotodegradação.
- Finalmente, lavar as células duas vezes rapidamente com PBS (pH 7,4), em seguida, com mais duas lavagens de 10 min para remover qualquer anticorpo secundário não ligado e montar as lamelas utilizando o reagente de montagem (Prolong ouro, Tabela 1) cerca de 10 ul por lamela. Permita 24 horas para definir a temperatura ambiente, enquanto protegido da luz antes de se transferir para 4° С para armazenamento a longo prazo.
- Analisar amostras utilizando um microscópio confocal de varredura a laser com um objetivo de imersão em óleo 63X. Certifique-se os níveis de luz e ganho de detector é ajustada para evitar a saturação.
- Observe contatos potenciais sinapse-like como regiões de co-localização entre os terminais pré-sinápticos positivos para GAD65, sinapsina I ou Cy5 marcado anti-synaptotagmin e os pós-sinápticos HEK293 células visualizadas por DIC ou pelo indictor fluorescente mCherry.
- Contagem contatos potenciais sinapse-like usando série Z-stack de secções ópticas (8-10), através de uma profundidade de 4-5 mm por celular usando o software de imagem.
Resultados
O protocolo para este neurónio-HEK293 sistema modelo de co-cultura de células foi afinado para permitir a sobrevivência celular óptimo. Neste sistema, a formação de contactos de sinapses-like e sua análise baseia-se na expressão estável e consistente de todas as três subunidades do receptor GABA A que R montar em um receptor funcional. Por conseguinte, é importante o uso de análise imunocitoquímica de teste para a expressão da subunidade na superfície da célula HEK293 antes de adicioná-los para culturas neuronais. Nestas experiências, a expressão de superfície da célula de α1, β2 e subunidades γ2 (Figura 1A), ou α1, β3 e γ2 subunidades (Figura 1B), foi detectada usando anticorpos específicos para a subunidade que se ligam aos epitopos extracelulares destas subunidades. Foi demonstrado um elevado grau de co-localização entre estas subunidades na superfície da HEK293.
Depois de confirmar a expressão de superfície e de co-localização de GABA AR subunidades em HEK293 células, co-culturas foram preparadas utilizando HEK293 células que expressam subunidades α1 / β2 / γ2 GABA A e R neurônios espinhosos médios cultivadas por 14 dias (14 dias in vitro (DIV)). As células em co-cultura foram incubadas durante 24 h, fixadas e analisadas usando imunocitoquímica e microscopia confocal. Análise de contatos indicaram que GABAergic terminais do axônio GAD65 positivo formado apenas contatos esporádicos com o controle de células HEK293 (Figura 2A, 2B). O número de contatos detectados em 4 horas foi de 7,3 ± 0,9 por célula HEK293, e este número foi reduzido para 5,5 ± 0,5 conexões (média ± EPM) por célula HEK293 em 24 horas após a adição de células HEK293 aos neurônios cultivados. Em contraste, os terminais GAD65 positivas axônio GABAergic formado numerosos contactos sinapse-like com células HEK293 expressando Rs GABA A. O número de contatos obtidos em 4 h após a adição de células HEK293 foi de 28,3 ± 4,7 por célula HEK293, e esse número foi de novo aumentod para 52,1 ± 6,3 (média ± SEM) por célula HEK293 às 24 h em co-cultura (Figura 2A, 2B).
Para determinar se esses contatos sinapse-like foram 'ativo', ou seja, apoiada liberação do transmissor vesicular, uma específica de domínio anti-synaptotagmin vesícula-luminal anticorpo Cy5 conjugado foi adicionado ao meio de co-cultura após 23 horas de incubação. Este anticorpo é apenas incorporados em terminais nervosos pré-sinápticos, quando se forma um poro entre o lúmen das vesículas sinápticas e o fluido extracelular na fenda sináptica durante a libertação de neurotransmissores. Após a libertação, o poro fechado, deixando a sinaptotagmina anticorpo fluorescente Cy5-conjugado ligado a sinaptotagmina dentro da vesícula. Desta forma, apenas as vesículas que participam activamente na libertação de neurotransmissores são marcados com o anticorpo. Nesses experimentos poucos ou nenhuns contactos entre o controle HEK293 células e os terminais dos neurônios espinhosos médios eram "active & #8217; como mostrado pela falta de co-localização entre o pré-sináptico GAD65 / fluorescência e sinaptotagmina mCherry fluorescência em células HEK293 (Figura 3A). Em contraste, foram formados vários contactos «activos» entre os terminais dos neurónios espinhosos médios e α1 / β2 / γ2-expressando células HEK293, como revelado por um elevado grau de co-localização entre GAD65 / sinaptotagmina e mCherry, expresso especificamente em células HEK293 ( A Figura 3B).
Α1 Para testar se um diferente subtipo de receptores GABA A R também pode promover a formação de sinapses semelhante in vitro, que foram co-cultivadas / β3 / γ2 expressando células HEK293 com neurónios espinhosos médios. Mais uma vez, controle HEK293 raramente recebeu contatos com terminais pré-sinápticos sinapsina positivo atingindo 10,8 ± 0,48 contatos por celular HEK293 após 24 horas em co-cultura (Figura 4A esquerda, 4B) (± SEM média). No entanto, células HEK293 expressandoα1 / β3 / γ2 forma GABA A Rs significativamente mais contatos sinapse-like com terminais pré-sinápticos sinapsina-positivo de neurônios espinhosos médios atingindo 25,3 ± 0,27 (média ± SEM) contatos por celular HEK293 após 24 horas em co-cultura (Figura 4A direito, 4B). Isto indica que α1 / β3 / γ2 GABA A Rs expressa em células HEK293 que também são capazes de promover a formação de contacto sináptico, ainda que a sua potência é inferior à potência de α1 / β2 / Rs-γ2 contendo GABA A.
Estas experiências indicam que o sistema de modelo de co-cultura desenvolvida no nosso laboratório permite a análise quantitativa da formação de contacto sináptico in vitro, bem como a avaliação da eficácia dos diferentes subtipos de Rs GABA A neste processo. Estas experiências demonstram ainda que Rs GABA A, além de serem componentes críticos de sinapses funcionais GABAérgicos, pode desempenhar um papel fundamentalno processo de reconhecimento e de formação de contactos sinápticos entre neurónios inibitórios e as células neuronais alvo adequadas, de forma independente de outras proteínas de adesão sinápticos.
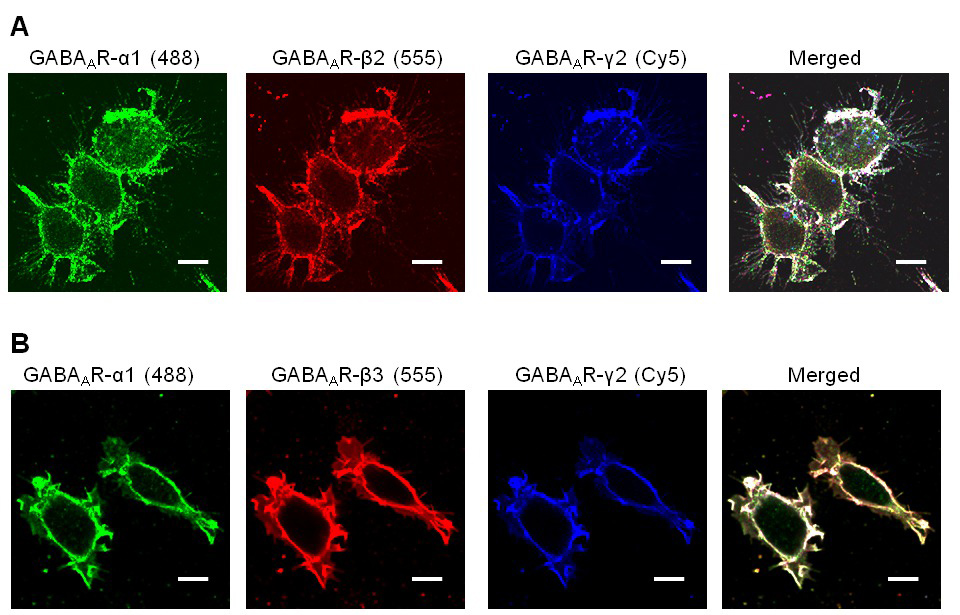
Figura 1. A análise de expressão de receptores GABA A R α1 imunocitoquímica / β2 / ou γ2 α1 / β3 / γ2 em linhas celulares estáveis HEK293. Os anticorpos que reconhecem os domínios extracelulares dos receptores GABA A subunidades R foram usadas para receptores de etiquetas expressas na superfície da célula. ( A) A linha de células HEK293 expressando α1 (Alexa Fluor 488), β2 (Alexa Fluor 555) e γ2 (Cy5) em níveis elevados. (B) linha celular HEK293 expressando α1 (Alexa Fluor 488), β2 (Alexa Fluor 555) e γ2 (Cy5)subunidades em níveis elevados. Barra de escala:. 10 mm Por favor, clique aqui para ver uma versão maior desta figura.

Figura 2. GABAergic neurônios espinhosos médios formar contatos sinapse-like com α1 / β2 / γ2- células que expressam HEK293 em co-cultura. (A) A microscopia por fluorescência de terminais pré-sinápticos com anticorpos anti-GAD65 (em verde) e as células HEK293 com mCherry (em vermelho, à esquerda) ou o GABA A R γ2 subunidade (em azul, à direita), revelou pontos de co-localização entre estes marcadores que indicam a formação de contatos sinapse semelhante após 4 ou 24 horas em co-cultura. Barra de escala:. 10 mm (B) Análise quantitativa de co-como sinapse ntacts. As células HEK293 foram identificados com base na sua forma, conforme revelado por DIC imagiologia e / ou expressão mCherry, e o número de contactos entre GAD-65 pontos lacrimais positiva (verde) e na superfície das células HEK293 foi contado por olho óptico em cada secção de um série Z-pilha (8-10) por célula utilizando o software de imagem, e expressa como o número de contactos / célula. O gráfico mostra o número de contatos entre os neurônios espinhosos médios e controle HEK293 células (cinza claro) ou α1 / β2 células / γ2-HEK293 (preto) após 4 e 24 horas de co-cultura (média ± SEM, n = 8 em cada condição de dois experimentos independentes). Esta figura foi modificada de Fuchs et al. (2013) 30. Por favor clique aqui para ver uma versão maior desta figura.
ad / 52115 / 52115fig3highres.jpg "width =" 600 "/>
Rs Figura 3. GABA A promover a formação de contatos sinápticos ativos. Imunomarcação de contatos sinapse-like formados após 24 horas de co-cultura entre os terminais dos neurônios espinhosos médios positivos para GAD65 (Alexa Fluor 405 ciano) e (a) de controle de células HEK293, ou (B) / β2 / γ2 células HEK293-α1, ambos transfectadas transitoriamente com a construção mCherry (vermelho). Contactos activos são identificados por co-localização específica entre o domínio luminal vesícula anticorpo anti-sinaptotagmina (Cy5) e anticorpo específico de GAD65 tanto em terminais pré-sinápticos, e mCherry expressos em células HEK293. Barra de escala:. 10 mm Por favor, clique aqui para ver uma versão maior desta figura.
igura 4 "fo: content-width =" "src =" 6 pol / files / ftp_upload / 52115 / 52115fig4highres.jpg "width =" 600 "/>
Figura 4. GABAergic neurônios espinhosos médios formar contatos sinapse-like com α1 / β3 / subunidade γ2- expressar HEK293 células em co-cultura. (A) A microscopia por fluorescência de terminais pré-sinápticos com anti-sinapsina I anticorpos (em verde), e controle de células HEK293 (à esquerda), ou α1 / β3 / γ2 expressando células HEK293, tanto transitoriamente transfectadas com mCherry (em vermelho), revelou pontos de co-localização entre estes marcadores que indicam a formação de contactos de sinapses semelhante após 24 h em co-cultura. Barra de escala: 10 um (B). A análise quantitativa de contatos sinapse-like. As células HEK293 foram identificados por expressão mCherry, e o número de contactos entre sinapsina I-positiva pontos lacrimais (a verde) e a superfície de células HEK293 que foi contada por olho óptico em cada secção de uma série Z-pilha (8 - 10) por célula usando software de imagem, e expressa como o número de contactos / célula. O gráfico mostra o número de contatos entre os neurônios espinhosos médios e controle HEK293 células (cinza claro) ou α1 / β3 células / γ2-HEK293 (preto) após 24 horas de co-cultura (média ± SEM, n = 8-12 células cada condição, a partir de dois experimentos independentes). Por favor, clique aqui para ver uma versão maior desta figura.
Discussão
Apesar de este protocolo não é tecnicamente difícil de realizar, existem vários passos críticos que devem ser seguidos para alcançar os ensaios de co-cultura mais precisas e repetíveis. Em primeiro lugar, em cultura de neurônios espinhosos médios devem ser semeadas em uma densidade ideal. Se semeadas muito baixa densidade, neurónios tendem a desenvolver-se muito lentamente e sobrevivência é grandemente reduzida. Por outro lado, se semeadas muito densamente, os neurónios tendem a agregar o que compromete a análise de contactos com células HEK293. Em segundo lugar, é recomendado para expressar transitoriamente um repórter fluorescente, GFP ou mCherry em células HEK293 que expressam estavelmente Rs GABA A, antes da tecendo-os para a co-cultura. Isso permite que o reconhecimento confiável de células HEK293, que podem ser comprometidos por semelhança em forma e tamanho entre essas células e células glia raro sobreviver em culturas neuronais. Para alcançar a transfecção eficiente com GFP ou mCherry cDNA, as linhas celulares HEK293 tem que estar na fase de crescimento exponencial esemeadas a uma densidade adequada em placas de 6 poços. Semeadura escassa seguida de transfecção fará com que as células a crescer mal, enquanto que sobre-semeadura vai impedir as células de tomar-se o cDNA. Idealmente, as células devem ser semeadas de modo a que eles estão entre 70 - 90% confluentes no dia da transfecção. Em terceiro lugar, a transfecção deve ser optimizada para cada linha celular utilizada, como algumas linhas de células são mais sensíveis do que os outros. Isto é porque o GABA A expressão constitutiva em células HEK293 R reduz a sobrevivência celular e a capacidade das células para se recuperar após a transfecção. Além disso, a sobrevivência depende do tipo de Rs GABA A expressos em células HEK293, com algumas linhas de células sendo significativamente mais sensíveis do que os outros. A transfecção usando o reagente de lipossomas é um método ideal para a expressão de proteínas estranhas em linhas de células de crescimento rápido, proporcionando tanto a alta eficiência de transfecção e nível de expressão. No entanto, este reagente causa demasiados danos ao crescimento lento, linhas celulares, paraque usamos regularmente um reagente de transfecção não lipossomal. Este trabalha de uma maneira semelhante ao reagente lipossomal mas a quantidade de ADN necessário para a transfecção eficiente é significativamente reduzida. Isto permite uma maior sobrevivência celular (aproximadamente 80 - 90% em comparação com 60% utilizando reagente lipossómico) mas com menor eficiência de transfecção (60%). Por último, o número de controlo HEK293 ou α1 / β2 / γ2 HEK293 expressando células adicionadas às culturas neuronais tem de ser optimizado. Adicionando muito poucas células compromete a análise bem sucedida de contactos entre as células HEK293 e neurônios, porque eles se tornam muito raro. Por outro lado, a adição de muitas células HEK293 que provoca a morte celular neuronal dentro de poucas horas.
Embrionárias culturas de neurônios espinhosos médios devem, idealmente, ser preparado usando tecido estriado dissecado de 15 anos de idade embrionária - 17. No entanto, acontece frequentemente que os embriões são ligeiramente mais jovens ou mais velhos do que a idade ideal. Neste caso, o número de neurônios semeadas em cultura vaiprecisa ser variada. Os tecidos que é mais jovem do que E15 podem precisar de ser semeadas a uma densidade ligeiramente mais baixa, ao passo que o tecido é mais velha do que E17 podem precisar de ser semeadas a uma densidade mais elevada, para permitir a sobrevivência celular óptimo. Além disso, o citosina-arabinósido (Ara-C) pode necessitar de ser adicionados a culturas mais velhas para evitar o crescimento de células da glia, a qual é mais abundante em tecidos mais velhos.
Ao criar co-culturas, é importante para a chapa do número optimizado de HEK293 transfectadas ou α1 / β2 / γ2 células HEK293 que expressam, como mencionado acima. No entanto, pode ser necessário para determinar esta linha de células para cada indivíduo, por causa das diferenças na sua sobrevivência. Tipicamente, 30.000 células num volume máximo de 50 mL deve ser adicionada a cada poço de um prato de 24 poços, que já contém 500 ul de meio de cultura neuronal, como isso garante que o meio neuronal condicionado não é muito diluída, e que as condições dentro de cada bem permanecer relativamente constante, por exemplo, A concentração de factores de crescimento. A adição de volumes superiores a 50 ul a cada poço, em geral, matar os neurónios.
Um dos principais inconvenientes da técnica de co-cultura é que as culturas neuronais são criados a partir de células dissociadas cultivadas como uma monocamada, o que significa que os neurónios foram removidos do seu microambiente normal e são incapazes de estabelecer a sua organização anatómica normal. Portanto, eles não têm as conexões apropriadas, insumos e moléculas secretadas a partir de outras células que podem influenciar as fases iniciais de desenvolvimento sinapse. Por exemplo, in vivo neurônios espinhosos médios são densamente inervados por entradas glutamatérgicos do outras regiões do cérebro 34 córtex, tálamo e, no entanto, em nossas culturas neuronais sinapses glutamatérgicos não fazem, porque essas entradas são danificados durante a dissecção do tecido estriado. Como a ausência de sinapses funcionais glutamatérgicos em neurônios espinhosos médios cultivadas affECTS sua capacidade de formar sinapses GABAérgicos uns com os outros e / ou células HEK293 expressando GABA A Rs permanece uma questão em aberto. Esta questão poderia ser facilmente tratadas pela cultura de neurônios espinhosos médios junto com os neurônios glutamatérgicos corticais permitindo-lhes formar sinapses funcionais 35 antes da adição de células HEK293. Uma abordagem alternativa seria a de criar um sistema de modelo de co-cultura com base em culturas organotípicas de fatias, que mantêm a citoarquitetura alguns dos quais pode ser importante para a maturação e a formação de sinapses. No entanto, as culturas fatia organotypic ter neuropil densa e heterogênea que pode comprometer a análise realizada aqui. Outra desvantagem importante da utilização de ensaios de co-cultura é que o GABA Um Rs expressa na superfície de células HEK293 não são agrupados à medida que são em neurónios, embora isto não parece ser necessário para a formação de sinapses dada uma expressão bastante elevada superfície 30. Por exemplo, no rOdent cérebro e nas culturas do hipocampo, a α1 GABA A R subunidade é encontrado na maioria das sinapses GABAérgicos em todos os domínios pós-sinápticos de células piramidais. No entanto, o α2 está especificamente localizado em um subconjunto de sinapses no somata e dendritos, mas é altamente enriquecida no segmento axonal inicial, conforme revelado por microscopia de imunofluorescência e de electrões 36. Dado que a formação de sinapses nas co-culturas ainda pode ser detectado com segurança e analisados 30, isto sugere que a densidade de GABA A Rs na superfície celular de células HEK293 que pode ser semelhante a, ou até mesmo maior do que a densidade destes receptores dentro sináptica clusters em neurônios. Isto pode explicar, pelo menos em parte, porque as proteínas sinápticas de adesão, tais como neuroligin, densidade e proteínas, tais como pós-sinápticos gephyrin, não são necessárias para a formação de sinapses nas co-culturas, se os Rs apropriadamente montados GABA A estão presentes em quantidade suficiente densidade.
Está bem documentado que Rs GABAA são estruturalmente e funcionalmente heterogéneas, e que a composição de subunidades do receptor determina a sua localização subcelular e propriedades farmacológicas. Por exemplo, a incorporação das duas subunidades é conhecido por ser um pré-requisito para a localização sináptica de Rs GABA A, enquanto a subunidade é quase exclusivamente presente em Rs extrasynaptic GABA A. Os receptores que incorporam apenas αβ combinações também são pensados para ser predominantemente localizada para os domínios extrasynaptic 12- 14. Se esta especificidade é mantida no nosso sistema de co-cultura pode ser facilmente testada por transfecção transiente, 2 ou subunidade cDNAs em linhas de células HEK293 que expressam estavelmente subunidades α e β, antes de adicioná-los para culturas neuronais. As nossas experiências preliminares usando esta abordagem têm sugerido que os contactos sinápticos são prontamente formadas apenas na presença da subunidade 2, indicando que a especituais observada in vivo é susceptível de ser preservada in vitro (dados não mostrados).
Além disso, Rs GABA A que incorporam diferentes subunidades α são seletivamente localizada contatos sinápticos formados com tipos específicos de neurônios pré-sinápticos. Por exemplo, no globo pálido, o Rs α1-GABA A são geralmente encontradas em striatopallidal (str-GP) e (GP-GP) palliopallidal sinapses, que estão localizados em regiões somáticas e dendritos dos neurónios espinhosos médios, respectivamente. Os Rs α3-GABA A estão localizados em regiões perisomatic de neurônios espinhosos médios e são contactados por colaterais axônio GP locais, enquanto os Rs α2-GABA A estão localizados em dendritos distais desses neurônios e contatou principalmente pelas entradas do striatum 32. Expressão de subunidades α específicos em diferentes tipos de sinapses e em diferentes compartimentos neuronais também foi demonstrada em outras áreas do cérebro, tais como Hippocampus 21 e neocórtex 18,20. Estes resultados levantam a questão sobre a forma como as sinapses inibitórias específicas são formadas no cérebro. Será que a adesão de um tipo específico de terminal pré-sináptico induzir a inserção de subtipos de receptores GABA A R específicos para os pontos de contacto? São os receptores traficadas para locais subcelulares específicas de acordo com a sua composição subunidade, onde sua inserção membrana plasmática é um pré-requisito para a adesão dos terminais axonais de origem específica? Até o momento, estas questões continuam sem resposta. O uso de reduzidas sistemas modelo tais como o sistema modelo de co-cultura, nos permitem começar a responder perguntas este complexo porque o sistema é facilmente adaptado a uma transfecção de construções de ADN e aplicação dos reagentes e, mais importante, é adequada para análise de imagem de células vivas 30. Assim, usando este sistema de modelo que pode começar a testar o papel de moléculas individuais, incluindo diferentes tipos de Rs GABA A, saben de estar presente em contatos sinápticos. Outra vantagem é que as sinapses neste formulário modelo de sistema rapidamente, dentro de minutos a horas, reduzindo a duração do experimento. Sistemas modelo de co-cultura Similar foram empregadas com sucesso no passado para rastrear as moléculas synaptogenic novos 27,37,38.
A compreensão de como o sistema nervoso central desenvolve, amadurece e formas conexões entre os neurônios tão intricada para controle, por exemplo, o comportamento ou cognição, é de fundamental importância. Este objectivo distante só será conseguida por delinear os mecanismos moleculares que regulam os passos individuais de reconhecimento e comunicação célula-a-célula durante o desenvolvimento. Devido à enorme complexidade, os detalhes moleculares desses múltiplas interações celulares atualmente pode ser estudado com precisão apenas em sistemas reduzidos. No entanto, a capacidade de aumentar a complexidade destes sistemas expressando múltiplas combinações de proteínas e como estudareles interagem tem algumas vantagens em comparação com, por exemplo, abordagens genéticas de deleção. Isto é porque a interpretação exacta dos efeitos de uma única deleção do gene é muitas vezes comprometido por alterações associadas com mecanismos compensatórios mascarando os efeitos de lesões originais, particularmente no desenvolvimento do cérebro. A técnica de co-cultura, mas informativa simples aqui descrita permitiu uma descoberta do papel estrutural de GABA A Rs na formação de sinapses e abriu a possibilidade de se investigar como Rs GABA A e outras moléculas de adesão celular e / ou proteínas de matriz sinápticas interagem uns com os outros durante a sinaptogênese. Proteínas de matriz sinápticas são de particular interesse uma vez que elas tenham sido recentemente demonstrado desempenhar um papel chave na formação de sinapses glutamatérgicas 39. Continuação do desenvolvimento de modelos de co-cultura é importante porque eles têm o potencial de aumentar o nosso conhecimento dos mecanismos moleculares que norteiam o 'normal &# 8217; o desenvolvimento do cérebro e, assim, aumentar a nossa compreensão de como esses mecanismos são alterados em muitas doenças do neurodesenvolvimento, como a epilepsia, esquizofrenia, transtornos do espectro do autismo e muitos outros.
Divulgações
The authors declare that they have no competing financial interests.
Agradecimentos
Nós gostaríamos de agradecer o apoio financeiro do MRC Reino Unido (G0800498). Gostaríamos também de agradecer ao professor JM Fritschy, da Universidade de Zurique, para a prestação do anticorpo GABA A -R específico da subunidade γ2 e Professor R. Harvey, UCL School of Pharmacy, para a prestação do pcDNA 3.1 (+) vetores de expressão contendo resistência a antibióticos genes para a produção de linhas celulares HEK293 transfectadas de forma estável.
Materiais
| Name | Company | Catalog Number | Comments |
| DMEM (Dulbecco's Modified Eagle Medium) | Life Technologies | 11960-044 | Warm in water bath at 37 °C before use |
| L-Glutamine | Life Technologies | 25030-024 | |
| Penicillin/Streptomycin | Life Technologies | 15070-063 | Danger: irritant |
| FBS (Fetal Bovine Serum) | Life Technologies | 10106-169 | |
| Neuralbasal | Life Technologies | 21103-049 | Warm in water bath at 37 °C before use |
| B27 Supplement | Life Technologies | 17504-044 | |
| Glucose | Sigma-Aldrich | G8769 | |
| HBSS (10X) | Life Technologies | 14180-046 | |
| HEPES (1M) | Life Technologies | 15630-056 | |
| PBS (1X) | Life Technologies | 10010-031 | |
| pcDNA 3.1(+) Mammalian Expression Vector (Geneticin-selection) | Life Technologies | V790-20 | |
| pcDNA 3.1(+) Mammalian Expression Vector (Zeocin-selection) | Life Technologies | V860-20 | |
| pcDNA 3.1(+) Mammalian Expression Vector (Hygromycin-selection) | Life Technologies | V870-20 | |
| Stable HEKα1β2γ2 line | Sanofi-Synthelabo, Paris | ||
| Poly-D-lysine | Sigma-Aldrich | P1149 | |
| G418 disulfate salt (Geneticin) | Sigma-Aldrich | G5013 | Danger: irritant |
| Phleomycin D1 (Zeocin) | Life Technologies | R25001 | |
| Hygromycin B | Life Technologies | 10687-010 | Danger: toxic, irritant and corrosive |
| Trypsin-EDTA | Life Technologies | 25300-054 | Warm in water bath at 37 °C before use. Danger: irritant. |
| Poly-L-lysine | Sigma-Aldrich | P6282 | |
| Laminin | Sigma-Aldrich | L2020 | |
| 100 μm Nylon Cell Strainer | VWR | 734-0004 | |
| Cytosine β-D-arabinofuranoside (Ara-C) | Sigma-Aldrich | C1768 | Danger: Irritant |
| Chelating agent (Versene) | Life Technologies | 15040-033 | |
| Liposomal transfection reagent (Lipofectamine LTX) with liposomal transfection buffering reagent (PLUS reagent). | Life Technologies | 15338-100 | Alternative transfection method: Effectene Reagent |
| Non-liposomal transfection reagent (Effectene reagent) | Qiagen | 301425 | |
| Reduced serum medium (Opti-MEM) | Life Technologies | 11058-021 | |
| Mouse anti-Synaptotagmin antibody conjugated to Cy5 | Synaptic Systems | 105311C5 | |
| Neurobasal A | Life Technologies | 10888-022 | |
| Sodium Chloride (NaCl) | VWR | 27810.364 | |
| Glycine | Sigma-Aldrich | G1726 | |
| BSA (Bovine Serum Albumin) | Sigma-Aldrich | A3294 | |
| Guinea pig anti-γ2 GABAA receptor antibody | Prof. Jean Marc Fritschy | N/A | (Institute of Zurich, Switzerland) Fritschy, JM and Mohler, H. J. Comp. Neurol. 359 (1), 154-194 (1995). |
| Triton X-100 | Promega | H5141 | |
| Mouse anti-Glutamate Decarboxylase (GAD)65 antibody | Merck Millipore | MAB351 | |
| Mouse anti-synapsin antibody | Synaptic Systems | 106-011 | |
| Mouse anti-β2/3 antibody (BD17) | Merck Millipore | MAB341 | |
| Rabbit anti-α1 GABAA receptor antibody | Professor Anne Stephenson | N/A | (UCL School of Pharmacy, London) FA Stephenson et al. J. Comp. Neurol. 416 (2), 158-172 |
| Goat anti-guinea pig conjugated to Cy5 antibody | Merck Millipore | AP1085 | |
| Goat anti-mouse Alexa Fluor 488 antibody | Merck Millipore | AP124S | |
| Goat anti-mouse Alexa Fluor 405 antibody | Life Technologies | A31553 | |
| Goat anti-mouse Alexa Fluor 555 antibody | Life Technologies | A21422 | |
| Goat anti-rabbit Alexa Fluor 488 antibody | Life Technologies | A11008 | |
| Mounting reagent (Prolong Gold) | Life Technologies | P36930 | Use at room temperature |
Referências
- Wang, D. D., Kriegstein, A. R. Defining the role of GABA in cortical development. J Physiol. 587, 1873-1879 (2009).
- Ben-Ari, Y., Khalilov, I., Kahle, K. T., Cherubini, E. The GABA excitatory/inhibitory shift in brain maturation and neurological disorders. The Neuroscientist : a review journal bringing neurobiology, neurology and psychiatry. 18, 467-486 (2012).
- Structure Sieghart, W. pharmacology, and function of GABAA receptor subtypes. Adv Pharmacol. 54, 231-263 (2006).
- Unwin, N. Neurotransmitter action: opening of ligand-gated ion channels. Cell. 72, 31-41 (1993).
- Homanics, G. E., et al. Mice devoid of gamma-aminobutyrate type A receptor beta3 subunit have epilepsy, cleft palate, and hypersensitive behavior. Proceedings of the National Academy of Sciences of the United States of America. 94, 4143-4148 (1997).
- Gunther, U., et al. Benzodiazepine-insensitive mice generated by targeted disruption of the gamma 2 subunit gene of gamma-aminobutyric acid type A receptors. Proceedings of the National Academy of Sciences of the United States of America. 92, 7749-7753 (1995).
- Mohler, H. GABA(A) receptor diversity and pharmacology. Cell Tissue Res. 326, 505-516 (2006).
- Low, K., et al. Molecular and neuronal substrate for the selective attenuation of anxiety. Science. 290, 131-134 (2000).
- Rudolph, U., et al. Benzodiazepine actions mediated by specific gamma-aminobutyric acid(A) receptor subtypes. Nature. 401, 796-800 (1999).
- Rudolph, U., Knoflach, F. Beyond classical benzodiazepines: novel therapeutic potential of GABAA receptor subtypes. Nat Rev Drug Discov. 10, 685-697 (2011).
- Hulst, C., Atack, J. R., Kooy, R. F. The complexity of the GABAA receptor shapes unique pharmacological profiles. Drug Discov Today. 14, 866-875 (2009).
- Essrich, C., Lorez, M., Benson, J. A., Fritschy, J. M., Luscher, B. Postsynaptic clustering of major GABAA receptor subtypes requires the gamma 2 subunit and gephyrin. Nat Neurosci. 1, 563-571 (1998).
- Schweizer, C., et al. The gamma 2 subunit of GABA(A) receptors is required for maintenance of receptors at mature synapses. Mol Cell Neurosci. 24, 442-450 (2003).
- Belelli, D., et al. Extrasynaptic GABAA receptors: form, pharmacology, and function. The Journal of neuroscience : the official journal of the Society for Neuroscience. 29, 12757-12763 (2009).
- Connolly, C. N., Wooltorton, J. R., Smart, T. G., Moss, S. J. Subcellular localization of gamma-aminobutyric acid type A receptors is determined by receptor beta subunits. Proceedings of the National Academy of Sciences of the United States of America. 93, 9899-9904 (1996).
- Connolly, C. N., Krishek, B. J., McDonald, B. J., Smart, T. G., Moss, S. J. Assembly and cell surface expression of heteromeric and homomeric gamma-aminobutyric acid type A receptors. J Biol Chem. 271, 89-96 (1996).
- Klausberger, T., Roberts, J. D., Somogyi, P. Cell type- and input-specific differences in the number and subtypes of synaptic GABA(A) receptors in the hippocampus. The Journal of neuroscience : the official journal of the Society for Neuroscience. 22, 2513-2521 (2002).
- Thomson, A. M., Jovanovic, J. N. Mechanisms underlying synapse-specific clustering of GABA(A) receptors. Eur J Neurosci. 31, 2193-2203 (2010).
- Fritschy, J. M., Panzanelli, P., Tyagarajan, S. K. Molecular and functional heterogeneity of GABAergic synapses. Cell Mol Life Sci. 69, 2485-2499 (2012).
- Ali, A. B., Thomson, A. M. Synaptic alpha 5 subunit-containing GABAA receptors mediate IPSPs elicited by dendrite-preferring cells in rat neocortex. Cereb Cortex. 18, 1260-1271 (2008).
- Thomson, A. M., Bannister, A. P., Hughes, D. I., Pawelzik, H. Differential sensitivity to Zolpidem of IPSPs activated by morphologically identified CA1 interneurons in slices of rat hippocampus. Eur J Neurosci. 12, 425-436 (2000).
- Nyiri, G., Freund, T. F., Somogyi, P. Input-dependent synaptic targeting of alpha(2)-subunit-containing GABA(A) receptors in synapses of hippocampal pyramidal cells of the rat. Eur J Neurosci. 13, 428-442 (2001).
- Treutlein, B., Gokce, O., Quake, S. R., Sudhof, T. C. Cartography of neurexin alternative splicing mapped by single-molecule long-read mRNA sequencing. Proceedings of the National Academy of Sciences of the United States of America. 111, 1291-1299 (2014).
- Siddiqui, T. J., Craig, A. M. Synaptic organizing complexes. Current opinion in neurobiology. 21, 132-143 (2011).
- Tanaka, H., et al. Higher-order architecture of cell adhesion mediated by polymorphic synaptic adhesion molecules neurexin and neuroligin. Cell reports. 2, 101-110 (2012).
- Krueger, D. D., Tuffy, L. P., Papadopoulos, T., Brose, N. The role of neurexins and neuroligins in the formation, maturation, and function of vertebrate synapses. Current opinion in neurobiology. 22, 412-422 (2012).
- Scheiffele, P., Fan, J., Choih, J., Fetter, R., Serafini, T. Neuroligin expressed in nonneuronal cells triggers presynaptic development in contacting axons. Cell. 101, 657-669 (2000).
- Graf, E. R., Zhang, X., Jin, S. X., Linhoff, M. W., Craig, A. M. Neurexins induce differentiation of GABA and glutamate postsynaptic specializations via neuroligins. Cell. 119, 1013-1026 (2004).
- Dong, N., Qi, J., Chen, G. Molecular reconstitution of functional GABAergic synapses with expression of neuroligin-2 and GABAA receptors. Mol Cell Neurosci. 35, 14-23 (2007).
- Fuchs, C., et al. GABA(A) receptors can initiate the formation of functional inhibitory GABAergic synapses. Eur J Neurosci. 38, 3146-3158 (2013).
- Ventimiglia, R., Lindsay, R. . Culturing nerve cells: Rat striatal neurons in low-density, serum-free culture. , 371-393 (1998).
- Gross, A., et al. Differential localization of GABA(A) receptor subunits in relation to rat striatopallidal and pallidopallidal synapses. Eur J Neurosci. 33, 868-878 (2011).
- Fritschy, J. M., Mohler, H. GABAA-receptor heterogeneity in the adult rat brain: differential regional and cellular distribution of seven major subunits. J Comp Neurol. 359, 154-194 (1995).
- Doig, N. M., Moss, J., Bolam, J. P. Cortical and thalamic innervation of direct and indirect pathway medium-sized spiny neurons in mouse striatum. The Journal of neuroscience : the official journal of the Society for Neuroscience. 30, 14610-14618 (2010).
- Lalchandani, R. R., Vicini, S. Inhibitory collaterals in genetically identified medium spiny neurons in mouse primary corticostriatal cultures. Physiological reports. 1, (2013).
- Nusser, Z., Sieghart, W., Benke, D., Fritschy, J. M., Somogyi, P. Differential synaptic localization of two major gamma-aminobutyric acid type A receptor alpha subunits on hippocampal pyramidal cells. Proceedings of the National Academy of Sciences of the United States of America. 93, 11939-11944 (1996).
- Linhoff, M. W., et al. An unbiased expression screen for synaptogenic proteins identifies the LRRTM protein family as synaptic organizers. Neuron. 61, 734-749 (2009).
- Pettem, K. L., Yokomaku, D., Takahashi, H., Ge, Y., Craig, A. M. Interaction between autism-linked MDGAs and neuroligins suppresses inhibitory synapse development. J Cell Biol. 200, 321-336 (2013).
- Wit, J., et al. Unbiased discovery of glypican as a receptor for LRRTM4 in regulating excitatory synapse development. Neuron. 79, 696-711 (2013).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados