É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Um Modelo de Leitão Neonatal encefalopatia hipóxico-isquêmica
Neste Artigo
Resumo
Hypoxic-ischemic encephalopathy following perinatal asphyxia can be studied using animal models. We demonstrate the procedures necessary for establishing a piglet model of neonatal hypoxic-ischemic encephalopathy.
Resumo
Asfixia durante o parto, o que faz com encefalopatia hipóxico-isquêmica (HIE), responde por 0,66 milhões de mortes no mundo a cada ano, cerca de um quarto dos 2,9 milhões de mortes neonatais no mundo. Modelos animais de HIE têm contribuído para a compreensão da fisiopatologia no HIE, e puseram em evidência o processo dinâmico que ocorrer em lesão cerebral por asfixia perinatal. Assim, os estudos em animais sugeriram um tempo de janela para estratégias de tratamento pós-insulto. A hipotermia foi testado como um tratamento para HIE em modelos pdiglet e subsequentemente mostrado eficaz em estudos clínicos. Variações do modelo ter sido aplicada no estudo de métodos neuroprotectores adjuvantes e estudos de leitões de xénon e melatonina levaram a fase clínica I e II ensaios 1,2. O modelo porquinho HIE é ainda utilizado para estudos hemodinâmicos e resuscitation- neonatal, bem como em investigações de hipoxia cerebral em um nível celular. No entanto, é um desafio técnicomodelo e variações no protocolo pode resultar ou demasiado leves ou demasiado grave lesão cerebral. Neste artigo, demonstramos os procedimentos técnicos necessários para o estabelecimento de um modelo estável de leitão HIE neonatal. Em primeiro lugar, o leitão recém-nascido (<24 horas de idade, peso médio 1500 g) é anestesiado, entubado, e monitorados em uma instalação comparável à encontrada em uma unidade de terapia intensiva neonatal. Hipóxia-isquémia global é induzida através da redução da fracção de oxigénio inspiratório para atingir hipoxia global, isquemia através de hipotensão e um traço EEG de amplitude plana integrada (aEEG) indicativo de hipoxia cerebral. A sobrevivência é promovida através do ajuste oxigenação de acordo com a resposta aEEG e pressão sanguínea. Lesão cerebral é quantificado pela histopatologia e ressonância magnética após 72 horas.
Introdução
A asfixia perinatal é uma condição aguda e freqüentemente imprevisíveis associado com encefalopatia hipóxico-isquêmica (HIE). O objetivo geral deste protocolo é demonstrar um modelo de sobrevivência dos leitões de encefalopatia hipóxico-isquêmica perinatal. Este modelo pode ser usado para investigar o efeito de vários graus de hipóxia-isquémia no cérebro neonatal e de tratamentos experimentais em neuropatologia, imagem por ressonância magnética e espectroscopia (MRI e de MRS) e biomarcadores em fluidos corporais tais como sangue, fluido cerebroespinal e urina . O modelo também se mostrou útil para investigar o sistema cardiovascular, sistema respiratório, do rim e do fígado, os quais são afectados em hipóxia-isquémia global.
A asfixia perinatal é o resultado de intraparto comprometida suprimento de oxigênio ou no período pós-parto imediato. Intraparto eventos hipóxico respondem por 0,66 milhões de mortes no mundo a cada ano, cerca de um quarto de 2,9 mill do mundoiões de óbitos neonatais em 2012 3. Em 2010 1.150.000 bebês foram estimados para ter desenvolvido encefalopatia neonatal após a asfixia nascimento 4. HIE definido como encefalopatia em crianças nascidas depois de 34 semanas de gestação ocorre em 1-3 / 1.000 nascidos vivos 5 do mundo industrializado e até 8,5 / 1.000 nascidos vivos em países em desenvolvimento 4. O risco de morte é 10-60%, e o risco de deficiência neurológica em sobreviventes de 30-100% 6,7. 50,2 milhões de anos de vida ajustados por incapacidade (DALY) são atribuídos aos eventos de hipóxia intraparto 4. Actualmente, o único tratamento que não seja favorável para HIE é a hipotermia pós-hipóxica. Assim, os avanços em procedimentos de diagnóstico e estratégias de tratamento são essenciais para melhorar a gestão dos HIE 8.
Melhorias no prognóstico após asfixia e gestão de lesão cerebral neonatal perinatal são baseados em expandir o conhecimento dos mecanismos da doença subjacente umad tratamentos possíveis. Os modelos animais de HIE são particularmente úteis como eventos clínicos diferentes pode levar a HIE e a incidência em qualquer centro de nascimento único é baixo 5. Uma configuração experimental em que a influência da variação biológica pode ser minimizado, é essencial ao testar as novas ferramentas de prognóstico e de diagnóstico e as estratégias de tratamento. Um modelo animal deve aproximar-se da situação clínica, tanto quanto possível, contribuindo, assim, para a compreensão dos mecanismos patológicos subjacentes da lesão induzida e o processo dinâmico envolvidos na doença e IT'S resultado 9. Modelos animais de HIE neonatal incluíram um número de espécies, incluindo roedores, cordeiro e de suínos. Em comparação, a leitões recém-nascido tem maior semelhança com um recém-nascido humano com respeito ao tamanho, sistema cardiovascular 10 e maturidade cerebral no momento da entrega 11,12. Monitoramento, instrumentação e avaliação de resultados no modelo de leitão é semelhante ao that usado no cuidado clínico de recém-nascidos com EHI. Por conseguinte, existe um elevado grau de tradução para o cuidado recém-nascido a partir deste modelo.
Leitões modelos de hipóxia perinatal e HIE são usados por muitos grupos e variam em uma série de áreas 13. De acordo com o objectivo da experiência, muita atenção deve ser dada à escolha de medicamentos método de indução de hipóxia-isquemia, método de controlar a duração e gravidade insulto, reanimação pós-insulto e cuidado, e avaliação dos resultados,. Para evitar viés de um projeto de estudo randomizado deve sempre ser utilizado em estudos de intervenção.
O método aplicado quando indução de lesão hipóxico-isquêmica é importante. Hipoxia global levando a HIE muitas vezes resulta em falha de múltiplos órgãos envolvendo cérebro, coração, pulmões, rins e fígado. Dependendo dos resultados avaliados, modelos de HIE deve basear-se em hipoxia e isquemia global, em vez de confiar em isquemia focal, por exemplo., Por ligação de carroartérias otid 14. Um estudo recente aplicou uma combinação de hipóxia (FiO2 12%) e a compressão da artéria carótida, mantendo a pressão sanguínea arterial média> 40 mm Hg 2. Outro grupo hipóxia induzida global de 8% O 2 até que o excesso de base negativa> 20 mmol / L ou a pressão arterial (PAM) <15 mm Hg dizer, e se sacrificaram os animais em 4 h 15. A hipoxia foi também titulado pelo débito cardíaco (a 30-40% da linha de base), a PSM (a 30-35 mm Hg) e o pH arterial (6,95-7,05) 16.
Todos os modelos de hipóxia-isquemia global titulado por aEEG supressão semelhante à apresentada no presente relatório, têm demonstrado que é clinicamente encefalopatia, electrofisiologicamente, e neuropatologicamente comparável à condição encontrada no bebê asfixiado termo 17,18.
O grau de HIE induzida é essencial. Um modelo animal útil de HIE também deve permitir o teste do novo diagnóstico procedimentos e opções de tratamento. Para permitir isso, os modelos devem induzir HIE moderada onde há um potencial tratamento como lesão cerebral grave, com pouco ou nenhum potencial tratamento seria menos relevante ao avaliar novos tratamentos. A tolerância à hipóxia varia consideravelmente entre os animais de teste. Estudos anteriores mostraram que uma lesão cerebral mais consistente pode ser conseguida e que mais animais sobreviver 17,19 por individualizar a hipoxia induzida de acordo com a resposta de cada leitão cerebral avaliada pela amplitude integrado electroencefalográfica (aEEG) em vez de utilizar um conjunto FiO valor 2 ao longo do evento hipóxico. A duração da supressão aEEG se correlaciona com o grau de lesão cerebral, com algumas alterações histopatológicas em <20 min a supressão aEEG convulsões graves e crescentes em> 45 min supressão aEEG. Uma revisão recente de tratamentos neuroprotetores para HIE identificou a necessidade de modelos de sobrevivência permitindo meas resultado comportamentalUres em modelos animais 20.
Existem inúmeras vantagens do modelo leitão HIE apresentados. Baseia-se uma espécie em que os resultados são altamente propensos a traduzir a fisiologia humana. Modelos de hipóxia-isquemia global falência de múltiplos órgãos e titulação de hipóxia-isquemia por aEEG induz um grau consistente de lesão cerebral com desfechos clínicos relevantes de sobrevivência de tal forma que os biomarcadores, ressonância magnética e comportamento pode ser avaliado em momentos relevantes.
Leitão modelos de asfixia perinatal e HIE não só contribuiu de forma significativa para uma visão atual para HIE fisiopatologia, mas também têm precedido com sucesso os ensaios clínicos, em última análise, resultando em novos tratamentos em seres humanos. Estudos modelo de leitões desempenhou um papel chave no estabelecimento de hipotermia como um tratamento para HIE 21, e são utilizados na investigação reanimação neonatal 22. Vários grupos têm usado modelos de leitões ao realizar pesquisa dentro asfixia e HIE, umd estudos incluem hipotermia 23, hormônio alfa-melanócito-estimulante 24, parada cardíaca 25, a tirosina hidroxilase 26, exposição repetida hipóxico 27, a atividade do receptor NMDA 14, e espectroscopia de infravermelho próximo 28.
O modelo de HIE leitão apresentada neste relatório é tecnicamente desafiador para trabalhar, como pequenos ajustes durante o curso do processo pode resultar em demasiado branda ou muito grave lesão cerebral 29,2. Descobrimos que a literatura existente carecia de detalhes suficientes para reproduzir modelos previamente publicados. Assim, nós aqui demonstrar cada etapa dos procedimentos técnicos necessários para o estabelecimento de um leitão modelo de sobrevida de 72 horas neste relatório, permitindo aos investigadores para estabelecer este modelo avançado para o estudo do HIE.
Protocolo
O presente protocolo foi aprovado pela Inspecção das Experiências com Animais da Dinamarca. Todos os animais de teste foram anestesiados durante os procedimentos. A reprodução deste protocolo deve ser realizado em conformidade com a ética e orientações nacionais de bem-estar animal, e aprovado por comitês de ética locais.
1. Os animais
- Leitões da raça Landrace Dinamarquês <24 horas de idade, pesando aproximadamente 1.500 - 2.000 g.
2. Anestesia e Manutenção de Fluidos
- Prepare o equipamento necessário para a anestesia (Figura 1): Uma máscara para a administração do sevoflurano, compressas com álcool, cateter venoso periférico, elástico, seringas com solução salina, propofol (5 mg / kg), fentanil (10 ug / kg), e procaína benzilpenicilina (15.000 IU / kg).
- Induzir a anestesia através da apresentação de 1-2% sevoflurano através de uma máscara de respiração.
- Avaliar a profundidade da anestesia por meio da avaliação para palpebral e retirada reflexes. Quando a certeza de que o porquinho é profundamente anestesiados, percutaneamente inserir um cateter intravenoso periférico na veia da orelha.
- Para confirmar a permeabilidade do cateter intravenoso periférico, lave o cateter com 1-2 ml de solução salina estéril a 0,9%. Administrar as injecções de bolus de propofol (5 mg / kg) e de fentanilo (10 ug / kg). Após a administração da injecção de bolus limpar o cateter intravenoso uma segunda vez utilizando 1-2 ml de solução salina estéril a 0,9%.
- Coloque as seringas com propofol (10 mg / ml) e o fentanilo (10 ug / ml) em duas bombas de infusão de seringa separadas. Conectar iv tubos das duas bombas de seringa a uma torneira de três vias juntar infusões em uma única linha que está ligada ao cateter intravenoso. Iniciar a infusão contínua iv de propofol (4-12 mg / kg / h) e de fentanilo (10 ug / kg / h). Uma vez infusões contínuas estão em execução, não dão mais injeções em bolus de propofol e fentanil.
- Suspender a administração do anest gás sevofluranohesia.
- Injectar benzilpenicilina procaína (15.000 UI / kg) via subcutânea ou intramuscular conforme as diretrizes locais para a profilaxia antibiótica. Repita diariamente. O vídeo mostra administração sc, em leitões que foi mostrado para resultar numa concentração plasmática mais elevada e maior meia-vida, quando comparado com a administração im.
- Aplicar lubrificante olho pomada para evitar o ressecamento dos olhos. Puxe a pálpebra inferior para baixo com cuidado para formar uma abertura de bolso-like. Espremer uma pequena quantidade de pomada no interior do bolso. Fechar os olhos para distribuir pomada. Verifique para secura horária e reaplicar conforme necessário.
- Iniciar uma infusão contínua de 5% de dextrose / 0,45% de NaCl IV a 10 ml / kg / h. Reduzir a taxa de 5 ml / kg / h durante e após a hipóxia. Ajuste a taxa de infusão para manter os níveis de glicose no sangue entre 2-10 mmol / L.
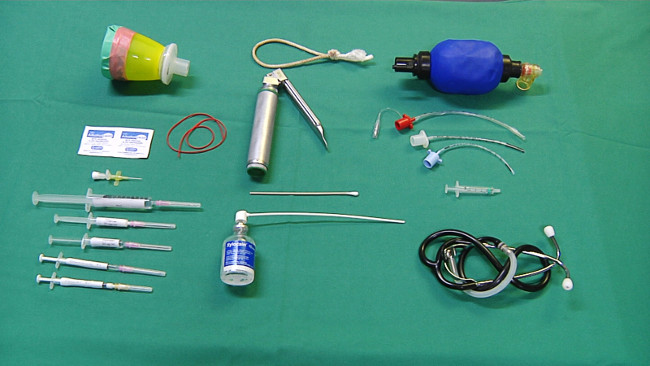
Figure 1. Equipamentos para a anestesia e intubação. Por favor clique aqui para ver uma versão maior desta figura.
3. intubação e ventilação
- Prepara-se o equipamento necessário para intubação (Figura 1): O brometo de rocurónio (1 mg / kg) para o relaxamento muscular, uma linga (amarrar ambas as extremidades do mesmo quatro milímetros corda de nylon em conjunto para formar um círculo, conforme ilustrado na Figura 1) para a abertura da boca, um algodão derrubado do cotonete e laringoscópio com lâmina reta veterinária, spray de xilocaína (100 mg / ml), vários tubos endotraqueais porte, com manguito (tamanhos 3,0 milímetros, 2,5 milímetros, 2,0 mm), 500 ml balão auto-inflável (válvula de saco mascarar) para a ventilação, 2 ml para a inflação do manguito, e estetoscópio.
- Entubar, seguindo os passos abaixo:
- Lugar leitão na posição supina apoiar o pescoço de cada lado para garantir um pas de laringe retassábio para intubação.
- Estimar o comprimento do tubo endotraqueal através da medição da ponta do focinho até o entalhe do esterno (tipicamente cerca de 13 cm).
- Lugar estilingue corda em torno do maxilar superior (voltado para baixo) e mantenha mandíbula e língua para cima para manter a boca aberta.
- Administrar brometo de rocurónio (1 mg / kg) iv para induzir o relaxamento muscular.
- Use laringoscopio para levantar a língua para cima.
- Use o algodão derrubado do cotonete para libertar longo epiglote do leitão, que pode ser tanto retrovertido para o esôfago ou capturados por trás do palato mole.
- Avançar laringoscópio para manter a epiglote levantou contra a base da língua permitindo visão completa das cartilagens aritenóides e cordas vocais.
- Aplicar xilocaína spray (100 mg / mL) por via tópica na laringe para evitar espasmos da laringe.
- Avançar tubo endotraqueal através das cordas vocais. Use um movimento de rotação para auxiliar a passagem das cartilagens traqueais estreitas. Acomodação tubo de antecedênciarding à distância pré-medido e se conectar a um balão auto-inflável (máscara de válvula de saco) para ventilação manual. Para ajudar a reduzir o atrito durante a intubação pulverizar o 1/3 distal do tubo endotraqueal com spray de xilocaína.
- Para confirmar o posicionamento do tubo endotraqueal correto: observar para qualquer indicação de dificuldade respiratória, ausculate peito escuta para a entrada de ar bilateral em ambos os pulmões, confirmar visualmente a presença de condensação no aspecto proximal do tubo endotraqueal, e verificar a presença de final de carbono das marés dióxido com um detector de dióxido de carbono colorimétrica ou por expiratório CO 2 leitura no ventilador mecânico, se disponível. Fim normal de dióxido de carbono das marés é de cerca de 5%. Um valor superior a 2%, juntamente com uma forma de onda de aparência normal irá confirmar que o tubo endotraqueal está na traqueia.
- Inflar o manguito do tubo endotraqueal para evitar a aspiração. Pressão de insuflação da braçadeira deve ser inferior a 25 cm de H 2 O para evitar danos isquémicos para o tecido circundante. Segurando o tubo endotraqueal no lugar, enrole um pedaço de fita em volta do tubo, fechar a mandíbula e continuar gravando em torno do focinho para fixar o tubo no lugar. Puxe delicadamente o tubo para garantir que ele permanece no lugar.
- Conecte tubo endotraqueal para ventilação mecânica.
- Ajuste as configurações do ventilador: a ventilação controlada a volume, volume corrente (TV): 10 ml / kg [ou pico de pressão inspiratória (PIP) 15 cm, com ventilação com pressão controlada]. Pressão expiratória positiva (PEEP): 5 cm. Relação I: E de 1: 2. Frequência respiratória: 35 (ajustar a taxa para manter a corrente final de CO 2 entre 4,5-5,5 kPa).
4. Acompanhamento e Corpo amostragem de fluidos
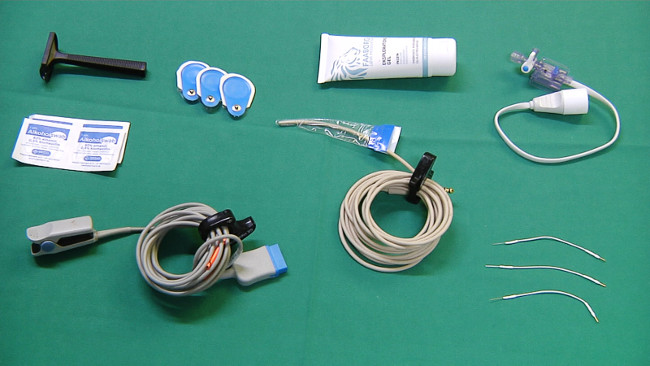
Figura 2. Equipamentos para monitoração.ank "> Clique aqui para ver uma versão maior desta figura.
- Prepare o equipamento necessário para o acompanhamento (Figura 2): fita adesiva, lubrificante estéril, sonda para medição da temperatura retal contínua, eletrocardiograma (ECG) eletrodos, eletrodos oxímetro de pulso, de barbear, e EEG.
- Local sonda saturação numa pata traseira, lubrificar sonda de temperatura rectal e de encaixar 6 cm no recto, colocar aquecedor radiante sobrecarga e / ou aquecida colchão de ar inflável para manter a temperatura rectal ao nível fisiológico de 38,5-39 ° C, e o lugar de ECG eletrodos.
- Coloque leitão na posição prona para raspar áreas de 1 cm x 1 centímetro para a colocação de eletrodos de agulha subcutâneos EEG; um na frente de cada orelha, eo eletrodo de referência na linha média, logo atrás dos olhos. Limpe o local do eletrodo com um algodão embebido em álcool, em seguida, insira o eletrodo por via subcutânea agulha. Eletrodos seguras com fita adesiva e retorno leitão à po supinasição.
- Ligue monitor de aEEG.
NOTA: A amplitude do EEG integrados é composto por um traço densa com margens superior e inferior. Margens inferior e superior neste modelo são tipicamente 15-50 mV, muitas vezes mais elevados do que o observado em crianças. Durante a hipóxia, é importante notar, que artefato do ECG podem falsamente elevar o traço aEEG. Medicamentos bolus (propofol ou fentanil) também podem suprimir temporariamente a traço aEEG e deve ser evitada, se possível, durante a experiência. A administração de drogas e eventos clínicos devem ser marcados para facilitar a interpretação do traçado aEEG.
- Prepare o equipamento necessário para a colocação de cateteres umbilicais arterial central para monitorização da pressão arterial e coleta de sangue (Figura 3): luvas estéreis, drapeados estéril, bisturi, compressas com álcool, toalhetes estéreis, cateter da veia umbilical (5 Fr), cateter de artéria umbilical (3,5 Fr ), sutura definido com uma pinça, micro pinça curva, tesouras, porta-agulhas e fios de sutura (por exemplo, o tamanho 3-0), remendo adesivo transparente, 5 ml seringas para coleta de sangue.
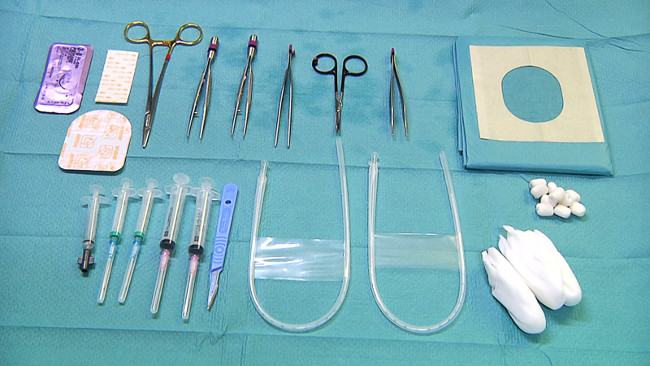
Figura 3. Equipamento para linhas umbilicais e coleta de sangue. Por favor clique aqui para ver uma versão maior desta figura.
- Esterilizar e armar a área ao redor do umbigo. Usar um bisturi para cortar o cordão umbilical tão perto quanto possível da pele. Se este não expõe os vasos umbilicais no leitão anestesiado, cortar a pele umbilical 2 mm abaixo do cordão umbilical para expor os navios. Identificar as duas pequenas artérias umbilical e a uma maior veia umbilical (Figura 4).
- Use micro fórceps curvo para dilatar a artéria (Figura 4) e inserir o cateter arterial umbilical(3,5 Fr). Estimativa comprimento de inserção no cm a 3 x peso (kg) + 10 (fórmula empírica com base no posicionamento correto na aorta descendente acima artérias renais na autópsia).
- Coloque um segundo cateter 5 Pe 5 centímetros para a veia umbilical (Figura 4). Verifique a colocação do cateter intravascular pelo retorno do sangue. Cateteres Seguros pela colocação de uma sutura em bolsa ao redor do umbigo, passe a sutura termina em torno de cada um dos cateteres umbilicais e dê um nó. Cubra com cateteres de vestir adesiva transparente.
- Recolha de amostras de sangue em pontos de tempo pré-determinado: 1) imediatamente antes da hipoxia, 2) 30 min em insulto hipóxico 3) no final de 45 minutos a hipóxico insulto 4) 2 h após o insulto hipóxico. Dependendo da finalidade da experiência outros pontos de tempo para as amostras de sangue podem ser escolhidos.
- Use gasometria arterial a partir de amostras de sangue colhidas durante a hipóxia para verificar alterações de gases sangüíneos provocados por hipóxia-isquemia (Tabela 1). Note-se que leitões têm um baixo nível de hemoglobinat nascimento (cerca de 8 g / dL) e pode tornar-se anêmico de coleta de sangue freqüentes. Retirar a menos de 2 ml de sangue / kg de peso corporal por sorteio, a menos de 5 ml de sangue / kg de peso corporal dentro de 24 horas e aderir às diretrizes locais para coleta de sangue. Sinais de anemia incluem a diminuição do hematócrito e taquicardia.
- Conecte linha arterial para um monitor para continua monitorização da pressão arterial intra-arterial (PAM). Use linha venosa para administração de líquidos e medicamentos.
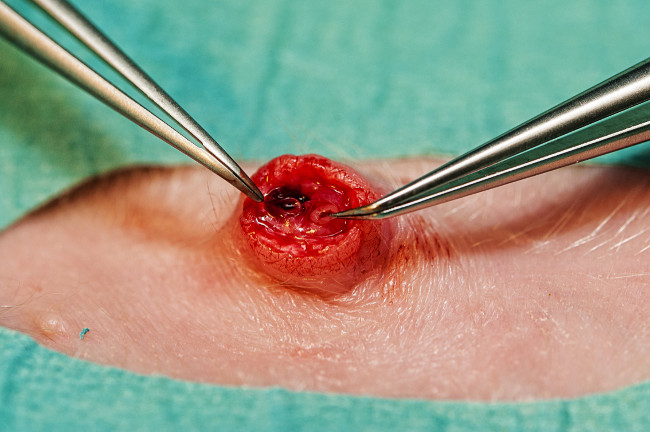
Figura 4. Os navios de umbilicais. Veia umbilical (à direita) e uma das duas artérias umbilicais (esquerda). Por favor clique aqui para ver uma versão maior desta figura.
5. A hipoxia
- Aguarde 60 minutos após a conclusão de monitoramento. Induzir hipóxia por mudar para um O 4% 2 / 96% N2 mistura de gás. Monitorar os parâmetros vitais e aEEG de perto e continuar hipoxia durante 45 min.
- Uma vez que o rastreio aEEG é plana (margem superior <7 mV), ajustar a oxigenação por alteração da fracção de oxigénio inspirada (FiO 2) e a pressão da via aérea ao nível mais elevado 2 FiO mantendo um traço plano aEEG de acordo com o fluxograma mostrado na Figura 5 significa. Alvo para PSM inferiores a 70% da linha de base durante pelo menos 10 minutos e, se necessário FiO2 inferior para garantir a hipotensão e isquemia. O nível de hipotensão descrito foi previamente demonstrado por outros 19,13,30 para produzir lesão hipóxico-isquémica do cérebro relevantes.
- Em caso de hipotensão grave (PAM <25 mm Hg) tratar por passos como se segue: resumidamente aumentar FiO2 por 1-5%, bolus solução salina (10 ml / kg), infusão de dopamina (5-20 mg / kg / min), e infusão de noradrenalina (20 ng-1 ng / kg / min).
- Em caso de convulsões com duração> 10 min (clônicas, tônicas or convulsões mioclónicos, tipicamente focal ou como indicado por alterações súbitas na amplitude aEEG) tratar por passos com (permitindo 30 min antes de prosseguir para a próxima injecção): bolus lento de fenobarbital iv de 20 mg / kg, repetir fenobarbital iv de 20 mg / kg, e midazolam iv de 0,5 mg / kg.
- Se apreensões desenvolver e estão sem resposta ao tratamento medicamentoso está indicado a eutanásia.
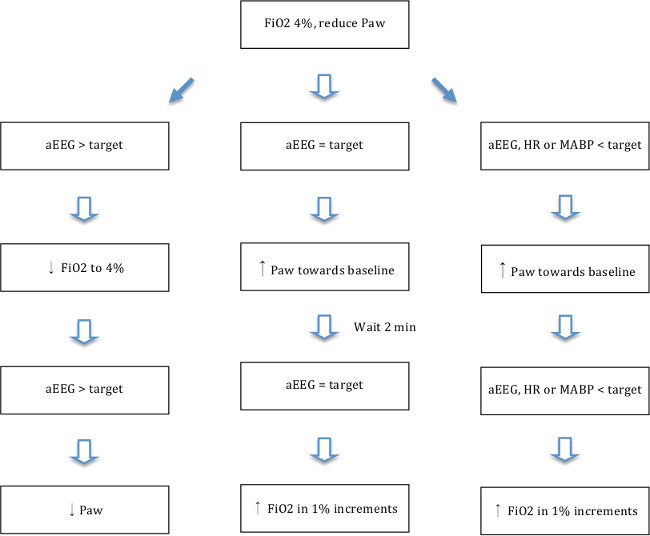
Figura 5. A hipóxia-isquemia fluxograma. Fluxograma mostrando ajustes na oxigenação (F i O 2 e P aw) de acordo com a resposta aEEG. Pressão das vias aéreas (P aw) médio foi ajustado mudando PIP / TV (inferior PIP dá inferior aw P) e frequência respiratória (RR inferior dá inferior aw P). Alvo aEEG = margem superior do traço <5 mV e menor margem de vestígios> 3 mV (média de 4 mV). Alvofreqüência cardíaca (FC) => 80. Alvo pressão arterial média (PAM) = MABP> 25. Clique aqui para ver uma versão maior desta figura.
Sobrevivência 6. 72 hr
- Monitorar o leitão de perto após o insulto hipóxico e, gradualmente, reduzir as taxas de infusão de propofol e fentanil. Extubar no ponto em que o animal está a respirar voluntariamente.
- Durante o período de sobrevivência, manter leitões em um biotério com relógio de 24 horas por pessoal treinado nos cuidados intensivos e monitorização. Administrar infusões de glicose iv 20 ml / kg de 2-3 horas. Em 26-48 horas após hipóxia-isquemia uso de mamadeira parcial pode ser iniciado. Aspiração para a traquéia e os pulmões pode ocorrer por uso de mamadeira, se o reflexo de vômito não está presente.
- Caso seja relevante para o experimento, avaliar o estado neurológico utilizando sistema de pontuação desenvolvido pela Thoresen et al., Descrito emdetalhe na publicação original 17.
Avaliação 7. Resultado
- Após 72 horas, anestesiar e ventile novamente como descrito no ponto 2 e 3. Execute ressonância magnética com modalidades de imagem relevantes descritos por Munkeby et al 31 e os outros dois.
- No final da experiência leitões eutanásia com uma dose letal de pentobarbital (5 g / kg iv).
- Preparar o cérebro para exame de acordo com o objetivo da experiência.
- Para histologia cérebro no tecido fixado em formalina:.. Usar perfusão cardíaca com paraformaldeído 4% em PBS, seguido de dissecção e pós-fixação em paraformaldeído como descrito por Robertson et al 2, Chakkarapani et al 1 ou Liu et al 18 ou remover o cérebro e imergir em paraformaldeído a 4%, tal como descrito por Andresen et al. 32
- Para a análise exigindo tecido snap-congelado (por exemplo, RNAanálise ou ensaios de actividade da enzima 33):. Remover o cérebro, dissecar regiões cerebrais de interesse e snap-congelar blocos de tecido de no máximo 1 cm x 1 cm de nitrogênio líquido, como descrito por Munkeby et al 33
Resultados
Os efeitos da hipóxia-isquémia no cérebro que ocorrem durante o insulto induzida são documentados por gravar o rastreio aEEG. Um representante aEEG traço é mostrado na Figura 6.
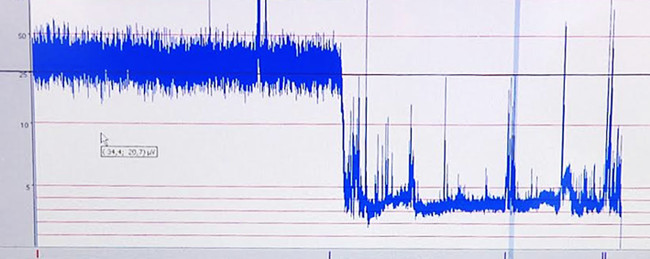
Figura 6. Representante traço aEEG. Baixa amplitude devido à hipóxia-isquemia.
Discussão
Devido à sua complexidade, o modelo descrito só pode ser implementada em instalações credenciadas e com experiência em pesquisa animal. Aprovação por comitês de ética locais deve ser obtida antes do início dos experimentos, e bem-estar animal ideal deve ser garantida em todos os momentos. Como o modelo baseia-se na sobrevivência dos animais do teste, é importante que um ambiente estéril é mantida durante procedimentos invasivos para prevenir infecções.
A escolha da anestesia ...
Divulgações
Os autores não têm nada a revelar.
Agradecimentos
The authors would like to thank John Kristensen and Søren Braad Andersen from the Department of Communication, Aarhus University Hospital, Denmark, for their exceptional help with filming and editing. Animal technician Diana Gyldenløve and veterinarian Birgitte Kousgaard, Institute of Clinical Medicine Aarhus University Hospital, Denmark for assisting with animal care. This study was supported by the Lundbeck Foundation, the Laerdal Foundation for Acute Medicine, Central Denmark Region’s Research Foundation, Augustinus Foundation, Aase and Ejnar Danielsens Foundation, the Institute of Clinical Medicine Aarhus University Hospital, Brødrene Hartmanns Foundation, Karen Elise Jensens Foundation, Fonden til Lægevidenskabens Fremme, and Marie Dorthea og Holger From, Haderslevs Fond.
Materiais
| Name | Company | Catalog Number | Comments |
| Warm-touch-pediatric blanket | Covidien | 5030840 | |
| Adhesive Apertrue Drape | Barrier | 915447 | |
| Utility Drape (sterile) 75x80 cm | Barrier | 800530 | |
| Neoflon | BD - Luer | 391350 | |
| Laryngoscope | Miller | 85-0045 | |
| Endotracheal tube 2.5 mm | Covidien | 111-25 | |
| Endotracheal tube 3.0 mm with cuff | Unomedical | MM61110030 | |
| Endotracheal tube 3.5 mm with cuff | Unomedical | MM61110035 | |
| Anesthesia machine | GE Healthcare | 1009-9002-000 | |
| EEG - electrodes/disposable subdermal needle electrode | Cephalon | ACCE120550 | |
| ECG - electrodes | medtronic | 3010107-003 | |
| ECG-electrodes for MR | philips | ACCE120550 | |
| Arterial blood sampler - aspirator | Radiometer medical ApS | 956552 | |
| Polyurethane Umbilical vein catheter (5 Fr/Ch) | Covidien | 8888160341 | |
| Polyurethane Umbilical vein catheter (3,5 Fr/ch) | Covidien | 8888160333 | |
| Suture set (size 3-0) | Covidien | 8886 623341 | |
| BD Spinal needle 0.7x38mm | BD needles | 405254 | |
| Gas with 96% Nitrogen / 4% oxygen | Air Liquide | made on order | |
| NeuroMonitor (CFM) system | Natus Medical Incorporated | OBM70002 |
Referências
- Chakkarapani, E., et al. Xenon enhances hypothermic neuroprotection in asphyxiated newborn pigs. Annals of. 68, 330-341 (2010).
- Robertson, N. J., et al. Melatonin augments hypothermic neuroprotection in a perinatal asphyxia model. Brain : a journal of neurology. 136, 90-105 (2013).
- Lawn, J. E., et al. Every Newborn: progress, priorities, and potential beyond survival. Lancet. 384, 189-205 (2014).
- Lee, A. C., et al. Intrapartum-related neonatal encephalopathy incidence and impairment at regional and global levels for 2010 with trends from 1990. Pediatric research. 74, 50-72 (2013).
- Kurinczuk, J. J., White-Koning, M., Badawi, N. Epidemiology of neonatal encephalopathy and hypoxic-ischaemic encephalopathy. Early human development. 86, 329-338 (2010).
- Shankaran, S., Woldt, E., Koepke, T., Bedard, M. P., Nandyal, R. Acute neonatal morbidity and long-term central nervous system sequelae of perinatal asphyxia in term infants. Early human development. 25, 135-148 (1991).
- Robertson, C. M., Finer, N. N., Grace, M. G. School performance of survivors of neonatal encephalopathy associated with birth asphyxia at term. The Journal of pediatrics. 114, 753-760 (1989).
- Bennet, L., Booth, L., Gunn, A. J. Potential biomarkers for hypoxic-ischemic encephalopathy. Seminars in feta., & neonatal medicine. 15, 253-260 (2010).
- Yager, J. Y., Ashwal, S. Animal models of perinatal hypoxic-ischemic brain damage. Pediatric neurology. 40, 156-167 (2009).
- Buckley, N. M. Maturation of circulatory system in three mammalian models of human development. Comparative biochemistry and physiology. A, Comparative. 83, 1-7 (1986).
- Dobbing, J., Sands, J. Comparative aspects of the brain growth spurt. Early human development. 3, 79-83 (1979).
- Dobbing, J., Sands, J. Quantitative growth and development of human brain. Archives of disease in childhood. 48, 757-767 (1973).
- Foster, K. A., et al. An improved survival model of hypoxia/ischaemia in the piglet suitable for neuroprotection studies. Brain research. 919, 122-131 (2001).
- LeBlanc, M. H., Li, X. Q., Huang, M., Patel, D. M., Smith, E. E. AMPA antagonist LY293558 does not affect the severity of hypoxic-ischemic injury in newborn pigs. Stroke; a journal of cerebral circulation. 26, 1908-1914 (1995).
- Andresen, J. H., et al. Nicotine affects the expression of brain-derived neurotrophic factor mRNA and protein in the hippocampus of hypoxic newborn piglets. J Perinat Med. 37, 553-560 (2009).
- Cheung, P. Y., Gill, R. S., Bigam, D. L. A swine model of neonatal asphyxia. Journal of visualized experiments : JoVE. , (2011).
- Thoresen, M., et al. A piglet survival model of posthypoxic encephalopathy. Pediatric research. 40, 738-748 (1996).
- Liu, X., Tooley, J., Loberg, E. M., Suleiman, M. S., Thoresen, M. Immediate hypothermia reduces cardiac troponin I after hypoxic-ischemic encephalopathy in newborn pigs. Pediatric research. 70, 352-356 (2011).
- Bjorkman, S. T., et al. Hypoxic/Ischemic models in newborn piglet: comparison of constant FiO2 versus variable FiO2 delivery. Brain research. 1100, 110-117 (2006).
- Robertson, N. J., et al. Which neuroprotective agents are ready for bench to bedside translation in the newborn infant. The Journal of pediatrics. 160, 544-552 (2012).
- Jacobs, S. E., et al. Cooling for newborns with hypoxic ischaemic encephalopathy. Cochrane Database Syst Rev. 1, CD003311 (2013).
- Andresen, J. H., et al. Resuscitation with 21 or 100% oxygen in hypoxic nicotine-pretreated newborn piglets: possible neuroprotective effects of nicotine. Neonatology. 93, 36-44 (2008).
- Karlsson, M., et al. Delayed hypothermia as selective head cooling or whole body cooling does not protect brain or body in newborn pig subjected to hypoxia-ischemia. Pediatric research. 64, 74-78 (2008).
- Kovacs, J., et al. Asphyxia-induced release of alpha-melanocyte-stimulating hormone in newborn pigs. Peptides. 22, 1049-1053 (2001).
- Varvarousi, G., et al. Asphyxial cardiac arrest, resuscitation and neurological outcome in a Landrace/Large-White swine model. Laboratory animals. 45, 184-190 (2011).
- Tammela, O., Pastuszko, A., Lajevardi, N. S., Delivoria-Papadopoulos, M., Wilson, D. F. Activity of tyrosine hydroxylase in the striatum of newborn piglets in response to hypocapnic hypoxia. Journal of neurochemistry. 60, 1399-1406 (1993).
- Cote, A., Barter, J., Meehan, B. Age-dependent metabolic effects of repeated hypoxemia in piglets. Canadian journal of physiology and pharmacology. 78, 321-328 (2000).
- Tichauer, K. M., et al. Assessing the severity of perinatal hypoxia-ischemia in piglets using near-infrared spectroscopy to measure the cerebral metabolic rate of oxygen. Pediatric research. 65, 301-306 (2009).
- Jasani, M. S., Salzman, S. K., Tice, L. L., Ginn, A., Nadkarni, V. M. Anesthetic regimen effects on a pediatric porcine model of asphyxial arrest. Resuscitation. 35, 69-75 (1997).
- Chakkarapani, E., Thoresen, M., Liu, X., Walloe, L., Dingley, J. Xenon offers stable haemodynamics independent of induced hypothermia after hypoxia-ischaemia in newborn pigs. Intensive care medicine. 38, 316-323 (2012).
- Munkeby, B. H., et al. A piglet model for detection of hypoxic-ischemic brain injury with magnetic resonance imaging. Acta radiologica. 49, 1049-1057 (2008).
- Andresen, J. H., et al. Newborn piglets exposed to hypoxia after nicotine or saline pretreatment: long-term effects on brain and heart. J Matern Fetal Neonatal Med. 22, 161-168 (2009).
- Munkeby, B. H., et al. Resuscitation with 100% O2 increases cerebral injury in hypoxemic piglets. Pediatric research. 56, 783-790 (2004).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados