É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Técnica microfluídico genipina Deposição de Cultura Extensão da micropatterned vasculares musculares Filmes Finos
Neste Artigo
Resumo
We present a method for microfluidic deposition of patterned genipin and fibronectin on PDMS substrates, allowing extended viability of vascular smooth muscle cell-dense tissues. This tissue fabrication method is combined with previous vascular muscular thin film technology to measure vascular contractility over disease-relevant time courses.
Resumo
The chronic nature of vascular disease progression requires the development of experimental techniques that simulate physiologic and pathologic vascular behaviors on disease-relevant time scales. Previously, microcontact printing has been used to fabricate two-dimensional functional arterial mimics through patterning of extracellular matrix protein as guidance cues for tissue organization. Vascular muscular thin films utilized these mimics to assess functional contractility. However, the microcontact printing fabrication technique used typically incorporates hydrophobic PDMS substrates. As the tissue turns over the underlying extracellular matrix, new proteins must undergo a conformational change or denaturing in order to expose hydrophobic amino acid residues to the hydrophobic PDMS surfaces for attachment, resulting in altered matrix protein bioactivity, delamination, and death of the tissues.
Here, we present a microfluidic deposition technique for patterning of the crosslinker compound genipin. Genipin serves as an intermediary between patterned tissues and PDMS substrates, allowing cells to deposit newly-synthesized extracellular matrix protein onto a more hydrophilic surface and remain attached to the PDMS substrates. We also show that extracellular matrix proteins can be patterned directly onto deposited genipin, allowing dictation of engineered tissue structure. Tissues fabricated with this technique show high fidelity in both structural alignment and contractile function of vascular smooth muscle tissue in a vascular muscular thin film model. This technique can be extended using other cell types and provides the framework for future study of chronic tissue- and organ-level functionality.
Introdução
As doenças vasculares, tais como vasospasmo cerebral 1,2, 3 hipertensão, aterosclerose e 4, desenvolvem-se lentamente, são tipicamente de natureza crónica, e envolvem disfuncional força de geração de células do músculo liso vascular (VSMCs). Nosso objetivo é estudar essas disfunções vasculares em progressão lenta utilizando métodos in vitro com um controle mais preciso de condições experimentais do que em modelos in vivo. Nós já desenvolvidas películas finas musculares vasculares (vMTFs) para a medição da contractilidade funcional de engenharia de tecidos in vitro cardiovasculares 5, mas este método tem sido limitada a estudos relativamente curto. Aqui, nós apresentamos uma técnica de modificação substrato que se expande a nossa técnica anterior vMTF para medições de longo prazo.
Enquanto o endotélio é também crítico na função vascular no geral, lamelas arterial projetado fornecer um sistema modelo útil para avaliar alterações na vascularcontractilidade durante a progressão da doença. Para manipular um modelo de tecido de doença vascular funcional, tanto a estrutura e função da lamela arterial, a unidade de base contrátil do recipiente, deve ser reproduzido com alta fidelidade. Arterial lamelas são concêntricos folhas, circunferencialmente alinhadas de VSMCs de contrácteis separadas por folhas de elastina 6. Microcontact impressão de matriz extracelular (ECM) proteínas sobre substratos de polidimetilsiloxano (PDMS) foi anteriormente utilizada para fornecer sinais de orientação para a organização do tecido para imitar alinhados tecido cardiovascular 5,7-10. No entanto, tecidos estampados com impressão microcontact pode perder a integridade após 3-4 dias em cultura, o que limita a sua aplicabilidade em estudos crônicos. Este protocolo fornece uma solução para este problema, substituindo técnicas de impressão microcontact anteriores com uma nova técnica de deposição de microfluidos.
Genbutsu et al. PDMS substratos modificados com genipina e found viabilidade de miócitos prolongada até um mês na cultura 11. Aqui, usamos uma abordagem semelhante para estender a cultura de células de músculo liso vascular estampados em PDMS. Genipina, um derivado hidrolítica natural da fruta gardénia, é um candidato desejável para modificação do substrato, devido à sua toxicidade relativamente baixa em comparação com agentes de reticulação similares e a sua crescente utilização como biomaterial nos domínios da reparação de tecidos e modificação 12,13 ECM 14, 15. Neste protocolo, a fibronectina é utilizada como um sinal de orientação de células, tal como nos processos anteriores de impressão microcontacto; no entanto, genipina é depositada sobre substratos de PDMS antes da fibronectina padronização. Assim, como as células degradam a matriz modelado, ECM recém-sintetizados a partir de VSMCs de anexados podem ligar-se ao substrato revestido PDMS-genipina.
Este protocolo utiliza um dispositivo de fornecimento de microfluidos de genipina de duas etapas e de deposição de ECM. O design do dispositivo microfluídico imita micromedidorpadrões de impressão ntact utilizados para lamelas arterial engenharia em estudos anteriores 16. Assim, esperamos que este protocolo para produzir imita lamelas arterial que recapitulam o sucesso altamente alinhado na estrutura vivo e função contrátil de lamelas arterial. Nós também avaliar a contratilidade tecido para confirmar que genipina é um composto modificação substrato adequado para longo prazo em modelos de doenças vasculares in vitro.
Access restricted. Please log in or start a trial to view this content.
Protocolo
Nota: O objectivo deste protocolo é de construir e utilizar um filme fino vascular muscular (vMTF) com a estrutura mostrada na Figura 1 para avaliar a contractilidade durante a cultura prolongada de células de músculo liso vascular (VSMC) em substratos de PDMS. Para prolongar a viabilidade VSMC, nós utilizamos o genipina composto reticulador. Os substratos para estes vMTFs são projetados para analisar a contratilidade tecido desenvolvido pelo Grosberg et al. 8 Outros métodos vMTF 5 também podem ser utilizados, com mudanças sutis ao protocolo fabricação substrato apresentados.
1. Substrato Fabrication
- Limpeza lamela
- Coloque 25 milímetros lamelas de vidro de diâmetro em um suporte de coloração lamela. Coloque o rack em um grande copo ou recipiente (por exemplo, um vazio 100 -. 1000 ul pipeta de ponta recipiente).
- Adicionar etanol a 70% ao recipiente para imergir completamente as lamelas. Sonicar durante pelo menos 30 min.
- Remover a cremalheira lamela da solução de etanol. Permitir que as lamelas para o ar seco por enforcamento do rack em uma capa de cultura estéril (para evitar a acumulação de partículas em lamelas) por 1- 2 horas.
Nota: As lamelas de cobertura deve ser completamente seco antes de as seguintes etapas.
- Poli (N-iso-propilacrilamida) (PIPAAm) Faixa de isolamento em Coverslip
- Usando fita adesiva, fita de fora dos lados de uma lamela limpa, deixando uma tira exposta centrado sobre a lamela (Figura 1A). Modificar a largura desta faixa exposta com base na aplicação e / ou projeto microfluídico.
- Mark as bordas de tiras de fita sobre a lamela usando um marcador de laboratório para posterior referência (Figura 1A).
- Corte em torno do perímetro da lamela para liberar a partir do prato (Figura 1A, linha tracejada vermelha).
- Poli (N-iso-propilacrilamida) (PIPAAm) Revestimento
- Usando uma balança analítica, pesar 1 g de PIPAAm pó. Não use não polimerizado N-iso-propilacrilamida, que é uma substância cancerígena.
- Transferir a PIPAAm para um tubo de centrífuga de 50 ml. Adicionar 10 ml de 1-butanol no interior de uma capa química para se obter uma solução a 10% w / v. CUIDADO: O ponto de inflamação de 1-butanol é de 37 o C. Guardar a solução resultante em um gabinete inflamável e evitar aquecimento.
- Permitir que o PIPAAm para dissolver durante 10 min. Se o pó é ainda visível, misturar a solução com um vortex-mixer até que todos se dissolve em pó.
Nota: Os seguintes passos requerem a utilização de um revestidor de rotação. Para cada lamela: - Coloque a lamela gravado na rotação coater chuck com uma pinça.
- Transferir 150 ul da solução PIPAAm para a lamela, colocando gotículas ao longo do vidro exposta no centro da lamela. Assegurar a cobertura completa da área exposta.
- Revestimento de spin PIPAAm com a seguinte receita:
- Rampa de 10 segundos a 3000 rpm. Habitar por 5 s.
- Rampa de 10 seg a 6,000 rpm. Habitar durante 60 segundos.
- Rampa de 10 segundos a 3000 rpm. Habitar por 5 s.
- Coloque a lamela numa caixa de Petri coberta com o PIPAAm voltado para cima. Deixar secar ao ar durante pelo menos 15 min.
- Remova cuidadosamente a fita adesiva de todos os lamelas, deixando a lamela completa exposta com uma fina camada de revestimento PIPAAm em uma faixa central.
- PDMS Coating
- Misture e desgaseificar 15 g de PDMS em uma proporção de 10: crosslinker: base 1. Adicionar 7-8 gotas de sonicadas microesferas fluorescentes 0,2 um antes de se misturar. Cubra o copo de PDMS com folha de alumínio quando não estiver em uso para evitar a poeira e outras partículas de contaminar o PDMS.
Nota: Os seguintes passos requerem a utilização de um revestidor de rotação. Para cada lamela: - Coloque uma lamela PIPAAm-revestido na rotação coater chuck com uma pinça.
- Transferir para o PDMS lamela, abrangendo, pelo menos, um terço da área da lamela.
- Casaco de rotação com a seguinte recipe:
- Rampa de 5 segundos a 500 rpm. Habitar 5 sec.
- Rampa de 5 segundos a 1000 rpm. Habitar 5 sec.
- Rampa de 10 segundos a 3000 rpm. Habitam 10 seg.
- Rampa de 10 segundos a 4000 rpm. Habitam 60 seg.
- Rampa de 10 seg a 2000 rpm. Habitam 15 seg.
- Rampa de 10 segundos a 1000 rpm. Habitam 10 seg.
- Rampa de 5 segundos a 500 rpm. Habitar 5 sec.
- Coloque a lamela numa caixa de Petri coberta com o PDMS voltado para cima. Registre o momento em que a lamela foi spin-revestido. Mantenha o controle do tempo associado a cada lamela durante todo o experimento para uso posterior na determinação da espessura do substrato PDMS.
- Colocar a placa de Petri contendo as lamelas em um forno a 90 ° C durante pelo menos 1,5 h para assegurar uma cura adequada PDMS. Se um forno não está disponível, as lamelas deixar curar durante pelo menos 48 horas à temperatura ambiente.
- Retirar as lamelas do forno e armazená-los em uma gaveta escura até que esteja pronto para uso.
- Separe cada quarta lamela fou posterior medição da espessura do substrato, como uma função do tempo de revestimento por rotação, com um perfilómetro.
- Misture e desgaseificar 15 g de PDMS em uma proporção de 10: crosslinker: base 1. Adicionar 7-8 gotas de sonicadas microesferas fluorescentes 0,2 um antes de se misturar. Cubra o copo de PDMS com folha de alumínio quando não estiver em uso para evitar a poeira e outras partículas de contaminar o PDMS.
2. Patterning microfluídicos para Tecidos Engenharia
- Fabricação de dispositivos microfluídicos
- Design of Tissue fotomáscara Microfluidic
- Use qualquer programa de desenho assistido por computador apropriado para projetar padrões microfluídicos. Para lamelas arterial composto de artéria cordão umbilical células musculares lisas vasculares humanas, utilizam um padrão alternado de 10 uM canais com paredes 10 um.
- Use canal binário de ramificação, se possível 17, mas podem ser utilizados outros modelos de ramificação. Diminuir a largura e comprimento dos canais para cada iteração de ramificação até atingir o padrão de tecido desejado espaçamento (paredes e canais, Figura 1B).
- Conceber o dispositivo ter uma única entrada para a colocação solução de tratamento de superfície e uma única saída para aplicação de vácuo.
- Fabricate uma fotomáscara contendo o desenho de microfluidos (s), como previamente descrito 18.
- Fotolitográfica Wafer Fabricação
Nota: Execute fotolitografia em uma sala limpa adequada ou instalação semelhante. Para fazer pastilhas de silício com os padrões para a fabricação litográfico macio de dispositivos microfluídicos de tecido (~ 20-25 mm altura do canal) utilizando fotolitografia:- Limpar uma bolacha de silício em acetona, metanol e álcool isopropílico durante 1 min cada. Seca-se a pastilha com uma pistola de azoto.
- Prebake a bolacha sobre uma placa de aquecimento durante 5 minutos a 115 ° C para remover o excesso de humidade.
- Revestimento de spin o wafer com SU-8 3025 photoresist usando a seguinte receita para produzir apresenta 20-25 mm de altura:
- Rampa de 5 segundos a 500 rpm. Habitar 5 sec.
- Rampa de 15 seg a 4000 rpm. Habitam 15 seg.
- Coza macio a bolacha sobre uma placa quente a 95 ° C durante 15 min.
- Coloque uma photomask, e expor tele bolacha por 16 seg usando um programa de contato vácuo em um alinhador de contato da máscara.
- Disco cozer a bolacha sobre uma placa quente a 95 ° C durante 4 min.
- Desenvolver o wafer de 6 min em desenvolvedor. Em seguida, lava-se a pastilha por duas vezes durante 2 segundos em revelador novo e enxaguar o wafer com álcool isopropílico.
- Silanate modelado a bolacha S / N, colocando 2-3 gotas de tridecafluoro-triclorossilano num prato vazio num exsicador de vácuo. Prop-se a bolacha usando pratos de Petri de modo a que tanto a parte inferior e superior da bolacha são expostos.
CUIDADO: Tridecafluro-trichlorosilane é um líquido inflamável e corrosivo. Equipamento de protecção individual adequado e exaustão local é necessária para o uso.
- Tecido de dispositivos microfluídicos Fabrication
- Coloque um silanado, recurso do lado do wafer modelou-se em uma placa de Petri.
- Misture e desgaseificar 100 g de PDMS com uma proporção de 10: crosslinker: base 1. Despeje o PDMS para o prato, completa e uniformemente cobrindo o wafer.
- Colocar a cápsula num exsicador de vácuo até que todas as bolhas de ar são removidas a partir dos PDMS não curado, a cerca de 30 min. Curar o PDMS no prato a 90 ° C durante pelo menos 1,5 h. O tempo ea temperatura pode ser ajustada como ditado pelas orientações de fabrico para se obter uma cura completa.
- Uma vez que o PDMS tem curado, cortar os PDMS em todo o wafer com uma lâmina de barbear e solte cuidadosamente o wafer PDMS-cobertos do prato. Remover o excesso de PDMS e por baixo da bolacha lentamente casca PDMS de distância da parte superior da bolacha.
- Coloque recurso do lado do disco PDMS-se em um prato limpo e armazenar o wafer longe da luz após o uso.
- Cortar o excesso de PDMS em torno dos padrões usando uma lâmina de barbear. Dispositivos de corte em forma rectangular (Figura 1C) para facilitar a casca de dispositivo a partir de substratos em etapas posteriores. Cortes precisos não são necessários, desde que existe um amplo espaço para a entrada, de saída e a área de padrão de tecido (Figura 1C).
- Socoorifícios de entrada e de saída (Figura 1C), utilizando de 1 mm biópsia cirúrgica perfurador.
- Design of Tissue fotomáscara Microfluidic
- Deposição de dispositivos microfluídicos
Nota: Neste protocolo, a entrega de microfluidos é utilizado para depositar modelado genipina, o agente de reticulação chave para a cultura de tecido a longo prazo, bem como a fibronectina. Passos anteriores à esterilização penicilina / estreptomicina (2.2.3) não precisa ter lugar em condições estéreis, mas limitando coleção contaminação e poeira é incentivada ao longo do protocolo. Todos os passos que ocorrem após a esterilização lamela com penicilina / estreptomicina (2.2.3) deve utilizar uma técnica estéril. Nota: Esta parte do protocolo deve ser iniciado um dia antes da sementeira celular.- Substrato e microfluídicos dispositivo de preparação
- Sonicar os microcanais em etanol a 70% durante pelo menos 30 min.
- Secar os dispositivos microfluídicos sonicadas usando ar comprimido ou nitrogênio, e colocá-los em uma placa de Petri with canal possui a face para cima para evitar o desgaste desnecessário sobre os recursos.
- Coloque até 10 vMTF lamelas de substrato em um aspirador de UVO (tampa removida no prato assim que a superfície é funcionalizado) para 8 min.
- Retirar as lamelas tratados com UVO, e coloque o recurso do lado dispositivos microfluídicos para baixo em cada deslizamento um de cada vez (orientação deve ser semelhante à Figura 1C). Pressione firmemente os dispositivos para garantir um selo apertado para as lamelas PDMS-revestidos.
- Deposição de genipina e Fibronectina
- Prepara-se uma solução / genipina ml 5 mg por adição de 1 ml de ddH 2 O esterilizada para um recipiente de 5 mg de genipina liofilizada. Misturar a solução com um vortex-mixer. Pôr de lado à temperatura ambiente durante pelo menos 30 min.
Nota: O pó é difícil de solubilizar à TA, a mistura de modo repetitivo, durante pelo menos um minuto é muitas vezes necessário. - Rapidamente, colocar uma gota de etanol a 70% na entrada de cada dispositivo para dispositivo de escorvamento. Nota: O ethanol deve pavio através dos dispositivos.
- Após 5-10 minutos, aspirar cuidadosamente o excesso de etanol na entrada, imediatamente substituindo-o com solução salina tamponada com fosfato 1X (PBS) na entrada. Deste ponto em diante, certifique-se de não permitir a entrada para tornar-se completamente seca para evitar a introdução de ar para o dispositivo.
- Inserir uma ponta do aspirador de vácuo na saída de cada dispositivo. Desenhar 1X PBS por meio de dispositivos para enxaguar etanol distância. Deixar uma pequena quantidade de PBS 1X na entrada. Nota: Se entrada aparece quase seca, adicione mais 1X PBS.
- Aspirar o excesso de 1X PBS, de forma que apenas uma pequena quantidade permanece à entrada do tubo, antes da aplicação da solução de genipina.
- Colocar 60 ul da solução / genipina ml 5 mg em cada entrada (Figura 1D). Desenhar a solução genipina através dos dispositivos de colocação de um aspirador de vácuo a ponta da tomada (Figura 1D). Certifique-se para não chamar toda a solução através, deixando uma pequena quantidade de solução na entrada.
- Local gotas (cerca de dime-size) de 1X PBS, tanto a entrada e a saída para manter molhante durante a incubação. Mover o prato que contém dispositivos para um forno ou incubadora humidificada (ambiente estéril não é necessário) definido como 37 ° C e incubar durante 4 horas. O prato não tem de ser coberto.
- Durante a incubação, ressuspender fibronectina a uma concentração de 50 ug / ml em ddH2O estéril em gelo durante pelo menos 30 minutos antes da aplicação para o dispositivo de microfluidos.
- Após a incubação de genipina, Aspirar todo o restante 1X PBS nas saídas do dispositivo. Continuar para aplicar um aspirador a vácuo em cada dispositivo de saída, por meio de puxar o restante 1X PBS na entrada.
- Coloque 100 ml de / 50 ml de solução de fibronectina ug em cada entrada, a adição de uma quantidade mínima de permanecer 1X PBS a entrada (Figura 1D).
- Desenhar a solução de fibronectina pelos dispositivos que utilizam uma ponta do aspirador de vácuo na saída ( Figura 1D). Certifique-se de não chamar toda a solução completamente. Observação: A queda Fibronectina terá um aspecto diferente do que o 1X PBS e genipina devido a diferenças na tensão superficial.
- Mover o prato descoberto que contém os dispositivos para um forno ou incubadora ajustada a 37 ° C, e incuba-se durante 24 h. Nota: O passo de fibronectina não requer humedecimento da entrada e saída com 1X PBS. A piscina restante de fibronectina na entrada vai secar. Isso é esperado.
- Prepara-se uma solução / genipina ml 5 mg por adição de 1 ml de ddH 2 O esterilizada para um recipiente de 5 mg de genipina liofilizada. Misturar a solução com um vortex-mixer. Pôr de lado à temperatura ambiente durante pelo menos 30 min.
- Esterilização e Preparação para Sementeira celular
- Prepara-se uma solução de penicilina / estreptomicina para a esterilização de lamelas vMTF modelado. Adicionar 5 ml de penicilina / estreptomicina (10000 unidades / ml; 10.000 ug / ml) em 500 ml de 1X PBS estéril.
- Coloque o prato contendo os dispositivos em uma capa de biossegurança estéril.
- Remova cuidadosamente os dispositivos das lamelas por descascar lentamente o dispositivo em um canto, enquanto segurando levemente a lamela na mão oposta.Nota: Esta etapa requer prática para reduzir os danos lamela no processo de remoção. Uma alternativa é utilizar uma seringa para injectar 1X PBS na entrada e / ou saída para ajudar na libertação do dispositivo.
- Coloque as lamelas em placas de seis poços estéreis. Adicionar, pelo menos, 5 ml de solução de penicilina / estreptomicina a cada poço. Colocar as cápsulas numa incubadora esterilizada, a 37 ° C durante pelo menos 30 min.
- Após a esterilização, aspirar a solução de penicilina / estreptomicina e semear as lamelas com cultura humana artéria umbilical vascular cells19 músculo liso (Figura 1D). A concentração para a semeadura é VSMCs de ~ 80.000 células por cm2. Para reduzir o número de células necessárias para cada amostra, utilizar um redutor para diminuir a área da sementeira. Um exemplo de um redutor é o corte superior de um tubo cónico de 15 ml ligado a lamela com graxa de vácuo estéril antes da semeadura.
- Incubar as lamelas inoculadas numa incubadora esterilizada, a 37 ° C e 5% de CO 2 e permitir que as células semeadas para prender e formar alinhados imita lamelas arteriais S / N (Figura 2A-B).
- Longo prazo Cultura de Tecidos vMTF
- Um dia após a semeadura, remova o meio celular e redutores. Lavar os tecidos com 1X PBS. Adicione 4 ml de meio de células isento de soro para induzir um fenótipo contrátil no VSMCs 20.
- Repetir a lavagem 1X PBS e adição de meio isento de soro fresco a cada dois dias, como desejado para a cultura a longo prazo.
- Substrato e microfluídicos dispositivo de preparação
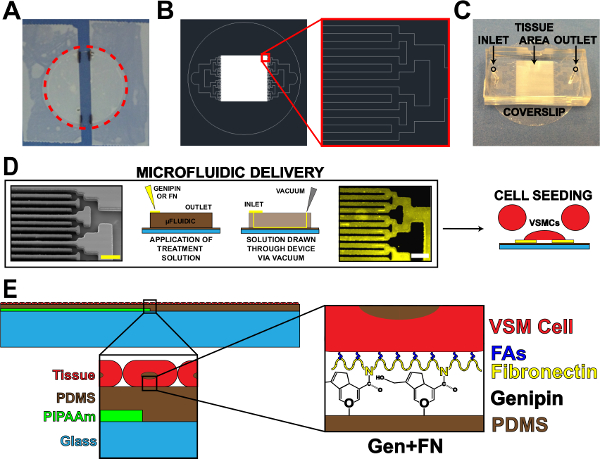
Figura 1. Dispositivo Microfluidic Protein Delivery. (A) Gravado fora lamela para o revestimento PIPAAm. Círculo vermelho pontilhada: cortando caminho para a libertação lamela (B) Representante desenho AutoCAD de tecido padrão de máscara microfluídico.. Detalhe: Detalhe de ramificação binário para AlternAting 10 um x 10 um padrão de tecido. (C) A colocação de dispositivo de microfluidos sobre um substrato lamela com entrada e saída indicado. (D) Esquema de modelação de proteínas de microfluidos e entrega. Imagem microscópio eletrônico de varredura de canais microfluídicos (barra de escala:: 50 mm) da esquerda para a direita; Esquemática detalhada do método para deposição de proteína; Imunohistoquímica fibronectina manchado (barra de escala: 50 mm); Sementeira celular com células do músculo liso vascular. (E) Esquema de tecido fabricado. 1º inserir: Detalhe de construção em camadas. 2º inserir: Detalhe de modificação genipina de substrato PDMS após a deposição de microfluidos. © IOP Publishing. Reproduzidos e / ou modificado com permissão. Todos os direitos reservados. 19 Por favor, clique aqui para ver uma versão maior desta figura.
3. Tissue Análise de função com vMTF Contractilidade Assay
Nota: O ensaio MTF contratilidade apresentado aqui é modelado após a técnica desenvolvida em Grosberg et al 8.
- vMTF Contractilidade Experiment
- Colocar uma amostra de tecido em um placa de 100 mm. Adicionar solution8 de estéril 1X Tyrode a pH 7,4 aqueceu-se a 37 ° C para cobrir a amostra.
- Usar uma lâmina de barbear para fazer vários cortes paralelos perpendiculares à aresta PIPAAm. Faça cortes de uma maneira que produz cortes de tecido mais amplos que serão o vMTFs (com largura ~ 2 mm) alternando com tiras finas (Figura 3A, cortes laterais). Para fazer cortes limpos, colocar uma lâmina de barbear em contacto com a amostra e firmemente arraste para o lado.
- Rodar o prato 90 ° e faz dois cortes direitos, paralelos no meio do tecido, paralela à tira de PIPAAm (Figura 3A, cortes finais). Remova e elimine a tira de tecido solto entre estes cortes e as tiras finas no meio vMTFs (corte na etapa anterior) para impedir filmes adjacentes de fazer contato.
- Deixar a amostra em repouso à temperatura ambiente durante 10 minutos, ou até que todo o PIPAAm tenha dissolvido. Nota: Se PIPAAm permanece nos passos futuros, a amostra pode ser devolvida para o prato de corte para dissolver PIPAAm residual. Um raspagem suave da parte inferior do vMTF pode ajudar na remoção PIPAAm, conforme necessário.
- Coloque um pequeno ponto de graxa de vácuo em um ambiente limpo 35 milímetros placa de Petri. Adicionar 5 ml de solução fresca, estéril 1X de Tyrode a 37 ° C. Transfira a lamela com corte filmes da placa de 100 mm a de 35 mm prato e pressione para graxa de vácuo para evitar o movimento da lamela.
- Colocar a cápsula em uma plataforma com temperatura controlada na fase estereomicroscópio.
- Captura de lapso de tempo transmitidos e imagens fluorescentes em intervalos desejados (por exemplo., 30 seg) durante todo ensaio de tratamento.
- Serialmente tratar vMTFs com 50 nM de endotelina-1 durante 20 min (contracção induzida) e 100 pM HA-1077 durante 30 minutos (relaxamento do tecido). Adicionar soluções concentradas de cada tratamento para o prato experimental contendo 5 ml de solução de Tyrode estéril 1X em pontos de tempo específicos, dando origem a concentração de tratamento desejado no volume de 5 ml. Fazer adições de tratamento durante o intervalo entre as aquisições de imagens de lapso de tempo para evitar a captura de pipeta nas imagens.
- vMTF Análise Contractilidade
- Usando lamelas retiradas, a 1.4.8, medir a espessura substrato PDMS com uma profilometer21. Criar uma espessura vs. curva do tempo de centrifugação para cada conjunto de lamelas. Esta curva é utilizada para calcular a espessura da vMTF para cada lamela utilizada numa experiência de contractilidade.
- Medir o comprimento de projecção vMTF para cada ponto de tempo durante a experiência e calcular os raios de curvatura associado (Figura 3B), utilizando métodos anteriormente relatados 8.
- Calcule vMTF estresse em cada po tempoint usando métodos vMTF anteriores 5.
Nota: Utilize a espessura vMTF estimativa calculada a partir de 3.2.1. Medir a espessura VSMC usando imagens confocal, como relatado previamente 9. Obter o módulo de PDMS Jovem de fichas de dados da empresa.
Access restricted. Please log in or start a trial to view this content.
Resultados
O principal objetivo deste trabalho foi estender a viabilidade de VSMCs micropatterned em substratos PDMS hidrofóbicas. Isto foi conseguido por incorporação de um sistema de entrega de microfluidos para depositar modelado genipina e fibronectina em PDMS (Figura 1). Deposição de proteínas ECM usando entrega microfluídico rendeu transferência de alta fidelidade do padrão de canal com PDMS descalços entre as linhas de genipina e fibronectina (Figura 1D). As células ligadas
Access restricted. Please log in or start a trial to view this content.
Discussão
Aqui, apresentamos um protocolo que se baseia em tecnologia vMTF anteriormente desenvolvido, permitindo tempos de experiência estendidas mais típico dos caminhos da doença vasculares crônicas 1,23,24. Para conseguir isso, micropadrão genipina, que tem sido mostrado previamente para fornecer funcionalização de longo prazo de PDMS substratos 11, usando uma técnica de deposição de microfluidos para se obter lamelas arterial concebido com melhoria da viabilidade do tecido vascular para uso em...
Access restricted. Please log in or start a trial to view this content.
Divulgações
The authors have nothing to disclose.
Agradecimentos
We acknowledge financial support from the American Heart Association Scientist Development Grant, 13SDG14670062 (PWA) and the University of Minnesota Doctoral Dissertation Fellowship (ESH). We also acknowledge the microfabrication resources of the Minnesota Nano Center (MNC) and the image processing resources of the University Imaging Centers (UIC), both at the University of Minnesota. Parts of this work were carried out in the Characterization Facility, University of Minnesota, which receives partial support from NSF through the MRS program.
Access restricted. Please log in or start a trial to view this content.
Materiais
| Name | Company | Catalog Number | Comments |
| Coverslip staining rack | Electron Microscopy Sciences | www.emsdiasum.com/ | 72239-04 |
| Microscope cover glass - 25 mm | Fisher Scientific, Inc. | www.fishersci.com | 12-545-102 |
| Poly(N-iso-propylacrylamide) (PIPAAm) | Polysciences, Inc. | www.polysciences.com/ | #21458 |
| 1-butanol | Sigma-Aldrich | www.sigmaaldrich.com | 360465 |
| Spincoater | Specialty Coating Systems, Inc. | www.scscoatings.com | |
| Polydimethylsiloxane (PDMS) | Ellsworth Adhesives (Dow Corning) | www.ellsworth.com | 184 SIL ELAST KIT 0.5KG |
| Fluorescent microbeads | Polysciences, Inc. | www.polysciences.com/ | 17151 |
| Silicon wafers | Wafer World, Inc. | www.waferworld.com | 2398 |
| Photoresist | MicroChem Corp. | www.microchem.com | |
| Contact mask aligner | Suss MicroTec | www.suss.com | |
| Developer | MicroChem Corp. | www.microchem.com | |
| Tridecafluro-trichlorosilane | UCT Specialties, Inc. | www.unitedchem.com | T2492 |
| Surgical biopsy punch | Integra LifeSciences Corp. | www.miltex.com | 33-31AA-P/25 |
| Genipin | Cayman Chemical | www.caymanchem.com | 10010622 |
| 1X phosphate buffered saline | Mediatech, Inc. | www.cellgro.com | 21-031-CV |
| Fibronectin | Corning, Inc. | www.corning.com | 356008 |
| Penicillin/streptomycin | Life Technologies, Inc. | www.lifetechnologies.com | 15140-122 |
| Umbillical artery smooth muscle cells | Lonza | www.lonza.com | CC-2579 |
| Tyrode's solution components | Sigma-Aldrich | www.sigmaaldrich.com | various |
| Stereomicroscope | Zeiss | www.zeiss.com | 4350020000000000 |
| Temperature-controlled platform | Warner Instruments | www.warneronline.com | 641659; 640352; 641922 |
| Endothelin-1 | Sigma-Aldrich | www.sigmaaldrich.com | E7764-50UG |
| HA-1077 | Sigma-Aldrich | www.sigmaaldrich.com | H139-10MG |
Referências
- Humphrey, J. D., Baek, S., Niklason, L. E. Biochemomechanics of cerebral vasospasm and its resolution: I. A new hypothesis and theoretical framework. Ann. Biomed. Eng. 35, 1485-1497 (2007).
- Hald, E. S., Alford, P. W. Smooth muscle phenotype switching in blast traumatic brain injury-induced cerebral vasospasm. Transl. Stroke Res. 5, 385-393 (2014).
- Olivetti, G., Anversa, P., Melissari, M., Loud, A. V. Morphometry of medial hypertrophy in the rat thoracic aorta. Lab. Invest. 42, 559-565 (1980).
- , Atherosclerosis. Nature. 407, 233-241 (2000).
- Alford, P. W., Feinberg, A. W., Sheehy, S. P., Parker, K. K. Biohybrid thin films for measuring contractility in engineered cardiovascular muscle. Biomaterials. 31, 3613-3621 (2010).
- Rhodin, J. A. G. Architecture of the vessel wall. Physiol. Rev. ed, B. erne,R. ., , American Physiology Society. (1979).
- Balachandran, K., et al. Cyclic strain induces dual-mode endothelial-mesenchymal transformation of the cardiac valve. Proc. Natl. Acad. Sci. U. S. A. 108, 19943-19948 (2011).
- Grosberg, A., Alford, P. W., McCain, M. L., Parker, K. K. Ensembles of engineered cardiac tissues for physiological and pharmacological study: heart on a chip. 11, 4165-4173 (2011).
- Alford, P. W., Nesmith, A. P., Seywerd, J. N., Grosberg, A., Parker, K. K. Vascular smooth muscle contractility depends on cell shape. Integr. Biol. (Camb). 3, 1063-1070 (2011).
- Win, Z., et al. Smooth muscle architecture within cell-dense vascular tissues influences functional contractility). Integr. Biol. (Camb). , (2014).
- Genchi, G. G., et al. Bio/non-bio interfaces: a straightforward method for obtaining long term PDMS/muscle cell biohybrid constructs). Colloid Surface B. 105, 144-151 (2013).
- Fessel, G., Cadby, J., Wunderli, S., van Weeren, R., Snedeker, J. G. Dose- and time-dependent effects of genipin crosslinking on cell viability and tissue mechanics - Toward clinical application for tendon repair. Acta Biomater. , (2013).
- Lima, E. G., et al. Genipin enhances the mechanical properties of tissue-engineered cartilage and protects against inflammatory degradation when used as a medium supplement. J. Biomed. Mater. Res. A. 91, 692-700 (2009).
- Madhavan, K., Belchenko, D., Tan, W. Roles of genipin crosslinking and biomolecule conditioning in collagen-based biopolymer: Potential for vascular media regeneration. J. Biomed. Mater. Res. A. , (2011).
- Satyam, A., Subramanian, G. S., Raghunath, M., Pandit, A., Zeugolis, D. I. In vitro evaluation of Ficoll-enriched and genipin-stabilised collagen scaffolds. J. Tissue Eng. Regen. Med. , (2012).
- Alford, P. W., et al. Blast-induced phenotypic switching in cerebral vasospasm. Proc. Natl. Acad. Sci. U. S. A. 108, 12705-12710 (2011).
- Song, H., Tice, J. D., Ismagilov, R. F. A microfluidic system for controlling reaction networks in time. Angew. Chem. Int. Ed. Engl. 42, 768-772 (2003).
- Whitesides, G. M., Ostuni, E., Takayama, S., Jiang, X., Ingber, D. E. Soft lithography in biology and biochemistry. Annu. Rev. Biomed. Eng. 3, 335-373 (2001).
- Hald, E. S., Steucke, K. E., Reeves, J. A., Win, Z., Alford, P. W. Long-term vascular contractility assay using genipin-modified muscular thin films. Biofabrication. 6, 045005(2014).
- Han, M., Wen, J. K., Zheng, B., Cheng, Y., Zhang, C. Serum deprivation results in redifferentiation of human umbilical vascular smooth muscle cells. Am. J. Physiol. Cell Physiol. 291, C50-C58 (2006).
- Feinberg, A. W., et al. Muscular thin films for building actuators and powering devices. Science. 317, 1366-1370 (2007).
- Volfson, D., Cookson, S., Hasty, J., Tsimring, L. S. Biomechanical ordering of dense cell populations. Proc. Natl. Acad. Sci. U. S. A. 105, 15346-15351 (2008).
- Intengan, H. D., Schiffrin, E. L. Vascular remodeling in hypertension: roles of apoptosis, inflammation, and fibrosis. Hypertension. 38, 581-587 (2001).
- Kayembe, K. N., Sasahara, M., Hazama, F. Cerebral aneurysms and variations in the circle of Willis. Stroke. 15, 846-850 (1984).
- McCain, M. L., Agarwal, A., Nesmith, H. W., Nesmith, A. P., Parker, K. K. Micromolded gelatin hydrogels for extended culture of engineered cardiac tissues. Biomaterials. 35, 5462-5471 (2014).
- Weir, B., Grace, M., Hansen, J., Rothberg, C. Time course of vasospasm in man. 48, 173-178 (1978).
- McCain, M. L., Sheehy, S. P., Grosberg, A., Goss, J. A., Parker, K. K. Recapitulating maladaptive, multiscale remodeling of failing myocardium on a chip. Proc. Natl. Acad. Sci. U. S. A. 110, 9770-9775 (2013).
- Agarwal, A., Goss, J. A., Cho, A., McCain, M. L., Parker, K. K. Microfluidic heart on a chip for higher throughput pharmacological studies. Lab. Chip. 13, 3599-3608 (2013).
- Huh, D., Torisawa, Y. S., Hamilton, G. A., Kim, H. J., Ingber, D. E. Microengineered physiological biomimicry: organs-on-chips. Lab. Chip. 12, 2156-2164 (2012).
- Meer, A. D., van den Berg, A. Organs-on-chips: breaking the in vitro impasse. Integr. Biol. (Camb). 4, 461-470 (2012).
Access restricted. Please log in or start a trial to view this content.
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados