Method Article
Método multifuncional, baseado em Micropipeta de Incorporação e estimulação do bacteriana Mechanosensitive canais iônicos em gotículas de interface Bicamadas
Neste Artigo
Resumo
Canais mechanosensitive bacterianas podem ser utilizados como transdutores mecanoelétrica em dispositivos biomoleculares. Bilayers de interface de gotículas (DIBs), de inspiração celulares blocos de construção para tais dispositivos, representam novas plataformas para incorporar e estimular canais mechanosensitive. Aqui, demonstramos um novo método baseado na micropipeta de formar DIB, permitindo que o estudo de canais mechanosensitive sob estimulação mecânica.
Resumo
MsCl, um canal de grande condutância mechanosensitive (MSC), é uma válvula de libertação de osmólito ubíquo que ajuda a bactéria sobreviver choques hipo-osmótico abruptas. Foi descoberto e rigorosamente estudado usando a técnica de patch-clamp de quase três décadas. O seu papel de base de traduzir a tensão aplicada à membrana celular em resposta a permeabilidade torna um forte candidato para funcionar como um transdutor de mecanoelétrica em dispositivos biomoleculares artificiais à base de membrana. Servindo como blocos de construção para esses dispositivos, bicamadas de interface gotícula (DIBs) pode ser utilizada como uma nova plataforma para a incorporação e a estimulação de canais de MsCl. Aqui, nós descrevemos um método baseado na micropipeta para formar DIB e medir a actividade dos canais de MsCl incorporados. Este método consiste em gotículas aquosas envolto em lípidos ancorados até as pontas dos dois opostos (coaxialmente posicionadas) micropipetas de vidro de borosilicato. Quando as gotas são postas em contacto, uma interface de bicamada lipídica éformado. Esta técnica permite o controlo sobre a composição química e o tamanho de cada gota, bem como as dimensões da interface bicamada. Tendo uma das micropipetas ligados a um actuador piezoeléctrico harmónica fornece a capacidade de entregar um estímulo oscilatório desejado. Por meio da análise das formas das gotículas durante a deformação, a tensão criada na interface pode ser estimada. Usando esta técnica, a primeira atividade de canais MSCL em um sistema de DIB é relatado. Além canais MS, as actividades de outros tipos de canais pode ser estudada utilizando este método, demonstrando a multi-funcionalidade desta plataforma. O método aqui apresentado permite a medição das propriedades da membrana essencial, proporciona um maior controlo sobre a formação de membranas simétricas e assimétricas, e é uma forma alternativa para estimular e estudar canais mechanosensitive.
Introdução
Na última década, o conjunto de bicamadas lipídicas artificiais foi substancialmente avançado através do desenvolvimento do método de dupla camada de interface de gota. Conhecido como estável e robusto, DIBs se impuseram como sistemas modelo alternativo para o clássico pintado (Mueller) e dobrados bilayers (Montal-Mueller) planares 1. Embora a idéia de usar gotas para criar camadas duplas lipídicas remonta à década de 1960 2, que não ganhou popularidade até recentemente. A primeira tentativa bem sucedida foi relatado pelo Grupo Takeushi 3, seguido por vários estudos demonstrando a formação de bicamada utilizando uma rede de gotículas pelo grupo Bayley 4-6. Mais recentemente, técnicas de encapsulamento foram propostas pelo grupo de Leo 7-9, que foi pioneiro no conceito de usar DIBs como blocos de construção de novos sistemas de material de estímulo de resposta 10. Em estudos anteriores, DIBs provaram a sua capacidade de responder a 9,11 elétrica, chemiCal 10,12, e óptica estímulos 13. Vários biomoléculas com diferentes funcionalidades estímulos de resposta foram efetivamente estimulada quando reconstituída no DIB 10,14. À luz dessas tentativas bem sucedidas uma importante questão é levantada: poderia a responder ao estímulo mecânico DIB quando biomoléculas adequadas são incorporadas? As forças interfaciais que actuam em um DIB diferem daquelas em outros 15,16 sistema de duas camadas. Por conseguinte, a tensão na bicamada realizada pelas gotículas pode ser controlado através do controlo da tensão nas interfaces óleo-água-lípido; um conceito não aplicável com os sistemas de duas camadas pintadas ou dobradas.
Canais MSCL, amplamente conhecidas como válvulas de liberação osmólito e elementos fundamentais da membrana citoplasmática bacteriana, reagir ao aumento da tensão da membrana 17,18. No caso de choques hipo-osmótico, vários canais que reside na membrana de uma pequena célula 19 pode gerar um masresposta permeabilidade sive para liberar rapidamente os íons e moléculas pequenas, poupando bactérias de lise 20. Biofísico, MSCL é bem estudada e caracterizada principalmente por meio da técnica de patch clamp proeminente 21-23. Modelos estruturais que explicam confiáveis do mecanismo de gating MSCL 24,25 são propostas com base na estrutura do seu homólogo de cristal 26,27, modelagem de 28, e os resultados de extensa experimentação 24,29-31. Sob uma tensão aplicada de ~ 10 mN / m, o canal fechado que consiste em um pacote apertado de hélices transmembranares, transforma-se em um anel de hélices muito inclinado formando um ~ 28 Å cheio de água dos poros condutora 21,24,32. Também foi estabelecido que a hidrofobicidade do portão apertado, posicionada na intersecção dos domínios TM1 interiores, determina o limiar de activação do canal 33. Correspondentemente, descobriu-se que ao diminuir a hidrofobicidade do portão, o tension limiar poderia ser reduzido 22. Este estabelecimento de MSCL tornou possível a concepção de várias válvulas controláveis 34, principalmente para fins de distribuição de drogas. Para todas as propriedades acima mencionadas e com base no seu papel fundamental de traduzir membrana celular tensões excessivas em atividades eletrofisiológicas, MSCL faz um grande ajuste como um transdutor mecanoelétrica em DIBs.
Neste artigo, apresentamos um método baseado em micropipeta original para formar DIBs e medir a atividade dos canais MSCL constituída sob estímulo mecânico. Relatamos pela primeira vez, a resposta de DIB para estímulos mecânicos e a reconstituição funcional de mutante V23T baixo limiar de MsCl em 35 DIB.
O sistema experimental é composto por lipídios envolto gotículas aquosas ancoradas até as pontas dos dois micropipetas de vidro borosilicato opostas. Quando as gotas são postas em contacto uma interface bicamada lipídica é formou. Esta técnica permite o controlo sobre a composição química e o tamanho de cada gota (em massa), bem como as dimensões da interface bicamada. Além disso, as membranas assimétricas com várias composições de lípidos em cada folheto poderia ser formada facilmente. Tendo uma das micropipetas ligados a um actuador piezoeléctrico harmónica, oferece a possibilidade de aplicar uma pré-programado de ciclo único ou de estímulo oscilatório. A tensão é enviada para a membrana artificial através da compressão de ambas as gotículas que o suportam. Como um resultado da deformação das gotas, as zonas de interfaces de aumento de lípidos-água-óleo, e, simultaneamente, o ângulo entre as gotículas diminui, provocando um aumento na tensão da membrana e activação transiente MsCl. Por meio da análise das formas das gotículas durante a deformação, a tensão criada na interface pode ser estimada. Mesmo que o foco neste artigo é sobre as propriedades mecano-transdução do DIB, nós também enfatizar que outros tipos de biomoléculas, tais como alameticina, pode ser activado por esta plataforma multi-funcional. Nós apresentamos aqui, todos os aspectos técnicos da preparação, montagem e tomando medidas com esse novo método em uma maneira passo-a-passo.
Protocolo
1. Preparação de PEG-DMA hidrogéis
- Selecione uma medida adequada / mistura recipiente (garrafa, taça, etc.) Para a aplicação. Limpe-o cuidadosamente, com detergente e água, e, em seguida, limpe-o com limpadores de tecido que não solte fiapos.
- Usar luvas para evitar a contaminação do material de vidro com óleos de alcance. Enxaguar o recipiente com água desionizada suficiente para eliminar os resíduos de detergente.
- Limpe o recipiente com o tecido que não solte fiapos para se livrar da água, em seguida, pulverizar com álcool isopropílico (IPA, 99,5%) e limpe até limpo. Coloque-o em uma câmara de vácuo para permitir que todos IPA para evaporar completamente. Limpar o resto do equipamento de laboratório utilizado no processo de formação de hidrogel com água destilada.
- Para preparar um 40% (w / v) de solução de PEG-DMA hidrogel, pesa 4 g de poli (etileno-glicol) dimetacrilato (PEG-DMA; PM = 1.000 g / mol) de polímero utilizando uma escala laboratorial.
- Coloque o pesado PEG-DMA no balão e calor utilizando um banho de ultra-sons a 45-55 ° C, até o sólido PEG-DMA foi liquefeito. Durante o processo, cobrir a abertura do frasco com Parafilm papel / cera para manter a água.
- Uma vez que o PEG-DMA foi liquefeito, adicionar uma solução tampão (500 mM de KCl, 10 mM de MOPS, pH 7,0) até que o volume total chega a ~ 10 ml (suficiente para várias experiências durante um período de seis meses).
- Adicionar o agente de cura a 0,5% (w / v). Neste caso, adicionar 0,05 g de agente de cura para a mistura 10 mL. Colocar o balão de volta para o banho de ultra-sons e permitir que os componentes de dissolver em solução (cerca de 10 min, 250 watts).
Observação: Uma vez que o agente de cura foi adicionado à solução, os hidrogeles irá curar (solidificar), se forem expostos a qualquer fonte de luz durante um período de tempo suficiente. Para ajudar a combater este, enrole o frasco / recipiente com fita preta e armazená-lo em um local escuro. Esta solução pode ser guardada durante várias semanas à temperatura ambiente (22 ° C).
2. Preparação de Liposomes
- Preparar 10 ml de uma / ml de solução de lípido de 2 mg por adição de 10 ml de tampão (500 mM de KCl, 10 mM de MOPS, pH 7,0) a 20 mg de 1,2-sn-glicero-diphytanoyl- 3-fosfocolina (DPhPC) sintético lípidos comprada como pó liofilizado. Faça vesículas se ambos os lípidos e solução tampão são misturados (a mistura deve olhar homogênea e nebuloso em que tudo é dissolvido).
- Congelamento (-20 ° C) e descongelar completamente a nova mistura de lípidos para um total de seis vezes. Deixe o degelo mistura à temperatura ambiente, nunca em um ambiente aquecido.
- Utilizando uma extrusora disponível comercialmente, extrudir os lípidos, forçando todo o primeiro suspensão de lípido através de um filtro de membrana de policarbonato de 0,4 um e depois seis vezes através de um filtro de membrana de 0,1 um. Este processo produz partículas com diâmetros próximos de 100 nm (igual ao tamanho dos poros do filtro).
NOTA: Outros lipídios e rácios de lipídios pode ser preparado usando esta meTHOD. Os lipossomas devem ser armazenadas a 4 ° C durante várias semanas.
3. MSCL Isolamento e Reconstituição
- Streak uma placa de agarose de temperatura, contendo 100 ug / ml de ampicilina, E. coli MJF465 com um plasmídeo portador do gene pB10b V23T MsCl alargado com um marcador 6-His no terminal 3 '(terminal C). Permitir que a placa de cultura durante a noite (12-16 horas) a 37 ° C num incubador estacionário. O plasmídeo é seleccionado para e mantido em células com 100 ug / ml de ampicilina em meio LB padrão. O próximo lugar dia 20 ml de meio LB com 100 ug / ml de ampicilina em uma vesícula cultura (um frasco de 50 ml ou o que está disponível para manter a cultura). Pegue a placa que foi cultivada durante a noite e selecionar uma colônia a partir da placa de transferência (inocular) para o preparado de 20 ml de meio LB com uma vara de inoculação estéril. Permitir que a cultura de 20 ml para crescer durante a noite (12-16 horas) a 37 ° C a 250 rpm num incubador com agitação.
- Decantar a 20 ml overncultura ight em 2-4 L de meio LB. Ampicilina não é mais necessária. Agitar os frascos em uma incubadora com agitação a 250 rpm a 37 ° C até a DO600 atinge 0,5. Adicionar isopropílico β-D-1-tiogalactopiranósido (IPTG) para uma concentração final de 0,6 mM e a cultura deixar passar por mais uma hora (a OD 600 = 0,8-1,0).
- Coloque os frascos no gelo para relaxar as culturas e recolher as bactérias por centrifugação. Use seis tubos cônicos de 400 ml (ou como muitos como permitido pelo rotor utilizado) e centrifugar por 5-8 min a 7438 xg o que é suficiente para sedimentar as bactérias. Decantar o sobrenadante, e repita o procedimento até que todas as células da mídia são colhidas. O número de rotações necessárias variam com base na quantidade de cultura, que foi cultivado e o rotor utilizado. Para uma cultura 2 L só é necessária para girar as células uma vez. Transferir todas as células colhidas para um único tubo de centrífuga.
- Ressuspender as células em peletes de ~ 20 ml de tampão de prensa francesa (KP 100 mMi e 5 mM de MgCl2, pH 7,4). A suspensão deve ser denso (como o creme ou leite). Imediatamente antes francesa de prensagem de adicionar a suspensão do inibidor de protease fluoreto de fenilmetilsulfonilo (PMSF) para uma concentração final de 2 mM e misturar vigorosamente.
- Francês-prima a cultura, numa célula francesa de pressão 35-mL, a 10.000 a 16.000 psi. Girar a suspensão para separar as células não quebradas em 7438 xg, 10 min a 4 ° C.
- Colocar o sobrenadante num tubo separado, e adicionar-lhe a lisozima e ADNase (0,2 mg ml cada /). Deixe tombo sobrenadante durante 10 minutos à temperatura ambiente.
NOTA: DNase é opcional; que reduz a viscosidade para a centrifugação de alta velocidade. A lisozima é crítico; digere os restos da parede celular e ajuda a aumentar o rendimento da extracção da membrana feita com um detergente não desnaturante suave.
- Distribua a mistura de sobrenadante em dois tubos de ultracentrífuga e colocá-los em106,883-153,911 xg (dependendo do rotor) a 4 ° C durante 40 min. Após centrifugação, o sobrenadante é decantado e o sedimento acastanhado no fundo (fracção do total da membrana) pode ser congelado no tubo para o armazenamento a longo prazo (- 80 ° C), ou utilizada para a purificação de proteínas imediato.
- Prepare 0,5-1 L de tampão de alta imidazole: 100 mM de NaCl + 500 mM de imidazole, titula-se até pH 7,2-7,4 com HCl concentrado. Note-se que é uma boa imidazol substância tampão por si só.
- Prepare 0,5-1 L de tampão de baixa imidazole: 100 mM de NaCl, 15 mM de imidazole +, apropriadamente por diluição do tampão anterior com NaCl 100 mM. Não é necessário ajuste de pH.
- Leve 100-150 ml de cada tampão, em frascos separados, e adicionar 1% (w / v) b-glucopiranósido de octilo (OG). Agita-se bem a solução e filtra-se através de um filtro de 0,22 um. Estas soluções são as soluções de cromatografia de baixa e alta-imidazole.
- Preparar tampão de extracção, tomar 50 ml de tampão de baixa-imidazol, e adicionar 3% (w / v)OG e filtrar o buffer.
- Use peletes de membrana de 0,5-2 g de peso fresco para o isolamento de proteínas. Adicionar 5-7 ml de tampão de extracção, ressuspender o sedimento, e homogeneizar num conduzido à mão de vidro e de pistão homogeneizador 30 ml. Com 5-10 movimentos suaves fazer uma suspensão homogénea sem grumos. Tenha cuidado, tensão de cisalhamento é conhecido por causar a desnaturação de proteínas.
- Girar as partículas insolúveis (centrífuga de gama média, do rotor de ângulo fixo, 38,478-68,405 xg, a 4 ° C durante 15 min). Enquanto isso, tomar 3 ml de pérolas de Ni NTA (6 ml) de suspensão e lavá-los uma vez com o tampão de baixo-imidazol (w / o OG), agitando-los em 15 ml com tampa de rosca tubo. Deixe as contas resolver sobre o fundo (~ 5-7 min) ou colocá-los para baixo em 129-201 xg, por um minuto, a 4 ° C. Uma vez que o pelete é formado, decanta-se cuidadosamente o sobrenadante por mão e repetir o procedimento. Equilibrar as contas com 2-3 ml de tampão de extracção OG 3%.
- Misture a mistura homogeneizada (sedimento de membranas e tampão de extracção) a partir de 3.12 com 3-3,5 ml contas de Ni NTA. Deixe a queda mistura num tubo com tampa de rosca de 60 min (lote-loading). Girar os grânulos para baixo em 201 xg (30 seg), decanta-se o sobrenadante à mão, e lava-se os grânulos com 1% de OG tampão de baixa-imidazol uma vez. Agregar as contas como em 3.13 novamente e ressuspender-los em 20-30 ml de tampão low-imidazol fresco.
- Pacote de uma pequena coluna (equipado com um adaptador de fluxo superior) com as contas de Ni NTA, e deixar que as contas se contentar abrindo a torneira para deixar o fluxo de extrato através de (não permitir que as contas para secar). Lave as contas com uma alíquota de 10 ml de tampão low-imidazol (1% OG), com a torneira de paragem aberta.
- Carregue a máquina com cromatografia de baixa e alta-puro tampões de imidazole a cerca de 25 ml de cada um à taxa de fluxo da máquina definida (varia por máquina); isto é feito fazendo passar o tampão de baixa-imidazol por meio do primeiro sistema. Zero o gravador óptica a OD 260 (linha de base). Note-se que o tampão é bastante diferente da água porque imidazol baixo grau tem impurities que absorvem UV. Insira o adaptador de fluxo para a coluna e anexá-lo para a máquina.
- Lava-se a coluna outra vez com tampão de baixa-imidazol (a 1 ml / min) até a densidade óptica do fluxo através vem atinge a linha de base (pode demorar 10-20 mL). Isto remove as proteínas não ligadas provenientes da coluna.
- Aplicar um gradiente linear de imidazol, de 20 a 500 mM, durante 30 minutos, a 1 ml / min. Iniciar a coleta de 4 ml frações quando OD 600 mostra um aumento. As primeiras duas fracções estão cheios de proteínas fracamente ligadas, ao passo que MsCl-6His começa eluição em ~ 40% do gradiente linear. A maioria da proteína aparece nas fracções 3 a 8.
NOTA: um aumento linear de OD será observado devido à crescente% de imidazol. - Reunir as fracções de 3-4, 5-6, e 7-8 em conjunto. Opcionalmente, concentrar as fracções individualmente. Concentram-se as fracções 6-10 vezes usando filtros centrífugos. Depois de 20 minutos de centrifugação a 804 x g e a 4 ° C, a proteína ressuspender cuidadosamente concentrado,a proteína tende a ficar com o filtro.
- Retirar 50 mL alíquotas, misturá-los com tampão de amostra SDS, e verificar a pureza de proteínas por eletroforese em gel PAGE.
NOTA: MsCl irá migrar como uma banda difusa de cerca 17 kDa a parte inferior do gel. - Use as fracções concentradas para quantificar a proteína usando um kit de ensaio de proteína, seguindo as instruções do fabricante. Um rendimento típico a partir de um sedimento de membranas é 0,8 g até 0,2 mg de proteína pura nas fracções combinadas.
- Reconstituir V23T MSCL em lipossomas DPhPC através de diálise. Aqui uma solução a 10 mg / ml de clorofórmio DPhPC e alíquota de 0,5 ml (isto é, 5 mg de lípido) de lo em três de fundo redondo descartáveis (12 x 130 mm) tubos de vidro. Seca-se o lípido sob a corrente de azoto e remover os restos de clorofórmio, sob vácuo (4-6 h).
- Adicionar 15 de 20 mg de OG em pó para o lípido seco em cada tubo, dissolvê-lo em 2 ml de tampão de diálise (KCl, 5 mM de KPi, pH 7,2, 100 mM), vortex, e misonicate ldly. Os lipídios solubilizado-OG deve formar uma solução clara.
- Adicionar soluções concentradas V23T MsCl a cada tubo para atingir 1: 100, 1: 300 e 1: 1.000 proteína e lípido e rácios vórtice bem. Cortar e lavar três peças (~ 12 cm de comprimento) de tubo de diálise (MWCO 8000, 7.5 mm de diâmetro, tem três pares de clips numeradas prontos.)
- Coloque as misturas de lípido-proteína solubilizada no interior do tubo, cuidadosamente fechar as extremidades com grampos, e dializar contra 2 L de tampão (100 mM de KCl, 5 mM de KPi, pH 7,2) durante 48 h a 4 ° C, com quatro mudanças do tamponar a cada 12 h. Após diálise, os PROTEO-lipossomas estão prontos.
NOTA: A solução de lipossomas pode ser suplementado com 2 mM de NaN3 (azida de sódio) e armazenadas a 4 ° C. Evite congelamento.
4. Fabricação de o reservatório de óleo
- Faça dois furos opostos (1,0 mm de diâmetro) todo o caminho através da parede de um diâmetro de 2 polegadas, 1,5 cm de comprimento acrílico cylinder a 1 cm a partir da parte inferior (Figura 1A).
- Faça dois furos concêntricos de 4 mm ao previamente perfurados orifícios de 1 mm. As profundidades dos furos deve ser de 1 mm cada (certifique-se de não perfurar todo o caminho). Estes buracos são feitas para caber as juntas de borracha.
- Colocar e cola de borracha dois empanques tendo diâmetros internos de 1 mm nos orifícios maiores, a fim de impedir que o óleo de vazamento.
- Cole o cilindro usinado para um 10 cm x 10 cm chapa acrílica fina usando qualquer epoxy multiuso (Figura 1).
No dia da experiência:
5. Preparação de eletrodos
- Cortar um comprimento de 7 cm de dois fios de prata de 250 micrometros de diâmetro e, em seguida, mergulhar as suas pontas em lixívia durante duas horas para formar um revestimento de prata-cloreto (AgCl). Uma cor cinza indica que um revestimento de AgCl foi formada (Figura 2E).
- Usando um cortador de vidro, dividir um 10 cm de comprimento, 1 / 0,58 OD / ID mm capil classe de borosilicatolary em duas 5 cm capilares.
- Usando uma agulha Microfil 34 calibre encher os capilares com o hidrogel PEG-DMA. Para evitar que o hidrogel hidratado de inchaço fora do capilar, mantenha uma distância de três milímetros nas pontas e verifique se não há bolhas de ar nos capilares.
- Insira os eléctrodos Ag / AgCl no hidrogel preenchido capilares (Figura 2E).
- Curar o hidrogel de PEG-DMA através fotopolimerização de radicais livres por exposição à luz UV durante 2 min a 1 W utilizando uma pistola de mancha UV.
6. Configuração do Experimento
NOTA: O experimento é a instalação sob uma gaiola de Faraday aterrado para uma ligação à terra no amplificador patch.
- Anexar uma das micropipetas a um detentor de microeletrodos em linha reta que tem um conector macho (Figura 2E).
- Ligue o suporte do microeléctrodo para o andar de entrada do amplificador de patch (Figura 2A). Para conectar o headstage ao chão, solde um fio de cobre isolado de calibre 18 a um conector apropriado para o headstage.
- Monte o headstage em um manual de 3 eixos micromanipulador. Fixe a placa de montagem headstage (que deve ser comprado juntamente com o micromanipulador ou feitos em uma loja de máquina) para o micromanipulador e, em seguida, conecte o headstage à placa de montagem usando parafusos adequados.
- Fixar a segunda micropipeta para o actuador linear por meio de um conector feito em laboratório e depois em montar tanto um segundo micromanipulador (Figura 2B). As micropipetas devem ser opostas uma à outra, alinhadas e horizontalmente nivelado. Nota: a marca eo estilo dos manipuladores, não importa.
- Em um frasco de vidro, misturar 0,1 ml de lipossomas DPhPC com 0,01 ml da solução de proteolipossoma V23T MsCl.
NOTA: Este passo é necessário para reduzir a proporção entre proteína e lípido (~ 0,0002), o que é crítico para a formação de um lípido estável bilayer.
- Usando um Microfil agulha 34 gauge, preencher as pontas de ambos os micropipetas com proteolipossoma solução (Figura 3A).
- Coloque reservatório no topo de um microscópio vertical, e alimentar as micropipetas através dos orifícios opostos de 1 mm (Figura 2B). NOTA: qualquer microscópio poderia ser utilizado, desde as gotículas pode ser claramente visto.
- Encher reservatório para a superfície com Hexadecano (99%). O Hexadecano não precisa de purificação adicional.
- Para formar as gotículas esféricas na ponta das micropipetas, usar um terceiro 10 um de diâmetro micropipeta de vidro de borossilicato, montado sobre um terceiro micromanipulador, para dispensar V23T solução diluída MsCl proteolipossoma (~ 0,00052 ml) nas pontas das micropipetas e formar o gotas (Figura 3).
- Controlar o tamanho das gotículas (por decréscimo ou aumento do volume) na forma desejada e deixar repousar durante 10 minutos para as monocamadas para formar completamente (Figura 3).
- Traga as gotículas em contacto, formação em bicamada irá ocorrer dentro de 1 a 2 min.
7. Configurando o Software e Equipamentos
- Prepare o software rodando nos computadores, microscópio, controlador oscilador piezoelétrico, geradores de funções, amplificador remendo, eo sistema de aquisição de dados de baixo ruído.
NOTA: qualquer amplificador de patch poderia ser usado e as seguintes instruções são especificamente para o que usamos e que está listado na lista de materiais e equipamentos. - No painel frontal do amplificador de patch, configure os botões "Mode" para VHOLD / IHOLD e V-Clamp.
- No painel frontal definir o "Lowpass" filtro de Bessel a 1 kHz e saída de ganho para 2.
- Defina o "Configuração" para células inteiras β = 1.
- Certifique-se o resto dos botões são postos a zero ou na posição neutra.
- Amostra de todas as medições de corrente DIB a 5 kHzcom um 1 kHz Bessel filtro anti-aliasing.
- Executar o software clicando duas vezes no ícone na área de trabalho.
- Clique em "Configurar> digitador" para abrir o diálogo "digitador", e em seguida, clique no botão "Alterar".
- Na caixa de diálogo "Alterar digitador", selecione "Digidata 1440 Series" da lista de "digitador Type".
- Clique no botão Scan para detectar o digitalizador.
- Clique em "OK" para sair do diálogo "Alterar digitador" e clique em "OK" para sair do diálogo "digitador".
- Clique em "Configurar> Lab Bench".
- Na guia Sinais de entrada do banco de laboratório, selecione Analog em um digitador sob Channels. Defina o fator de escala para 0,002.
8. A formação da bicamada lipídica
- Usando um cabo BNC, conecte a saída de awaveform gerador para a frente de entrada de comando externo ligado (no painel traseiro do sistema de aquisição de dados). Enviar um pk-to-pk forma de onda triangular 10 Hz, 500 mV para a headstage.
- Usando o micromanipulador, mover as micropipetas de vidro horizontalmente para trazer gotas em contato até que ligeiramente tocar e esperar por bicamada diluindo a ocorrer (geralmente em torno de 1 a 2 min) (Figuras 3C e 3D).
NOTA: A progressão do processo de formação de duas camadas pode ser visto visualmente através de um microscópio e pode ser monitorizado por medição de corrente (Figura 4).
- Ajustar o tamanho da bicamada (~ 250 um de diâmetro) através do controlo da posição da gotícula montado no actuador, utilizando o micromanipulador. Nota: o tamanho bicamada pode ser estimado visualmente através de um microscópio. Este método faz com que seja mais fácil para o pesquisador para controlar o tamanho da bicamada por facilmentemover as gotículas utilizando os micromanipuladores.
9. excitação dinâmica e MSCL Gating
- Uma vez que a bicamada formou e é estável (ou seja, a bicamada não está quebrando ou condutora), estimular as gotículas através do envio de um sinal sinusoidal utilizando um gerador de função.
- Para estimular a proteína MSCL incorporados na bicamada, envie uma forma de onda senoidal com uma amplitude 175 um pico-a-pico, a freqüência de 0,2 Hz, e 50% ciclo de trabalho para o servo-controlador piezoelétrico. (Diversos tipos de formas de onda pode ser enviado com amplitudes diferentes, freqüências e ciclo de trabalho)
10. Tratamento e interpretação de resultados
- Salve as medições de corrente, gravadas usando o sistema de aquisição de dados, em formato .ABF. Importar dados (em formato .ABF) para Matlab usando um arquivo de função "abfload", em seguida, analisar e processar os dados. O arquivo "abfload" está disponível gratuitamente online.
- Estimativa tele tensão na bicamada e expansão de área das gotículas, usando vídeos da gotícula durante ciclos completos de accionamento que são gravados utilizando uma câmara apropriada.
- Processo de vídeos em Matlab, através do processamento de quadros individuais usando técnicas de processamento de imagem para estimar a área da interface água / óleo, bem como o ângulo entre as gotículas. NOTA: 2D utilizando um quadro de vídeo a partir da tomada, detectar a interface óleo-água (isto é, a borda da gotícula) e, em seguida, estimar a área da superfície por revolução.
Resultados
As Figuras 1 e 2 mostram a configuração e equipamento experimental utilizado para registar a actividade da proteína no decurso da estimulação mecânica da membrana bicamada lipídica. Para minimizar ruídos elétricos em nossas medições, a estação de trabalho é colocado dentro de uma gaiola de Faraday fez-lab, aterrado para uma ligação à terra na Axopatch 200 B amplificador.
A formação de uma bicamada lipídica estável isolante é um passo chave neste estudo. Neste arranjo, uma monocamada lipídica monta na interface óleo / água das gotículas aquosas imerso num banho de um solvente orgânico. Quando as gotículas são colocadas em contacto, o excesso de óleo é eliminada, e as monocamadas lipídicas finas opostas a uma de duas moléculas de espessura bicamada lipídica. A técnica mais comum utilizada na caracterização da bicamada é de tensão-grampo. Com tensão-grampo, a tensão através da bicamada é mantida a um valor constante, enquanto a corrente é medida. A Figura 4 retrata uma gravação de corrente em tempo real típica de formação de bicamada inicial. Sabendo a capacitância específica (~ 0,6 uF / cm 2) 5 da bicamada lipídica DPhPC, a área da bicamada formado podia ser calculada. A área da bicamada pode ser controlado alterando a posição das gotículas (Figura 4A). Usando o actuador piezoeléctrico, diferentes tipos de formas de onda (senoidal, quadrada, triangular, etc.) Em diferentes frequências, amplitudes, e os ciclos de funcionamento podem ser aplicados para as gotas para horizontalmente e axialmente oscilar eles e, assim, a tensão de duas camadas e a área pode ser alterada (Figura 4B).
Quando o DIB é estimulada mecanicamente, mantendo ao mesmo tempo um potencial DC constante em toda a membrana, um limiar baixo (ganho de função) mutante V23T de MsCl gera actividades fiáveis, incluindo estados principalmente sub-condutoras e eventos de abertura ocasionalmente completos (Figura 5) . Estes eventos são idênticos aos registados utilizando a técnica de patch-clamp de membranas internas intactas de E. coli e lipossomas reconstituídos com o V23T purificada MsCl. Os resultados na Figura 5 gating provar que ocorre em resposta a um aumento da tensão, uma vez que todos os picos de corrente são observados no pico de compressão. Na compressão de pico, a expansão de área relativa das gotículas é máxima e, por conseguinte, a tensão na interface é máxima.
Alameticina, um canal de iões dependentes da voltagem e uma das mais estudadas péptidos, aumenta a permeabilidade da membrana, quando uma tensão de CC é aplicada através da membrana 36. A capacidade da interface bicamada lipídica para acolher as proteínas de transmembrana e os péptidos também é testado através da realização de gravações de corrente-tensão gating usando alameticina péptido. Alameticina é misturado com a solução de fosfolípido para uma concentração final de 100 ng / ml. A Figura 6 mostra as medições de corrente sob fixador de tensão (115 mV). As gotículas nesta experiência são separadas, a fim de alcançar a interface de bicamada pequena e, portanto, resistência mais elevada e menor capacitância. O comportamento de propagação do péptido Alameticina é mostrada através dos passos discretos de corrente (Figura 6). O histograma no lado direito do gráfico mostra as alterações na condutância do nível de base (0,0962 NS), que é, basicamente, o primeiro nível de condutibilidade do próprio canal.

Figura 1:. Um esquema que descreve as partes principais e as dimensões do reservatório de óleo O reservatório de óleo é fabricado na oficina mecânica na Universidade Virginia Tech. É constituída por um tubo cilíndrico maquinado acrílico colada à superfície de uma folha de acrílico. As dimensões e design pode ser modificado para acomodar diferentes aplicações ou mais de duas micropipetas."Target =" _ blank /53362/53362fig1large.jpg "> Clique aqui para ver uma versão maior desta figura.
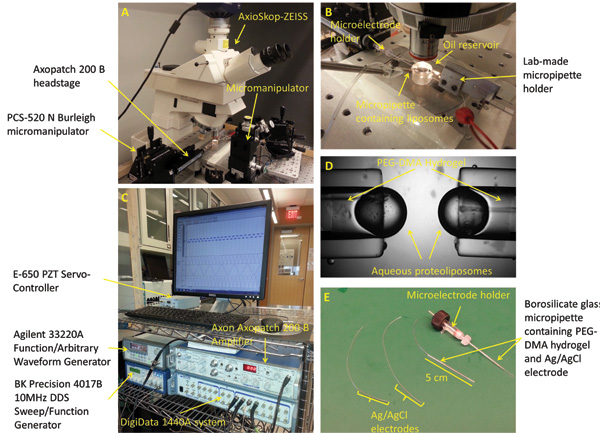
Figura 2:. Preparação e configuração micropipetas Experimental (A) A estação de trabalho padrão para a formação, mecanicamente estimulando, e caracterizar as duplas camadas de interface inclui um microscópio, manipuladores de 3 eixos, uma câmera digital, oscilador piezoelétrico, mesa de isolamento de vibração, e uma gaiola de Faraday (não mostrado). (B) A montagem experimental é constituído por dois opostos PEG-DMA hidrogel preenchido micropipetas horizontalmente posicionado dentro de um banho de óleo Hexadecano. Cada uma das micropipetas contém um eléctrodo de Ag / AgCl para proporcionar ligação eléctrica. Um terceiro micropipeta cheia com solução de proteolipossoma é utilizado para formar as gotículas na ponta dos outros micropipetas. (C) A resposta actual DIB poderia ser medidoutilizando uma combinação do amplificador de patch e o sistema de aquisição de dados de baixo ruído. (D) Uma fechada acima da imagem que mostra as gotículas aquosas formadas na ponta das micropipetas. Eléctrodos (E) de Ag / AgCl são feitas mergulhando a ponta de dois fios 250 um de prata em água sanitária. Os eléctrodos são então alimentados através de dois capilares de vidro de borossilicato cheios com PEG-DMA hidrogel, que é curado com luz UV para solidificar. Um detentor de microeletrodos em linha reta com conector macho é utilizado para conectar uma das micropipetas ao headstage do amplificador de patch.
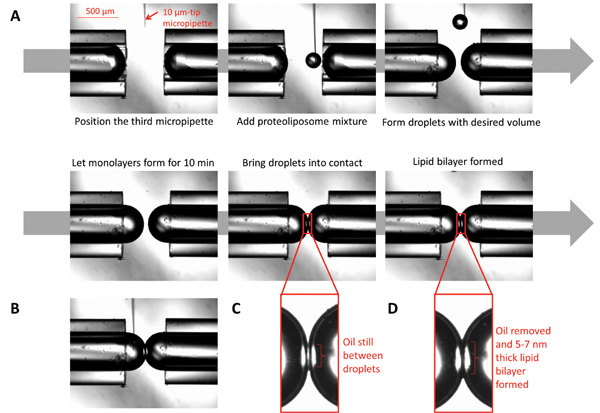
Figura 3:. Imagens que ilustram a formação de bicamadas de interface de gotículas (A) Um 10 um micropipeta cheia com proteolipossomas está posicionado sob o microscópio na proximidade das pontas micropipeta. Usando uma seringa ligada ao micropipeta, dispensar pequenos volumesdos proteolipossomas para formar gotas esféricas para volume desejado. Deixe o formulário monocamada, permitindo que as gotas se sentar por dez min. Traga as gotas em contato; bicamada irá formar após todo o óleo na interface é eliminada. (B) Embora a bicamada é formada, a composição química em ambos os lados da interface pode ser controlada através da injecção de produtos químicos desejados utilizando uma micropipeta de micro porte. (C) As gotículas no momento do primeiro contato. (D) As gotículas quando a bicamada de lípido é formado.
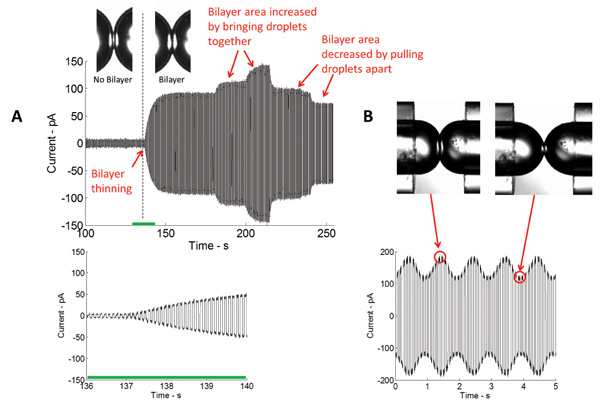
Figura 4: Real-time medições mostram tanto o desbaste inicial e subsequente expansão da interface (A) A corrente medida no decurso de formação de duas camadas por meio da aplicação de um potencial eléctrico triangular.. A magnitude da corrente medida é directamente proporcional à capacitância, e assim a área da interface bicamada. Quanto mais perto as gotas são reunidas, maior a área da interface e vice-versa. (B), após aplicação de excitação mecânica, a área da interface de duas camadas aumenta e diminui na mesma frequência que o sinal de estimulação.
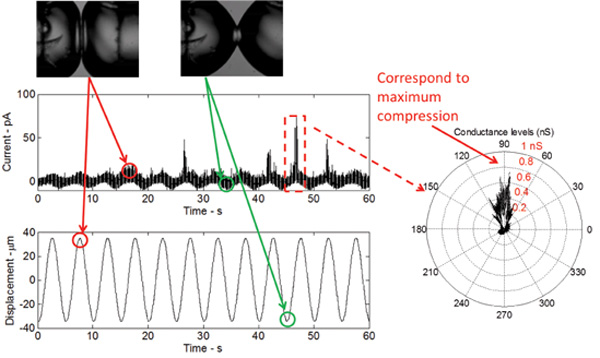
Figura 5:. Medições em tempo real mostra a resposta da bicamada de excitação mecânica, bem como a propagação do mutante V23T de MsCl A forma da resposta da corrente é sinusoidal, a qual se refere a uma mudança sinusoidal em bicamada capacitância como um resultado de a mudança área bicamada. Os picos de corrente, que ocorrem no pico de cada ciclo, indicam sub-condutância propagação do mutante V23T. Um diagrama polar indica ainda que gating ocorre no pico de compressão, o que reflecte um aumento da tensão na interface bicamada.
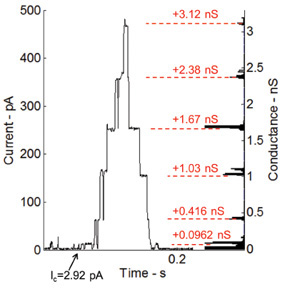
Figura 6:. Medições atuais sob braçadeira de tensão e histograma correspondente de níveis de condutância para a actividade de selecção de canais alameticina incorporados O comportamento gating do peptídeo Alameticina é mostrado através do aumento gradual discreto na atual. Os níveis de condutância combinar muito bem com medições anteriores realizados por nosso grupo de pesquisa na Virginia Tech 7.
Discussão
Mechanosensation significa uma das primeiras vias de transdução sensoriais que evoluíram em organismos vivos. Usando esse fenômeno para estudar e compreender as propriedades mecano-elétrica do DIB, é um passo crucial para materiais de estímulos de resposta funcionais. Ela envolve a incorporação e a activação de um canal mechanosensitive, MsCl, no DIB como um transdutor mecanoelétrica e um medidor de tensão para detectar o aumento da tensão na interface bicamada lipídica. Em outra nota, a função de canais MS pode ser regulado através das propriedades do material de base de bicamadas lipídicas, incluindo a espessura, curvatura intrínseca, e compressibilidade. À luz do acima referido, a técnica baseada no micropipeta fornece uma ferramenta valiosa permitindo que o investigador a capacidade para estudar os canais MS em DIB e proporciona perspectivas sobre a estrutura da bicamada lipídica, bem como as interacções lípido-proteína.
Nos últimos três décadas, de patch-clamp foi o principal método para estudar MS canais, uma vez que permite a fixação de tensão e a tensão. No entanto, patch-clamp requer equipamento volumoso e não é adequado para a miniaturização, uma propriedade necessária para a engenharia de dispositivos sensoriais e de conversão. DIB, devido à sua simplicidade, estabilidade, compacidade e representam um ambiente adequado para o estudo da actividade de MsCl. Aqui, estendemos avanços nas técnicas anteriores de formação de DIB, propondo uma técnica baseada na micropipeta, com a capacidade para controlar o tamanho das gotículas e a interface de camada dupla, a composição química de cada gotícula, e a tensão na interface através da estimulação dinâmica. A técnica consiste em ancorar gotículas aquosas, contendo proteoliposomes, até as pontas dos coaxialmente opostas capilares de vidro. As gotículas são colocadas em um banho de dissolvente orgânico e, quando trazido em contacto de formas bicamada lipídica na interface.
As micropipetas estão ligados a posciladores iezoelectric, permitindo o deslocamento horizontal das gotículas. Dinamicamente comprimindo as gotículas, resulta num aumento da tensão interfacial na interface do óleo e da água, por conseguinte, um aumento da tensão bicamada. Dois aspectos principais diferenciam este método do semelhante e recentemente publicado contato bolha bicamada (CBB) técnica 37. Usando a técnica aqui apresentada, o tamanho da bicamada é controlado utilizando micromanipuladores e, assim, os volumes das gotículas permanecem constantes, ao contrário do método CBB. Além disso, a técnica CBB apela para bombas de pressão, que não são necessários no método apresentado neste trabalho tornando-o mais simples e mais fácil de construir.
Nós somos capazes de incorporar e estimular bacteriana MsCl para o primeiro tempo, sem a utilização de uma pipeta patch ou modificações químicas 38. Uma vez que o sistema possibilita a formação de membranas de bicamada lipídica assimétricos robustas, que imita mais de perto a lassimetria IPID encontrado em membranas biológicas. Isso nos permite estudar os efeitos da composição da membrana controlada ou assimetria na atividade de MSCL. Além disso, por meio de técnicas de processamento de imagem, este método ajuda a estimar a tensão na interface bicamada. Esta técnica auxiliam na compreensão dos princípios da interconversão entre as forças de superfície em massa e o DIB, facilita as medições de propriedades fundamentais de membrana, e melhora a compreensão da resposta MsCl a membrana de tensão.
Embora este método nos dá um passo para mais perto de um sistema de material de estímulos-responsivo biomolecular e a um ambiente fisiológico diferente para estudar MsCl, existem limitações para o sistema. A tensão neste sistema não pode ser fixada devido à presença do reservatório de lípidos sob a forma de lipossomas em cada gotícula, o que tende a aliviar a tensão na interface óleo / água. Portanto, no presente canais mechanosensitive pode ser estimuladaem DIBs única em regime dinâmico. A presença de bolhas de ar no sistema afeta significativamente a precisão e reprodutibilidade dos experimentos. As bolhas de ar presentes nos hidrogéis pode resultar perda se a ligação eléctrica.
Enquanto que descrevem a utilização do método baseado micro-pipeta para a estimulação de MsCl, a técnica pode ser utilizada para estudar outros tipos de canais de MS e tem o potencial para ser usado por investigadores a estudar uma variedade de biomoléculas. Por exemplo, a configuração semelhante foi usado no nosso laboratório para estudar a resposta mecanoelétrica de uma membrana de bicamada de interface gotícula livre de canal. Várias proteínas poderia ser reconstituído e ativado usando esta configuração altamente controlado, levando em consideração que os ambientes de reconstituição de cada biomolécula variar. O método descrito neste artigo aborda um potencial de aplicação consideravelmente maior que é limitada apenas à imaginação do pesquisador.
Divulgações
Os autores não têm nada a revelar.
Agradecimentos
Pesquisa relatada nesta publicação é apoiada pelo escritório da força aérea da Scientific Research Initiative Básico Grant FA9550-12-1-0464.
Materiais
| Name | Company | Catalog Number | Comments |
| 0.22 µm filter | Corning | 430624 | |
| 1,2-diphytanoy-sn-glycero-3-phosphocholine (DPhPC) | Avanti Polar Lipids | 850356P | Purchased as lyophilized powder |
| 34-gauge microfil | World Precision Instruments | MF24G-5 | |
| 400 mL Centrifuge bottels | ThermoFisher | 3141 | Nalgene |
| Agilent Function/Arbitrary Waveform Generator, 20 MHz | Keysight Technologies | 33220A | |
| Ampicillian | ThermoFisher | BP1760 | ACS Grade |
| Avanti® Mini-Extruder | Avanti Polar Lipids | 610000 | |
| Axio Scope.A1 | Carl Zeiss | - | |
| AxioCam HSm | Carl Zeiss | - | |
| Axopatch 200B Amplifier | Molecular Devices | - | |
| BCA protein assay kit | Pierce | 23225 | |
| BK Precision 4017B 10 MHz DDs Sweep/Function Generator | Digi-Key | BK4017B-ND | |
| Borosilicate Glass Capillaries | World Precision Instruments | 1B100F-4 | |
| Dialysis tubing | 7 Spectra/Por | 132113 | MWCO 8000, 7.5 mm diameter |
| DigiData 1440A system | Molecular Devices | - | |
| DNAse | Sigma-Aldrich | DN25 | |
| DPhPC | Avanti | 850356C | |
| E-625 PZT Servo-Controller | Physik Instrumente | E-526 | |
| FPLC System | Pharmacia Biotech | - | |
| HCl | J.T. Baker | 9535-33 | |
| Hexadecane, 99% | Sigma-Aldrich | 544-76-3 | |
| Homoginizer | Wheaton | 357426 | 15 mL |
| Imidazole | Sigma-Aldrich | I5513 | |
| IPTG | Affymetrix | 17886 | |
| IRGACURE® 2959 | IRGACURE® | 555047962 | |
| Isopore Membrane Filters | EMD Millipore | VCTP02500 | |
| Isopropyl Alcohol | VWR International | BDH1133-4LP | |
| KCl | Sigma-Aldrich | P3911 | ACS Grade |
| KH2PO4 | Mallinckrodt | 7100 | ACS Grade |
| Kimble-Chase | Kontes | 420401-1515 | Flex-Column |
| LED-100 UV Spot Curing System | Electro-Lite, corp. | 81170 | |
| Lysozyme | Sigma-Aldrich | L6876 | |
| Manual Patch-Clamp Micromanipulators | Thorlabs | PCS-520N | |
| MgCl2 | ThermoFisher | M33 | ACS Grade |
| Microelectrode Holder | World Precision Instruments | MEH1S | |
| Micropipette Puller | Sutter Instruments | P-1000 | |
| MOPS, minimum 99.5% titration | Sigma-Aldrich | M1254-100G | |
| N2 Gas | Airgas | UN1066 | |
| NaCl | EMD | SX0420-1 | ACS Grade |
| Ni NTA agarose beads | Qiagen | 1000632 | |
| Optically Clear Cast Acrylic Tube, 2-1/2" OD x 2" ID | McMaster-Carr | 8486K545 | |
| P-601 PiezoMove Flexure-Guided Linear Actuator | Physik Instrumente | P-601 | |
| PAGE gel | Bio-Rad | 456-9033 | |
| Parafilm M® All-Purpose Laboratory Film | Parafilm® | PM999 | |
| Phenylmethylsulfonyl fluoride | Sigma-Aldrich | P7626 | |
| Poly(ethylene glycol)1000 dimethacrylate | Polysciences, Inc. | 15178-100 | |
| Polycarbonate (PCTE) Membrane Filters, Black, 0.4 Micron, 25mm, 100/Pk | Sterlitech Corporation | PCTB0425100 | |
| Potassium Chloride | Sigma-Aldrich | P5405-500G | |
| Powder Free Soft Nitrile Examination Gloves | VWR International | CA89-38-272 | |
| Replacement Gasket 1.0mm | World Precision Instruments | GO1-100 | |
| SDS | Sigma-Aldrich | L5750 | |
| Silver wire | GoodFellow | 147-346-94 | Different diameters could be used depending on the application |
| Sodium Azide | Affymetrix | 21610 | |
| Test tubes | ThermoFisher | 14-961-27 | 12 x 130 mm |
| Tryptone | ThermoFisher | BP1421 | |
| Ultracal 30K | Millipore | UFC803024 | Amicore Ultra 30 MWCO |
| VWR Light-Duty Tissue Wipers | VWR International | 82003-820 | |
| VWR Scientific 50D Ultrasonic Cleaner | VWR International | 13089 | |
| Water Purifier | Barnstead | D11931 | |
| Yeast | ThermoFisher | BP1422 | |
| β-octylglucopyranoside | Anatrace | O311S |
Referências
- Montal, M., Mueller, P. Formation of bimolecular membranes from lipid monolayers and a study of their electrical properties. P NATL ACAD SCI USA. 69, 3561-3566 (1972).
- Tsofina, L., Liberman, E., Babakov, A. Production of bimolecular protein-lipid membranes in aqueous solution. Nature. , (1966).
- Funakoshi, K., Suzuki, H., Takeuchi, S. Lipid Bilayer Formation by Contacting Monolayers in a Microfluidic Device for Membrane Protein Analysis. ANAL CHEM. 78, 8169-8174 (2006).
- Holden, M. A., Needham, D., Bayley, H. Functional bionetworks from nanoliter water droplets. J AM CHEM SOC. 129, 8650-8655 (2007).
- Hwang, W. L., Chen, M., Cronin, B., Holden, M. A., Bayley, H. Asymmetric droplet interface bilayers. J AM CHEM SOC. 130, 5878-5879 (2008).
- Maglia, G., et al. Droplet networks with incorporated protein diodes show collective properties. Nat Nano. 4, 437-440 (2009).
- Sarles, S. A., Stiltner, L. J., Williams, C. B., Leo, D. J. Bilayer formation between lipid-encased hydrogels contained in solid substrates. ACS APPL MATER INTER. 2, 3654-3663 (2010).
- Sarles, S. A., Leo, D. J. Regulated attachment method for reconstituting lipid bilayers of prescribed size within flexible substrates. ANAL CHEM. 82, 959-966 (2010).
- Sarles, S. A. . Physical Encapsulation of Interface Bilayers. , (2010).
- Sarles, S. A., Leo, D. J. Membrane-based biomolecular smart materials. SMART MATER STRUCT. 20, 094018 (2011).
- Sarles, S. A. The use of virtual ground to control transmembrane voltages and measure bilayer currents in serial arrays of droplet interface bilayers. SMART MATER STRUCT. 22, 094023 (2013).
- Sarles, S. A., Leo, D. J. Cell-inspired electroactive polymer materials incorporating biomolecular materials. SPIE Smart Structures and Materials+ Nondestructive Evaluation and Health Monitoring. , 797626 (2011).
- Hwang, W. L., Chen, M., Cronin, B., Holden, M. A., Bayley, H. Asymmetric droplet interface bilayers. Journal of the American Chemical Society. 130, 5878-5879 (2008).
- Bayley, H., et al. Droplet interface bilayers. MOL BIOSYST. 4, 1191-1208 (2008).
- White, S. H. Analysis of the torus surrounding planar lipid bilayer membranes. BIOPHYS J. 12, 432 (1972).
- Tien, H. T., Ottova, A. L. The lipid bilayer concept and its experimental realization: from soap bubbles, kitchen sink, to bilayer lipid membranes. J MEMBRANE SCI. 189, 83-117 (2001).
- Perozo, E. Gating prokaryotic mechanosensitive channels. NAT REV MOL CELL BIO. 7, 109-119 (2006).
- Kung, C., Martinac, B., Sukharev, S. Mechanosensitive channels in microbes. ANNU REV MICROBIOL. 64, 313-329 (2010).
- Bialecka-Fornal, M., Lee, H. J., DeBerg, H. A., Gandhi, C. S., Phillips, R. Single-cell census of mechanosensitive channels in living bacteria. PLoS ONE. 7, e33077 (2012).
- Levina, N., et al. Protection of Escherichia coli cells against extreme turgor by activation of MscS and MscL mechanosensitive channels: identification of genes required for MscS activity. The EMBO Journal. 18, 1730-1737 (1999).
- Chiang, C. -. S., Anishkin, A., Sukharev, S. Gating of the large mechanosensitive channel in situ: estimation of the spatial scale of the transition from channel population responses. BIOPHYS J. 86, 2846-2861 (2004).
- Anishkin, A., Chiang, C. -. S., Sukharev, S. Gain-of-function mutations reveal expanded intermediate states and a sequential action of two gates in MscL. J GEN PHYSIOL. 125, 155-170 (2005).
- Sukharev, S. I., Sigurdson, W. J., Kung, C., Sachs, F. Energetic and Spatial Parameters for Gating of the Bacterial Large Conductance Mechanosensitive Channel, MscL. J GEN PHYSIOL. 113, 525-540 (1999).
- Deplazes, E., Louhivuori, M., Jayatilaka, D., Marrink, S. J., Corry, B. Structural investigation of MscL gating using experimental data and coarse grained MD simulations. PLOS COMPUT BIOL. 8, e1002683 (2012).
- Kubalski, A., Martinac, B. . Bacterial ion channels and their eukaryotic homologs. , (2005).
- Chang, G., Spencer, R. H., Lee, A. T., Barclay, M. T., Rees, D. C. Structure of the MscL homolog from Mycobacterium tuberculosis: a gated mechanosensitive ion channel. Science. 282, 2220-2226 (1998).
- Steinbacher, S., Bass, R., Strop, P., Rees, D. C. Structures of the prokaryotic mechanosensitive channels MscL and MscS. Mechanosensitive Ion Channels, Part A. , 1-24 (2007).
- Sukharev, S., Durell, S. R., Guy, H. R. Structural models of the MscL gating mechanism. BIOPHYS J. 81, 917-936 (2001).
- Perozo, E., Cortes, D. M., Sompornpisut, P., Kloda, A., Martinac, B. Open channel structure of MscL and the gating mechanism of mechanosensitive channels. Nature. 418, 942-948 (2002).
- Betanzos, M., Chiang, C. -. S., Guy, H. R., Sukharev, S. A large iris-like expansion of a mechanosensitive channel protein induced by membrane tension. NAT STRUCT MOL BIOL. 9, 704-710 (2002).
- Corry, B., Jayatilaka, D. Simulation of structure, orientation, and energy transfer between AlexaFluor molecules attached to MscL. BIOPHYS J. 95, 2711-2721 (2008).
- Wang, Y., et al. Single Molecule FRET Reveals Pore Size and Opening Mechanism of MscL. eLife. 3, e01834 (2014).
- Anishkin, A., Akitake, B., Kamaraju, K., Chiang, C., Sukharev, S. Hydration properties of mechanosensitive channel pores define the energetics of gating. J Phys Condens Matter. 22, 454120 (2010).
- Koçer, A., Walko, M., Meijberg, W., Feringa, B. L. A light-actuated nanovalve derived from a channel protein. Science. 309, 755-758 (2005).
- Najem, J., Dunlap, M., Sukharev, S., Leo, D. J. Mechanosensitive Channels Activity in a Droplet Interface Bilayer System. MRS Proceedings. 1621, (2014).
- Fox, R. O., Richards, F. M. A voltage-gated ion channel model inferred from the crystal structure of alamethicin at 1.5-Å resolution. Nature. 300, 325-330 (1982).
- Iwamoto, M., Oiki, S. Contact Bubble Bilayers with Flush Drainage. Sci Rep. 5, (2015).
- Barriga, H. M., et al. Droplet interface bilayer reconstitution and activity measurement of the mechanosensitive channel of large conductance from Escherichia coli. J R Soc Interface. 11, 20140404 (2014).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados