Method Article
Extração seqüencial de solúveis e insolúveis alfa-sinucleína de Brains parkinsonianos
Neste Artigo
Resumo
Here, we present a protocol for the isolation of increasingly insoluble/aggregated alpha-synuclein (α-syn) from post-mortem human brain tissue. Through the utilization of buffers with increasing detergent strength and high-speed ultracentrifugation techniques, the variable properties of α-syn aggregation in diseased and non-diseased tissue can be examined.
Resumo
Alfa-sinucleína (α-syn) proteína é abundantemente expresso principalmente nos neurónios, e existe num número de formas diferentes - monómeros, oligómeros, tetrâmeros e fibrilas. Durante a doença, α-syn sofre alterações conf ormacionais para formar oligómeros e agregados de peso molecular elevado que tendem a tornar a proteína mais insolúvel. Anormalmente agregada α-syn é uma característica neuropatológica da doença de Parkinson (DP), demência com corpos de Lewy (DLB) e atrofia de múltiplos sistemas (MSA). Caracterização e análise de buffers usando Syn-ct insolúveis com o aumento da força do detergente e ultracentrifugação alta velocidade Biochemical proporciona uma ferramenta poderosa para determinar o desenvolvimento da patologia α-syn associada com a progressão da doença. Este protocolo descreve o isolamento de cada vez mais insolúveis / agregado α-syn partir de tecido de cérebro humano post-mortem. Esta metodologia pode ser adaptada, com modificações para estudos de α normal e anormalbiologia -syn em modelos animais transgénicos que albergam diferentes mutações Syn-ct, bem como em outras doenças neurodegenerativas que apresentam depósitos de proteínas fibrilares aberrantes relacionadas com as respectivas patologias.
Introdução
Uma das características patológicas comuns fundamentais entre várias doenças neurodegenerativas é a formação de agregados de proteínas anormais que ocorre numa proteína / doença modo específico 1. Assim, existem as características de placas de amilóide-beta e extraneuronais depósitos agregados tau hiperfosforiladas dentro de neurónios na doença de Alzheimer (AD); os depósitos syn-alfa agregados em Lewy Corpos (LBS), que são inclusões intraneuronais, e também no âmbito de processos distróficos neuronal chamado Lewy neurites (LNs) em PD, PD demência e demência com corpos de Lewy (DLBs) 2-4. Depósitos syn-alfa anormais também são vistas nas lesões da indicação de inclusões citoplasmáticas gliais em MSA 5. Na doença de Huntington, existem os depósitos de poli-Q característicos, e de ligação de ADN anormal Tar-43 e proteína fundidas em proteínas de sarcoma (FUS) são depositados na demência fronto-temporal. Importante para a DP, mutações no gene α-syn foram encontrados para cause autossômica dominante PD 11/06. Além disso, o gene triplicação α-syn 12 e 13 também causa a duplicação PD familiar ligando deste modo o aumento da expressão α-syn para os patomecanismos de PD. Notavelmente, casos de DP tanto esporádica e familiar abrigar depósitos anormais de α-syn patologia 14. Atuais tratamentos disponíveis para PD são apenas paliativos e não têm nenhum efeito sobre como travar ou atrasar a progressão da doença inexorável.
α-syn é expressa abundantemente no cérebro humano e torna-se cerca de 1% da proteína total do cérebro. Ela está presente, mais especificamente, dentro dos neurônios, mas pode existir embora em quantidades menores dentro das células gliais. Um ponto controverso é a estrutura nativa de α-syn que pode existir como um monómero ou aleatória 15 como um tetrâmero dobrado 16. Durante a doença, α-syn muda a sua conformação que lhe permite obter misfolded e este processo é pensado para ser a causa da doença pathogenesis. Apesar de vários anos de investigações sobre os aspectos fisiopatológicos da α-syn e da doença, as causas exatas da doença mecanismos permaneceram indescritíveis 14.
Estudos utilizando análise post-mortem dos cérebros de Parkinson têm até agora forneceu pistas importantes sobre a biologia normal e anormal de ambos em PD esporádica e também syn-α PD associado com mutações no gene LRRK2 17-22. Aqui, um protocolo de extracção bioquímica (ver esquema apresentado na Figura 1) para depósitos de syn-ct cada vez mais insolúveis no período de pós-mortem de tecido PD cérebro humano que abrigam agregados α-syn em diferentes graus tem sido descrita. Esta técnica também pode ser adaptada, com modificações em composições de tampão para estudar proteínas agregadas a partir de outras doenças neurodegenerativas 23,24 e também a partir de tecido cerebral animal transgénico 25-27. A principal consideração para as adaptações são as diferenças de solubilidade e os montantes totais das respectivas proteínas, algumas das quais são principalmente nuclear e pode precisar de buffers de elevado-sal para a extração ideal como mostrado para FUS 28.
Protocolo
Tecido cerebral post-mortem foi doado para Queen Square Cérebro Banco para doenças neurológicas, University College London, Institute of Neurology utilizando protocolos e eticamente aprovados armazenada para a investigação sob uma licença emitida pela autoridade de tecido humano (HTA) Reino Unido (n. 12198). Veja a lista dos casos usados para este protocolo (Tabela 1).
1. Preparação de buffers
- Prepare 1X TBS (solução salina Tris) buffer:
- Prepare 10X TBS como solução de reserva com 500 mM Tris-HCl pH 7,4 e 1500 mM de NaCl.
- Pesar 60,5 g de Tris-Cl pH 7,6 e 87,6 g de NaCl em 800 ml de água de elevada pureza. Ajustar o pH com HCl 1 M e perfazer o volume final para estoque 1 L.
- Preparar a concentração final de 1X TBS, diluindo o estoque 10 vezes em água destilada.
- Adicionar inibidores de protease (PI), (1 comprimido por 50 ml de tampão) e Fos-stop comprimidos de inibidor de fosfatase (1 comprimido por 10 ml de tampão) arevogar os efeitos das ações enzimáticas não-específicas de proteases e fosfatases.
Nota: Aqui, utilizamos a enzima inibidor comprimidos de Roche, mas igualmente outros inibidores disponíveis comercialmente podem ser utilizados de acordo com as instruções do fabricante.
- Prepare 10X TBS como solução de reserva com 500 mM Tris-HCl pH 7,4 e 1500 mM de NaCl.
- Preparar tampão TBS-SDS por adição de 5% w / v de dodecilsulfato de sódio (SDS) a 1X TBS (pH 7,4) tampão. Aquece-se a solução a 60 ° C com agitação constante usando um agitador magnético para solubilizar SDS.
- Preparar tampão TBS-SDS-ureia, adicionando ureia a uma concentração final de 8 M w / v de tampão TBS 1X-SDS (pH 7,4). Aquece-se a solução a 60 ° C com agitação constante num agitador magnético para dissolver a ureia.
2. A homogeneização da amostra e Ultracentrifugação Diferencial
Nota: A parte seguinte do trabalho envolve a manipulação de tecido cerebral humano de acordo com as regras da HTA Reino Unido. Procedimentos operacionais padrão locais são seguidos em todos os times. Amostras do cérebro são dissecados a partir de blocos de cérebro congeladas e material de tecido homogeneizado num microcabinet mantido a pressão negativa. Vestidos de luvas descartáveis, máscaras, face-over-sapato protetores e óculos de segurança são usados durante todo o procedimento. Resíduos de tecidos humanos é descartado após a autoclavagem a 121 ° C durante 20 minutos para a eliminação segura. Sharps (lâminas de bisturi) estão dispostos em um recipiente apropriado apropriado para contenção e eliminação segura.
- Pegue um pedaço de tecido humano congelado (cerca de 0,5 g no peso da região gânglios basais) e mediu-se rapidamente em pequenos fragmentos (aproximadamente 1 mm 2) em gelo usando um pequeno petri-prato e uma lâmina de bisturi estéril. Use uma placa de petri separada e lâmina de bisturi para cada amostra. Recolhe-se o tecido moído num tubo de 15 ml e adicionar 10 volumes de tampão arrefecido com gelo 1XTBS ao tubo.
- Homogeneizar as amostras utilizando um homogeneizador mecânico a 20.000 rpm durante 10 segundos. Arrefecer em gelo durante 2 min. Repita este passo três vezess.
Nota: Isso é feito de modo a que as amostras não são aquecidos durante a homogeneização. - Clarificar por centrifugação a 1000 xg durante 5 min a 4 ° C. Descartar pelete de material não homogeneizado.
- Tome sobrenadante (homogeneizado bruto), adicione a tubos de centrífuga de policarbonato (tamanho do tubo depende do tamanho do rotor) e equilibrar cuidadosamente. Centrifugar a 100.000 xg durante 1 h a 4 ° C.
- Reter sobrenadante como esta é a fracção solúvel em TBS.
- Lave o peletizado duas vezes em cinco volumes de tampão 1X TBS e centrífuga cada vez a 100.000 xg durante 15 min a 4 ° C. Descartar o sobrenadante.
- Ressuspender o sedimento final a pelota por sonicação durante 10 segundos a 20 KHz em cerca de 5 volumes de TBS 1X-SDS a RT.
Nota: Antes da adição das amostras de tampão contendo SDS deve ser levado a 10 ° C para evitar a precipitação de SDS. - Ultracentrífuga a 100.000 xg durante 30 min a 25 ° C.
- Ressuspender o sedimento final a pelota por sonicação durante 10 segundos a 20 KHz em cerca de 5 volumes de TBS 1X-SDS a RT.
- Reter sobrenadante como este é the SDS fracção solúvel.
- Lave o peletizado duas vezes em 5 volumes de tampão de TBS 1X-SDS a RT. Centrifugar cada vez a 100.000 xg durante 15 min a 25 ° C.
- Solubiliza-se o sedimento final em 50 ul de tampão TBS-1X SDS-ureia usando um sonicador ajustada a 20 KHz durante 10 segundos para atingir a solubilização completa; este é denominado a fracção solúvel em ureia.
- Dosear cada fracção para teor de proteína total utilizando um kit de ensaio de proteínas comerciais de acordo com o protocolo do fabricante. Diluir as amostras de TBS-SDS-ureia 1: 1 com tampão 1X TBS para permitir a compatibilidade com os reagentes de ensaio de proteína. Congelar as amostras em pequenas alíquotas (20 ul) a -80 ° C para reduzir os ciclos de congelamento e descongelamento.
Nota: A adição de glicerol a 10% para as amostras é recomendado para o armazenamento a longo prazo a -80 ° C.
3. Immunoblotting de amostras e os resultados da análise
- Executar a partir de amostras de TBS, TBS-SDS e extratos TBS-SDS-uréia em 10 poços 4-12% de gel de poliacrilamida Tris-Biscom MOPS como tampão de corrida usando técnicas padrão. Veja Gallagher e Chakravarti (2008) 29 para um protocolo de western blot detalhado.
- Carga de 10 ug de proteína de cada amostra em cada pista, juntamente com um marcador de peso molecular para TBS e SDS e as fracções de ureia.
- Executar gel a 200 V durante 1 h ou até que o corante azul de tampão de carregamento atingiu o fundo do gel.
- Proteínas a partir de geles de transferir electroforeticamente para membranas de nylon 28, pré-humedecido pela primeira vez em 100% de metanol e em seguida em tampão de transferência contendo 20% de metanol. Proporcionar uma marca de identificação no lado blot para determinar a proteína e a orientação dos marcadores de tamanho de peso molecular.
- Sandwich o gel com a membrana ao lado de papel de filtro húmido. A colocação correcta da membrana é crucial com a membrana entre o gel e o ânodo. Realize a transferência durante 2 horas a 40 V.
- Make up 1X PBS-tween (1X PBS-T) tampão: dissolver 1 comprimido de PBS em 200 mlágua, para se obter 0,01 M tampão fosfato, 0,0027 M de cloreto de potássio e cloreto de sódio 0,137 M, pH 7,4.
- Bloquear a membrana em solução de BSA a 5% em 1X PBS-T, durante 30 min com agitação a 70 rpm. Isto evita a ligação não específica do anticorpo primário para a membrana.
- Sondar a mancha de proteína com 6 ml de-α syn anticorpo primário SIN-1 (BD Biosciences; anticorpo monoclonal de ratinho) a 1: 750 de diluição (O / N a 4 ° C), seguido por uma série de lavagens com 1x PBS-T ( 3 x 5 min de cada vez) 28.
- Incubar a mancha com o conjugado de HRP apropriado anticorpo secundário de 1: 2000 de diluição durante 30 min. Executar uma série de lavagens (3 x 5 min de cada vez) com 1X PBS-T.
- Imergir blots em solução melhorada quimioluminescência durante 15 segundos num quarto escuro. Borrões Cubra com um filme plástico e coloque filmes autoradiografia contra a mancha com o lado proteína-se em uma fita à prova de luz para capturar os sinais apropriados (bandas de tamanho adequado).
- Desenvolver filmes auto-radiografia em um desenvolvedor automatizado.
Nota: As manchas também pode ser desenvolvido manualmente utilizando revelador e do fixador de uma fonte comercial no caso de uma máquina automatizada programador não está disponível.
- Incubar a Western blot com 6 ml de tampão de extracção de western blot, durante 10 min com agitação constante para remover a mancha de sinal do anticorpo syn-α. Siga as etapas de 3,43 até 3.6.2 usando beta-actina anticorpo primário (mouse monoclonal) a 1: 8000 diluição.
- Digitalizar e converter a imagem final em uma imagem TIFF e medir as densidades usando NIH ImageJ para fins de quantificação (um software de download gratuito).
Nota: O software permite a leitura das densidades de área relativa de interesse (as bandas de tamanho adequado) e os dados podem ser expressos como uma razão de α-syn densidade / β-actina (um gene de manutenção da casa) como unidades arbitrárias ou sobre quando a sua própria casa mantendo um gene não é válido (como no caso de amostras solúveis em ureia).
Resultados
TBS, SDS e as proteínas extraídas a partir de ureia solúvel em gânglios da base, seguindo o protocolo mostrado na Figura 1 foram corridas em géis e imunotransferidas com o SIN-1 monoclonal de murganho α-syn anticorpo primário. As fracções solúveis em TBS apresentada a presença de monomérico α-SYN (~ 14 espécies kDa) nos casos de DP e de controlo examinados (Figura 2A). As fracções solúveis em SDS mostrou também abundante monomérica α-syn em todos os três subtipos de casos estudados como exibido na baixa exposição blot (Figura 2C). Os casos de PD também apresentaram maiores espécies de peso molecular (MW) SYN-alfa como pode ser visto no alto blot exposição, que são susceptíveis de ser oligômeros (Figura 2C). As frações solúveis de uréia a partir de casos PD mostraram valores elevados de monómeros syn-a, oligômeros e espécies agregadas comparadas para controlar casos. Os casos DP idiopática neocortical demonstrar maior quantidade de AGGREG espécies ated α-syn, enquanto os casos límbicas mostrar níveis intermediários de insolúvel α-syn. Ambos os SDS e uréia frações de casos DP idiopática demonstram níveis variáveis de produtos syn-alfa truncadas em 12 kDa e 6 kDa, conforme descrito 20. Em contraste, os casos de controlo não mostraram qualquer α-syn insolúvel ou agregados (Figura 2E). Medidas semiquantitativos densidade de reflectir a quantidade de carga de LB como categoriesd usando α-syn imunohistoquímica demonstra a natureza do agregado insolúvel α-SYN (Figura 2B, 2D, 2F), em casos de DP neocorticais e límbicas.
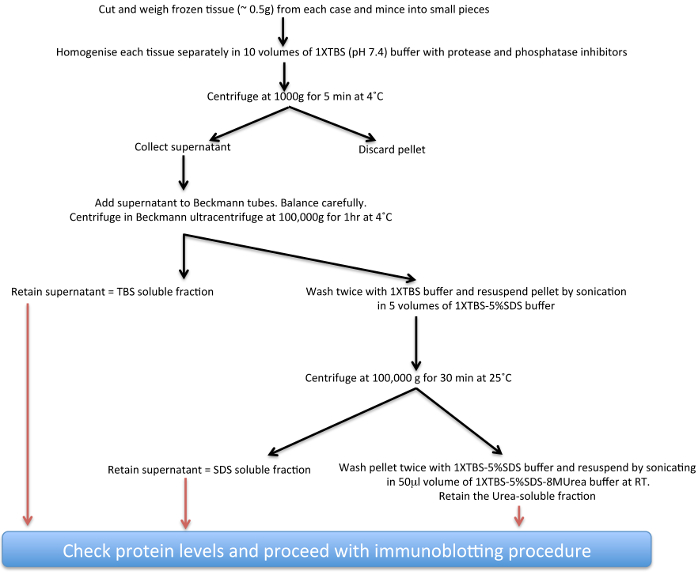
Figura 1. Diagrama esquemático do α insolúvel procedimento de extração -syn.rPegue = "_ blank"> Clique aqui para ver uma versão maior desta figura.
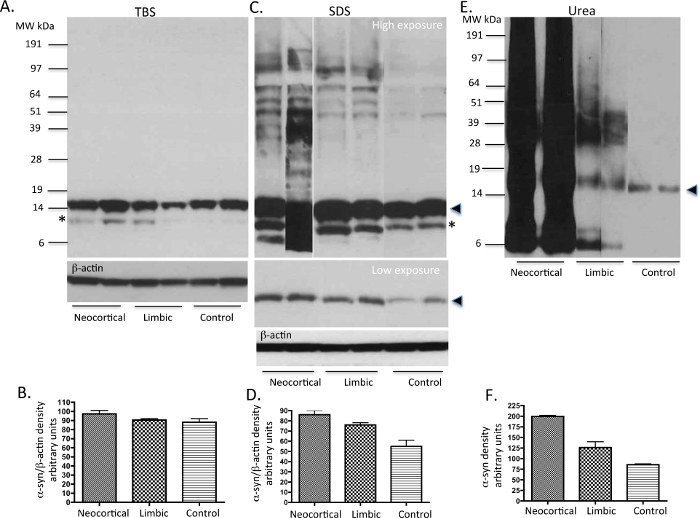
Figura 2. immunoblots representativos de níveis -syn alfa de PD e controlar o tecido humano. TBS, SDS e as fracções solúveis de uréia a partir de gânglios basais (uma região que abriga α-syn patologia em casos PD) dos casos DP idiopática e neurologicamente normal (controle) cérebros foram analisados para a presença de α-syn utilizando imunotransferência de Western. 10 ug de proteína foi carregada sobre cada pista. Em TBS fracções (A), monómeros principalmente α-syn estão presentes em todos os casos. Em SDS fracções (C), alguns oligómeros de α-syn são vistos juntamente com monómeros principalmente no tecido PD. Em frações de ureia (C), monômeros, oligômeros e agregados α-syn são variavelmente expressas no casos de DP reflecting respectiva carga LB. As amostras de controlo neurologicamente normais mostram a presença de apenas pequenas quantidades de monomérico α-syn. Por favor note possíveis produtos de degradação de α-syn são vistas em alguns dos casos, com elevada carga de LB. A ponta de seta sólida representa a forma monomérica da α-syn. O *, possivelmente, representa uma forma truncada no terminal C de α-syn como previamente descrito 20,26. Por favor clique aqui para ver uma versão maior desta figura.
| Caso | Sexo | idade em anos de morte | atraso post-mortem (hrs) | pH de tecido |
| Neocortical 1 | M | 82 | 40 | 6.3 |
| Neocortical 2 | F | 75 | 35,3 | 6.4 |
| Límbico 1 | M | 81 | 28,5 | 6.2 |
| Límbico 2 | F | 79 | 36,5 | 6.2 |
| Controlo 1 | M | 80 | 38 | 6.1 |
| Control 2 | F | 83 | 32,5 | 6.3 |
Tabela 1. demografia limitada dos casos usados
Discussão
Este artigo descreve um protocolo de bioquímica para extração e análise das propriedades de solubilidade diferencial de monoméricos, oligoméricos e agregados α-syn de cérebros doentes usando desnaturação condições gel de funcionamento. Esta é uma técnica bem estabelecida para estudar agregada α syn-17, 18, 20, 21, uma proteína que é normalmente solúvel na sua forma nativa, mas obter propriedades de agregação amiloidogénicos ou aumentou com a progressão da doença ou com mutações genéticas. No entanto, alguns grupos usaram pequenas variações nas concentrações de SDS em respectivas memórias intermédias (8% ou 10%, em vez de 5%) 21,22, 30. O SDS é um detergente aniónico e solubiliza α-syn oligómeros que podem incluir formas de membrana ligada α-syn, enquanto a ureia, um reagente caotrópico desnatura as formas agregadas e fibrilares insolúveis ou amiloidogénicos de α-syn 20. A este respeito um estudo sistemático por Paleologou et al 31 examinaram a estabilidadee oligómeros de fibrilas com diferentes concentrações de ureia Syn-a- (6,5 - 8 M) ou SDS (0,25-2%) e relataram que concentrações de oligómeros estáveis em SDS mas não com concentrações elevadas de ureia. A sua Fila-1 anticorpo, específico para oligómeros e fibrilas de Syn-ct detectadas concentrações mais elevadas de fibrilas em 6.5 M concentrações de ureia em condições não desnaturantes. As concentrações de tampão utilizado no presente protocolo espelha o que tem sido descrito em Culvenor et ai. (1999) 32.
As regiões cerebrais anatômicas para a extração de bioquímica da insolúvel α-syn deve ser cuidadosamente selecionado e isso deve refletir carga LB e LN syn-α dependendo a progressão da doença 33,34. Os casos usados aqui são amostras dos gânglios da base dos subtipos neocortical e límbicas do PD refletem estágios finais e intermediários de progressão PD de acordo com McKeith ctriteria 34. No cérebro Banco Queen Square, uma metade do cérebro érotineiramente fixados em formol para análise histoquímica e a outra metade é cuidadosamente dissecado em diferentes regiões anatômicas e flash congelados e armazenados em freezers -80 ° C durante mais bioquímica e estudos de análise de DNA / RNA. Após a fixação de formalina dos cérebros e dissecção por neuropathologists, imuno-histoquímica é realizada utilizando anticorpo α-syn e resultados arquivados. Além disso, como um procedimento de rotina, o pH do tecido do cérebro é medida na chegada como uma medida do estado agonal do tecido cerebral. Esta constitui uma base sólida para a qualidade da preservação de tecido para análise bioquímica.
Os nossos dados apresentados mostram que há mais de SDS monómero solúvel α-syn em casos de DP comparação com os controlos; em particular os casos de PD neocortical tem maior carga α-syn comparados com a variedade PD límbico. Os casos neocorticais representar uma maior progressão da DP α-syn patologia nas regiões neocorticais tais como frontal e parietal CRcas 33,34. Os casos de DP límbicas têm maiores escores LB nas áreas frontais do cérebro basal / regiões límbicas tais como a amígdala, transentorrinal e as regiões do cíngulo. Para dados e análise estatística significativa, deve-se executar, pelo menos, 4 casos de cada coorte. Da mesma forma que não se tentou a análise estatística dos dados aqui apresentados blot.
Deve também notar-se que os anticorpos podem reconhecer diferentes formas diferentes / composição de ordem superior ct-syn oligómeros e cada um pode ter a sua própria sensibilidade relativa e preferências. Isto é evidente a partir dos resultados de Tong et al. 29, onde eles mostram que 4 anticorpos syn-alfa diferentes (SIN-1, SS, Onco e LB509) dão resultados mutáveis, pelo menos, para sin-alfa oligômeros / agregados. Os monómeros α-SYN foram reconhecidos em graus semelhantes por todos os 4 anticorpos embora estes podem ter variações dependendo de se o epitopo do anticorpo syn-α está localizado quer na extremidade N-terminal ou C-terminal 29. Do mesmo modo, anticorpos específicos para fosfo-alfa sinucleína determinar o peso molecular elevado distinta α-sinucleína espécies 20,21. No protocolo aqui descrito, o anticorpo altamente caracterizado SIN-1 tem sido usada 19-21.
No entanto, é importante considerar a validar qualquer novo anticorpo em transferências de Western com as experiências pré-absorção de anticorpos e também sobre-expressão e knockdown da proteína nas células.
É importante considerar outras variações que foram aplicados pelos pesquisadores para determinar fragmentos menores de formas alfa-syn e instáveis ou tetraméricas alfa-syn. Isto pode incluir fixação leve de membranas com 0,4% de PFA em PBS para manter as formas truncadas de α-syn 35 ou tratamento de homogenatos de exemplo com agentes de reticulação para estabilizar tetrâmeros 36.
Avaliação bioquímica de proteínas precisas usando post-mortem tissue requer a minimização da degradação enzimática e modificação de proteínas. Por isso, é aconselhável a utilização de tecido com os menores atrasos post mortem e / ou selecionar amostras pareadas dentro das coortes de casos. A imuno-histoquímica utilizando anticorpos para o padrão α-syn imunohistoquímica deve ser realizado antes de se iniciar o protocolo de isolamento. A extensão da patologia α-syn é altamente variável e pode variar de acordo com regiões seleccionadas. É aconselhável para selecionar regiões com patologia abundante como um controlo positivo para o rendimento ideal com cada corrida. O uso de inibidores de protease e inibidores de fosfatase, se necessário para prevenir a degradação enzimática indesejada após a libertação de proteases intracelulares ou fosfatases que ocorrem durante a lise celular e mantendo as amostras a 4 ° C é crucial.
É importante que todas as amostras dentro do lote de experiências são tratadas de maneira uniforme e consistente para evitar as variações intra-utilizador; fre múltiplaciclos eze-descongelação deve ser evitada, pois esta pode retrair potencialmente modificações pós-translacionais, tais como a fosforilação. Um ponto crítico para ter em conta quando se analisa um grande número de amostras é que os dados de imunomanchas deve ser normalizada para uma amostra, o qual deve ser executado em paralelo com todas as outras amostras sobre os géis, e todos os dados de referência para aquela amostra. Isto é feito para assegurar a normalização dos dados entre várias manchas de imunotransferência. Este é o método adotado em nosso estudo recente 22.
Deve notar-se que, a fim de manter o ECL de fundo baixo, as manchas não devem ser deixadas a secar fora em qualquer momento durante o protocolo de transferência de Western. Além disso, a exposição muito longas (> 10 min) em filmes auto-radiografia deve ser evitado pois isso irá conduzir à saturação do sinal de ECL e conduzirá a quantificação imprecisa.
Este protocolo acima é uma técnica relativamente simples, utilizando reagentes de laboratório comuns e emtrumentos e pode ser uma ferramenta valiosa para estudar a patofisiologia da proteína α-syn em investigação PD. Esta metodologia não só pode ser prorrogado com as modificações apropriadas para o estudo da biologia α-syn em animais transgênicos syn-alfa, mas também para outras doenças neurodegenerativas que caracterizam depósitos anormais de proteínas agregadas, como AD, MSA, DLB, HD e frontotemporaldementias. No entanto, os dados de transferência de Western aqui descrita poderia também ser validada utilizando ensaios de imunoabsorção enzimática, utilizando anticorpos específicos para as formas de α-syn 31.
Divulgações
O autor não tem nada a divulgar.
Agradecimentos
I thank Dr Adamantios Mamais for extracting α-synuclein from human tissue and running of blots. This work was supported in part by a MRC Grant (MR/L010933/1) and in part by the Wellcome Trust/MRC Joint Call in Neurodegeneration award (WT089698) to the UK Parkinson's Disease Consortium (UKPDC) whose members are from the UCL Institute of Neurology, the University of Sheffield and the MRC Protein Phosphorylation Unit at the University of Dundee. RB received funding from MJFox foundation for this work and is also funded by the Reta Lila Weston Trust.
Materiais
| Name | Company | Catalog Number | Comments |
| Tris-HCL | Sigma | T5912 | |
| sodium chloride | VWR | 27800.291 | |
| SDS | Fluka | 71727 | |
| Urea | Sigma | U5378 | |
| Protease inhibitor tablets | Roche | 04 693 116001 | |
| Phosphatase inhibitor tablets | Roche | 04 906 837001 | |
| Phosphate buffered saline tablets | Sigma | P4417 | |
| Tween-20 | Sigma | P9416 | |
| NuPAGE MOPS SDS running buffer | Invitrogen | NP0001 | |
| NuPAGE transfer buffer | Invitrogen | NP0006-1 | |
| Hybond-P membrane | GE Healthcare | RPN303F | |
| Whatman 3MM filter paper | Sigma | WHA30306185 | |
| Bis-tris gels 4-12% | Invitrogen | NP0322BOX | |
| Supersignal West Pico Chemiluminescent substrate | Pierce | 34080 | |
| Bio-RAD DC protein assay kit | Bio-Rad | 500-0112 | |
| Thickwall Beckman Polycarbonate tubes | Beckman | 355630 | |
| Western blot stripping buffer | Thermo scientific | 46430 | |
| Syn-1 primary antibody (mouse monoclonal) | BD Biosciences | 610786 | |
| beta-actin primary antibody (mouse monoclonal | Sigma | A5441 | |
| HRP cojugated goat anti-mouse secondary antibody | Santa Cruz | sc-2031 | |
| Bovine serum albumin | Sigma | A7030 | |
| Instrument | Company | Rotor/ model no | |
| Benchtop Ultracentrifuge Optima Max | Beckman | MLA-80 | |
| Sonicator | Heat Systems | XL20-20 | |
| Homogeniser | Jenke and Kunkel | TP18/10 |
Referências
- Forman, M. S., Trojanowski, J. Q., Lee, V. M. Neurodegenerative disease a decade od discoveries paves the way for therapeutic breakthroughs. Nat Med. 10, 1055-1063 (2004).
- Spillantini, M. G., Schmidt, M. L., Lee, V. M., Trojanowski, J. Q., Jakes, R., Goedert, . M. A-synuclein in Lewy bodies. Nature. 388, 839-840 (1997).
- Spillantini, M. G., Crowther, R. A., Jakes, R., Hasegawa, M., Goedert, M. Alpha-synuclein in filamentous inclusions of Lewy bodies from Parkinson's disease and dementia with Lewy bodies. Proc Natl Acad Sci. 95, 6469-6473 (1998).
- Baba, M., et al. Aggregation of alpha-synuclein in Lewy bodies of sporadic Parkinson's disease and dementia with Lewy bodies. Am J Pathol. 152, 879-884 (1998).
- Ahmed, Z., et al. The neuropathology, pathophysiology and genetics of multiple system atrophy. Neuroptahol Appl Neurobiol. 38 (1), 4-24 (2012).
- Ploymeropoulos, M. H., et al. Mutation in the alpha-synuclein gene identified in families with Parkinson's disease. Science. 276, 2045-2047 (1997).
- Kruger, R., et al. Ala30Pro mutation in the gene encoding alpha-synuclein in Parkinson's disease. Nat Genet. 18, 106-108 (1998).
- Zarranz, J. J., et al. The new mutation, E46K, of alpha-synuclein causes Parkinson and Lewy Body dementia. Ann. Neurol. 55, 164-173 (2004).
- Proukakis, C., et al. A novel alpha-synuclein missense mutation in Parkinson disease. Neurology. 80 (11), 1062-1064 (2013).
- Kiely, A., et al. Synucleinopathy associated with G51D SNCA mutation: a link between Parkinson's disease and Multiple System atrophy?. Acta Neuropathol. 125 (5), 753-769 (2013).
- Lesage, S., et al. G51D alpha-synuclein mutation causes a novel Parkinson-pyramidal syndrome. Ann Neurol. 73 (4), 459-471 (2013).
- Singleton, A. B., et al. Alpha-synuclein locus triplication causes Parkinson's disease. Science. 302, 841 (2003).
- Chartier-Harlin, M. C., et al. Alpha-synuclein locus duplication as a cause of familial Parkinson's disease. Lancet. 364, 1167-1169 (2004).
- Cookson, M. R., Hardy, J., Lewis, P. A. Genetic neuropathology of PD. Int J Clin Exp Pathol. 1 (3), 217-231 (2008).
- Fauvet, B., et al. α-synuclein in central nervous system and from erythrocytes, mammalian cells, and. Escherichia coli exists predominantly as disordered monomer. J Biol Chem. 287, 15345-15364 (2012).
- Bartels, T., et al. α-synuclein occurs physiologically as a helically folded tetramer that resists aggregation. Nature. 477, 107-110 (2011).
- Campbell, B. C., et al. Accumulation of insoluble alpha-synuclein in dementia with Lewy bodies. Neurobiol of Dis. 7 (3), 192-200 (2000).
- Campbell, B. C., et al. The solubility of alpha-synuclein in multiple system atrophy differs from that of dementia with Lewy bodies and Parkinson's disease. J Neurochem. 76, 87-96 (2001).
- Miller, D. W., et al. Alpha-synuclein in blood and brain from familial Parkinson's disease with SNCA locus triplication. Neurology. 62, 1835-1838 (2004).
- Anderson, J. P., et al. Phosphorylation of Ser-129 is the dominant pathological modification of alpha-synuclein in familial and sporadic Lewy body disease. J Biol Chem. 281, 29739-29752 (2006).
- Zhou, J., et al. Changes in the solubility and phosphorylation of alpha-synuclein over the course of Parkinson's disease. Acta Neuropathol. 121, 695-704 (2013).
- Mamais, A., et al. Divergent solubility and aggregation properties in G2019S LRRK2 Parkinson's disease brains with Lewy Body pathology compared to idiopathic cases. Neurobiol of Dis. 58, 183-190 (2013).
- Lashley, T., et al. A comparative clinical, pathological, biochemical and genetic study of fused in sarcoma proteinopathies. Brain. 134 (pt9), 2548-2564 (2011).
- Brelstaff, J., et al. Transportin-1: a marker of FTLD-FUS. Acta Neuropathol. 122 (5), 591-600 (2011).
- Kahle, P. J., et al. Hyperphosphorylation and insolubility of alpha-synuclein in transgenic mouse oligodendrocytes. EMBO reports. 3 (6), 583-588 (2002).
- Nuber, S., et al. A progressive dopaminergic phenotype associated with neurotoxic conversion of α-synuclein in BAC-transgenic rats. Brain. 136, 412-432 (2013).
- Tofaris, G. K., et al. Pathological changes in dopaminergic nerve cells odf the substantia nigra and olfactory bulb in mice transgenic for truncated human a-synuclein (1-120): implications for Lewy Body disorders. J Neurosci. 26 (15), 3942-3950 (2006).
- Neumann, M., et al. FET proteins TAF15 and EWS are selective markers that distinguish FTLD with FUS pathology from amyotrophic lateral sclerosis with FUS mutations. Brain. 134 (9), 2595-2609 (2011).
- Gallagher, S., Chakravarti, D. Immunoblot analysis . J Vis. Exp. (16), e759 (2008).
- Tong, J., et al. Brain alpha-synuclein accumulation in multiple system atrophy, Parkinson's disease and progressive supranuclear palsy: a comparative investigation. Brain. 133, 172-188 (2010).
- Paleologou, K. E., et al. Detection of elevated levels of soluble α-synuclein oligomers in post-mortem brain extracts from patients with dementia with Lewy bodies. Brain. 132, 1093-1101 (2009).
- Culvenor, J. G., et al. Non-Aβ component of Alzheimer s disease Amyloid (NAC) revisited. American Journal of Pathology. 155 (4), 1173-1181 (1999).
- Braak, H., et al. Staging of brain pathology related to sporadic Parkinson's disease. Neurobiol Aging. 24, 197-211 (2003).
- McKeith, I. G., et al. Diagnosis and management of dementia with Lewy bodies: third report of the DLB consortium. Neurology. 65, 1863-1872 (2005).
- Lee, B. R., Kamitani, T. Improved immunodetection of endogenous α-synuclein. PLoS ONE. 6, e23939 (2011).
- Newman, A. J., et al. A new method for quantitative immunoblotting of endogenous α-synuclein. PLoS ONE. 8 (11), e81314 (2013).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados