Method Article
Um protocolo detalhado para caracterizar a linhagem celular murina C1498 e seu Modelo Associated leucemia mouse
Neste Artigo
Resumo
Este manuscrito fornece um processo técnico que pode ser utilizado para caracterizar culturas de células C1498 in vitro e a leucemia aguda induzida em ratos após a sua injecção. análises fenotípicas e funcionais são realizadas utilizando citometria de fluxo, microscopia de imunofluorescência, citoquímica e coloração May-Grünwald Giemsa.
Resumo
A injecção intravenosa de células C1498 em ratinhos singénicos ou congénicos foi realizada desde 1941. Estas injecções resultar no desenvolvimento de leucemia aguda. No entanto, a natureza da doença não tem sido bem documentada na literatura. Aqui, nós fornecemos um protocolo técnica para a caracterização de células C1498 in vitro e para determinar a natureza da leucemia induzida in vivo. A primeira parte deste procedimento é focada em determinar a linhagem hematopoiética eo estágio de diferenciação de células C1498 cultivadas. Para alcançar este objectivo, de multi-paramétrico de coloração de citometria de fluxo é utilizada para detectar marcadores de células hematopoiéticas. Microscopia de imunofluorescência, e citoquímica uma coloração May-Grunwald Giemsa são então realizados para avaliar a expressão de mieloperoxidase, a actividade de esterases e morfologia celular, respectivamente. A segunda parte deste protocolo é dedicada a descrever a doença leucemia que é induzido emvivo. Este último pode ser alcançado pela determinação das frequências de células leucémicas e inerentes no sangue, órgãos hematopoiéticos (por exemplo, medula óssea e baço) e tecidos não linfóides (por exemplo, o fígado e os pulmões) utilizando coloração específica e citometria de fluxo análises. A natureza da leucemia é então confirmada utilizando a coloração de May-Grunwald Giemsa e coloração por esterases específicos na medula óssea. Aqui, apresentamos os resultados que foram obtidos utilizando este protocolo em camundongos C1498- e PBS-injetados com a mesma idade.
Introdução
A leucemia mielóide aguda (LMA) é caracterizada pela proliferação não controlada de células mielóides hematopoiéticas que são bloqueados em diferentes estádios de maturação. Esta desregulação pode afetar a granulocítica, monocítica, eritrocítica ou vias de diferenciação megaryocytic 1. células AML acumulam na medula óssea, levando a hematopoiese prejudicada, o que resulta em trombocitopenia, linfopenia e anemia. As células leucémicas também invadem o sangue e órgãos não linfóides.
O mouse modelo C1498 tem sido usado por décadas como um modelo para leucemia aguda vez que as células cancerosas foram isolados de um rato leucêmica 10 meses de idade C57BL / 6 (H-2 b) do sexo feminino em 1941. A literatura descreve a invasão no sangue , órgãos hematopoiéticos (por exemplo, o baço e os gânglios linfáticos) e órgãos não-hematopoiéticas (por exemplo, o fígado, pulmões, ovários, rins) e por células C1498 altamente proliferativas após terem sido injectadas por meio de um emintravenosa, subcutânea ou via intra-peritoneal em ratos suscetíveis 2-4. No entanto, neste modelo de ratinho foi relatado para induzir quer granulocítica 2,5 ou 6 mielomonocítica leucemia. Mais recentemente, um estudo publicado em 2002 descreveu este tipo de câncer como leucemia de células NKT murino 7. Assim, a literatura diverge sobre a natureza desta linha de células C1498 ea leucemia associada induz em ratinhos. Estas discrepâncias devem-se principalmente à falta de detalhadas e atualizadas informações publicadas sobre as células e que a doença leucêmica em geral, porque muitos estudos foram realizados na década de 1950 - 70.
Aqui nós fornecemos um protocolo detalhado para descrever como a caracterização de células C1498 e analisar a natureza da doença leucémica que é induzida pela sua injecção intravenosa em ratinhos. A primeira seção deste protocolo é dedicado a uma descrição de células C1498 que foram cultivadas in vitro. anti fluorescentecorpos dirigidos contra marcadores de superfície e hematopoiéticas intracelulares foram usadas para determinar o seu fenótipo utilizando citometria de fluxo. A presença de mieloperoxidase foi avaliada utilizando microscopia de imunofluorescência, a sua linhagem hematopoiética e diferenciação fase foram avaliados usando citoquímica para avaliar a actividade de esterase, e coloração May-Grunwald Giemsa foi realizada. As células C1498 foram então injectadas em ratinhos, e a doença de leucemia aguda que foi induzido é descrito na segunda parte deste manuscrito. As mesmas técnicas foram utilizadas para determinar as frequências e os fenótipos de células leucémicas e inerentes na medula óssea, sangue periférico, baço e órgãos não-hematopoiéticas (do fígado e pulmões).
Este protocolo é altamente reprodutível, e os dados aqui apresentados ajudará os investigadores a avaliar os efeitos de novas estratégias terapêuticas. Este modelo de leucemia do murganho que já foi usado para testar se aproxima de uma imunoterapiand diferentes fármacos quimioterapêuticos do cancro 8,9. A sua eficácia foi avaliada determinando-se a evolução da carga de tumor e as taxas de sobrevivência. Este protocolo pode ser usado para fornecer informações adicionais sobre a distribuição e de subsistência de populações de células hematopoiéticas leucêmicas e outros durante o tratamento.
Protocolo
alojamento dos animais e todos os procedimentos experimentais foram aprovados pelo Comitê de Ética local, Animal Care, CEEA.NPDC (acordo no.512012), e todos os experimentos foram realizados em conformidade com as orientações francesas e europeias para o Cuidado e Uso de Animais de Laboratório.
1. Caracterização in vitro da linha celular C1498
- A cultura in vitro de células C1498
- Prepare RPMI completo (Instituto Roswell Parque Memorial) 1640 por adição de 50 ml de soro fetal de bovino (FBS), 5 ml de penicilina (100 U / ml) -streptomycin (100 ug / ml), 500 ul de mM β-mercaptoetanol 50 , 5 ml de N-2-hidroxietilpiperazina-N-2-etano sulfónico (HEPES), 5 ml de aminoácidos não essenciais e 5 mL de piruvato de sódio a 500 ml de meio RPMI.
- Cresça a linha de células C1498 em RPMI completo. Colher as células em suspensão por pipetagem, e transferência das células para um tubo de 50 ml. Centrifugar a 350 xg durante 10 min, e remover a supernatant.
- Adicionar 20 ml de solução salina tamponada com fosfato (PBS) (1x) solução, centrifugar a 350 xg durante 10 min, e remover o sobrenadante.
- Ressuspender as células em 10 ml de fluorescência de células activadas Classificador (FACS) tampão (2,5 g de albumina de soro bovino BSA) em pó (e 2 ml de solução de ácido etilenodiaminotetra-acético 0,5 M (EDTA) em 500 ml de solução de PBS). Contar as células utilizando uma célula de Thoma câmara de contagem após coloração das células com azul de tripano.
- Caracterização fenotípica da linha de células C1498 usando a imunocoloração e citometria de fluxo de análise
- coloração da superfície celular
- Preparar tampão FACS.
- Ajustar as células recolhidas em tampão FACS a 10 7 culas / mL e dispensam 10 6 células (em 100 ul) para cada experiência coloração em tubos de citometria de fluxo.
- Rotular as células com 100 uL dos seguintes anticorpos ou os seus controlos isotípicos associados diluídos em tampão FACS:
- Formatoarkers de precursor e as células diferenciadas, marcar as células com anti-CD11b / anti-CD18 (1), anti-Ly-6G (1), anti-CD19, anti-B220 (2), anti-NK1.1, anti- CD49b, anti-CD4 (1), anti-CD8 (2), anti-CD3 (3), anti-CD21 / 35, anti-CD115 e anti-TCRVβ anticorpos.
- Para as células estaminais / progenitoras hematopoiéticas marcadores, use uma combinação de anti-CD34 / anti-CD117 / anti-Sca-1, anti-CD150 / anti-CD117 / anti-Sca-1, anti-CD117 / anti-CD127 ou anti- CD16 anticorpos / 32-biotina sozinho.
- Para marcadores de funções celulares (por exemplo, adesão, a apresentação de antigénio, moléculas co-estimuladoras e receptores), corar as células com anti-CD18 (2) / anti-CD11a, anti-MHC de classe I, anti-MHC de classe II, anti- CD31, anti-CD44, anti-CD80 com biotina, anti-CD86, anti-CD274 e anticorpos.
- Incubar todas as citometria de fluxo tubos a 4 ° C durante 30 min.
- Lavar as células duas vezes por adição de 2 ml de tampão de SCAF a cada tubo de centrífuga, a 350 xg durante 5 min, e remover o sobrenadante.
- Adicionar 100 ul de tampão de SCAF a cada tubo e prossiga para a coloração secundário pela adição de 100 ul de estreptavidina fluorescente (1/100 em tampão de SCAF para uma diluição final de 1/200) para os anticorpos biotinilados-conjugados. Incubar os tubos à temperatura de 4 ° C durante 30 min.
- Lavar as células duas vezes como se segue: adicionar 2 ml de tampão de SCAF a cada um dos tubos, os tubos de centrifugação a 350 xg durante 5 min, e remover o sobrenadante por pipetagem.
- Ressuspender as células em 500 ul de PBS frio e colocar as células em gelo, mantendo-os no escuro, utilizando uma folha de alumínio para cobrir os tubos. Analisar resultados usando um citômetro 10.
- coloração intracelular
- Preparar tampão de fixação por adição de 125 ml de uma solução a 4% de paraformaldeído (PFA) a 375 ml de solução de PBS.
NOTA: Para preparar 500 mL de PFA a 4%, de calor a 400 ml de solução de PBS a cerca de 60 ° C numa placa de agitação numa hotte ventilada. Adicionar 20 g de pó de PFA, e elevar o pHaté que o PFA é dissolvido. Deixar a solução arrefecer, ajustar o pH para 6,9, e perfazer o volume até 500 ml com PBS. - Preparar o tampão de permeabilização através da adição de 0,5 g de saponina e 0,5 g de BSA para 500 ml de solução de PBS.
- Ajustar as células recolhidas em tampão FACS a 10 7 células / ml e distribuí-10 6 de células (100 ul) para cada experiência coloração em tubos de citometria de fluxo. Centrifugar as células a 350 xg durante 5 min, e remover o sobrenadante.
- Fixar as células em 200 ul de solução 1% de PFA e incubar durante 10 min a 4 ° C.
- Adicionar 2 ml de tampão de permeabilização a cada tubo, os tubos de centrifugação a 350 xg durante 5 min, e remover o sobrenadante por pipetagem. Adicionar 100 ul de tampão de permeabilização a cada tubo.
- Rotular as células com 100 uL dos seguintes anticorpos ou os seus controlos de isotipo correspondentes após a sua diluição em tampão de permeabilização de: anti-CD3 (2) / anti-CD8 (1), anti-CD3 (3) / anti-CD4 (2), anti-CD107b e anti-CD3 (3) / anti-TCRVβ.
- Incubar as células a 4 ° C durante 30 min.
- Lavar as células duas vezes por adição de 2 ml de tampão de permeabilização a cada tubo. Centrifugar os tubos a 350 xg durante 5 min, e remover o sobrenadante.
- Adicionar 100 ul de tampão de permeabilização das células. Proceder à coloração secundária, adicionando 100 ul de estreptavidina fluorescente diluído em permeabilização buffer para anticorpos biotinilado-conjugados. Incubar os tubos à temperatura de 4 ° C durante 30 min.
- Adicionar 2 ml de tampão de permeabilização a cada tubo, centrifugar os tubos a 350 xg durante 5 min, e remover o sobrenadante. Repetir este passo mais uma vez.
- Ressuspender as células em 500 ul de PBS frio, e, em seguida, colocar as células em gelo no escuro. Analisar os resultados usando um citómetro de fluxo 10.
- Preparar tampão de fixação por adição de 125 ml de uma solução a 4% de paraformaldeído (PFA) a 375 ml de solução de PBS.
- coloração da superfície celular
- Preparação de uma suspensão de células em lâminas para microscopia
- Wash 10 6 do harvested células C1498 (obtido no passo 1.1.4) com 5 ml de tampão FACS frio, duas vezes, e diluir as células em 1 ml de tampão FACS frio. Colocar os tubos em gelo.
- Colocar as lâminas em câmaras descartáveis com pré-inscritos cartões de filtro e colocá-los em um citocentrífuga.
- Adicionar 100 ul de tampão FACS para cada cartão e câmara de filtro, e colocá-los durante 2 min a 4,52 x g.
- Adicionar 100 uL de células para cada cartão e câmara de filtro, e girar as células em 4,52 xg durante 2 min.
- Remova cuidadosamente os slides das câmaras e deixe secar os slides antes da coloração-los com mieloperoxidase (passo 1.4), esterases (passo 1.5) ou May-Grünwald Giemsa (passo 1.6).
- coloração mieloperoxidase por imunofluorescência
- Fixar as células nas lâminas por imersão das lâminas numa solução de metanol frio: acetona (1: 1) solução durante 2 min, e, em seguida, ar-Secar as lâminas.
- Para limitar o líquido para a área da lâmina que contém as células, desenhar um ICrcle em torno das células usando uma caneta repelente de água.
- Lavar as células em 200 ul de solução de PBS frio durante 10 min.
- Bloquear as células em 200 ul de tampão de BSA a 3% / PBS contendo 10 ul de soro de burro normal, e 10 ug / ml de anti-CD16 32 / anticorpos purificados.
- Aplicar 200 ul da mieloperoxidase anti-ratinho (diluído para 20 fig / ml em tampão de BSA a 3% / PBS). Incubar as células o / n a 4 ° C numa câmara de humidade.
- Lavam-se as células com 200 uL de BSA a 0,1% frio / PBS.
- Aplicar 200 ul de anticorpos IgG anti-cabra, diluído a 1/250 em BSA a 3% / tampão PBS. Incubam-se as células durante 2 h à temperatura ambiente numa câmara de humidade.
- Lavam-se as células 3 vezes com 200 uL de BSA a 0,1% / tampão de PBS e duas vezes em PBS frio.
- Manchar os núcleos de células com 200 ul de Hoechst diluído a 1 / 1.000 em PBS (para uma concentração final de 1 ug / mL) durante 2 min à temperatura ambiente.
- Lavar as lâminas com água e deixe-os secar ao ar antes de mounting. Aplique uma gota de meio de montagem 1 para as células, coloque uma extremidade de um vidro de cobertura para o slide, e cuidadosamente abaixá-lo para as células usando uma pinça. Pressione suavemente o vidro da tampa para remover quaisquer bolhas de ar.
- citoquímica esterase
Nota: Pré-quentes todos os reagentes à RT.- preparação fixador
- Para preparar a solução de citrato-acetona-formaldeído (CAF), adicionar 2,5 ml de solução de citrato, 6,5 ml de acetona e 0,8 ml de formaldeído a 37% a um frasco de vidro. Misturar suavemente e armazenar a 4 ° C.
- Naftol AS-D cloroacetato esterase ensaio de actividade (CAE)
- água desionizada morna a 37 ° C.
- Num tubo de 50 ml, adicionar 1 ml de uma solução de nitrito de sódio a 1 ml de solução de corante. Misture delicadamente e deixe repousar por 2 min. Adicionar 40 ml de água desionizada pré-aquecida, 5 ml de tampão pH 6,3 de concentrado e 1 ml de uma solução de naftol AS-D cloroacetato. Misturar e transferir para um frasco Coplin.
- Fixar as células para olâminas (ver secção 1.3) durante 30 segundos com a solução CAF (veja o passo 1.5.1.1), e lavar as lâminas por 45 segundos com água deionizada.
- Transferir as lâminas para dentro da solução que foi preparada no passo 1.5.2.2, e incuba-se as lâminas a 37 ° C durante 30 min numa câmara de humidade, ao abrigo da luz.
- Secar as lâminas e depois lavá-los através de imersão em água deionizada por 2 min.
- Contracoloração as células por adição de algumas gotas de solução de hematoxilina e incubando-os durante 1 min.
- Lavam-se as lâminas com água neutra (pH 7) e permitir-lhes secar ao ar. Aplicar uma gota de meio de montagem 2 para as células, Colocar uma extremidade de um vidro de cobertura sobre a lâmina e cuidadosamente baixá-la para as células usando uma pinça. Pressione suavemente o vidro da tampa para remover quaisquer bolhas de ar.
- Alfa-naftil butirato esterase ensaio de actividade (NBE)
- solução de butirato de α-naftilo Aquece-se até 37 ° C antes da utilização.
- Diluir um comprimido de nit de sódiorito em 6,25 ml de água deionizada.
- Num tubo de 50 ml, adicionar 1,5 mL de uma solução de nitrito de sódio em comprimidos e 1,5 ml de uma solução de pararosanilina. Misturar suavemente e deixar a solução em repouso durante 5 min. Suplemento a solução com 40 ml de solução tamponada com fosfato. Trazer para pH 6 por adição cuidadosa de NaOH 10 N, gota a gota. Adicionar 5 ml da solução de butirato de α-naftil, misturar a solução inteira, e transferi-lo para um frasco Coplin.
- Fixar as células nas lâminas para 10 seg usando a solução à TA CAF e lave durante 45 segundos com água desionizada.
- Transferir as lâminas para o frasco Coplin contendo a solução que foi preparado no passo 1.5.3.2 e incubar em conjunto durante 1 hora a 37 ° C numa câmara de humidade, enquanto protegida da luz.
- Lavar as lâminas por 2 min em água neutra (pH 7) e ar seco.
- Contracorante as células com solução de azul de metileno, adicionando algumas gotas na lâmina e incubar durante 4 min.
- Imergir as lâminas em Deioágua nhecida por 2 min e permitir-lhes a secar ao ar. Para montar os slides, aplicar uma gota de meio de montagem 2 para as células, coloque uma borda do vidro de cobertura para o slide, e cuidadosamente abaixá-lo para as células usando uma pinça. Pressione suavemente o vidro da tampa para remover quaisquer bolhas de ar.
- preparação fixador
- May-Grunwald Giemsa (MGG) coloração
- Corar as células (preparados no ponto 1.3) por imersão os slides em uma jarra de Coplin contendo solução de May-Grünwald por 3 min.
- Transferir as lâminas em um frasco Coplin contendo a solução tampão pH 6,8 para 1 min.
- Corar as lâminas, colocando-os em um frasco Coplin contendo a solução de Giemsa R (diluído a 1/20 em solução tampão de pH 6,8) durante 10 min. Lavam-se as lâminas com água neutra (pH 7) durante 10 seg.
- Escorra e deixe secar os slides. Montar as lâminas através da aplicação de uma gota de meio de montagem 2 sobre as células. Coloque uma borda do vidro de cobertura para o slide e baixe-a cuidadosamente sobrepara as células usando uma pinça. Pressione suavemente o vidro da tampa para remover quaisquer bolhas de ar.
2. Desenvolvimento Vivo e Caracterização de leucemia aguda
NOTA: ratinhos congénicos fêmeas de quatro semanas de idade C57BL / 6J-Ly5.1 foram mantidas em condições sem agentes patogénicos específicos (isto é, num ambiente estéril). Os ratinhos foram injectados quando tinham entre 5 e 6 semanas de idade.
- A injecção intravenosa com células C1498
- Colher as células C1498 cultivadas em suspensões por pipetagem. Transferir as células para um tubo de 50 ml e centrifugar a 350 xg durante 10 min. Lavam-se as células em 10 ml de PBS frio, duas vezes, e preparar uma suspensão de células de 10 7 células / ml em PBS. Colocar a suspensão celular em gelo antes de realizar a injecção.
- Colocar o rato num limitador e executar a injecção sob condições estéreis numa câmara de fluxo laminar.
- Utilize uma agulha 29G com uma seringa para injectar as células para ona veia da cauda. Agarrar a cauda na extremidade distal, e desinfectar com uma esponja de gaze embebida em 70% de etanol. Certifique-se de que não existem bolhas de ar na seringa, e, em seguida, injetar lentamente 100 ul da suspensão de células C1498 (10 6 células) na veia da cauda.
- Após a injecção, retire a agulha a partir da cauda, e controlar qualquer hemorragia, aplicando pressão com uma esponja de gaze estéril no local da injecção. Devolver o animal para sua gaiola, e verificar cuidadosamente a sua saúde ao longo dos próximos horas e dias.
- recolha de sangue retro-orbital
- Monitorar o comportamento dos ratinhos PBS e C1498-injectados para sinais de doença leucémica (por exemplo, piloerecção, o isolamento a partir do grupo, e diminuição ou ausência de movimentos na gaiola).
NOTA: Isto ocorre geralmente entre 17 a 19 dias após as células são injetadas. - Realizar a coleta de sangue retro-orbital, pouco antes da eutanásia (veja o passo 2.2.7) em condições estéreis em um fluxo laminarcapuz e sob uma lâmpada de aquecimento para evitar a hipotermia.
- Para anestesia, usar cetamina a 150 mg / kg e xilazina a 10 mg / kg. Preparar a solução de anestésico por diluição de 1,5 ml de cetamina e 0,5 ml de xilazina em 18 ml de solução de PBS.
- Anestesiar o controle e ratos leucêmicas. Prosseguir com uma injecção intraperitoneal de 200 ul da solução de anestésico por 10 g de ratinho usando uma agulha de 26G e uma seringa de 1 ml. Verificar a perda do reflexo pedal para confirmar anestesia.
- Inserir um tubo capilar para o canto medial do olho. O sangue vai subir a partir do seio orbital para dentro do tubo capilar. Controlar a hemorragia através da aplicação de pressão suavemente para o olho com uma gaze estéril.
NOTA: Um volume de 100 a 200 ul de sangue pode ser recolhido utilizando esta técnica. - Recolhe-se o sangue para um tubo de EDTA, e armazenar a amostra em gelo antes de se isolar as células mononucleares.
- Euthanize o mouse usando deslocamento cervical, eproceder a isolar os órgãos (secção 2.3).
- Monitorar o comportamento dos ratinhos PBS e C1498-injectados para sinais de doença leucémica (por exemplo, piloerecção, o isolamento a partir do grupo, e diminuição ou ausência de movimentos na gaiola).
- Órgãos e células de isolamento
- isolamento órgãos
- Posicione o mouse sacrificados em suas costas em uma placa de plástico e usar agulhas para fixar os pés do animal para facilitar o isolamento de órgãos. Desinfectar o mouse usando etanol 70% antes de realizar uma incisão.
- Usando uma tesoura esterilizada, realizar uma incisão ventral da pele abdominal para o pescoço. Cortar através da parede abdominal para aceder ao fígado. Corte através da caixa torácica e do diafragma para acessar os pulmões. Mova o intestino para o lado e remover o baço usando tesouras e pinças esterilizadas.
- Para isolar a medula óssea, cortar as pernas na parte superior dos fémures acima da articulação com uma tesoura estéreis. Desligue a tíbia do fémur puxando suavemente e retire a pele e os músculos dos ossos usando uma pinça e tesouras.
- Coloque cada órgão e osso em um tubo de 50 ml contendo frio PBS, e colocá-los no gelo.
- O isolamento de células a partir dos órgãos
- Pesa-se o baço antes de romper as células. Mecanicamente perturbar o baço, pulmões e fígado, pressionando-os através de um filtro de 70 um utilizando um êmbolo de seringa em um tubo de 50 ml, e recolher as células em 30 ml de PBS frio.
- Para recolher as células da medula óssea, colocar os fémures e tíbias em uma placa de Petri sobre gelo, cortar as extremidades usando uma tesoura estéreis, e expulsar a medula óssea através da inserção de uma agulha 26G ligada a uma seringa de 10 ml contendo 5 ml de PBS frio.
- Dissociação das células de medula óssea pela passagem da suspensão de células através da agulha / seringa, e filtrar a suspensão de células através de um filtro de 70 ^ M num tubo de 50 ml.
- Centrifugar todos os tubos contendo cada um dos órgãos e as células da medula óssea a 350 xg durante 10 min. Descartar o sobrenadante e ressuspender as células recolhidas a partir da medula óssea e pulmões em 2 ml de tampão de lise (1x) e a células isoladas a partir do fígado e baço, em 5 ml de tampão de lise (1x), pipetando suavemente a mistura para cima e para baixo. Encher os tubos de 50 ml com PBS frio.
- Centrifugar as células a 350 xg durante 10 min. Ressuspender as células em tampão FACS para análise de citometria de fluxo ou para preparar as células para microscopia. Contar as células utilizando uma câmara de contagem Thoma célula após coloração com azul de tripano-los.
- isolamento órgãos
- coloração da superfície celular de células isoladas a partir de órgãos para análise de citometria de fluxo
- Num tubo de citometria de fluxo, a etiqueta 10 6 células que foram isoladas a partir de órgãos com 10 ug / ml de anticorpo anti-CD16 / 32 anticorpos em 100 ul de tampão de FACS.
- Para 10 6 células da medula óssea, adicionar 100 ul de um dos seguintes anticorpos ou combinações de anticorpos e os controlos de isotipo correspondentes diluídos em tampão FACS: anti-CD11b / anti-CD3 (1) / anti-Ly6C / anti-Ly6G (2), anti-B220 (1) /anti-CD45.2/anti-CD19, anti-CD115 / anti-CD3 (1) / ati-Ly6C / anti-Ly6G (2), anti-CD45.2, anti-Ly6G (2), anti-CD11b, anti-CD115 e anti-CD19 sozinho para as definições de compensação.
- Para esplenócitos, adicionar 100 ul dos seguintes anticorpos e os seus controlos de isotipo correspondentes diluídos em tampão FACS: uma combinação de anticorpo anti-CD11b / anti-CD3 (1) / anti-Ly6C / anti-Ly6G (2), anti-B220 (1 ) /anti-CD45.2/anti-CD19, anti-CD45.2, anti-Ly6G (2), anti-CD11b e anti-CD19 para as definições de compensação.
- Para as células do pulmão e do fígado, adicionar 100 ul de anticorpos anti-CD45.2 e o seu controlo de isotipo correspondente diluída a 1/100 em tampão de FACS.
- Incubar todas as soluções de células durante 30 min a 4 ° C.
- Lavam-se as células por adição de 2 ml de tampão de SCAF a cada tubo. Centrifugar os tubos durante 5 min a 350 xg e o descarte do sobrenadante por pipetagem. Repetir este passo mais uma vez.
- Ressuspender as células marcadas em 500 ul de PBS frio. Manter as células em gelo e protegidas da luz antes da realização de citometria de fluxo para a corrente alternadaaqui- e análise 10.
- Isolamento de células mononucleares de sangue e de coloração imunofluorescente por análise de citometria de fluxo
- Antes de iniciar o protocolo, pré-aquecer a solução de separação para a TA.
- Transferência da amostra de sangue (100 a 200 ul; obtida a partir do passo 2.2) para um tubo de microcentrífuga, e adicionar PBS / 1 mM de solução de EDTA até o volume da solução é de 500 uL. camada cuidadosamente 500 ul de solução de separação de acordo com a solução que contém o sangue utilizando uma agulha de 30G e uma seringa de 1 ml. Não misturar o sangue e a solução de separação.
- Centrifugar os tubos a 800 xg (sem travão) durante 20 min à TA. Após centrifugação, recolher o anel de células (a camada branca opaca) utilizando uma pipeta. Transferir as células para um tubo de microcentrífuga.
NOTA: A camada branca opaca contém linfócitos, assim como os monócitos e aparece entre a camada inferior - a solução de separação - e a camada superior. - Adicionar 1 mlde solução de PBS, e o tubo de centrifugação a 350 xg durante 10 min. Ressuspender as células em 600 ul de tampão de FACS.
- Adicionam-se 10 ug / ml de anticorpo anti-CD16 / 32 anticorpos e distribuir 100 ul da suspensão de células em seis tubos separados (100 ul cada).
- Marcar as células com 100 uL dos seguintes anticorpos ou os seus controlos isotípicos associados diluídos em tampão FACS: uma combinação de anticorpo anti-CD3 (1) / anti-B220 (1) /anti-CD45.2 e anti-Ly6C / anti-CD115 /anti-CD45.2 ou anti-CD45.2 e anti-CD115 sozinho para ajustes de compensação.
- Incubar todos os tubos a 4 ° C durante 30 min.
- Lavam-se as células por adição de 2 ml de tampão de SCAF a cada tubo, e então centrifugar os tubos durante 10 minutos a 350 xg, e desprezar o sobrenadante utilizando uma pipeta.
- Volte a suspender as células marcadas em 500 � de PBS frio. Manter as células em gelo e protegidas da luz antes da realização de citometria de fluxo e análise de aquisição 10.
- Preparação de suspensões de células de medula óssea em lâminas para microscopia
- Seguir os passos descritos na secção 1.3, mas no passo 1.3.1, utilizar 5 a 10 células de medula óssea, e no passo 1.3.4, girar as células em cada câmara a 72,26 x g durante 10 min.
- Os ensaios de actividade de esterase utilizando células de medula óssea
- Para executar os ensaios de esterase citoquímica de medula óssea, proceder a partir de passos 1.5 a 1.5.3.7.
- coloração de May-Grunwald Giemsa de células de medula óssea
- Para corar as células de medula óssea, seguir o protocolo descrito na secção 1.6, mas no passo 1.6.1, incubar as lâminas em solução de May-Grunwald durante 5 min.
Resultados
Para caracterizar o modelo de rato C1498, procedeu com duas etapas principais. Em primeiro lugar, as células C1498 foram caracterizados para determinar a sua linhagem hematopoiética e estado de maturação in vitro (Figura 1). Estas células foram então injectadas em ratinhos congénicos, e a natureza da doença leucémica induzidos foi avaliada para determinar características diferentes: a infiltração de células leucémicas, o seu fenótipo, a quantificação das células hematopoiéticas (maduros e progenitoras / precursoras) na medula óssea, as frequências de células C1498 e células hematopoiéticas maduras no sangue e uma avaliação do inchaço órgão (no baço, fígado e pulmões) e composição celular.
Para caracterizar os fenótipos de células C1498 in vitro, as células foram marcadas com anticorpos dirigidos contra moléculas que são expressas pelos precursores hematopoiéticos e células maduras (tabela 1), e os resultados foram analisados por meio de fluxo cytometry. As células C1498 foram positivas para a expressão na superfície celular de Mac-1 (CD11b / CD18) (~ 7%), B220 (> 25%), e eles exibiram expressão intracelular de CD3ε, receptores das células T cadeias (TCR) Vp e MAC -3 (Figuras 2A e B). As células foram negativos para os marcadores de superfície celular Ly6G, Ly6C, CD115, CD21 / CD35, CD19, CD3, CD4, CD8, NK1.1, e pan-NK moléculas e para a expressão intracelular de CD4 e CD8 (dados não apresentados) . Eles foram, em seguida, examinadas para os marcadores de células estaminais hematopoiéticas e progenitoras (Tabela 1). Eles também foram negativos para a expressão na superfície celular de CD117, CD34, Sca-1, CD150 e CD16 / 32 (dados não mostrados). Estas células leucémicas foram então testadas para determinar a expressão da adesão, a apresentação de antigénios e moléculas co-estimuladoras. As células expressaram os marcadores de superfície de LFA-1 (CD11a / CD18), CD44, CD31 (PECAM-1), e H-2D e B foram negativas para MHC de classe II, CD80, CD86 e CD274 (dados não mostrados). células C1498 tor conseguinte expresso tanto mielóide (Mac-1, Mac-3) e marcadores linfóides (B220, CD3, TCR).
Para melhor caracterizar sua linhagem hematopoiética, expressão mieloperoxidase foi avaliado usando microscopia de imunofluorescência. Todas as células foram positivas para a mieloperoxidase, a qual verificada a sua origem mielóide (Figura 3A). A maioria das células coradas também positivas para esterases α-naftil butirato (Figura 3B, painel da esquerda), e alguns deles corado para os naftol AS-D cloroacetato esterase (setas pretas) (Figura 3B, painel da direita). Os resultados indicam que as células continham misturas de células monocíticas e granulocítica. Após a coloração May-Grunwald Giemsa foi realizada, as células C1498 foram observados para exibir uma morfologia de explosão do tipo com uma proporção nucleo-citoplasmático alta, 3 a 5 nucléolos no núcleo, halo perinuclear, numerosos vacúolos e citoplasma basofílico (Figura 3C ). ºnós, a linha de células C1498 é composto por monoblastos e mieloblastos.
As células C1498 (CD45.2 +) foram então injectados intravenosamente em ratinhos CD45.1 +. Os ratinhos sucumbiu 17 a 19 dias depois, as células foram injectadas. Estes ratos foram sacrificados de modo a que o seu tipo de leucemia pode ser analisada antes de morrer da doença. Os ratinhos de controlo, que foram injectados com PBS, foram analisados no mesmo intervalo de tempo para comparação. Os ratinhos injectados com células C1498 exibida infiltração massiva de células C1498 em sua medula óssea, como demonstrado pelo aparecimento de explosão do tipo das células depois de May-Grunwald Giemsa coloração foi realizada (Figura 4A). Eles também conservaram a sua monocítica e fenótipos granulocíticas (Figura 4B e C), demonstrando uma acumulação de células monoblástica mieloblásticas e que é característica de leucemia mielomonocítica aguda.
para determine se medulares números de células hematopoiéticas foram menores após células leucêmicas invasão, C1498 células CD45.2 +, B linfocítica, monocítica e populações granulócitos (incluindo progenitores, precursores e células maduras), foram quantificados utilizando coloração de imunofluorescência e fluxo de multi-paramétricos citometria análise. As células leucêmicas representava 16 a 36% das células hematopoiéticas (dados não mostrados). Os outros tipos de células estavam presentes em números significativamente mais baixos nos ratos C1498 injectados do que nos murganhos injectados com PBS (por 5 vezes, em média, para as subpopulações de células B, 4 vezes em média para células granulocíticas e 3 vezes em média para subconjuntos monocíticas) (Figura 5A a C).
Uma investigação das frequências de células mononucleares em amostras de sangue leucêmicas e mouse controle mostrou que eles continham uma percentagem comparável de linfócitos (Figura 6A), mas uma maior freqüência de monocíticae células leucémicas. Estas características são representativas de leucemia mielomonocítica aguda 11 (Figura 6B).
Entre as outras características de leucemia mielomonocítica aguda 12, os ratinhos injectados com C1498 apresentados com fígados inchados (hepatomegalia), pulmões e baço (esplenomegalia) (Figura 7A). Várias frequências de células CD45.2 + C1498 foram detectados nestes órgãos utilizando coloração de imunofluorescência e a citometria de fluxo de análise (Figura 7B). Como esplenomegalia pode resultar de um elevado número de monócitos infiltrados, que também estimou as proporções de populações esplênicas. Os números de células B no linfocítica, monocítica e fracções de células granulocíticas foram significativamente maiores, por uma média de 2 vezes, 2,5 vezes e 3-vezes, respectivamente, em baços leucémicas que em baços de controlo (Figura 7C).
thin-page = "1"> 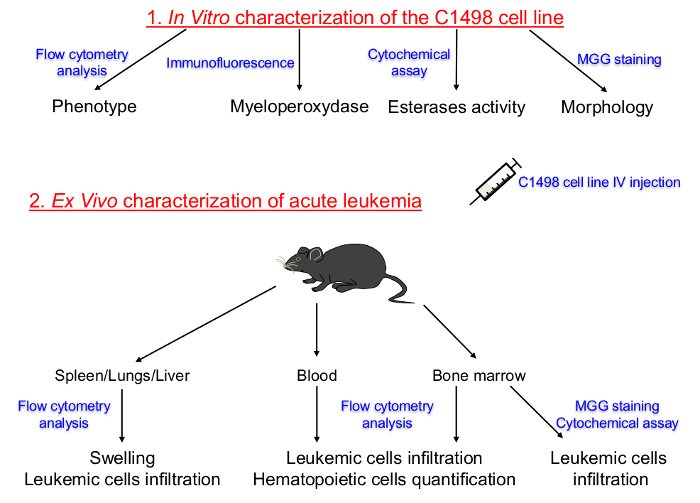
Figura 1. Representação esquemática do protocolo descrito acima para a caracterização in vitro linhas de células cultivadas em Descrições C1498 e in vivo de leucemia aguda. A linhagem hematopoiética e a fase de diferenciação das células C1498 em cultura de tecido foram determinados pela primeira vez. Células C1498 foram então injectadas em ratinhos congénicos para induzir o desenvolvimento de leucemia aguda. O isolamento da medula óssea, sangue periférico, baço, fígado e tecidos pulmonares foi realizada para determinar as frequências, fenótipos e alterações morfológicas após a infiltração de células C1498. IV: MGG intravenosa:. May-Grunwald Giemsa Por favor clique aqui para ver uma versão maior desta figura.
ad / 54270 / 54270fig2.jpg "/>
Figura 2. Análise fenotípica de C1498 células após cultura in vitro. Citometria de fluxo representativas gráficos de pontos e os histogramas de superfície celular (A) e intracelular (B) C1498-expressa moléculas que foram associados com a diferenciação de células hematopoiéticas maduras são mostrados. Células C1498 foram colhidas a partir de culturas, lavadas e marcadas utilizando anticorpos fluorescentes que eram específicos para a superfície celular CD11b, CD18 e B220 marcadores ou os respectivos controlos de isotipo. Para a coloração intracelular, as células foram fixadas, permeabilizadas e marcadas utilizando anticorpos dirigidos contra a Mac-3, CD3ε, e um epitopo comum do TCR (T-Cell Receptor) cadeia Vp ou seus controlos de isotipo. As análises foram realizadas usando gating com células vivas. Por favor clique aqui para ver uma versão maior desta figura.
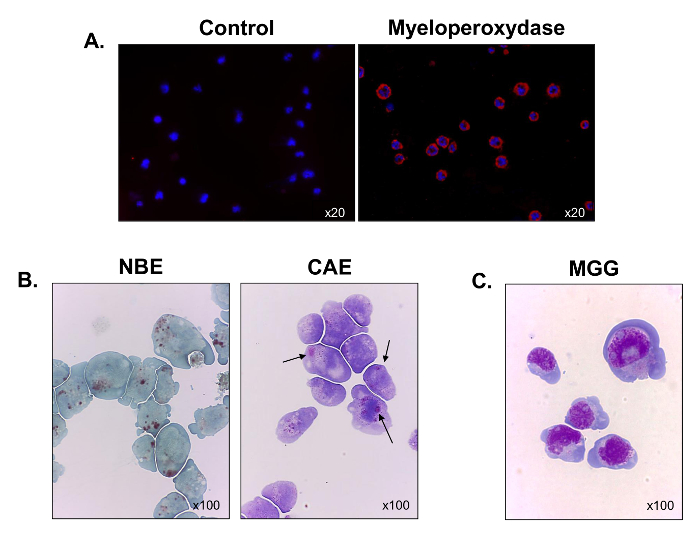
Figura 3. funcionais e morfológicas Caracterização de células cultivadas C1498. Células C1498 foram colhidas a partir de culturas e centrifugou-se em lâminas de microscopia. (A) Coloração para a expressão da mieloperoxidase foi realizada utilizando imunofluorescência. (B) reacções citoquímicos foram utilizados para analisar a esterase α-naftil butirato (NBE) e naftol AS-D cloroacetato esterase (CAE) atividades em células C1498. As células foram considerados positivos para cada rótulo quando, grandes grânulos citoplasmáticos marrom e vermelho-púrpura, respectivamente, foram observados. (C) May-Grunwald Giemsa (MGG) coloração de C1498 células. Para cada experimento a coloração, a ampliação microscopia objectivo é indicado. Cada imagem é representativa de três experiências separadas.large.jpg "target =" _ blank "> Clique aqui para ver uma versão maior desta figura.
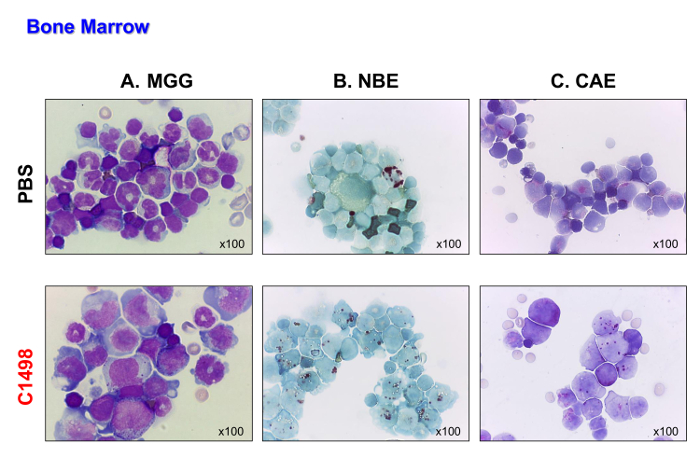
Figura 4. Os ratinhos de Medula Óssea Morfologias em PBS e injectou-C1498. Células da medula óssea foram isoladas a partir de PBS e ratinhos injectados com células C1498 e centrifugadas em lâminas para microscopia. (A) May-Grunwald Giemsa (MGG) coloração. (B ) esterase α-naftil butirato (NBE) e naftol (C) AS-D cloroacetato esterase (CAE) funções foram avaliados utilizando citoquímica. No painel A, a banda (imaturo) ou neutrófilos segmentados (maduros) são menos visíveis na medula óssea dos ratinhos injectados C1498 do que os ratinhos injectados com PBS. O painel B e C indicam que houve uma acumulação de células monocíticas e granulócitos na medula óssea leucémicas em comparação com os números observados na medula óssea de controlo. Todosanálises microscópicas foram realizadas usando uma objetiva de ampliação 100X. Por favor clique aqui para ver uma versão maior desta figura.
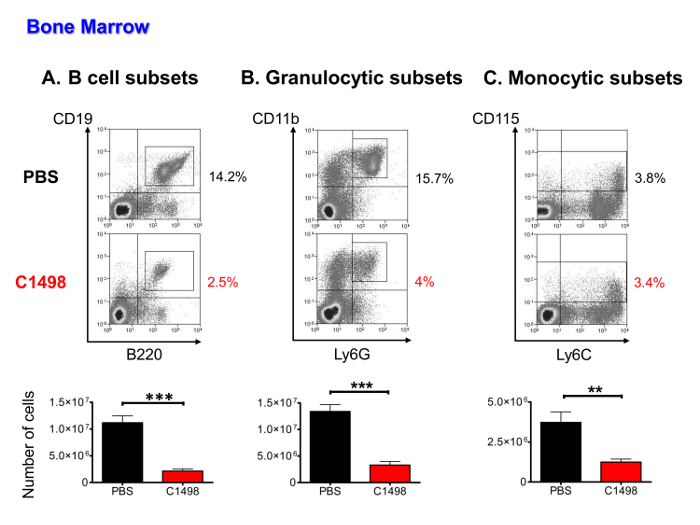
Figura 5. Os ratinhos Análise Quantitativa de medulares Populações em PBS e injectou-C1498. Células da medula óssea foram isoladas a partir de PBS e ratinhos injectados com células C1498 e estimado após a contagem das células foi realizada. As frequências dos diferentes populações de células foram determinadas após imunocoloração e fluxo de célula fechada ao vivo citometria de análise. (A) Os subconjuntos de células B incluído células CD19 + B220 + em fases de células pró-B para amadurecer linfócitos B (B) células granulócitos no CD3 - CD11b + e + Ly6G linhagens, que incluiu um precursores. nd granulócitos imaturos e maduros (c) Os subconjuntos monócitos foram definidos como CD3 - CD115 + e as células do progenitor incluída a amadurecer estágios de monócitos. n = 7 ratinhos / grupo, e os dados são apresentados como histogramas mostrando as médias ± SEM. *** P <0,0001 e ** p <0,01, teste t de Student não pareado comparando PBS e ratos C1498-injetados. Por favor clique aqui para ver uma versão maior desta figura.
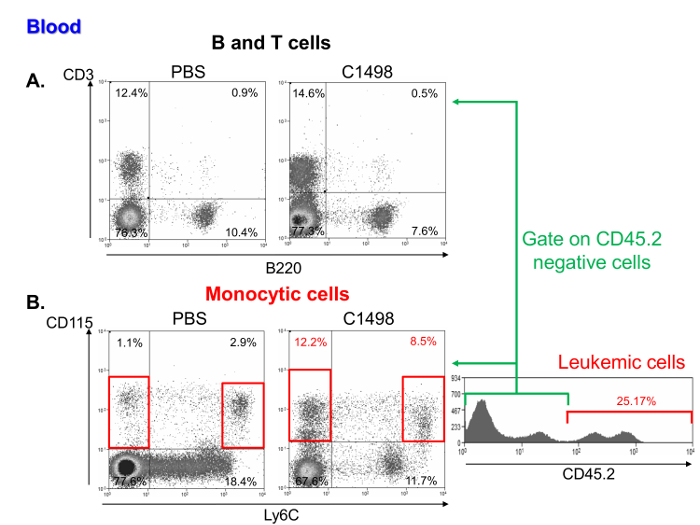
Figura Análise 6. Sangue de subpopulações de células mononucleares em PBS e ratos C1498-injetado. Fluxo representativas citometria de gráficos de pontos de percentagens de linfócitos T (A) e B respectivamente, que foram definidas como as células CD3 + e B220 + em PBS e injectou-C1498 célula. ratinhos (B) As frequências de células monocíticas em leucémicas C1498 e controlo (PBS) murganhos foram determinados através da análise de CD115 + Ly6C - CD115 + e Ly6C células elevados. A análise foi realizada por gating células vivas. Para comparar ratos leucêmicas e controle, CD45.2 + foram excluídos C1498 células. Por favor clique aqui para ver uma versão maior desta figura.
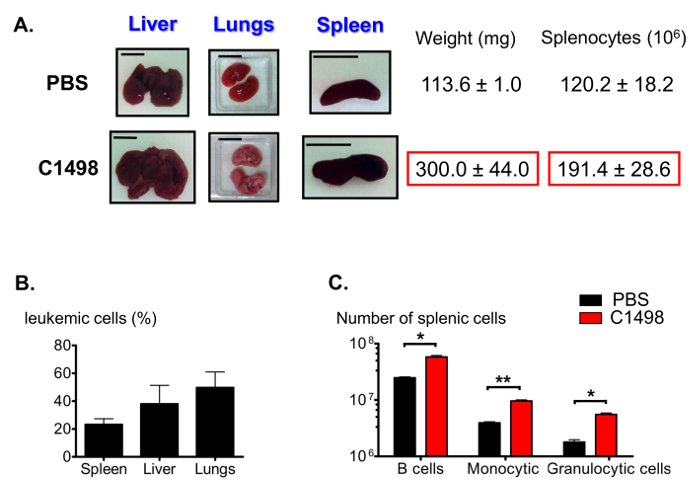
Figura 7. Estimativa do baço Populações em leucêmicas e Controle de Ratos. (A) Fotografias representativas de fígado, pulmão e baço inchaço em murganhos leucémicos em comparação com ratinhos de controlo. Os baços foram recolhidos e pesados, e os esplenócitos foram contadas seguinte ruptura de tecido. (B) histograma que representa as frequências de células leucémicas em DIFFórgãos erent após imunocoloração foi realizada para células CD45.2 + e os resultados foram analisados por citometria de fluxo. (C) As estimativas de baço B, o número de células granulócitos e monócitos após imunocoloração e citometria de fluxo gating análises foram realizadas para identificar vivo CD19 + B220 + , CD3 - CD11b + Ly6G +, CD3 - CD11b + Ly6C - e CD3 - CD11b + de células de alta Ly6C. As barras de escala mostradas para os pulmões, fígados e baços indicar 1 cm. .. n = 5-8 ratinhos / grupo, e os dados são representados em histogramas como médias ± SEM * p <0,05; **, p = 0,0033 ratinhos, teste t de Student desemparelhado comparando PBS e injectados C1498 favor clique aqui para ver uma versão maior desta figura.
| Tipo celular | Membrana ou intracelulares Moléculas |
| Precursores e células maduras | |
| células NK | NK1.1 +, pan-NK + |
| células NKT | NK1.1 +, pan-NK +, TCR vbeta + (8,2), CD3 + |
| linfócitos T | VBeta TCR +, CD3 +, CD4 +, CD8 + |
| células B e os linfócitos B precursores | B220 +, CD19 +, CD21 / 35 + |
| precursores de granulócitos e de granulócitos | Ly6G +, Mac-1 +, CD11b + |
| precursores monócitos / macrófagos e monócitos | CD11b +, Mac-1 +, Mac-3 +, CD21 / 35 +, CD115 +, Ly6Chi |
| progenitores | |
| progenitores multipotentes | CD117 + Sca-1+ CD34 + (Lin CD150-) |
| progenitores multipotentes preparado linfóides | CD117hi Sca-1hi CD127 + (Lin) |
| progenitores linfóides comuns | CD117lo Sca-1lo CD127 + (Lin) |
| progenitores mielóides comuns | CD16 / 32lo CD117 + CD34int (Lin Sca-1) |
| progenitores de granulócitos-macrófagos | CD16 / 32hi CD117 + CD34hi (Lin Sca-1) |
| progenitores de megacariócitos-eritróide | CD16 / 32lo CD117 + CD34lo (Lin Sca-1) |
| Células-tronco hematopoéticas | CD117 + Sca-1 + CD150 + (Lin- CD34-) |
Tabela 1. Os marcadores de linhagens de células hematopoiéticas e diferenciação.
CD: cluster de diferenciação; Lin: marcadores de células maduras; lo:baixa expressão; oi: alta expressão; int: expressão intermediária; NK: células assassinas naturais; TCR: receptor de células T.
Discussão
Em estudos anteriores, a linha de células C1498 foi descrito como um indutor da granulocítica aguda 5, NKT mielomonocítica 6 ou 7 leucemia de células. No entanto, os dados demonstrativos na literatura estavam ausentes ou incompletos. O protocolo aqui apresentado utiliza técnicas diferentes, como a citometria de fluxo, imunofluorescência, a coloração citoquímica MGG e ensaios, para caracterizar as células C1498 em cultura e para determinar a natureza da leucemia que é induzida em ratos depois de serem injectados.
Quando fenotipados em células cultivadas in vitro C1498 após imunocoloração e citometria de fluxo foram realizadas análises, observaram-se algumas limitações porque estas células expressaram alguns marcadores da superfície das células hematopoiéticas que foram previamente descritos na literatura 6,7. De acordo com nossos resultados, Labelle et al. Não observar a expressão na superfície celular de madura TCR em células C1498 usando cytomet fluxocoloração ry. No entanto, eles consideram-nos uma linha de células NKT depois de terem detectado CD3ε e TCRVβ8.2 mRNAs 7. Observou-se também a expressão intracelular de cadeias e moléculas TCRVβ CD3ε na maioria das células (> 70%), mas as suas linhagens hematopoiéticas não pode ser determinada porque havia também a expressão intracelular concomitante da molécula de Mac-3.
Mieloperoxidase, MGG coloração e avaliações para analisar esterases funcionais usando citoquímica demonstraram que a linhagem de células C1498 teve uma origem mielóide e foi composto por monoblastos e mieloblastos. Estes resultados foram concordantes com a percentagem de Mac-3 + células que foram obtidos na análise de citometria de fluxo de coloração. Embora não quantitativas, estes passos representam experiências principais para ser realizada. Com efeito, eles permanecem, até agora, os melhores métodos existentes para a caracterização da estirpe e diferenciação de células hematopoiéticas fase que não expressam ou fmarcadores fenotípicos específicos ew.
Citometria de fluxo coloração foi útil para demonstrar o desenvolvimento de leucemia aguda em ratos cong�icas após C1498 células foram injetadas por via intravenosa. As células C1498 CD45.2 + que se infiltrou num sangue periférico e vários órgãos foram isolados, e as suas frequências foram determinados. Quantificação também foi realizado para analisar medular inerente e as células esplénicas após imunofenotipagem. Limitações foram encontrados quando o fenótipo de células C1498 foi examinada em órgãos como expressaram alguns marcadores hematopoiéticas (apenas alguns deles foram B220 +). Para definir a natureza da leucemia aguda observada, coloração May-Grunwald Giemsa e uma análise das actividades de monocítica e esterases granulocítica foram realizadas utilizando medula óssea. Os resultados mostraram que as células C1498 preservaram a sua morfologia e função mieloblástica e monoblástica, revelando o aparecimento de leucemia mielomonocítica.
Em consideração para as etapas críticas descritas neste protocolo, deve ser dada especial atenção ao pH ao realizar reações citoquímicas e coloração MGG porque erros no pH podem levar a interpretações incorrectas de resultados. Por exemplo, a actividade de esterase butirato α-naftilo é específico para células monocíticas-se apenas com um pH de 6,0 devido granulócitos e linfócitos também pode manchar positivo para este teste a valores de pH mais elevados. A fixação das células não é recomendado antes de executar coloração MGG, e nós mostrou que apenas a fixação CAF apresentou resultados satisfatórios quando se realiza esterases reações citoquímicas usando C1498 células. Para preservar a expressão da molécula de CD115 e sua detecção por citometria de fluxo, todas as amostras de células (por exemplo, sangue, medula óssea e baço) deve ser mantido em gelo durante o procedimento. Se nenhuma coloração é observada em citometria de fluxo e / ou ensaios de imunofluorescência, a referência dos anticorpos, o seu armazenamento recomendas e suas diluições devem ser verificados. As referências especificadas na tabela de materiais / equipamentos foram selecionados para aplicações de citometria de fluxo ou imunofluorescência. Os anticorpos primários / secundários ou os seus conjugados fluoróforos podem ter perdido a sua actividade devido a armazenamento inadequado (por exemplo, a exposição à luz ou calor), diluição incorrecta, extenso de congelamento / descongelamento ou o uso de tampões contaminados. Executar controlos positivos para garantir que eles estão funcionando corretamente. Use de medula óssea de rato ou células derivadas de baço que são conhecidas por expressar as proteínas de interesse. Para evitar o elevado ruído de fundo e a coloração não específica, certifique-se de que as células são lavadas apropriadamente e mantida a elevada humidade (por imunofluorescência) e que os anticorpos são diluídos conforme instruído. Utilizar a mesma concentração e diluição para o anticorpo de controlo de isotipo e o anticorpo primário para determinar com precisão o nível de fundo na amostra. Para as experiências de esterase citoquímica, oOs reagentes podem ser testados usando lâminas de controlo positivas e negativas contendo rato purificada granulocítica esplénica (Ly6G +) e monocítica (+ CD115) células.
O procedimento descrito no presente estudo mostrou que muitas das características leucémicas observados em ratinhos após a injecção de células C1498 partilhada características comuns com leucemia mielomonocítica aguda humano 11,12. As células leucémicas invadiram resultou numa redução de maduras e imaturas (progenitores e de precursores de células hematopoiéticas da medula). C1498 células estão presentes em alta frequência (> 20%) no sangue periférico, como são células monocíticas. Hepatomegalia e esplenomegalia foram observadas como resultado da infiltração das células leucémicas, e aumentos significativos nos linfócitos B e células mielóides também foram observados para acompanhar esplenomegalia. Trombocitopenia foi também observada quando os números de plaquetas do sangue foram estimadas usando um analisador de hematologia.
Foi show den, utilizando experimentos in vitro, que C1498 células inibir a hematopoiese murino normal, através da secreção de fatores solúveis 13. Em diversos modelos de ratinho de tumor, as células mielóides imaturas (incluindo monocíticas e células granulocíticas) também têm sido mostrados para migrar a partir da medula óssea para o baço, onde eles inibem a activação das células T específicas do tumor e anti-proliferação 14. Assim, a redução nas células hematopoiéticas que foi observada na medula óssea podem ser resultantes de uma deficiência tanto na hematopoiese e / ou da sua emigração. Este último mecanismo pode explicar a presença de monocitose no sangue periférico ou da observação de fracções mielóides no baço alargada. É também concebível que essas células poderiam ter sido derivado da melhoria da hematopoiese esplénica. De fato, sob condições de estado estacionário, foram identificados alguns subconjuntos de células B do baço como precursores de linfócitos B maduros 15. Além disso, em condições inflamatórias, medAs células estaminais e progenitores ullary foram mostrados para mudar para o baço para induzir a produção de monócitos maduros 16. Este protocolo não permite tirar conclusões sobre os mecanismos que estão envolvidos no desenvolvimento de leucemia, e os ensaios funcionais, bem como moleculares adicionais devem ser empregadas para o fazer. No entanto, estes dados incluem informações detalhadas sobre as características clínicas da leucemia mielomonocítica aguda e ajudará os investigadores a avaliar e compreender os efeitos de novos agentes terapêuticos.
Divulgações
The authors declare that they have no competing financial interests.
Agradecimentos
The authors would like to acknowledge the "Ligue Nationale contre le Cancer" (Comité du Septentrion), the SIRIC ONCOLille (Grant INCa-DGOS-INSERM 6041) and the Institut pour la Recherche sur le Cancer de Lille (IRCL) for supporting this work. They would like to thank Delphine Taillieu and the animal facility staff for housing the mice and maintaining their welfare. We also thank Raphaëlle Caillerez and Nathalie Jouy for their respective help in microscopy and flow cytometry.
Materiais
| Name | Company | Catalog Number | Comments |
| C1498 cell line | ATCC | TIB 49 | |
| C57BL/6J-Ly5.1 | Charles River | B6.SJL-Ptprc a Pep3 b/BoyCrl | |
| Cells culture reagents | |||
| 2-Mercaptoethanol, Gibco | ThermoFisher Scientific | 21985 | |
| Fetal Bovine Serum (FBS) | ThermoFisher Scientific | 10270 | |
| HEPES, Gibco (1 M) | ThermoFisher Scientific | 15630 | |
| Non-Essential Amino Acids Solution, Gibco | ThermoFisher Scientific | 11140 | |
| Penicillin-Streptomycin, Gibco | ThermoFisher Scientific | 15140 | |
| RPMI 1640 Medium (Gibco, GlutaMAX Supplement) | ThermoFisher Scientific | 61870 | |
| Sodium Pyruvate, Gibco (100 mM) | ThermoFisher Scientific | 11360 | |
| Flow cytometry staining reagents | |||
| anti-mouse B220 APC (1) | ebiosciences | 17-0452 | clone RA3-6B2, final dilution 1/100 |
| anti-mouse B220 biotin (2) | ebiosciences | 13-0452 | clone RA3-6B2, 1/400 |
| anti-mouse CD3 eFluor450 (1) | ebiosciences | 48-0032 | clone 17A2, 1/100 |
| anti-mouse CD3 PE (2) | BD biosciences | 555275 | clone 17A2, 1/100 |
| anti-mouse CD3 PE-Cy5 (3) | ebiosciences | 15-0031 | clone 145-2C11, 1/100 |
| anti-mouse CD4 APC (1) | ebiosciences | 17-0041 | clone GK1.5, 1/500 |
| anti-mouse CD4 PE (2) | ebiosciences | 12-0041 | clone GK1.5, 1/200 |
| anti-mouse CD8 biotin (1) | ebiosciences | 13-0081 | clone 53-6.7, 1/100 |
| anti-mouse CD8 eFluor450 (2) | ebiosciences | 48-0081 | clone 53-6.7, 1/500 |
| anti-mouse CD11a biotin | ebiosciences | 13-0111 | clone M17/4, 1/100 |
| anti-mouse CD11b PE | ebiosciences | 12-0112 | clone M1/70, 1/200 |
| anti-mouse CD16/32 biotin | ebiosciences | 13-0161 | clone 93, 1/400 |
| purified anti-mouse CD16/32 (FcR blocking) | BD biosciences | 553141 | clone 2.4G2 |
| anti-mouse CD18 biotin (1) | ebiosciences | 13-0181 | clone M18/2, 1/100 |
| anti-mouse CD18 FITC (2) | ebiosciences | 11-0181 | clone M18/2, 1/50 |
| anti-mouse CD19 PE | ebiosciences | 12-0193 | clone 1D3, 1/200 |
| anti-mouse CD21/35 PE | ebiosciences | 12-0211 | clone 8D9, 1/50 |
| anti-mouse CD31 PE | ebiosciences | 12-0311 | clone 390, 1/100 |
| anti-mouse CD34 eFluor660 | ebiosciences | 50-0341 | clone RAM34, 1/20 |
| anti-mouse CD44 PE | BD biosciences | 553134 | clone IM7, 1/50 |
| anti-mouse CD45.2 FITC | ebiosciences | 11-0454 | clone 104, 1/100 |
| anti-mouse CD49b/Pan NK PE | BD biosciences | 553858 | clone DX5, 1/50 |
| anti-mouse CD80 biotin | ebiosciences | 13-0801 | clone 16-10A1, 1/200 |
| anti-mouse CD86 biotin | ebiosciences | 13-0862 | clone GL1, 1/200 |
| anti-mouse CD107b (Mac-3) PE | ebiosciences | 12-5989 | clone M3/84, 1/40 |
| anti-mouse CD115 PE | ebiosciences | 12-1152 | clone AFS98, 1/100 |
| anti-mouse CD117 eFluor450 | ebiosciences | 48-1171 | clone 2B8, 1/100 |
| anti-mouse CD127 PE | ebiosciences | 12-1271 | clone A7R34, 1/100 |
| anti-mouse CD150 APC | ebiosciences | 17-1501 | clone 9D1, 1/20 |
| anti-mouse CD274 (PD-L1) biotin | ebiosciences | 13-5982 | clone MIH5, 1/200 |
| anti-mouse Ly-6A/E (Sca-1) PE | ebiosciences | 12-5981 | clone D7, 1/100 |
| anti-mouse Ly-6C APC | ebiosciences | 17-5932 | clone HK1.4, 1/200 |
| anti-mouse Ly-6G (Gr-1) biotin (1) | ebiosciences | 13-5931 | clone RB6-8C5, 1/400 |
| anti-mouse Ly-6G FITC (2) | ebiosciences | 11-9668 | clone 1A8, 1/50 |
| anti-mouse MHC class I (H-2Db) biotin | ebiosciences | 13-5999 | clone 28-14-8, 1/50 |
| anti-mouse MHC class II (I-A/I-E) PE-Cy5 | ebiosciences | 15-5321 | clone M5/114.15.2, 1/1000 |
| anti-mouse NK1.1 PE | BD biosciences | 557391 | clone PK136, 1/50 |
| anti-mouse TCRVb FITC | BD biosciences | 553170 | clone H57-597, 1/50 |
| streptavidin PE-Cy5 | ebiosciences | 15-4317 | 1/200 |
| Immunofluorescence staining reagents | |||
| Anti-mouse myeloperoxidase (heavy chain antibody) | Santa Cruz Biotechnology | sc-16129 | 1/10 (20 µg/ml) |
| anti-goat IgG (Texas Red coupled antibody) | Jackson Immunoresearch | 705-076-147 | 1/250 |
| Normal donkey serum | Jackson Immunoresearch | 017-000-001 | |
| Hoechst solution | BD Biosciences | 561908 | 1/1000 |
| Mounting medium 1 (Fluoromount) | Sigma-Aldrich | F4680 | |
| Acetone | VWR | 20066 | |
| Methanol | Merck Millipore | 106009 | |
| Esterase cytochemical staining reagents | |||
| Naphtol AS-D chloroacetate solution | Sigma-Aldrich | 911 | |
| Dye solution (Fast Red Violet LB Base solution) | Sigma-Aldrich | 912 | |
| pH6.3 buffer concentrate (TRIZMAL) | Sigma-Aldrich | 913 | |
| Sodium nitrite solution | Sigma-Aldrich | 914 | |
| Citrate solution | Sigma-Aldrich | 915 | |
| Hematoxylin solution | Sigma-Aldrich | GHS3 | |
| Acetone | VWR | 20066 | |
| Formaldehyde solution, 37% | Sigma-Aldrich | F1635 | |
| α-naphthyl butyrate solution | Sigma-Aldrich | 1801 | |
| Phosphate buffer solution | Sigma-Aldrich | 1805 | |
| Sodium nitrite Tablet | Sigma-Aldrich | 1809 | |
| Pararosaniline solution | Sigma-Aldrich | 1804 | |
| Methylene blue solution | Sigma-Aldrich | 1808 | 1/10 |
| mounting medium 2 (Clearmount) | Invitrogen | 00-8010 | |
| May-Grünwald Giemsa staining reagents | |||
| May-Grünwald solution | RAL Diagnostics | 320070 | |
| Giemsa R solution | RAL Diagnostics | 320310 | 1/20 |
| pH 6.8 buffer solution | RAL Diagnostics | 330368 | |
| Others materials, reagents and equipment | |||
| Ketamine 1000 (100 mg/ml) | VIRBAC | 3597132111010 | |
| Xylazine SEDAXYLAN (20 mg/ml) | CEVA | ||
| Bovin albumin serum (BSA) powder | ThermoFisher Scientific | BP671 | |
| PBS solution (1x concentrate) | ThermoFisher Scientific | 14190 | |
| Paraformaldehyde (PFA) | Sigma-Aldrich | 158127 | |
| Saponin | Sigma-Aldrich | 47036 | |
| Ultra Pure 0.5 M EDTA solution, pH 8.0 | ThermoFisher Scientific | 15575 | |
| Separating solution (Pancoll Mouse) | PANBIOTECH | P04-64100 | |
| Lysis buffer (Red Blood Cells Lysing Buffer) (10x) | BD Biosciences | 555899 | 1/10 |
| NaOH 10 N | ThermoFisher Scientific | SS267 | |
| Trypan blue solution (0.4 %) | ThermoFisher Scientific | 15250-061 | 1/2 |
| 50 ml tube (Falcon) | Fisher Scientific | 14-432-22 | |
| 70 µm Cell Strainer (Falcon) | Corning Life Sciences | 352350 | |
| Chamber & filter card (EZ Cytofunnel Shandon) | Thermo Scientific | A78710003 | |
| Microscope Cover Glasses, 24 x 24mm | Knittel Glass | VD1 2424 Y100 | |
| Slides (Starfrost - ground edges 90) | Knittel Glass | VS1137# 077FKB | |
| EDTA Tube | Greiner Bio-One | 454034 | |
| Pasteur Pipette 150 mm (capillary tube) | Fisherbrand | 1154-6963 | |
| 26 G needle | Terumo | NN-2613R | |
| insulin syringe and needle 29 G | Terumo | BS05M2913 | |
| 30 G needle | Becton & Dickinson | 304000 | |
| Flow cytometry tubes (blue) | Beckman Coulter | 2523749 | |
| Water-repellent pen (Dakopen) | Dako | S200230 | |
| Sharp sterile scissors | Nessi-care | SCI-01 | |
| Sterile forceps | Dominique Dutscher | 956506 | |
| Thoma cell counting chamber | VWR | 631-0397 | |
| Petri Dishes (Fisherbrand Plastic) | ThermoFisher Scientific | S33580A | |
| Microcentrifuge tube (1.5 ml) | ThermoFisher Scientific | 05-408-129 | |
| Cylindrical Restrainer 15 - 30 gm | Stoelting | 51338 | |
| Shandon Cytospin 3 Cytocentrifuge | ThermoFisher Scientific | ||
| 10 ml syringe | Terumo | SS-10L | |
| 1 ml syringe | Terumo | SS-01T | |
| Ethanol | Merck | 1.08543 | |
| Sterile gauze sponges | URGO | 501580 |
Referências
- Forthun, R. B., Hinrichs, C., Dowling, T. H., Bruserud, Ø, Selheim, F. The past, present and future subclassification of patients with acute myeloid leukemia. Curr. Pharm. Biotechnol. 17 (1), 6-19 (2016).
- Goldie, H., Butler, C. H., Anderson, M. M., Maxwell, M. C., Hahn, P. F. Growth characteristics of free C1498 (granulocytic leukemia) tumor cells in the peritoneal fluid and the blood of C57 mice. Cancer Res. 13 (2), 125-129 (1953).
- Tanaka, K. K., Roberts, E. Biological studies of E.L.4 lymphoma and C Leukemia in susceptible (C57BL) and resistant (B10.D2) mice. Cancer Res. 24 (1498), 1785-1797 (1964).
- Law, L. W. Characterization of an influence affecting growth of transplantable leukemias in mice. Cancer Res. 4, 257-260 (1944).
- Graham, J. D., McMahon Welch, C., Patchen, M. L. Studies of an implanted murine myelogenous leukemia C1498. Ohio J. Sci. 75 (4), 202-208 (1975).
- Boyer, M. W., Orchard, P. J., Gorden, K. B., Anderson, P. M., Mclvor, R. S., Blazar, B. R. Dependency on intercellular adhesion molecule recognition and local interleukin-2 provision in generation of an in vivo CD8+ T-cell immune response to murine myeloid leukemia. Blood. 85 (9), 2498-2506 (1995).
- Labelle, J. L., Truitt, R. L. Characterization of a murine NKT cell tumor previously described as an acute myelogenous leukemia. Leuk. Lymphoma. 43 (8), 1637-1644 (2002).
- Bradner, W. T., Pindell, M. H. Myeloid leukemia as a screen for cancer chemotherapeutic agents. Cancer Res. 26 (4), Pt 2 375-390 (1966).
- Lin, J. M., Li, B., Rimmer, E., VanRoey, M., Jooss, K. Enhancement of the anti-tumor efficacy of a GM-CSF-secreting tumor cell immunotherapy in preclinical models by cytosine arabinoside. Exp. Hematol. 36 (3), 319-329 (2008).
- Robinson, J. P. Handbook of Flow Cytometry Methods. , Wiley-Liss, Inc. New York, NY. (1993).
- Xu, Y., McKenna, R. W., Wilson, K. S., Karandikar, N. J., Schultz, R. A., Kroft, S. H. Immunophenotypic identification of acute myeloid leukemia with monocytic differentiation. Leukemia. 20 (7), 1321-1324 (2006).
- Hassan, K., Qureshi, M., Shafi, S., Ikram, N., Akhtar, M. J. Acute myeloid leukemia-FAB classification and its correlation with clinico-haematological features. J. Pak. Med. Assoc. 43 (10), 200-203 (1993).
- Quesenberry, P. J., Rappeport, J. M., Fountebouni, A., Sullivan, R., Zuckerman, K., Ryan, M. Inhibition of normal murine hematopoiesis by leukemic cells. N.Engl.J. Med. 299 (2), 71-75 (1978).
- Youn, J. I., Nagaraj, S., Collazo, M., Gabrilovich, D. I. Subsets of myeloid-derived suppressor cells in tumor-bearing mice. J. Immunol. 181 (8), 5791-5802 (2008).
- Loder, F., et al. B cell development in the spleen takes place in discrete steps and is determined by the quality of B cell receptor-derived signals. J. Exp. Med. 190 (1), 75-89 (1999).
- Robbins, C. S., et al. Extramedullary hematopoiesis generates Ly-6C(high) monocytes that infiltrate atherosclerotic lesions. Circulation. 125 (2), 364-374 (2012).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados